
8. Электрохимия
.pdf
|
0 |
|
|
RT |
|
|
aOx |
|
|
|
||||
1-ый тип: r |
r |
|
|
|
ln |
|
|
|
|
|
|
|
||
|
zF |
aRed |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|||||
|
0 |
|
|
mRT |
|
|
a |
Ox |
a |
H |
+ |
|||
2-ой тип: r |
r |
|
|
zF |
|
ln |
|
aRed |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
||||
где φr – ОВ-потенциал, В;
φ°r – стандартный ОВ-потенциал, В;
z – число электронов, участвующих в ОВ-процессе;
а(Ох) – активность окисленной формы, моль/л;
а(Red) – активность восстановительной формы, моль/л;
m – число протонов;
а(н+) – активность ионов водорода, моль/л.
Стандартным ОВ-потенциалом называют потенциал, возникающий на границе раздела инертный металл – раствор, в котором активность окисленной формы равна активности восстановленной формы, а для системы второго типа, кроме того, активность ионов водорода равна единице.
§12. Классификация обратимых электродов
Рассмотрев принцип работы электродов можно сделать вывод, что по свойствам веществ, участвующих в потенциалопределяющих процессах, а также по устройству все обратимые электроды делят на следующие группы:
-электроды первого рода;
-электроды второго рода;
-ионоселективные электроды;
-окислительно – восстановительные электроды.
Правила, рекомендованные ИЮПАК, при записи гальванических цепей и уравнений реакций, протекающих в них.
1.Гальванический элемент представляет собой систему, производящую работу, а не потребляющую её, поэтому ЭДС элемента целесообразно считать положительной величиной.
2.ЭДС элемента рассчитывают, вычитая из числового значения потенциала правого электрода числовое значение потенциала левого электрода – правило «правого плюса». Поэтому схему элемента записывают так, чтобы левый электрод был отрицательным, а правый – положительным.
3.Границу раздела между проводниками первого и второго ряда обозначают одной чертой: Zn׀ZnSO4; Cu׀CuSO4
4.Границу раздела между проводниками второго рода изображают пунктирной линией: ZnSO4 (р) ׃CuSO4 (р)
5.Если на границе раздела двух проводников второго рода используют электролитный мостик, его обозначают двумя
чертами: ZnSO4 (р) ׀׀CuSO4(р).
6. Компоненты одной фазы записываются через запятую:
Pt|Fe³+, Fe²+ ; Pt, H2 |HCl(p)
7.Уравнение электродной реакции записывают, чтобы слева располагались вещества в окислительной форме, а справа – в восстановительной: Zn|ZnSO4(р) : CuSO4 (р) |Cu
§13. Измерение ЭДС гальванических элементов
Наибольшее применение в практике нашел компенсационный метод измерения ЭДС. Он основан на включении во внешнюю цепь источника тока, который может скомпенсировать ЭДС исследуемого элемента.
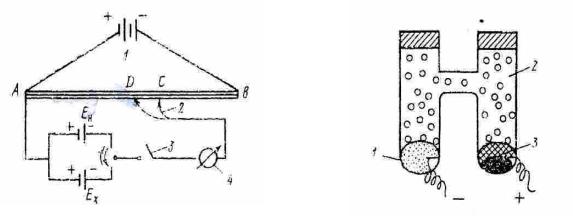
Принципиальная компенсационная схема измерения ЭДС представлена на (рисунок 11)
|
|
|
Рис.11 Конденсационная схема измерения ЭДС: 1 |
Нормальный элемент Вестона: |
|
– аккумулятор; |
1– (Hg)Cd; |
|
2 |
– подвижной контакт, |
2– CdSO4; |
3 |
– переключатель тока; |
3– Hg2SO4 |
4 |
– гальванометр |
|
От аккумулятора 1 на реохорд АВ с большим сопротивлением подают напряжение (2–4 В). Подвижный контакт 2 позволяет менять напряжение. С помощью переключателя тока 3 в цепь включают элемент Вестона с известным значением ЭДС (Ен = 1,018В при 298К). Элемент Вестона подключают одноименными полюсами, чтобы ток от элемента Вестона шёл навстречу току аккумулятора.
Передвигая контакт 2, подбирают такое положение на реохорде , чтобы падение напряжения на участке АС равно ЭДС элемента Вестона (Ен). При этом стрелка гальванометра не должна отклонятся от нуля. При таком положении ток в цепи не идёт и система находится в равновесии. Это позволяет найти цену деления реохорда как Ен/Ас (В/м). Затем с помощью переключателя 3 вместо элемента Вестона включают таким же образом исследуемый элемент (Еx). Передвигая контакт 2, находят положение, при котором падение

напряжения на участке АД равно Еx. при этом стрелка гальванометра так же не должна отклонятся от нуля в указанном состоянии равновесия:
EX ACEH AÄ
§14. Потенциометрия
Потенциометрией называют совокупность физико-химических методов исследования, в основе которых лежит измерение электродвижущей силы цепей, составленных из индикаторного электрода и электрода сравнения,
Поскольку потенциал индикаторного электрода зависит от активности (концентрации) исследуемого иона в растворе, измерение ЭДС позволяет определять количество соответствующих ионов. Различают прямые и косвенные потенциометрические методы.
Прямые потенциометрические методы.
Впрямых потенциометрических методах источником информации для определения активности или концентрации ионов является числовое значение индикаторного электрода. Успешное потенциометрическое определение возможно только при правильном подборе индикаторного электрода, соответствующего целям исследования.
Вкачестве индикаторного электрода для потенциометрического определения рН можно использовать любой электрод, потенциал которого зависит от активности ионов водорода. Чаще всего для этих целей применяют стеклянный электрод, реже – водородный.
Измерение ЭДС проводят с помощью специальных приборов – универсальных ионометров.
Косвенные потенциометрические методы.
Чаще всего потенциометрические измерения используют для определения точки эквивалентности в титриметрическом анализе – потенциометрическое титрование. В ацидиили алкалиметрии в качестве индикаторного электрода применяют стеклянный электрод , т.к. его потенциал зависит от рН среды. В оксидиметрическом титровании применяют редокс – электрод. В осадительном и комплексонометрическом – ионоселективные электроды.
Для определения точки эквивалентности строят кривую титрования (рисунок 12) – график зависимости ЭДС измерительной цепи от объёма прилитого титранта.

Рис.12 Определение точки эквивалентности в потенциометрическом
титровании: а – по графику E=f(V) б – по графику E f1 (V )
V
Затем проецируют точку перегиба кривой титрования на ось абсцисс (рис.12а). Более точно искомое значение можно определить по графику изменения приращения потенциала на единицу, добавляемого объёма титранта ∆Е/ΔV в зависимости от общего объёма прилитого титранта (рис12б).
§15. Лабораторный практикум
Работа 1. Измерение ЭДС гальванических элементов Цель работы:
1.Составить гальванический элемент и измерить его ЭДС.
2.Вычислить ЭДС гальванического элемента при заданных концентрациях растворов электролитов и сравнить экспериментальные и теоретические значения ЭДС.
Прежде чем приступить к выполнению работы по определению ЭДС гальванических элементов, необходимо сдать допуск и получить задание у преподавателя, а именно: ЭДС каких элементов следует измерить. Например, требуется измерить ЭДС цинк-медного элемента при различных концентрациях
ZnSO4 (c1) и CuSO4 (c2)
Порядок выполнения работы.
Записать элемент в строку. Для этого по таблице стандартных потенциалов (см. приложение) определить знаки электродов в гальваническом элементе:
0 |
2+ |
|Zn = – 0,763B; φ |
0 |
2+ |
φ |
Zn |
Cu |
|Cu = 0,337B. |
Так как цинковый электрод отрицательный, а медный – положительный, то в соответствии с Международной конвенцией гальванический элемент следует записать следующим образом:
Zn|ZnSO4||CuSO4|Cu
C1 C2

Приготовить электроды. Для этого медную и цинковую пластинки зачистить мелкой наждачной бумагой. При зачистке электродов употреблять индивидуальную наждачную бумагу.
Промыть электроды дистиллированной водой, затем соответствующим для металла раствором электролита.
Погрузить электроды в специальные сосуды с соответствующими растворами требуемой концентрации.
Обмыть концы электролитического мостика дистиллированной водой и ввести в электродные сосуды специальные патрубки (рисунок 1).
рис.1.
1.Стеклянный сосуд с патрубком для соединения с другим электродом;
2.Цинковая пластинка;
3.Раствор сульфата цинка;
4.Медная пластинка;
5.Раствор сульфата меди;
6.Электролитический мостик.
Подключить зажимы от цифрового вольтметра к соответствующим электродам и измерить ЭДС. Если на цифровом табло высветится отрицательное значение ЭДС, необходимо зажимы у электродов поменять местами. Занести измеренное значение ЭДС в таблицу 1.
Рассчитать теоретическое значение ЭДС воспользовавшись уравнением Нернста.
E = E0 RT ln aCu2+ zF aZn2+
или, подставив значения R(8,314Дж/моль·К) и коэффициент пересчёта от натурального к десятичному логарифму (2,3), уравнением:

E = E0 2 10 4 T lg aCu2+ z aZn2+
При небольших концентрациях (с ≈ 0,001 моль/л) можно считать, что
2+ |
2+ |
2+ |
2+ |
aZn |
(Cu |
) ≈ c Zn |
(Cu ) |
Если концентрация велика – больше 0,01 моль/л, необходимо рассчитать среднюю ионную активность электролита a+ = γ+,·c+ ,где
γ+ – средний ионный коэффициент активности (см. приложение). c+ – cредняя ионная концентрация, она связана с молярной
соотношением
c+ c( + + )1
где ν+, ν– – число катионов, анионов, на которое распадается молекула электролита; ν – общее число ионов.
Для сульфата меди и цинка ν+ = ν–_ = 1
Значит, с+ = с и а+ = γ+ ·с Подобным образом измеряют и рассчитывают ЭДС других элементов.
Полученные данные заносят в таблицу 1. Таблица 1.
|
№ |
|
|
|
Относительная |
|
Гальванический элемент |
Еизм., В |
Етеор, В |
ошибка |
|
|
измерения |
||||
|
|
|
|
измерений, % |
|
|
|
|
|
|
|
|
1. |
|
|
|
|
|
2. |
|
|
|
|
|
3. |
|
|
|
|
|
|
|
|
|
|
Работа 2. Изменение потенциалов отдельных электродов |
|
||||
|
Цель работы: |
|
|||
1.Составить полуэлементы и вычислить на основании экспериментальных данных потенциалы заданных электродов.
2.Рассчитать электродные потенциалы по уравнению Нернста и сравнить их значения с вычисленными на основании опытных данных.
3.Изучить влияние концентрации электролита и природы электрода на значение электродного потенциала.
Порядок выполнения работы.
В основе определения потенциалов электродов лежит измерение ЭДС гальванических элементов, состоящих из электродов, потенциалы которых нас интересуют, и электрода сравнения, например, хлорсеребряного
(е0Cl–|AgCl|Ag = + 0,222B).

Для экспериментального определения электродных потенциалов составляют следующие гальванические элементы:
Ag | AgCl | KCl || CuSO4 | Cu,
С1
Zn | ZnSO4 || KCl | AgCl | Ag.
С2
Хлорсеребряный электрод по отношению к медному является отрицательным, по отношению к цинковому – положительным.
ЭДС составленных элементов (Ех) измеряют на установке, схема которой приведена на рисунке 2.
Рис.2. Схема установки для измерения потенциалов отдельных электродов:
1 – стеклянный сосуд с раствором и патрубком для соединения с другим электродом; 2 – электрод сравнения; 3 – металлическая пластинка.
Зная потенциал стандартного электрода Сl– |AgCl | Ag и измеренную ЭДС, вычисляют потенциал исследуемого электрода.
Для цинк – хлорсеребряного элемента:
Ех = φCl-|AgCl|Ag – φZn2+|Zn ,
Для хлорсеребряно – медного элемента:
Ех = φCu2+|Cu – φCl–|AgCl|Ag
Откуда соответственно
φZn2+|Zn = φCl-|AgCl |Ag – Ex ,
φCu2+|Cu = φCl-|AgCl |Ag + Ex .

Для сопоставления потенциалы этих же электродов рассчитывают по уравнению Нернста:
E = E0 2 10 4 Tz lgai
где аi – активность потенциалопределяющего катиона.
Указанную последовательность определений выполняют, проводя опыты с растворами электролитов разных концентраций.
Полученные результаты заносят в таблицу 2. Таблица 2.
|
|
|
|
|
|
|
Относит. |
|
№ |
Гальванический |
Концентрация |
Еизм.,В |
φизм.,В |
φтеор.,В |
ошибка |
|
|
элемент |
моль/л |
|
|
|
измерения, |
|
|
|
|
|
|
|
% |
|
|
|
|
|
|
|
|
|
1 |
Zn|ZnSO4||KCl|AgCl|Ag |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
4 |
Ag|AgCl|KCl||CuSO4|Cu |
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Работа 3. Определение |
константы диссоциации слабой |
кислоты |
|||||
|
|
потенциометрическим титрованием |
|
|
|
||
Показатель константы диссоциации слабой кислоты находят по измерению рН раствора, в котором кислота на 50% нейтрализована основанием. Требуемое количество основания определяют при помощи потенциометрического титрования, сущность которого заключается в том, что конечную точку нейтрализации находят по резкому изменению потенциала индикаторного электрода.
Вкачестве индикаторного электрода в данной работе берут стеклянный электрод. Электродом сравнения служит хлорсеребряный.
Оборудование: потенциометр, мешалка, электролитическая ячейка. Реактивы: раствор уксусной кислоты, раствор гидроксида натрия
0,1моль/л.
Ход работы.
Вэлектролитическую ячейку наливают 20мл раствора уксусной кислоты
ититруют 0,1М раствором NaOH. Концентрация NaOH должна быть больше концентрации кислоты, чтобы не сильно разбавлять раствор кислоты. После добавления каждой порции щёлочи раствор помешивают и через 2-3 мин. при помощи потенциометра измеряют ЭДС.
Измерения проводят по шкале «+мв». Сначала 2–3 раза добавляют 0,2мл, а затем по 0,1мл. NaOH до резкого скачка ЭДС. После скачка ЭДС приливают последовательно ещё 0,2; 0,3; 0,5мл NaOH.

Результаты титрования заносят в таблицу 3.
№ |
Объём |
|
|
|
|
|
щёлочи, |
ΔV, мл |
Е, мВ |
∆Е, мВ |
∆Е/∆V |
||
опыта |
||||||
мл |
|
|
|
|
||
|
|
|
|
|
1.
2.
3.
n
По полученным данным строят график. На ординате откладывают соотношение ∆Е/ΔV, а на абсциссе количество миллилитров, добавленной NaOH. Пик на кривой соответствует точке эквивалентности.
Точку эквивалентности можно также найти, если после каждой порции NaOH измерить рН и построить график в координатах рН/ΔV и V. Количество миллилитров NaOH, необходимое для полной нейтрализации данной порции кислоты, будет также соответствовать пику на кривой.
Для определения константы диссоциации следует взять новую порцию такого же объема кислоты, нейтрализовать её половинным количеством NaOH
иизмерить рН полученного раствора.
Вотчёте должны быть приведены таблица результатов, график, расчёты константы диссоциации и исходной концентрации кислоты.
Работа 4. Редокс–системы. Потенциометрическое измерение окислительно
– восстановительных потенциалов Цель работы:
1.Научиться потенциометрически измерять величину редокс-потенциала.
2.Изучить зависимость редокс-потенциала от соотношения концентрации окислительной и восстановительной форм.
Для исследования редокс – системы и измерения её потенциала можно взять любую окислительно – восстановительную систему, титруемую в присутствии платиного индикаторного электрода, например, систему, состоящую из красной K3[Fe(CN)6] и жёлтой K4[Fe(CN)6] кровяных солей. В данной системе на определённом этапе устанавливается равновесие:
[Fe(CN)6]3– +ē ↔ [Fe(CN)6]4–
Пользуясь бюретками, налить в стаканчики на 50мл 0,01М растворы указанных солей и 2М раствор хлористого калия в следующем соотношении:
1.10 мл K3[Fe(CN)6] + 1мл K4[Fe(CN)6] + 5мл KCl
2.8 мл K3[Fe(CN)6] + 3 мл K4[Fe(CN)6] + 5мл KCl
3.3 мл K3[Fe(CN)6] + 8 мл K4[Fe(CN)6] + 5мл KCl
4.1 мл K3[Fe(CN)6] + 10 мл K4[Fe(CN)6] + 5мл KCl
5.5 мл K3[Fe(CN)6] + 5 мл K4[Fe(CN)6] + 5мл KCl
В каждый из растворов погрузить электроды и произвести измерение ЭДС (в мв) , возникшую между платиновым и хлорсеребряным электродами.
Используя полученные значения ЭДС, рассчитать редокс-потенциал данной системы для пяти составов электролита по формуле.
e2 Er eõñ
где еr – редокс-потенциал
Еr – ЭДС редокс – хлорсеребряного электрода
ехс – потенциал хлорсеребряного электрода , величина которого равна
0,201В при 250.
Полученные данные занести в таблицу 4. Таблица 4.
Vр – ра, мл |
Vр – ра,мл |
Соотнош |
Соотнош. |
ЭДС, |
er |
er |
K3[Fe(CN)6] |
K4[Fe(CN)6] |
компонентов |
конц. |
мВ |
(эксп) |
(теор) |
|
|
|
окис. и |
|
|
|
|
|
|
восс. |
|
|
|
|
|
|
форм |
|
|
|
|
|
|
|
|
|
|
Построить график зависимости редокс-потенциала от соотношения концентраций окисленной и восстановленной форм.
Найти величину нормального редокс-потенциала данной системы по графику при условии С(окисл.) = С(восст.)
Рассчитать величину редокс-потенциала для данной системы при всех пяти соотношениях, используя уравнение Петерса:
e |
|
= e0 |
2 10 4 |
T |
lg |
Cî êèñë |
r |
|
|
||||
|
r |
|
z Câî ññò |
|||
|
|
|
|
|||
где е0r – нормальный редокс – потенциал системы, равный 0,36 В. С(окисл.) – концентрация окисленной формы K3[Fe(CN)6]; С(восстан.) – концентрация восстановленной формы K4[Fe(CN)6]
z – число электронов, которое приобретает одна молекула окисленной формы при переходе в восстановленную.
По расчетным значениям также построить график зависимости в указанных координатах и сравнить две графические зависимости.
§16. Примеры решения задач и задания для самостоятельной работы
Задача№1:
Рассчитать потенциал кадмиевого электрода, опущенного в водный
раствор сульфата кадмия с активностью ионов кадмия 0,015, при температуре
30ºС.
