
8. Электрохимия
.pdf
Для разбавленных растворов используют вместо активностей концентрации растворов
E RT ln C2 . zF C1
§6. Диффузный потенциал
В гальванических элементах на границах соприкосновения растворов могут возникать диффузионные потенциалы (φд).
Скачок потенциала на границе между неодинаковыми по составу или по концентрации растворами называется диффузионным потенциалом.
Диффузионный потенциал можно определить экспериментально, а так же вычислить. Сделаем это на примере рассмотренной выше концентрационной цинковой цепи.
При работе элемента электроны во внешней цепи переносятся слева направо. Следовательно, внутри элемента сульфат–ионы переходят справа налево. Ионы цинка движутся в обратном направлении. Подвижность сульфат ионов (la) больше подвижности ионов цинка (lk).
Соответственно работы переноса одного грамм – иона равны.
w |
2- RTln |
a2 |
; w |
|
2+ RTln |
a2 |
|
Zn |
|
||||
|
SO4 |
a1 |
|
|
a1 |
|
|
|
|
|
|
Через границу проходят неравные количества ионов, а количества, пропорциональные числам переноса ионов и суммарная работа тогда равна:
W = RT(t(-) t(+) )ln a2 a1
где |
t(-) |
|
la |
, число переноса сульфат-ионов |
||||
la |
lk |
|||||||
|
|
|
|
|
||||
t(+) |
|
|
lk |
|
, число переноса ионов цинка |
|||
|
|
|
|
|||||
|
|
la |
lk |
|
||||
Доля количества электричества, переносимого ионами данного знака по отношению к электричеству, переносимому всеми ионами, называется числом переноса данных ионов.
Подставим значения t(-) и t(+) в уравнение для суммарной работы:
W RT |
la lk |
ln |
a2 |
||
|
|
||||
|
l |
l |
|
a |
1 |
|
a |
k |
|
|
|

Зная, что W = zFφД, запишем
zF |
|
RT |
la lk |
ln |
a2 |
|
Ä |
|
|
||||
|
|
la |
lk |
|
a1 |
|
|
|
|
|
|||
Откуда
|
|
|
RT |
|
la lk |
ln |
a2 |
|
Ä |
|
|
|
|||||
|
|
zF la |
lk |
|
a1 |
|||
|
|
|
|
|||||
ЭДС концентрационной цинковой цепи с учетом диффузионного потенциала будет равна:
E = EK Ä
E |
RT |
2la |
ln |
a2 |
|||
|
|
|
l |
|
|||
|
zF l |
|
a |
1 |
|||
|
|
|
a |
k |
|
|
|
При lk > la ЭДС концентрационной цепи была бы равна
E = EK Ä
При точных вычислениях ЭДС гальванических элементов обязательно должна вводиться поправка на величину диффузионного потенциала. Однако, на практике чаще всего устраняют влияние диффузионного потенциала, включая между растворами электролита насыщенный раствор хлорида калия.
§7. Электроды первого рода
К электродам первого рода относят металлические электроды, обратимые относительно катионов, и металлоидные, обратимые относительно анионов. Обратимость электрода относительно тех или других ионов означает зависимость его потенциала от концентрации данных ионов. Примерами металлических электродов типа М/Мz+ являются Zn°/Zn²+, Cu°/Cu²+ и др.
Электродный потенциал их определяется уравнением:
0 RTzF ln a(Mz+ )
изависит только от концентрации (активности) одного вида ионов. Для электродов, обратимых относительно анионов, применимо уравнение:
0 RTzF ln a(A z )
Примером металлоидного электрода, обратимого относительно аниона, может служить селеновый электрод Se/Se2–.

К электродам первого рoда относят также газовые электроды, которые могут быть обратимы по отношению к катиону или аниону. Их создают по схеме (металл), газ|раствор. Металл в газовых электродах необходим как переносчик электронов и для создания поверхности, на которой протекает реакция. Металл должен быть инертным по отношению к веществам, находящимся в растворе. Типичным примером газового электрода является водородный электрод:(Pt), Н2|Н+
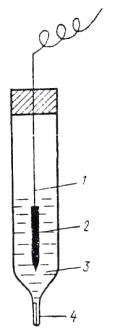
Водородный электрод
Водородный электрод (рисунок 7) представляет собой покрытую платиновой чернью платиновую пластинку, насыщенную газообразным водородом, которая опущена в водный раствор кислоты.
Рис.7 Водородный электрод: 1,3 – стеклянные трубки; 2 – патрубок для ввода водорода; 4 – платинированный платиновый электрод; 5 – сосуд с исследуемым раствором.
Водород, растворенный в платине, частично диссоциирует на протоны и электроны:
Н2 ↔ 2Н+ + 2ē
В результате такая платиновая пластинка приобретает способность обмениваться с раствором ионами водорода:
Н+(Рt) + Н2О ↔ Н3О+(Рt)

Возникающий при этом потенциал зависит от активности ионов водорода в растворе и ионов водорода в платине Н3О+(р) + 2ē ↔ Н2(Рt) + 2Н2О
Активность ионов водорода в платине пропорциональна давлению газообразного водорода. Количественно эта зависимость выражается уравнением Нернста:
|
|
|
= 0 |
|
|
RT |
|
a |
2 |
+ |
|
|
|
|
ln |
|
H |
|
|||
H |
|
|
|
|
|
|
||||
|
2 |
H |
2 |
|
2F |
|
pH |
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
2 |
где р(H2) – давление газообразного водорода, Па.
Стандартным водородным электродом (φ°н2) называют электрод, в котором давление газообразного водорода поддерживается равным 101кПа, а активность ионов водорода в растворе равна 1.
Потенциал стандартного водородного электрода условно принят за нуль: φ°н2 = 0B.
При всех других активностях ионов водорода при условии, что р(H2)=101кПа уравнение Нернста для водородного электрода принимает вид
H2 = RTF ln aH+
или с учетом, что – lg а(н+) = рНH2 = 2,3 RTF pH
Стандартный водородный электрод используется как электрод, относительно которого измерены потенциалы всех остальных стандартных электродов.
Стандартный электродный потенциал численно равен электродвижущей силе со знаком «+» или «–» гальванического элемента, составленного из стандартного водородного и стандартного данного электродов.
Например, цепь с цинковым электродом
Zn|ZnSO4||H2SO4|H2, Pt
ЭДС водородно-цинковой цепи будет равна
E0 0 |
|
0 |
, 0 |
= E0 |
H |
2 |
Zn |
Zn |
|
в случае медно – водородной гальванической цепи ЭДС равна
Pt, H2|H2SO4|CuSO4|Cu
E0 0 |
0 |
|
, 0 |
= E0 |
Cu |
H |
2 |
Cu |
|
|
|
|
|

Последовательность металлов, расположенных в порядке убывания (возрастания) значений их стандартных электродных потенциалов, называют рядом напряжений.
§8. Ионоселективные электроды
Ионоселективные электроды – это электроды, которые состоят из двух фаз: ионита и раствора, а потенциал на границе раздела фаз возникает за счет ионообменного процесса, в результате которого поверхность ионита и раствора приобретают электрические заряды противоположного знака. Иониты обладают повышенной избирательной способностью по отношению к определенному виду ионов, находящихся в растворе, поэтому такие электроды и называют ионоселективными.
Все ионоселективные электроды в зависимости от агрегатного состояния ионита (мембраны) подразделяются на электроды с жидкими и твердыми мембранами.
Вкачестве жидких мембран используют органические жидкости: хлор – бензол, толуол, которые не смешиваются с водой, не растворяют ионогенное вещество, способное к обмену с ионами данного вида в исследуемом растворе.
К твердым мембранам относятся стеклянные, кристаллические: монокристаллы или прессованные пластинки труднорастворимого соединения
идр.
Впоследнее время область применения ионоселективных электродов
расширилась благодаря использованию фермента. Например, мочевина под действием уреазы превращается в ион NH+4. С помощью ионоселективного электрода, содержащего уреазу, можно анализировать раствор на содержание мочевины. В настоящее время используют электроды, содержащие ферменты для определения глюкозы, витаминов, антибиотиков, гормонов, аминокислот и др.
Стеклянный электрод
Стеклянные электроды изготавливают из стекла определенного состава. Стекло чаще всего представляет собой соединение диоксида кремния с щелочными и щелочно–земельными оксидами. В результате гидролиза силикатов на поверхности стекла образуется тонкая пленка геля поликремниевой кислоты, незначительно диссоциированной на ионы.
R O Si OH  R O Si O + H+
R O Si O + H+
O O

Анионы поликремниевой кислоты R–OSiO2ˉ сообщают отрицательный заряд поверхности стекла.
Ионы водорода заряжают положительно прилегающий к поверхности стекла слой раствора. Степень диссоциации поликремниевой кислоты зависит от концентрации ионов водорода в растворе.
Одной из распространенных форм стеклянного электрода является стеклянная трубка, заканчивающаяся шариком (рисунок 8). Шарик заполнен раствором HCl, в который погружен вспомогательный хлор-серебряный электрод. Шарик погружают в исследуемый раствор и с помощью мостика стеклянный электрод соединяют с внешним электродом сравнения. Собранную таким образом цепь можно записать следующим образом:
Ag,AgCl | HCl(p )| стекло | исследуемый раствор || KCl(p) || KCl(p) | AgCl, Ag
âí óò ðåí í èé |
|
|
âí åø í èé |
элект ро д |
|
|
элект ро д |
сравн ен ия |
|
|
сравн ен ия |
φ1 |
φ2 |
φ3 |
φ4 |
ЭДС этой цепи определяется суммой: φ1 + φ2 + φ3 + φ4.
Скачки потенциалов φ1, φ2 и φ4 постоянны, следовательно, ЭДС цепи изменяется в зависимости от потенциала φ3, зависящей от рН исследуемого раствора.
Рис.8 Стеклянный электрод: 1 – шарик из стеклянной мембраны; 2 – раствор HCl; 3 – внутренний сереброхлоридный электрод; 4 – исследуемый раствор; 5 – агарный мостик; 6 – раствор хлорида калия; 7 – внешний сереброхлоридный электрод.
Электродная реакция сводится к обмену ионами водорода между двумя фазами – раствором и стеклом. В реакцию обмена вовлекаются и ионы щелочных металлов.

Устанавливается равновесие Н+(ст) + М+(р) ↔ Н+(р) + М+(ст)
Условие равновесия этой реакции выражается в законом действующих
масс:
K |
|
|
aH+ ( ð) aM+ (ñò ) |
|
|
î áì |
|
aH+ (ñò ) |
aM+ ( ð) |
|
|
|
||
Размер этой константы обмена зависит от свойств стекла и температуры. Исходя из предположения, что в стекле данного сорта сумма активностей
ионов водорода и ионов щелочного металла постоянна, т.е.
aH+ (ñò ) +aM+ (ñò ) a
уравнение константы обмена можно представить в следующем виде:
K |
|
|
aH+ ( ð) (a aH+ (ñò ) ) |
|
|
î áì |
|
aH+ (ñò ) |
aM+ ( ð) |
|
|
|
||
Решая это уравнение относительно ан+(р) / ан+ (ст), получим:
a |
+ |
( ð) |
|
a |
+ |
( ð) |
Kî áì |
a |
+ |
( ð) |
|
H |
|
|
H |
|
|
M |
|||
aH+ (ñò ) |
|
|
|
a |
|
|
|
|||
|
|
|
|
|
|
|
||||
Потенциал стеклянного электрода (φ0) может быть выражен следующей зависимостью:
|
|
= 0 |
|
RT |
ln |
aH+ ( p) |
ñò |
|
|
||||
|
ñò |
|
zF aH+ (cò ) |
|||
|
|
|
|
|||
Замена ан+ (р)/ан+ (ст) в уравнении электродного потенциала стекла его значением приводит к следующей зависимости:
ñò = ñò0 RTzF ln(aH+ ( p) Kî áì aM+ ( p) )
где RT/zF·ln(a) входит стандартный потенциал стеклянного электрода φ0.
Таким образом, в общем случае потенциал любого стеклянного электрода обусловливается двумя величинами – активностью ионов водорода и активностью щелочного металла. Если в растворе ан+ (р) >> Кобм·ам+ (р), то
ñò = ñò0 RTzF ln aH+ ( p) ñò0 2,3 RTF pH
т.е. электрод обладает водородной функцией и поэтому может служить индикаторным электродом при определении рН.
Если в растворе ан+ (р) << Кобм·ам+ (р), то
|
|
|
|
|
|
0 |
|
|
RT |
ln K |
|
|
+ |
RT |
lna |
|
||||
Ì |
ñò |
|
|
|
|
î áì |
|
+ |
||||||||||||
|
|
|
ñò |
|
|
zF |
|
|
zF |
M ( p) |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
èëè |
|
|
0 |
|
|
RT |
ln a |
|
|
, во всех уравн ен иях z = 1 |
||||||||||
Ì |
|
|
+ |
|
||||||||||||||||
|
|
|
|
|
M |
|
|
|
zF |
M |
|
( p) |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Стеклянный электрод с металлической функцией может использоваться в качестве индикаторного электрода для определения активности соответствующего щелочного металла. Таким образом, в зависимости от сорта стекла, точнее от величины константы обмена, стеклянный электрод может обладать водородной и металлической функциями.
§9. Электроды второго рода
Электроды второго рода состоят из металла, труднорастворимой соли этого метала и второго соединения, хорошо растворимого и с тем же анионом, что и первое соединение. Условное обозначение таких электродов М׀МА׀А–. Представителями электродов второго рода являются хлорсеребряный и каломельный электроды.
Хлорсеребряный электрод Аg ׀ Ag Cl, KCl
Хлорсеребряный электрод (рисунок 9) представляет собой серебряную проволоку, покрытую слоем хлорида серебра и опущенную в сосуд, наполненный насыщенным раствором хлорида калия. Сосуд имеет микрощель для контакта с исследуемым раствором.
Рис.9 Хлорсеребрянный электрод: 1 – серебряная проволока; 2 – слой AgCl; 3 – раствор KCl; 4 –микрощель.

Основной химический процесс:
Аg+1 + ē ↔ Аg0
Сопровождается реакцией растворения или осаждения соли АgСl: АgСl ↔ Аg+ + Сl‾
В присутствии хлорида калия, содержащего одноименный с хлоридом серебра ион хлора, растворимость хлорида серебра снижается. При постоянных концентрации KCl и температуре концентрация ионов Аg+ постоянна, чем и объясняется необходимая устойчивость потенциала электрода.
Потенциал хлорсеребряного электрода возникает на поверхности соприкосновения металлического серебра с раствором его ионов и может быть выражен следующим уравнением:
õñ Ag0 RTzF ln aAg+
Хлорид серебра трудно растворим в воде. Его произведение растворимости ПР = a(Ag+)∙a(Сl‾), из которого следует что a(Ag+) = ПР/a(Сl‾). Подставляя a(Ag+) в уравнение для потенциала хлорсеребряного электрода, получим:
õñ Ag0 RTzF ln Ï Ð RTzF ln aCl
Объединяя постоянные при данной температуре величины φ°Ag и RT/zF·ln(ПР) в одну величину и обозначая её через φ°xc, получают уравнение для потенциала хлорсеребряного электрода:
õñ õñ0 RTzF ln aCl
Таким образом, потенциал хлорсеребряного электрода в конечном итоге зависит от концентрации (активности) ионов хлора.
§10. Окислительно-восстановительные (ОВ) системы и окислительновосстановительные электроды
В зависимости от механизма окисления – восстановления разнообразные ОВ-системы можно разделить на два типа:
1-ый тип: ОВ – системы, в которых окислительно – восстановительный процесс связан с передачей только электронов, например: Fe³+ +ē ↔ Fe²+
2-ой тип: ОВ – системы, в которых окислительно – восстановительный процесс связан не только с передачей электронов, но и протонов, например:
С6Н4О2 + 2Н+ +2ē ↔ С6Н4(ОН)2
хинон гидрохинон
MnO4– + 8H+ + 5ē ↔ Mn²+ + 4H2O

Инертный металл в сочетании с ОВ – системой называют окислительно – восстановительным или редокс – электродом, а возникающий на этом электроде потенциал называют окислительно – восстановительным (ОВ) или редокс – потенциалом.
Инертный металл принимает лишь косвенное участие в потенциалопределяющей реакции, являясь посредником в передаче электронов от восстановленной формы вещества Red к окисленной ОХ.
При погружении инертного металла в раствор, содержащий избыток окисленной формы железа, металлическая пластинка заряжается положительно (рисунок 10а)
При избытке восстановленной формы железа поверхность платины заряжается отрицательно (рисунок 10б).
Рис.10 Возникновение ОВ потенциала.
Передача электронов с одного иона на другой через металл приводит к образованию на поверхности металла ДЭС.
Межионный обмен электронами возможен и без металла. Но ионы Fe²+ и Fe³+ сольватированы различным образом и для переноса электронов необходимо преодолеть энергетический барьер. Переход электронов от ионов Fe²+ на металл и с поверхности металла к иону Fe³+ характеризуется меньшей энергией активации.
При равенстве активностей ионов Fe²+ и Fe³+ платиновая пластина заряжается положительно, т.к. электроно – акцепторная способность ионов Fe³+ больше чем электроно – донорная способность Fe²+.
§11. Уравнение Петерса
Количественная зависимость ОВ-потенциала от природы ОВ-системы (φ°r), соотношения активностей окисленной и восстановленной форм, температуры, и от активности ионов водорода устанавливается уравнением Петерса.
