
- •Строение водорода
- •Физические свойства водорода
- •Химические свойства водорода
- •1. Взаимодействие с галогенами
- •2. Взаимодействие с кислородом
- •3. Взаимодействие с серой
- •4. Взаимодействие с азотом
- •5. Взаимодействие со сложными веществами (оксидами металлов и неметаллов)
- •6. Взаимодействие с активными металлами
- •Получение водорода
- •Применение водорода
- •Общая характеристика элементов VII-a группы
- •Особые свойства фтора, как наиболее электроотрицательного элемента
- •Ахождение в природе
- •Способы получения
- •Химические свойства галогенов
- •Способы получения галогеноводородов и их свойства
- •Способы получения галогеноводородов и их свойства
- •Кислородсодержащие соединения галогенов
- •Оксикислоты хлора
- •Реакции разложения hClO
- •Гипохлорит калия
- •Получение белильной извести
Особые свойства фтора, как наиболее электроотрицательного элемента
Фтор. Из всех галогенов у него наименьший радиус. Относительная электроотрицательность равна 4, это самый электроотрицательный элемент, во всех соединениях имеет степень окисления – 1, остальные галогены от – 1 до + 7.
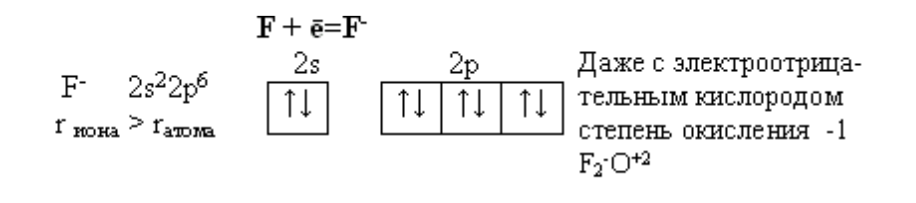
Исключительная химическая активность фтора обусловлена с одной стороны большой прочностью образуемых им связей, так энергия связи H - F 566кДж/моль, с другой стороны низкой энергией связи в молекуле F2 – 151кДж/моль.
Большая энергия связей Э – F является следствием значительной электроотрицательности фтора и малого размера его атома.
Низкое значение энергии связи в молекуле F2, объясняется сильным отталкиванием электронных пар, находящихся на π- орбиталях, обусловленным малой длинной связи F – F. Благодаря малой энергии связи молекулы фтора легко диссоциируют на атомы и энергия активации реакций с элементарным фтором обычно невелика, поэтому процессы с участием F2 протекают очень быстро.
Ахождение в природе
F CaF2 - плавиковый шпат
Na3[AlF6] – криолит
Ca+25(PO4)-3 3F - фтораппатит
Cl NaCl - поваренная (каменная соль)
KCl∙NaCl- сильвинит
KCl∙MgCl2∙6H2O- карналит
Br в нефтяных скважинах
I в морской воде
Способы получения
F2 - только электролизом расплавов солей (в смеси с HF) KF∙HF
Электроды из Ni, либо сплавов Ni с Fe, Mn, Cu, т. к. F2 очень активен и реагирует почти со всеми элементами. Ni устойчив в атмосфере фтора за счёт образования плёнки NiF2. Поэтому F2 хранят в баллонах, выполненных на основе сплавов никеля.
CoF3 = CoF2 + ½F2
в лаборатории разложением фторидов.
Сl2 в лаборатории действием сильных окислителей на соляную кислоту
2KMnO4 + 16HCl → 5Cl2 + 2MnCl2 + 2KCl + 8H2O
(при обычной температуре)
MnO2 + 4HCl → Cl2 + MnCl2 + 2H2O
PbO2 + 4HCl → PbCl2 + Cl2 + 2H2O
2AuCl3 → 2Au + 3Cl2
Промышленный способ – электролиз водных растворов поваренной соли NaCl
электролиз
2NaCl + 2H2O → H2 + Cl2 + 2NaOH
K ( - ) 2H2O + 2ē = H2 + 2ОH-
А ( + ) 2Cl- - 2ē = Cl2
Br2 и I2 получаются реакциями замещения.
2KBr + Cl2 → 2KCl + Br2
NaЭ + MnO2 + H2SO4 → Э2 +MnSO4 + Na2SO4 + H2O (Э=Br2 ,I2)
NaI + NaNO3 + H2SO4 → I2 + NO2 + Na2SO4
Химические свойства галогенов
Стандартная энтальпия диссоциации ∆Н > 0 (энергия поглощается)
Э2(г) = 2Э(г)
Первое сродство к электрону галогена X(г) + ē = X-(г) ∆Н<0 (энергия выделяется).
Энергия выделяется при образовании галогенида
M+(г) + X-(г) →MX(тв)
Фтор реагирует со взрывом со всеми металлами и неметаллами, кроме O2, N2, Гal2 при этом во всех соединениях с фтором элементы имеет высшую степень окисления.
Например:
SiO2 + 2F2 = Si+4F4 + O2 (во фторе горит SiO2, H2O)
t = 0º – 90º Н2O + F2 = Н+F + O+2F2 (H2O + F2=HF + O2 )
2 Au + 3F2 = 2AuF3
5P + 5F2 = 2PF5
2NH3 + 3F2 = 6HF + N2
F2 + NaOHP → NaF + OF2 + H2O
2F2 + 4NaOHК → 4NaF + O2 + 2H2O
F2 + Xe → XeF4
В ряду Cl2, Br2, I2 окислительная активность падает, а восстановительная активность увеличивается, поэтому, если протекает реакция,
Cl2 + I2 + H2O→HCl + HIO3
ок. восст
хлор выступает в роли окислителя.


