
- •Строение водорода
- •Физические свойства водорода
- •Химические свойства водорода
- •1. Взаимодействие с галогенами
- •2. Взаимодействие с кислородом
- •3. Взаимодействие с серой
- •4. Взаимодействие с азотом
- •5. Взаимодействие со сложными веществами (оксидами металлов и неметаллов)
- •6. Взаимодействие с активными металлами
- •Получение водорода
- •Применение водорода
- •Общая характеристика элементов VII-a группы
- •Особые свойства фтора, как наиболее электроотрицательного элемента
- •Ахождение в природе
- •Способы получения
- •Химические свойства галогенов
- •Способы получения галогеноводородов и их свойства
- •Способы получения галогеноводородов и их свойства
- •Кислородсодержащие соединения галогенов
- •Оксикислоты хлора
- •Реакции разложения hClO
- •Гипохлорит калия
- •Получение белильной извести
3. Взаимодействие с серой
При нагревании водород обратимо реагирует с серой с образованием сероводорода — газа с запахом тухлых яиц:
H2+S=H2S
4. Взаимодействие с азотом
С азотом водород обратимо реагирует при высокой температуре и в присутствии катализатора, например железа, с образованием аммиака NH3 :
3H2+N2=2NH3
5. Взаимодействие со сложными веществами (оксидами металлов и неметаллов)
При взаимодействии со сложными веществами водород проявляет восстановительные свойства, например, он восстанавливает многие металлы из их оксидов:
CuO+H2=Cu+H2O
Fe3O4+4H2=3Fe+4H2O
Эти реакции используются в металлургии для получения металлов. Однако не все металлы могут быть восстановлены водородом из оксидов: таким способом нельзя получить активные металлы, стоящие в ряду активности левее марганца Mn (натрий Na , кальций Ca , алюминий Al и др.).
Большое значение имеет взаимодействие водорода с оксидом азота (). Эта реакция используется в очистительных системах при производстве азотной кислоты:
2NO+2H2=N2+2H2O
Смесь водорода с оксидом углерода(II) CO называется «синтез-газом». Синтез-газ широко используется в органическом синтезе. Например, в присутствии катализатора синтез-газ используется для получения метанола:
![]() —
метанол
—
метанол
Сильным восстановителем является атомарный водород, который образуется из молекулярного в электрическом разряде в условиях низкого давления. Высокой восстановительной активностью обладает водород в момент выделения, образующийся при восстановлении металла кислотой.
6. Взаимодействие с активными металлами
При взаимодействии с металлами водород проявляет окислительные свойства: атом водорода присоединяет электрон и превращается в отрицательно заряженный гидрид-ион H- .
При нагревании водород взаимодействует с активными металлами, образуя белые кристаллические вещества — гидриды металлов:
2Na+H2=2NaH
Ca+H2=CaH2
Получение водорода
В лаборатории водород получают действием кислот (соляной или разбавленной серной) на активные металлы, например на цинк:
Zn+2HCL=ZnCL2+H2
Реакцию обычно проводят в аппарате Киппа, а для получения малых количеств водорода — в приборе Кирюшкина. Водород собирают методом вытеснения воздуха, держа пробирку донышком вверх, или методом вытеснения воды.

Рис. 1. Получение водорода в аппарате Киппа
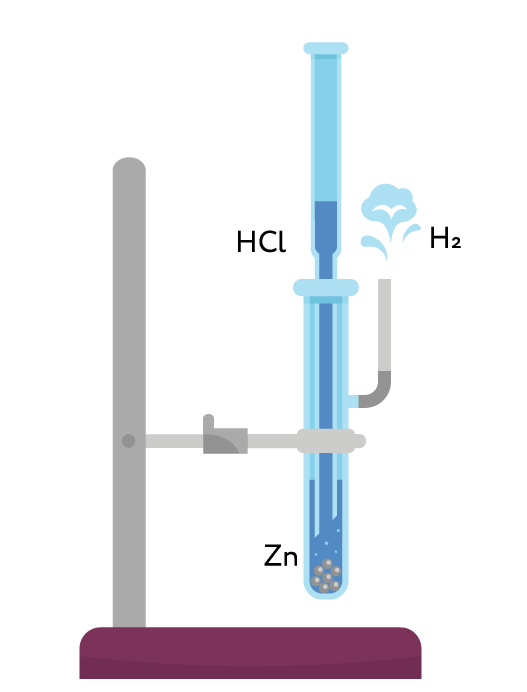
Рис. 2. Прибор Кирюшкина
Водород образуется также при действии растворов щелочей на цинк, кремний и алюминий, при реакции щелочных и щёлочноземельных металлов и их гидридов с водой.
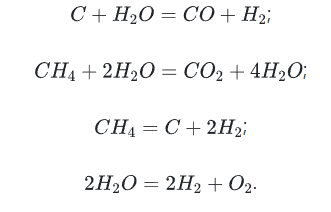 Промышленные
способы получения водорода отличаются
от лабораторных способов его получения.
В промышленности водород получают по
следующим реакциям:
Промышленные
способы получения водорода отличаются
от лабораторных способов его получения.
В промышленности водород получают по
следующим реакциям:
газопаровая конверсия угля:
взаимодействие метана с водяным паром
разложение метана
электролиз воды
.
Применение водорода
Водород применяется:
для получения аммиака, необходимого для производства азотных удобрений, пластмасс, синтетических волокон, лекарств;
для получения хлороводорода;
для получения метилового спирта и других органических веществ из синтез-газа — смеси водорода с угарным газом;
в производстве маргарина;
для получения металлов (например, вольфрама ) из оксидов;
жидкий водород используют как ракетное горючее.
