
2800
.pdfS |
2CL ΔT |
, % |
(3.16) |
|
2L (C |
C ) Т |
|||
|
L |
S |
|
|
где (Сl, и (С$ - удельные теплоемкости жидкого и твердого состояний;
L-скрытая теплота плавления.
Скорость роста дендритов можно найти из условия устойчивого состояния дендрита (по Фишеру), рис. 3.11,6. Пусть поверхность торца дендрита есть полусфера с радиусом rq, температура поверхности Тg , температура расплава Тр, равновесная температура TЕ. Тогда скорость перемещения дендрита U в глубь расплава
U |
2K |
(Tg |
Tp ) |
(3.17) |
|
|
|||||
L ρ rg |
|||||
|
|
|
|
где К - кинетический коэффициент; ρ - плотность металла в твердом состоянии. Полагая, что rq =rкр , получим
rg |
|
2σ TE |
(3.18) |
||
L(TE |
Tg ) |
||||
|
|
|
|||
Тогда
U |
K |
(TE |
Tg )(Tg |
Tp ) |
(3.19) |
|
|
||||||
ρ σ TE |
||||||
|
|
|
|
|
Тg есть величина неизвестная, поэтому скорость U найдем при следующих условиях ~
(TЕ - Тg ) = (Тg - Тр) и TЕ - Тр = ∆Т
U |
K ΔT 2 |
(T) 2 |
т.е. U ~ ΔT 2 |
(3.20) |
4π ρ σ T |
||||
|
E |
|
|
|
Полученное уравнение должно определять максимальную скорость роста. Сопоставление рассчитанной U по уравнению с экспериментом показало значительную расходи-
61
мость. Фишер объясняет это следующим: поверхность границы раздела может быть, во-первых, не строго сферической, и, во-вторых, неизотермической, необходимо учитывать зависимость К от ориентации поверхности дендрита.
4. ПЕРЕРАСПРЕДЕЛЕНИЕ ПРИМЕСИ В ПРОЦЕССЕ ЗАТВЕРДЕВАНИЯ
4.1. Коэффициент распределения
При затвердевании в сплавах обнаруживается различная концентрация компонентов в твердой (Ст) и жидкой (Сж) фазах. Эту особенность удобно характеризовать коэффициентом распределения. Если он определяется как отношение Ст/Cж при условии, что жидкая и твердая фазы находятся в равновесии друг с другом, то пользуются определением коэффициента равновесного распределения K0/11/ . В других случаях неоднородность состава двух фаз выражает через коэффициент эффективного распределения Кэфф, который равен отношению Ст/Со, где Со - средняя концентрация примеси. Анализ равновесных диаграмм состояния показывает, что в процессе затвердевания возможны два случая: 1) примесь оттесняется фронтом кристаллизации по мере образования твердой фазы; 2) растворитель оттесняется поверхностью раздела двух фаз. Эти два случая приведены на рис. 4.1: для первого случая К0 < I. для второго К0 > I.
62
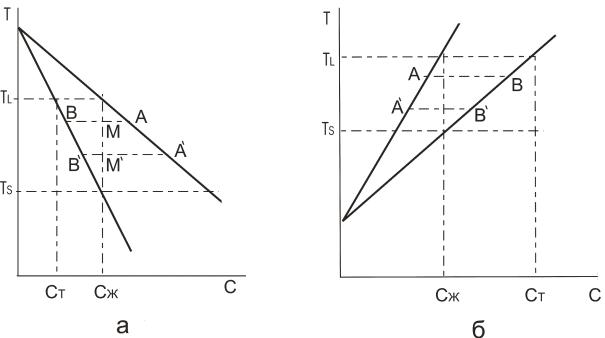
Рис. 4.1. Развитие процесса затвердевания сплавов в равновесных условиях для а) – эвтектических); б) - перитектических.
Пусть жидкая фаза имеет состав Сж. Образующаяся при затвердевании твердая фаза, при условии равновесия с жидким состоянием имеет состав Cт. Возникновение твердого состояния сопровождается изменением состава Сж таким образом, что в эвтектических сплавах Сж возрастает, в перитектических Сж понижается; общее содержание примеси в двух состояниях одного и того же сплава остается неизменным; составу жидкой фазы будет отвечать на диаграмме состояний точка А , составу твердой – точка В . При дальнейшем затвердевании точки А и В переместятся в новой положение А1 и В1 ; при этом относительное количество фаз будет равно отношению АМ/ВМ. Полному затвердеванию сплава будет отвечать смещение точки В до пересечения с вертикальной линией М1 Сж состав твердой фазы будет таким же, как и у жидкой в еѐ первоначальном виде. Однако, для этого необходимо,
63
чтобы скорость протекания диффузионных процессов была достаточной для уменьшения концентрационного градиента до малой величины. На практике это условие полностью никогда не выполняется.
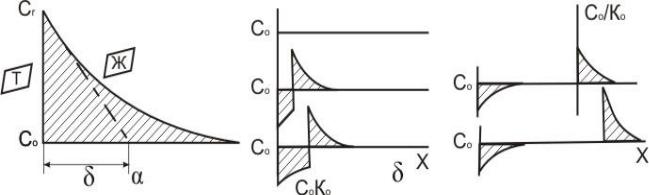
Если конвективный массоперенос примеси отсутствует как в жидкой, так и твердой фазах, то единственным механизмом массопереноса является диффузионный. Необходимо учесть, что диффузия в твердом состоянии протекает значительно медленнее, чем в жидком. Распределение примеси в жидкой фазе в любой момент времени отражается экспоненциальной кривой на рис. 4.2,а; Сг - концентрация примеси на границе раздела жидкое - твердое; С0 - начальный состав расплава.
Рис. 4.2. Схема перераспределения примеси на разных стадиях затвердевания.
В условиях устойчивого состояния количество примеси, оттесненной фронтом затвердевания, равно еѐ количеству, подведенной диффузионным способом, т.е. количеству, определяемому как 7) D (dc/dх). Если состав твердой фазы С0, то Сг =C0/K0 (K0<1). Тогда
|
|
|
1 |
1 KO |
е |
U |
δ , |
|
|
С |
Т |
С |
D |
(4.1) |
|||||
|
|||||||||
|
|
O |
KO |
|
|
||||
|
|
|
|
|
|
||||
64
где U- скорость перемещения границы раздела; б- расстояние от границы раздела до точки в расплаве с концентрацией Сж; D/U- характеристическая длина, в пределах которой концентрация уменьшается в е раз.
Полученная зависимость показывает, что примесь в жидкости распределяется по экспоненциальному закону. Образующаяся на первой стадии затвердевания твердая фаза имеет состав C0.K0 жидкая С0/К0. На рис. 4.2,6 показаны начальные условия, две промежуточные стадии, устойчивое состояние при K0 = 0,33 и концентрация примеси в пределах полностью затвердеващего сплава; площади заштрихованных областей равны, т.к. количество примеси в системе не меняется. Принятое допущение о том, что условие устойчивого состояния выражается в виде Ст = Со справедливо, если поверхность раздела имеет плоскую форму. При искривленной поверхности концентрация примеси в затвердевшем сплаве не будет достигать значе-
ния С0.
Практически обеспечить условия, при которых в затвердевающем сплаве конвекция отсутствует, очень трудно. Поэтому необходимо рассмотреть влияние конвекции, являющейся следствием градиента температуры или концентрации, на перераспределение примеси при затвердевании. Подобную задачу рассмотрел Вагнер. Он предположил, что примесь благодаря диффузии перемещается в жидкости только в слое толщиной , за пределами слоя имеет место конвекция, способствующая выравниванию состава, рис. 4.3,а. Диффузионный слой примыкает к поверхности раздела и содержит малоподвижный объем жидкости.
65
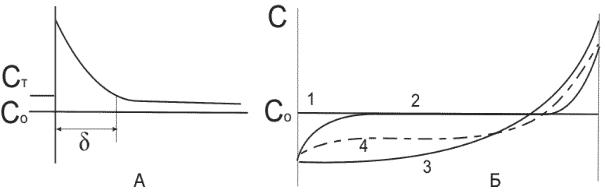
Рис. 4.3. Влияние конвекции на протяженность диффузионной зоны - а); распределение примеси после затвердевания - б) 1 - полностью завершившаяся диффузия в твердой и жидкой фазах (идеальный случай); 2 - диффузионное перемешивание Кэфф = 1+ Ко /2. ; 3 - интенсивное перемешивание в жидкой фазе [Кэфф=К0] ; 4 - частичное перемешивание жидкости [ Кэфф = ( 1 + К0)] .
Эффект конвекции и диффузионного слоя можно оценить, если вместо Ко использовать Кэфф. Тогда можно показать, что концентрация примеси в твердой фазе выражается уравнением
С Т К |
эфф |
С |
О |
(1 g)Ко 1 |
(4.2) |
|
|
|
|
где g - доля жидкой фазы, сохранившейся в системе состояний жидкое - твердое. Бертон, Примы, Слихтер использовали для определения Кэфф следующее выражение:
Кэфф |
|
|
Ко |
|
|
|
(4.3) |
|
|
|
)е |
uδ |
|
||
|
К |
о |
(1 К |
D |
|
|
|
|
|
о |
|
|
|
|
где(U )/D - безразмерный параметр скорости роста. Разные случаи распределения примеси при затвердевании, установленные на основе анализа уравнения для Кэфф, приведены на рис. 4.3,6.
66
Прикладное значение проблемы распределения примесей заключается в следующем. В условиях производства литых заготовок и реальной скорости затвердевания диффузия не успевает завершиться, и поэтому в сплавах не достигается состояние фазового равновесия, предсказываемое диаграммой состояния. Такой процесс кристаллизации является неравновесным: физико-химические условия его протекания лежат в основе явления, называемого ликвацией и сегрегацией. Выявляется она в литых сплавах в виде неоднородности химического состава и является дефектом. Классификация видов ликвации производится в зависимости от причин возникновения, размеров и характера распределения неоднородностей. Так как сплавы, в отличие от чистых металлов, кристаллизуются в интервале температур, то состав кристаллов, образовавшихся в начальной стадии затвердевания, может существенно отличаться от состава кристаллов, завершающих весь процесс образования твердого состояния. Чем шире интервал кристаллизации сплава, тем сильнее проявляется ликвация, причем наибольшую склонность к ней проявляют те компоненты сплава, которые в наибольшей мере влияют на ширину интервала затвердевания; в сталях - это сера, кислород, фосфор, графит и др.
Различают внутрикристаллитную (дендритную) ликвацию, которая обнаруживается в виде неоднородностей химического состава в микрообъемах сплава в пределах зерна (дендрита), выросшего из одного зародыша.
Зональная ликвация - это неоднородность состава в макрообъемах с градиентом концентрации в отливке в целом или в отдельных еѐ частях, еѐ разновидностями являются прямая ликвация (ликвационное пятно, осевая V - образная, внеосевая Λ - образная) и обратная ликвация. Прямая заключается в повышении концентрации компо-
67
нентов или примесей в центральных частях отливки. Обратная ликвация проявляется как повышение концентрации компонентов в периферийных областях отливки.
Особый вид ликвации – это ликвация по плотности, или гравитационная ликвация. По характеру распределения компонентов она также является зональной, т.к. приводит к неоднородному распределение концентрации в мактрообъемах отливки.
Тот факт, что кристаллизация из расплава сопровождается оттеснением фронтом затвердевания либо принеси, либо растворителя, делает возможным производить очистку материалов (зонное рафинирование).
4.2. Конституционное переохлаждение
При обычных условиях затвердевания жидкость, соприкасающаяся с границей раздела между твердой и жидкой фазами (ликват) имеет состав, отличный от состава основного расплава. Температура ликвидуса ликвата может быть больше или ниже температуры расплава (незначительно), удаленного от поверхности раздела. Это зависит от того, каким будет коэффициент распределения: при К0 > Т температура растворителя повышается, при Ко < Т - понижается. В любом случае температура жидкости Тж, ( вблизи границы раздела) обогащенной примесями, ниже температуры ликвидуса основного расплава ТL. Согласно Е. Чалмерсу расплав на некотором расстоянии от кристаллической поверхности становится переохлажденным; возникает так называемое конституционное (концентрационное) переохлаждение. На рис. 4.4. приведена кривая изменения концентрации Сж(Х) компонента в расплава в зависимости от удаления X от границы раздела, конвекция в ликвате отсутствует (устойчивое состояние). Изменение
68
концентрации компоненты на фронте затвердевания вызовет изменение температуры ликвидуса Т (нижняя экспонента Т(х) ); T1 и Т2 отражают температуры ликвидуса для составов Со и С0/К0; температура T1 характеризует основной состав, температура Т2 - ликват, рис. 4.4,б. Реальная температура самой границы раздела близка к Т2. Распределение температуры в жидкой и твердой фазах при условии резкого перепада температур (1) в расплаве
69
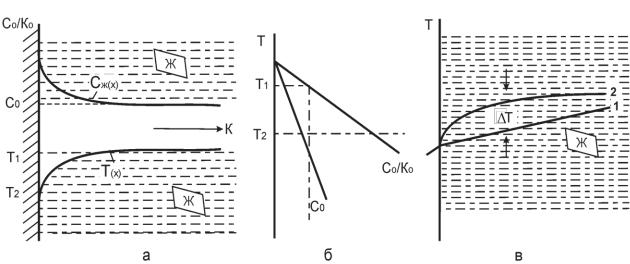
(например, за счет большого переохлаждения низкотеплопроводного расплава), рис, 4.4,в, показывает, что жидкость (ликват) находится в переохлажденной состоянии. Еѐ температура ниже температуры ликвидуса (кривая 2), При удалений от границы раздела (при
Рис. 4.4. -Изменение концентрации Сж (х); и температуры ликвидуса Т(х) в области ликвата - а); зависимость температуры ликвидуса от состава - б); изменение фактической температура (1) ликвата и ликвидуса (2) вблизи плоской границы - в). увеличении X)
величина конституционного переохлаждения возрастает, а затем понижается до нуля. Возникновение переохлажденного слоя вблизи фронта затвердевания может изменить форму фронта кристаллизации, повлиять на первичную структуру кристаллизующегося сплава. Причем достаточно очень небольшого переохлаждения, чтобы от устойчивого роста кристаллов перейти к неустойчивому. Возникающая неустойчивость, обусловленная конституционным переохлаждением, имеет периодический характер, поэтому, как полагает Л.Д, Ландау, содержание примеси в
70
