
Физическая химия.-1
.pdfОкончание табл. 6
Номер |
Реакция, параметры, |
t, мин |
Результат |
варианта |
условия протекания |
|
контроля за |
|
|
|
ходом реакции |
22 |
2NH3(г) N2(г) + 3H2(г); |
1,7 |
P |
|
Р– повышениедавлениясистемы, Па; |
1466,3 |
|
|
Р0 – начальноедавление, ммрт. ст., |
3,3 |
2945,9 |
|
Р0 = 200 мм рт. ст. |
6,7 |
5865,2 |
|
|
10,0 |
8837,8 |
|
|
13,3 |
11717,0 |
|
|
16,7 |
14663,0 |
23 |
C6H5N2Cl C6H5Cl + N2; |
|
а |
|
а – объем выделившегося N2, см3 |
6 |
19,3 |
|
|
9 |
26,0 |
|
|
12 |
32,6 |
|
|
14 |
36,0 |
|
|
18 |
41,3 |
|
|
22 |
45,0 |
|
|
24 |
46,5 |
|
|
26 |
48,3 |
|
|
30 |
50,4 |
|
|
|
58,3 |
24 |
C5H5N + C2H5I C7H10N+ + I–; |
3,9 |
с |
|
с – концентрация I–, ммоль/л; |
15 |
|
|
с0 – начальная концентрация C2H5I, |
7,8 |
26 |
|
ммоль/л, с0 = 100 ммоль/л |
12,0 |
35 |
|
|
17,3 |
44 |
|
|
24,0 |
52 |
|
|
32,0 |
59 |
|
|
39,5 |
64 |
25 |
2C4H6(г) C8H12(г); |
0 |
Р |
|
Р – общее давление системы, кПа; |
84,2 |
|
|
V = const |
10,1 |
78,9 |
|
|
20,8 |
74,2 |
|
|
29,2 |
71,4 |
|
|
49,5 |
66,4 |
|
|
60,9 |
64,4 |
|
|
90,0 |
60,4 |
|
|
119,0 |
57,7 |
41
Задание 3.2. Определение кинетических характеристик сложных последовательных реакций
Последовательная реакция первого порядка протекает по схеме
k1 k2
А → Б → В.
При температуре 298 К константа скорости реакции А → Б равна k1, а реакции Б → В равна k2. Начальная концентрация исходного вещества [А]0. Вычислите:
1) координаты максимума кривой [Б] = f (t) (максимальную концентрацию промежуточного продукта [Б]max и время ее достижения tmax);
2)время t1, когда концентрация исходного вещества достигнет значения [А]1;
3)концентрации веществ [Б] и [В] в момент времени t1;
4)время t2, за которое концентрация промежуточного вещества станет равной [Б]1;
5)координаты точки перегиба ([В]пер, t3) кривой [В] = f (t);
6)точку пересечения кривых [А] = f (t) и [Б] = f (t).
По полученным данным постройте графики [А] = f (t), [Б] = = f (t) и[В] = f (t), представив результаты расчетовввиде таблицы:
tmax, |
[Б]max, |
t1, |
[Б]0, |
[В]t, |
t2, |
[В]пер, |
t3, |
[Б] = [А], |
t4, |
мин |
моль/л |
мин |
моль/л |
моль/л |
мин |
моль/л |
мин |
моль/л |
мин |
|
|
|
|
|
|
|
|
|
|
Необходимые для расчета данные возьмите в табл. 7
Таблица 7
Номер |
[А]0, |
[А]1, |
[Б]1, |
k1, |
k2, |
варианта |
моль/л |
моль/л |
моль/л |
мин–1 |
мин–1 |
1 |
2,0 |
0,003 |
0,01 |
0,10 |
0,05 |
2 |
1,2 |
0,011 |
0,01 |
0,15 |
0,05 |
3 |
1,4 |
0,002 |
0,03 |
0,12 |
0,05 |
4 |
1,0 |
0,006 |
0,02 |
0,10 |
0,05 |
5 |
1,3 |
0,005 |
0,01 |
0,11 |
0,05 |
42
|
|
|
Окончание |
табл. 7 |
|
Номер |
[А]0, |
[А]1, |
[Б]1, |
k1, |
k2, |
варианта |
моль/л |
моль/л |
моль/л |
мин–1 |
мин–1 |
6 |
2,0 |
0,004 |
0,02 |
0,10 |
0,06 |
7 |
1,2 |
0,011 |
0,01 |
0,15 |
0,06 |
8 |
1,4 |
0,001 |
0,02 |
0,12 |
0,06 |
9 |
1,0 |
0,007 |
0,01 |
0,13 |
0,06 |
10 |
1,3 |
0,005 |
0,02 |
0,11 |
0,06 |
11 |
1,5 |
0,001 |
0,01 |
0,10 |
0,07 |
12 |
1,5 |
0,001 |
0,02 |
0,11 |
0,07 |
13 |
1,5 |
0,002 |
0,01 |
0,12 |
0,07 |
14 |
2,0 |
0,002 |
0,02 |
0,13 |
0,07 |
15 |
2,0 |
0,004 |
0,02 |
0,10 |
0,07 |
16 |
1,2 |
0,010 |
0,01 |
0,15 |
0,07 |
17 |
1,4 |
0,02 |
0,03 |
0,12 |
0,07 |
18 |
1,3 |
0,09 |
0,03 |
0,13 |
0,07 |
19 |
2,0 |
0,003 |
0,01 |
0,14 |
0,08 |
20 |
2,0 |
0,005 |
0,01 |
0,10 |
0,08 |
21 |
1,2 |
0,005 |
0,01 |
0,15 |
0,08 |
22 |
1,4 |
0,001 |
0,02 |
0,12 |
0,08 |
23 |
1,0 |
0,008 |
0,01 |
0,13 |
0,08 |
24 |
1,2 |
0,010 |
0,02 |
0,15 |
0,09 |
25 |
1,2 |
0,005 |
0,02 |
0,10 |
0,09 |
Задание 3.3. Определение энергии активации и других кинетических констант химических реакций
Используя значения констант скорости k1 и k 2 реакции при двух различных температурах T1 и T2 (табл. 8), вычислите:
1)энергию активации реакции;
2)константу скорости при температуре Т3;
3)степень превращения исходного вещества к моменту времени t (с0 – начальная концентрация);
4)температурный коэффициент скорости реакции; проверьте применимость правила Вант-Гоффа.
Порядок реакции считайте равным молекулярности. Кон-
станты скорости для реакций первого, второго и третьего порядков соответственно имеют следующие размерности: мин–1; мин–1 (кмоль/м3)–1; мин–1 (кмоль/м3)–2.
43
44
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица |
8 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Номер |
|
|
|
Реакция |
Т1, К |
k1 |
|
|
|
Т2, К |
k2 |
|
Т3, К |
t, мин |
с0, |
|
3 |
|
варианта |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кмоль/м |
|
|
1 |
2NO2 2NO + O2 |
600 |
1,4 |
|
|
640 |
6,8 |
|
700 |
20 |
0,1 |
|
|
|||||
2 |
Cu + (NH4)2S2O8 CuSO4 + (NH4)2SO4 |
293,2 |
0,0096 |
|
333,2 |
0,0400 |
313,2 |
60 |
0,05 |
|
|
|||||||
3 |
C2H5I + NaOH C2H5OH + NaI |
288,8 |
0,00005 |
363,6 |
0,119 |
|
305,0 |
30 |
0,8 |
|
|
|||||||
4 |
C6H5COH + C6H5COH |
313,0 |
0,026 |
|
|
333,0 |
0,089 |
|
322,9 |
10 |
1,3 |
|
|
|||||
|
C6H5CHOHCOC6H5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
5 |
C12H22O11 + H2O C6H12O6 + C6H12O6 |
298,2 |
0,765 |
|
|
328,2 |
35,5 |
|
313,2 |
15 |
1,85 |
|
|
|||||
6 |
2NO + Br2 2NOBr |
265,2 |
0,00212 |
288,0 |
0,00268 |
273,7 |
18 |
2,0 |
|
|
||||||||
7 |
H2 + Br2 2HBr |
574,5 |
0,0856 |
|
497,2 |
0,00036 |
483,2 |
60 |
0,03 |
|
|
|||||||
8 |
H2 + Br2 2HBr |
550,7 |
0,0159 |
|
524,6 |
0,0026 |
568,2 |
10 |
0,1 |
|
|
|||||||
9 |
H2 + I2 2HI |
599,0 |
0,00146 |
672,0 |
0,0568 |
648,2 |
28 |
2,83 |
|
|
||||||||
10 |
H2 + I2 2HI |
683,0 |
0,0659 |
|
716,0 |
0,375 |
|
693,2 |
27 |
1,83 |
|
|
||||||
11 |
2HI |
|
H2 + I2 |
456,2 |
|
|
|
–6 |
700,0 |
|
–3 |
923,2 |
17 |
2,38 |
|
|
||
|
|
|
9,42 10 |
|
|
|
3,10 10 |
|
|
|
|
|
|
|||||
12 |
2HI |
|
H2 + I2 |
628,4 |
|
|
|
–5 |
780,4 |
0,1059 |
976,2 |
18 |
1,87 |
|
|
|||
|
|
|
8,09 10 |
|
|
|
|
|
|
|
|
|
|
|||||
13 |
2NO N2 + O2 |
1525,2 |
47059 |
|
1251,4 |
1073 |
|
1423,2 |
45 |
2,83 |
|
|
||||||
14 |
2N2O 2N2 + O2 |
986,0 |
6,72 |
|
|
1165,0 |
977,0 |
|
1053,2 |
65 |
1,75 |
|
|
|||||
15 |
N2O5 N2O4 + 0,5O2 |
298,2 |
2,03 10–3 |
288,2 |
0,475 10–3 |
338,2 |
32 |
0,93 |
|
|
||||||||
16 |
PH3 P + 1,5H2 |
953,2 |
0,0183 |
|
918,2 |
0,0038 |
988,2 |
80 |
0,87 |
|
|
|||||||
17 |
SO2Cl2 |
|
SO2 + Cl2 |
552,2 |
0,609 |
|
10 |
–4 |
593,2 |
|
–2 |
688,2 |
35 |
2,5 |
|
|
||
|
|
|
|
|
|
0,132 10 |
|
|
|
|
|
|||||||
18 |
CO + H2O CO2 + H2 |
288,2 |
0,00031 |
313,2 |
0,00815 |
303,2 |
89 |
3,85 |
|
|
||||||||
19 |
COCl2 |
|
CO + Cl2 |
655,0 |
|
|
|
–2 |
745,0 |
|
–2 |
698,2 |
104,5 |
0,8 |
|
|
||
|
|
|
0,53 10 |
|
|
|
67,6 10 |
|
|
|
|
|
|
|||||
44

|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Окончание табл. |
8 |
|||||
Номер |
Реакция |
Т1, К |
k1 |
|
|
|
Т2, К |
k2 |
|
Т3, К |
t, мин |
с0, |
|
3 |
||||||||
варианта |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кмоль/м |
|
|
20 |
2CH2O + NaOH |
|
HCOОNa + CH3OH |
323,2 |
5,5 |
|
10 |
–3 |
358,2 |
|
–3 |
368,2 |
10 |
0,5 |
|
|
||||||
|
|
|
|
|
|
|
|
294,0 10 |
|
|
|
|
|
|
||||||||
21 |
C2H5ONa + CH3I C2H5OCH3 + NaI |
273,3 |
0,0336 |
|
303,2 |
2,125 |
|
288,2 |
10 |
0,87 |
|
|
||||||||||
22 |
|
|
|
|
|
297,7 |
0,68 |
|
|
316,8 |
5,23 |
|
303,2 |
18 |
0,96 |
|
|
|||||
|
CH2OHCH2Cl + KOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
CH2OHCH2OH + KCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
23 |
CH2ClCOOH + H2O |
|
|
353,2 |
0,222 |
|
10 |
–4 |
403,2 |
|
–2 |
423,2 |
26 |
0,50 |
|
|
||||||
|
|
|
|
|
|
|
0,237 10 |
|
|
|
|
|
|
|||||||||
|
CH2OHCOOH + HCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
24 |
KClO3 + 6FeSO4 |
+ 3H2SO4 KCl + |
283,2 |
1,00 |
|
|
305,2 |
7,15 |
|
383,2 |
35 |
1,67 |
|
|
||||||||
|
+ 3Fe2(SO4)3 + 3H2O (реакция первого |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
порядка) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
25 |
CH3COОCH3 + H2O |
|
CH3COОH + |
298,2 |
0,653 |
|
10 |
–3 |
308,2 |
|
–3 |
313,2 |
25 |
1,60 |
|
|
||||||
|
|
|
|
|
|
1,663 10 |
|
|
|
|
|
|
||||||||||
|
+ CH3OH (в водн. р-ре с катал.) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
26 |
CH3COОCH3 + H2O |
|
CH3COОH + |
298,2 |
16,09 |
|
10 |
–3 |
308,2 |
|
–3 |
323,2 |
80 |
2,96 |
|
|
||||||
|
|
|
|
|
|
37,84 10 |
|
|
|
|
|
|
||||||||||
|
+ CH3OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
27 |
|
|
|
|
|
CH3COОH + |
273,2 |
2,056 |
|
10 |
–5 |
313,2 |
|
–5 |
298,2 |
67 |
3,55 |
|
|
|||
|
CH3COОC2H5 + H2O |
|
|
|
|
109,4 10 |
|
|
|
|
|
|
||||||||||
|
+ C2H5OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
28 |
2CH2O + NaOH |
|
HCOОNa + CH3OH |
323,2 |
5,5 |
|
10 |
–3 |
358,2 |
|
–3 |
338,2 |
5 |
0,5 |
|
|
||||||
|
|
|
|
|
|
|
|
294,0 10 |
|
|
|
|
|
|
||||||||
29 |
(CH3)2SO4 + NaI CH3I + |
273,2 |
0,029 |
|
298,2 |
1,04 |
|
285,8 |
100 |
3,89 |
|
|
||||||||||
|
+ Na(CH3)SO4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
30 |
C6H5CH2Br + C2H5OH |
298,2 |
1,44 |
|
|
338,2 |
2,01 |
|
318,2 |
90 |
2,67 |
|
|
|||||||||
|
C6H5CHOC2H5 + HBr |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
45
45

Пример 3.1. Определите порядок реакции CH3Br + H2OCH3OH + HBr и вычислите среднее значение константы скорости, пользуясь следующими экспериментальными данными:
t, ч |
4,8 |
8,3 |
15,0 |
23,3 |
33,3 |
50,0 |
|
сСН3ОН , ммоль/л |
12,0 |
18,7 |
28,9 |
37,9 |
45,0 |
51,6 |
57,2 |
|
|
|
|
|
|
|
|
Решение. Обозначим убыль концентрации CH3Br к текущему моменту времени через х (ммоль/л). В соответствии с уравнением реакции величина х равна концентрации полученного CH3OH. Тогда к моменту времени t концентрацию СН3Br рассчитаем по уравнению сСН3Br = с0 – x, где с0 – исходная кон-
центрация CH3Br. Величина с0 соответствует полному превра-
щению CH3Br в CH3OH (с0 = с ).
Получим следующие результаты:
t, ч |
0 |
4,8 |
8,3 |
15,0 |
23,3 |
33,3 |
50,0 |
сСН3Br , ммоль/л |
57,2 |
45,2 |
38,5 |
28,3 |
19,3 |
12,2 |
5,6 |
|
|
|
|
|
|
|
|
Для определения порядка реакции используем метод подстановки. Метод подстановки заключается в определении, какое уравнение кинетики реакции (первого, второго или третьего порядка) при подстановке в него экспериментальных данных дает при решении близкие значения констант скорости реакции. Именно это уравнение иопределяет порядокисследуемойреакции.
Эти уравнения имеют вид:
– для реакции первого порядка k1 1t ln сс0 ;
– для реакции второго порядка k2 |
|
1 |
|
1 |
|
|
1 |
|
; |
|
|
||||||
|
|
|
|
|
|||||||||||||
t |
|
с |
с0 |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||
– для реакции третьего порядка |
k |
|
|
1 |
|
|
|
1 |
|
|
|
|
1 |
|
, |
||
|
|
|
|
|
|
|
|
||||||||||
2t |
|
с2 |
|
с2 |
|||||||||||||
|
3 |
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
||
где с0 – начальная концентрация исходных веществ; с – концентрация исходных веществ к данному моменту времени t.
46

Подставим экспериментальные данные в уравнения для расчета констант скоростей реакции:
t, ч |
|
|
|
|
|
|
|
4,8 |
8,3 |
15,0 |
23,3 |
33,3 |
50,0 |
k1, ч–1 |
|
|
|
|
|
0,0491 |
0,0477 |
0,0469 |
0,0466 |
0,0464 |
0,0465 |
||
|
|
|
–1 |
|
|
|
–1 |
0,967 |
1,020 |
1,180 |
1,470 |
1,940 |
3,220 |
k2, л ч |
|
моль |
|
|
|
|
|
|
|||||
|
3 |
|
2 |
ч |
–1 |
–2 |
0,0191 |
0,0222 |
0,0314 |
0,0510 |
0,0963 |
0,3158 |
|
k3 10 |
|
, л |
|
|
моль |
|
|
|
|
|
|
||
Наиболее близкие значения констант скоростей получены для первого уравнения. Следовательно, рассматриваемая реакция имеет первый порядок.
Подсчитав их среднее значение, получим kcp = 0,0472 ч–1.
Пример 3.2. Определите графическим способом порядок реакции разложения N2O5 при температуре 298 К (V = const). В течение реакции N2O5(г) N2O4(г) + 0,5O2(г) общее давление изменялось следующим образом:
t, ч |
0,33 |
0,50 |
0,67 |
0,83 |
1,67 |
2,33 |
Р, Па |
44665,5 |
45925,0 |
47078,0 |
48144,4 |
52476,3 |
54862,2 |
Начальное давление в системе P0 = 41080 Па.
Решение. Концентрации исходного вещества можно заменить его парциальными давлениями, так как давление газа пропорционально его концентрации при Т = const.
Выразим парциальное давление исходного вещества через общее давление системы. Пусть к моменту времени t убыль парциального давления N2O5 будет равна х. Тогда по уравнению
реакции PN2O4 = x; PO2 = 12 х . Парциальное давление N2O5 в мо-
мент времени t
PN2O5 = P0 – x,
где P0 – начальное давление N2O5.
Общее давление системы в момент времени t
Р = Р0 – х + х + 12 х = Р0 + 12 х .
47
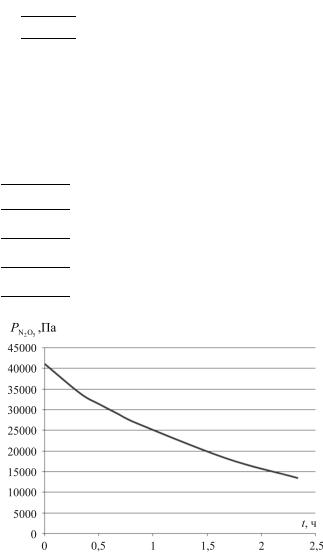
Отсюда х = 2(Р – Р0). Тогда
PN2O5 = P0 – x = 3 P0 – 2Р.
Рассчитаем PN2O5 в момент времени t:
t, ч |
|
0,33 |
0,50 |
0,67 |
0,83 |
1,67 |
2,33 |
РN2O5 , |
Па |
33909,0 |
31390,0 |
29084,0 |
26951,2 |
18287,4 |
13515,6 |
Построим графики следующих зависимостей (рис. 1–4):
1)PN2O5 = f(t);
2)ln PN2O5 = f(t);
3)1/ PN2O5 = f(t);
4)1/ PN22O5 = f(t).
Используем следующие данные:
t, ч |
РN2O5 , Па |
ln РN2O5 |
1/ РN2O5 105, Па–1 |
1/ РN2 2O5 1010, Па–2 |
|
41080,0 |
|
|
|
0 |
10,623 |
2,43 |
5,93 |
|
0,33 |
33909,0 |
10,431 |
2,95 |
8,70 |
0,50 |
31390,0 |
10,354 |
3,19 |
10,15 |
0,67 |
29084,0 |
10,278 |
3,44 |
11,82 |
0,83 |
26951,2 |
10,202 |
3,71 |
13,77 |
1,67 |
18287,4 |
9,814 |
5,47 |
29,90 |
2,33 |
13515,6 |
9,512 |
7,40 |
54,74 |
48
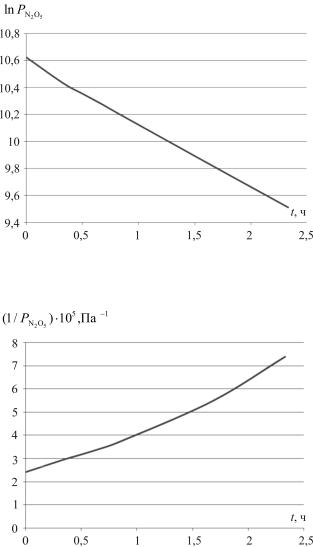
Рис. 1. Зависимость РN2O5 = f(t)
Рис. 2. Зависимость ln РN2O5 = f(t)
Рис. 3. Зависимость 1/ РN2O5 = f(t)
49

Рис. 4. Зависимость 1/ РN2 2O5 = f(t)
Линейная зависимость получается в координатах ln PN2O5 – t
(см. рис. 2), следовательно, данная реакция является реакцией первого порядка.
Пример 3.3. Рассчитайте энергию активации химической реакции, если константы скорости реакции при 273 и 280 К соответственно равны 4,04 10–5 и 7,72 10–5 с–1.
Решение. Зависимость константы скорости химической реакции от температуры описывается уравнением Аррениуса:
d ln k |
|
Eа |
, |
|
dT |
RT 2 |
|||
|
|
где Еа – энергия активации химической реакции; R – универсальная газовая постоянная, равная 8,31 Дж/(моль К).
Интегрируя уравнение Аррениуса в пределах от Т1 до Т2, получим
|
k |
|
Eа |
|
1 |
|
1 |
|
|
ln |
T2 |
|
|
|
|
, |
|||
kT1 |
|
|
|
||||||
|
|
R T1 |
T2 |
|
|
||||
50
