
Промышленные системы водоснабжения и водоотведения. Ресурсосберегаю
.pdf
Таким образом, регулирование состояния системы позволяет избирательно удалять нефтепродукты и взвешенные вещества, временно переводя компоненты синтетических моющих средств в неактивные формы, сохраняя ихдля дальнейшего использования.
Процессы рН-регулирования описаны в гл. 3. Получены закономерности устойчивости дисперсных систем, стабилизированных моющими средствами, установлена эффективность очистки, определяемая рН. Предпочтительным для оборотных систем является рН>8,4 (слабощелочная среда оборотных моечных вод). Регулирование рН может осуществляться как минеральными кислотами, так и другими реагентами, меняющими кислотность водных растворов при гидролизе.
а |
б |
в |
Рис. 4.15. Формы стабилизации загрязнений
Метод регулирования рН позволяет повысить эффективность очистки и может быть использован на стадии глубокой очистки моечных вод.
4.2.4. Реагентная сорбционная очистка (соосаждение при химической обработке загрязненных моечных вод)
В практике очистки загрязненных моечных вод применяют соли поливалентных металлов.
Алюмосодержащие коагулянты являются наиболее эффективными и доступными реагентами для очистки загрязненных моечных вод (водных растворов моющих средств). Коагулянтом нового поколения является гидроксохлорид алюминия
81
(ГХА), выпускаемый согласно ТУ 6-00-05795731-250-96 двух марок: марка А– раствор гидроксохлорида алюминия, марка Б– твердый продукт, содержат не менее 18 и 45 % основного вещества впересчете наоксид алюминия соответственно (табл. 4.2).
|
Т а б л и ц а 4 . 2 |
||
Реагенты на основе соединений алюминия |
|||
|
|
|
|
Наименование реагента |
Гидроксохлорид алюминия |
||
|
|
|
|
Химическая формула |
Al2(OH)nUm × H2O |
|
|
|
n = 3,0–5,0 m = 1,0–3,0 |
|
|
|
x = 1,0–1,5 для марки Б |
|
|
ТУ, ГОСТ |
ТУ 6-00-05795731-250-96 |
||
Технические характеристики: |
Марка А |
|
Марка Б |
– массовая доля Al в пересчете |
18,0 |
|
>45,0 |
на оксид %, |
4,0 ± 0,5 |
|
4,0 ± 0,5 |
– водородный показатель pH |
|
||
0,5 % водного раствора |
|
|
|
|
|
|
|
Торговая марка |
А – 208А |
|
А – 208Б |
Назначение |
Неорганическийполимер-коагулянт |
||
Использование неорганического полимерного коагулянта в качестве дестабилизатора системы приводит к разрушению химических соединений, входящих в состав моющих средств, и образованию нерастворимых соединений. Сорбционные процессы взаимодействия образованных соединений и присутствующих веществ ведут к их соосаждению (рис. 4.16).
Явление поглощения растворенных веществ осадками именуют сорбцией. Этот термин очень удобен, так как может быть применен для обозначения всех процессов безотносительно к тому, происходит ли адсорбция, абсорбция, хемосорбция или имеет место какой-либо другой механизм поглощения сорбата сорбентом. Кроме того, термин сорбция в одинаковой мере может быть использован для описания процесса поглощения компонентов раствора готовыми осадками в процессе соосаждения.
82

Рис. 4.16. Обработка моечных вод разными дозами гидроксохлорида алюминия
Основой современных синтетических моющих средств являются следующие химические вещества:
Na5P3O10 – триполифосфат натрия до 50 %; Na2CO3 – углекислый натрий до 30 %; Na2O·3SiO2 – силикат натрия до 30 %; поверхностно-активные вещества – до 10 %.
Компоненты моющих средств определяют электролитическое состояние водного раствора, характеризуемого щелочностью
(рис. 4.17).
В водной среде Na2CO3 гидролизуется с последующим разложением угольной кислоты и удалением углекислого газа из систем по реакциям:
Na2CO3 + 2H2O = 2NaOH + H2CO3,
H2CO3 = H2O + CO2↑.
83

Рис. 4.17. Изменение щелочности раствора СМС в зависимости от концентрации СМС
Силикат натрия разлагается с образованием щелочи и золя SiO2, который под действием противоположно заряженных ионов коагулянта нейтрализует поверхностный заряд, укрупняется и оседает.
Na2O·3SiO2 = Na2Si3O7,
Na2Si3O7 + H2O = 2NaOH + 3SiO2↓.
Триполифосфат натрия в щелочной среде разлагается с образованием фосфатов натрия:
NaP3O10 + 4NaOH = 3Na3PO4 + 2H2O.
Образующиеся фосфаты натрия взаимодействуют с ионами алюминия, образуя практически нерастворимое соединение фосфата алюминия, произведение растворимости которого равно 5,75·1019+. Одновременно фосфаты связывают из раствора ионы жесткости (Ca, Mg) и железа в фосфаты Ca3(PO4)2, Mg3(PO4)2 и FePO4, произведения растворимости которых соот-
ветственно равны 2·10–29; 1·10–19; 1,3·10–22.
В основу взаимодействия положены следующие реакции: Al3+ + Na3PO4 = AlPO4 + 3Na+,
3Ca2+ + 2Na3PO4 = Ca3(PO4)2 + 6Na+,
3Mg2+ + 2 Na3PO4 = Mg3(PO4)2 + 6Na+,
Fe3+ + Na3PO4 = FePO4 + 3Na+,
84
При использовании алюмосодержащих коагулянтов в процессе растворения образуются гидратированные ионы алюминия – [Al(H2O)6]3+, которые в процессе гидролиза отдают протон от координированной молекулы воды, образуя последовательно комплексные ионыпосхеме:
[Al(H2O)6]3+ + H2O = [Al(OH) (H2O)5]2+ + H3O+,
[Al(H2O)5(OH)]2+ + H2O = [Al(OH)4(H2O)2]+ + H3O+, [Al(H2O)4(OH)2]+ + H2O = [Al(OH)3(H2O)3] + H3O+ = = Al (OH) 3 + 3H2O + H3O+.
На образование четырехразрядных гидроксокомплексов [Al8(OH)20]9+ указывается рядом авторов. Они отмечают образование поликатионов с более высокой степенью полимери-
зации [Al13(OH)32(H2O)n] по схеме:
13Al+ + 32H2O = [Al13(OH)32]7+ + 32H7+.
Причем отмечается возможность существования полиядерных гидроксокомплексов с более высоким фактором полимериза-
ции: [Al14(OH)32]8+; [Al30Cl9(OH)81(H2O)38±5 ] и от [Al24(OH)60]12+ до [Al96(OH)264]24+.
Таким образом, гидроксохлорид алюминия является одновременно неорганическим полимером, обладающим свойствами флокулянта. Наличие хлора в составе гидроксохлорида алюминия придает ему свойства своеобразного дезинфектанта.
Гидроксохлорид алюминия является кислым коагулянтом. Одновременно в процессе его гидролиза изменяется pН системы (рис. 4.18–4.22). Введение гидроксохлорида алюминия, имеющего водородный показатель 0,5 %, водного раствора по оксиду алюминия, равного 4±0,5, снижает щелочной запас системы до 6,5–7,0 вобласти разрушенияПАВ, масел и нефтепродуктов.
Для снижения расхода дорогостоящего коагулянта рекомендуется совместная кислотно-коагуляционная обработка очищаемых вод. В отработанные моющие растворы вводят кислоту для снижения рН среды с 12 до 10–10,5 с целью нейтрализации избыточной щелочности с последующим достижением рН 6,5–7,0 после введения коагулянта.
85

Рис. 4.18. Изменение рН моечных вод при различных соотношениях гидроксохлорида алюминия и минеральной кислоты: 1–5 – кривые разных доз кислоты от 0 до 4,5 мл
1 |
2 |
3 |
Рис. 4.19. Обработка моечных вод гидроксохлоридом алюминия: 1 – проба загрязненных моечных вод;
2 – то же, после обработки гидроксохлоридом алюминия; 3 – то же, после обработки и фильтрования
через песчаный фильтр
86

Рис. 4.20. Исследование процессов отделения осадка фильтрованием моечных вод с высоким содержанием загрязнений, обработанных гидроксохлоридом алюминия
В настоящее время гидроксохлорид алюминия – один из наиболее эффективных дестабилизаторов многокомпонентных систем, содержащих в своем составе неорганические соединения, взвешенные вещества, масла и нефтепродукты, примером которых являются загрязненные моющие растворы. Реагентные методы очистки загрязненных моечных вод эффективны и могут быть рекомендованы для небольших объемов сточных вод, когда сохранение компонентов СМС для повторного использования экономически нецелесообразно по сравнению с затратами на водоочистное оборудование, или в случаях, диктуемых спецификой производства.
Отделение осадка после обработки гидроксохлоридом алюминия можно произвести отстаиванием и фильтрованием (см. рис. 4.19, 4.20). Динамика уплотнения осадка отстаиванием приведена нарис. 4.21, 4.22.
Отстаивание позволяет снизить объем до 20 % исходного слоя. Определение осадка на песчаных фильтрах дает хороший результат и может быть применено как на специальных фильтрах, так и на искусственных или естественных фильтрующих песчаных площадках.
87
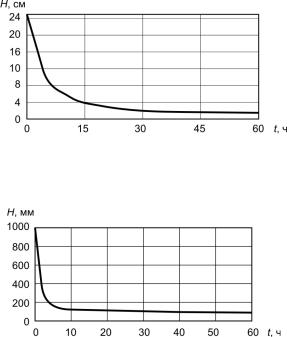
Рис. 4.21. Динамика уплотнения осадка в первый час, Н – высота слоя осадка, см
Рис. 4.22. Динамика уплотнения осадка за 60 часов
4.3. МЕТОД ОПРЕДЕЛЕНИЯ НЕОБХОДИМОЙ
СТЕПЕНИ ОЧИСТКИ ОБОРОТНЫХ ВОД
4.3.1. Моделирование процесса очистки загрязненных моечных вод в оборотных системах водопользования
Оптимизация процесса очистки оборотных вод является важной научно-технической задачей. Рассмотрение этого вопроса предлагается на примере очистки моечных вод.
Рассматриваем процесс очистки оборотных вод, который включает реагентную обработку и фильтрование. Исследуем эффективность процесса, которая зависит от дозы реагента. Необхо-
88
димоподобратьтакуюдозуреагента, котораябылабыоптимальной с точки зрения различных критериев, касающихся как качества, скорости очистки, так и эффективности всего процесса. Все критерииможноусловноразделитьнадвегруппы:
–критерии эффективности очистки воды,
–критерии технологической эффективности процесса. Введение второго критерия оптимизации является но-
вым, но закономерным решением исследования оборотных систем водопользования.
В процессе очистки происходят химические изменения свойств воды, которые также зависят от дозы реагента, поступившего в загрязненную воду (рис. 4.23, б).
При очистке моечных вод улучшаются эксплуатационные характеристики: уменьшаются поверхностное натяжение, вязкость, растет моющая способность. Моющий раствор, приготовленный на основе очищенных вод, подкрепляют новыми порциями СМС. Повышение концентрации СМС во вторичном растворе увеличивает его моющие характеристики (рис. 4.23, а). Чем лучше проведена очистка моечных вод, тем меньшее количество моющего средства требуется для достижения его максимальной моющей способности.
О восстановлении свойств раствора можно судить по показателю восстановления моющего действия (рис. 4.23, в), который может быть определен по формуле
Котм = ∆ t / Ссмс,
где t – время отмыва площадки, ∆ t = t1–t 2; t1; С– концентрация моющего средства.
На рис. 4.23, г дан совмещенный график двух параметров оптимизации процесса очистки.
Параметры, характеризующие эти изменения, должны находиться в допустимых пределах, установленных для данного процесса. Модель данного процесса можно представить в следующем виде (рис. 4.24).
89

Рис. 4.23. Функции критериев процесса очистки. Построение совмещенного графика оптимизации процесса очистки: а – изменение времени отмыва эталонной площадки вторичными растворами от дозы СМС; б – изменение физикохимических характеристик моечных вод при очистке – рН воды, где См – показатель загрязненности, Щм – щелочность общая, Щф – щелочность бикарбонатная; в – кривая показателя восстановления моющего действия очищаемых моечных вод, Котм – показатель моющей способности; г – совмещенный график двух параметров оптимизации,
Ссмс – концентрация синтетического моющего средства, t – время очистки загрязнений, Д – доза реагента
90
