
Микробиология и биотехнология
..pdfПо назначению различают элективные и дифференциальнодиагностические среды
Элективные (избирательные) среды обеспечивают пре-
имущественно развитие одного вида или группы микроорганизмов и менее пригодны, либо совсем непригодны для развития других. Элективные среды применяют для выделения микроорганизмов из мест их естественного местообитания или для получения накопительных культур.
Дифференциально-диагностические (индикаторные) среды
позволяют достаточно быстро отличить один вид микроорганизмов от других. Их применяют в клинической бактериологии, генетических исследованиях и для идентификации микроорганизмов.
По физиологическому состоянию различают среды жидкие, плотные и сыпучие.
Жидкие среды применяют для выявления физиологобиохимических особенностей микроорганизмов, для накопления биомассы или продуктов обмена, поддержания и хранения микроорганизмов.
Плотные среды используют для выделения чистых культур (получения изолированных колоний), в диагностических целях (установления морфологии колоний, особенностей роста), для хранения и количественного учета и в ряде других случаях.
Сыпучие среды применяют в промышленной микробиологии (отруби, кварцевый песок пропитанный питательным раствором и т.д.).
Стерилизация (обеспложивание) – один из важнейших приемов в микробиологической практике. Стерилизации подвергают посуду, инструменты, среды и другие необходимые предметы, чтобы не допустить развития посторонней микрофлоры в исследуемых культурах.
Питательные среды стерилизуют насыщенным паром при различных режимах в специальных аппаратах – автоклавах или в фильтрах холодной стерелизации. Среды, предназначенные для стерилизации в автоклаве, наливают в сосуд не выше поло-
21
вины его высоты, закрывают ватными пробками. Пробки обертывают материалом, пропускающим пар, иначе среды не простерилизуются.
Основным способом стерилизации стеклянной посуды является стерилизация горячим воздухом в сушильных шкафах при 165–180 ºС в течение двух часов. При этом погибают как вегетативные клетки, так и споры микроорганизмов. Посуду перед стерилизацией тщательно моют, сушат и завертывают в бумагу для сохранения стерильности.
Каждую пипетку заворачивают в длинные полоски бумаги шириной 4–5 см. В концы пипеток, которые берутся в рот, предварительно вставляют ватные тампоны. Шпатели обертывают отдельно. Чашку Петри завертывают отдельно и вместе по 2–4 штуки. Колбы, пробирки закрывают ватными пробками, которые обертывают бумагой и обвязывают ниткой или бечевкой из льна.
Посев микроорганизмов
Внесение клеток микроорганизмов в стерильную среду называют посевом или инокуляцией. Перед посевом стеклографом тщательно наносят надпись на пробирку (колбу, чашку Петри) – название микроорганизма, дату посева. Для посева или приготовления препарата клетки микроорганизмов с плотной среды берут бактериологической петлей, с жидкой питательной среды – стерильной пипеткой. Бактериальную петлю перед взятием клеток микроорганизмов стерилизуют, накаливая докрасна в пламени горелки (спиртовки). Петлю рекомендуется держать в пламени горелки (спиртовки) почти вертикально, чтобы проволока была равномерно раскалена на всем протяжении. Необходимо помнить, что наивысшая температура развивается в верхней и периферической частях пламени, поэтому не следует опускать петлю непосредственно к горелке (фитилю). После стерилизации петлю вводят в сосуд с микроорганизмами, предварительно охладив ее прикосновением к внутренней поверхности сосуда или к питательной среде, захватывают петлей небольшое количество микробной массы.
22
Методы высева микроорганизмов на питательные среды
Высев на плотные среды. Сущность метода заключается в высеве определенного объема исследуемой суспензии на плотную питательную среду в чашки Петри и последующем подсчете выросших колоний. При этом считают, что каждая колония является результатом размножения одной клетки.
Чашечный метод широко используется для определения количества жизнеспособных микроорганизмов в почве, воде и других естественных субстратах. Он позволяет учесть не только численность микроорганизмов, но и разнообразие морфологии колоний.
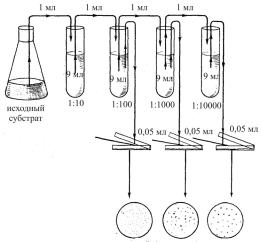
Приготовление разведений. При наличии небольшого количества микробов в среде (не более 100 в 1 мл) разведения не делают. Если исследуемый субстрат имеет обильную микрофлору, то производят разведение, чтобы посев дал десятки колоний в 1 мл.
Для разведений используют пробирки со стерильной водой, по 9 мл в каждой (до стерилизации в пробирки наливают по 10 мл воды). Стерильной пипеткой отбирают 1 мл исследуемой жидкости и вносят в пробирку с 9 мл стерильной воды, получают разведение 1/10, или 1-е. Затем другой стерильной пипеткой берут из первого разведения 1 мл и вносят таким же образом в следующую пробирку с 9 мл стерильной воды, получают разве-
дение 1/100 (или 2-е), и т.д. (рис. 5).
Посев в чашки Петри. Для посева приготавливают 3 чашки Петри, выбирают разбавления, чтобы исследуемый материал дал в одной из 3 чашек десятки, в другой – сотни, в третьей – тысячи колоний. Посевы из каждого разведения делают повторно. Для проверки чистоты работы используют контрольную чашку (без посева). Для посева берут пипеткой 1 мл соответствующего разбавления и вносят в чашку Петри со средой. Среду предварительно остужают до 40 ºС и только тогда вносят в нее посевной материал.
23
Легким вращательным покачиванием чашки смешивают питательную среду с посевным материалом. После того как питательная среда застынет, чашку с посевом на агаровых средах переворачивают вверх дном и ставят в термостат при температуре 30 ºС и выше.
Перед культивированием на крышке чашки указывают материал посева, разведение, дату посева.
Рис. 5. Схема приготовления разведений суспензии микроорганизмов и посева
Подсчет колоний. Подсчет бактерий на МПА при 30 ºС производят через 3 суток, при комнатной температуре – через 7 суток. Для подсчета колоний на чашках Петри лучшим разведением следует считать то, которое дает на агаре от 50 до 100 колоний бактерий и от 20 до 30 колоний плесневых грибов. Если количество колоний не более 100–200, их считают на всей поверхности чашки, перевернув ее вверх дном и пользуясь, при необходимости, лупой. При большом числе колоний дно чашки Петри делят на секторы, считают число колоний на 2–3 секторах и среднее число, найденное для одного сектора, умножают на количество секторов. Во всех случаях подсчета общее количество колоний умножают на разведение, и полученное число ука-
24
зывает количество микробов в 1 мл исследуемого субстрата.
Посев на плотную питательную среду штрихом. Берут пробирку с наклонно застывшим («косым») МПА. Пробирку с исследуемым микробом помещают между большим и указательным пальцем левой руки; пробирку с «косым» МПА зажимают указательным и средним пальцами той же руки. Обожженной петлей берут немного исследуемого материала из первой пробирки (концы ватных пробок предварительно вынимают
и зажимают между свободными пальцами так, чтобы входящая
впробирку часть ватной пробки не прикасалась к руке) и затем переносят его в стерильную пробирку с «косым» агаром. Посев производят штрихом микробиологической петлей, которую проводят снизу вверх по поверхности косо застывшей среды легко, не разрывая агара. Затем быстро в пламени горелки в пробирки вставляют ватные пробки.
Поверхность агара не должна быть залита конденсационной водой (иначе получиться сплошной рост). Важно, чтобы штрих был проведен ровно через всю поверхность питательной среды, в противном случае будет трудно отметить характерные свойства посевной черты.
Посев зигзагообразным штрихом осуществляют в тех случаях, когда необходимо получить больше посевного материала. На пробирке отмечают дату, название культуры и время посева, затем пробирку помещают в термостат для культивирования.
Посев уколом в мясопептонную желатину (МПЖ) или МПА применяют для исследования отношения микроорганизмов к кислороду воздуха и действия их на белки. Прокаленной иглой достают исследуемый посевной материал из пробирки, стерильную пробирку с вертикально застывшей средой МПЖ или МПА помещают в левую руку, опрокидывают ее вверх дном, вынимают ватную пробку и вводят иглу с посевным материалом в толщу питательной среды, посредине пробирки.
Посев в жидкие питательные среды. Прокаленный пет-
лей берут немного исследуемого материала и вносят в пробирку
25

со стерильной жидкой питательной средой (с поплавком) (рис. 6), соблюдая все вышеуказанные меры предосторожности
от заражения извне и используя полученные навыки. Прикасаясь петлей к стенке пробирки в том месте, где находится жидкость, слегка потирают петлей о стенку пробирки, чтобы посевной материал попал в пи-
тательную среду. Закрытую пробирку ставят в термостат при требуемой температуре.
Занятие 1
Содержание. Стерилизация питательных сред, посуды, материалов
Задание:
1.Ознакомиться с работой автоклава, сушильного шкафа, фильтров для холодной стерилизации.
2.Подготовить к стерилизации воду в пробирках и колбах.
3.Подготовить к стерилизации чашки Петри, пробирки, шпатели Дригальского, пипетки на 1–2 мл и 10 мл.
4.Приготовить ватные пробки к пробиркам.
Материалы и оборудование: пипетки, цилиндры, чашки Петри, шпатели Дригальского, колбы, ножницы, нитки, бумага, вата, марля, препаровальные иглы, бечевка, емкости для пробирок; автоклав, сушильный шкаф, мембранные и асбестовые фильтры, колбы Бунзена.
Занятие 2
Содержание. Принцип составления питательных сред для культивирования микроорганизмов.
26
Задание:
1.Приготовить плотную среду – мясопептонный агар (МПА), установить необходимую реакцию среды (рН). Отдать среду на стерилизацию.
2.Приготовить жидкую синтетическую среду для сапрофитных бактерий следующего состава (г/дм3): глюкоза – 20,0;
NH4Cl – 1,0; K2HPO4 – 2,0; MgSO4 · 7H2O – 0,5; дрожжевая вода –
2 мл. Перед посевом измерить реакцию среды. По необходимости добавить стерильный мел. Отдать среду на стерилизацию.
3.Разлить простерилизованную среду в чашки Петри, про-
бирки.
4.Приготовить « косячок» на МПА.
5.Засеять культурами микроорганизмов приготовленные стерильные среды (плотные и жидкие) различными способами (уколом, штрихом, пипеткой).
Материалы и оборудование: весы с разновесом, реактивы для сред, индикаторная бумага, колбы, цилиндры, пробирки с ватными пробками, пипетки, остальное оборудование в специальной коробке; микрофлора для инокуляции
Занятие 3
Содержание. Приготовление разведений.
Задание:
1.Подготовить стерильные пробирки с водой.
2.Научиться готовить разбавления.
Материалы и оборудование: пробирки с ватными пробка-
ми, стеклянные поплавки, штативы, пипетки на 10 мл, спиртовки, спички, исходный материал для приготовления разведений.
Занятие 4
Содержание. Выделение культур микроорганизмов из исследуемого материала.
Задание:
1. Подготовить стерильные чашки Петри с плотной стерильной средой МПА, промаркировав их.
27
2.Сделать высев на поверхность МПА из соответствующих разбавлений для определения числа живых клеток микроорганизмов висследуемой среде (почва, вода, исходная культура ит.д.).
3.Поставить чашки Петри, после посева, на проращивание
втермостат.
Материалы и оборудование: чашки Петри с МПА, сте-
рильные пипетки, стеклографы, спиртовки, спички, коробка с необходимыми материалами, пробирки с выбранными разведениями исследуемой среды.
Занятие 5
Содержание. Ознакомиться с методикой подсчета колоний, выросших на чашках Петри.
Задание:
1.Просчитать количество выросших колоний на чашках Петри, засеянных на предыдущем занятии.
2.Сделать пересчет колоний на 1 мл и 1 дм3 культуры с учетом разбавлений. Результаты параллельных высевов суммировать и определить среднее число колоний, выросших при высеве из этого разведения.
3.Приготовить и просмотреть препараты наиболее характерных микроорганизмов (грибы, дрожжи, бактерии) для использованного исходного материала.
4.Записать полученные результаты в лабораторную тетрадь, отметить морфологические особенности различных групп микроорганизмов и зарисовать их.
Материалы и оборудование: микроскоп и осветитель, ко-
робка с материалами, кристаллизатор с мостиком, микробиологическая петля, спиртовка, спички.
Занятие 6
Содержание. Ознакомление с методами посева на твердую питательную среду.
Задание:
1.Приготовить мясопептонный агар (МПА), разлить МПА
впробирки. Отдать на стерилизацию при 1 атм.
28
2.После стерилизации МПА разлить из пробирок в чашки
Петри.
3.Оставшиеся пробирки использовать для посева штрихом
иуколом. С этой целью приготовить скошенный агар и столбик.
4.Высеять используемый материал на плотную среду методом штрих и уколом.
5.Поставить засеянные и предварительно подписанные пробирки для культивирования в термостат.
Материалы и оборудование: весы с разновесом, сухой МПА, шпатели, плитка с закрытой спиралью, колбы конические на 250 мл, чашки Петри, пробирки, коробки с материалами, штатив для приготовления скошенного агара, обычные штативы для пробирок, исследуемый материал.
Тема 4. ОСОБЕННОСТИ РОСТА МИКРООРГАНИЗМОВ НА ПЛОТНЫХ И ЖИДКИХ ПИТАТЕЛЬНЫХ СРЕДАХ
Краткие теоретические сведения
Рост на плотной среде. Микроорганизмы, развиваясь на поверхности плотных сред, образуют характерные для данного вида колонии. Описание колоний – один из признаков, который необходим для идентификации исследуемого микроорганизма.
При описание колоний отмечают следующие признаки:
–форма колонии – округлая, амебовидная, ризоидная, неправильная и т.д.;
–размеры – диаметр в мм;
–оптические свойства – прозрачная, полупрозрачная (просвечивает), не прозрачная, блестящая, матовая, флуоресцирующая;
–цвет – отмечают цвет колоний и выделение пигмента в
среду;
–поверхность – гладкая, складчатая, шероховатая, бугристая;
–профиль – плоский, выпуклый, кратерообразный, врастающий в агар;
29
–край колонии – ровный, волнистый, лопастной, ризоидный и т.д.;
–структура колонии – однородная, мелкоили крупнозернистая, струйчатая;
–консистенция – маслянистая, тестообразная, вязкая, плен-
чатая;
–способность к эмульгированию – равномерная или зернистая в воде, слабо суспензируется или совсем не суспензируется.
Край и структуру колонии определяют при малом увеличение микроскопа. Консистенцию колонии устанавливают прикосновением к ее поверхности микробиологической петли.
При посеве клеток в толщину плотной питательной среды отмечают образование глубинных и донных колоний.
Если микроорганизмы в процессе развития выделяют газы, образование глубинных колоний сопровождается разрывом плотной среды.
Рост микроорганизмов по штриху. Отмечают интенсив-
ность роста: скудный, умеренный, обильный и его особенности: налет сплошной с ровным или волнистым краем, четковидный в виде цепочки изолированных колоний, диффузный, пористый, древовидный или ризоидный. Характеризуют оптические свойства штриха, его цвет, поверхность и консистенцию. При описании колонии и роста микроорганизмов по штриху указывают состав среды и возраст культуры, так как колонии на различных средах могут отличаться рядом признаков.
Рост в жидкой среде. Рост микроорганизмов в жидких средах характеризуется большим единообразием по сравнению с ростом на плотных питательных средах.
В жидкой среде отмечают:
–интенсивность роста – скудный, умеренный или обильный;
–помутнение среды – однородное, хлопьевидное или с шелковистой волнистостью;
–образование пленки – кольцеобразная, сплошная, тонкая, толстая, плотная или рыхлая, гладкая или складчатая, сухая или слизистая, всползающая или опадающая;
30
