
Аналитические методы в биохимии и биотехнологии
..pdf
Степень разделения пиков 1 и 2 вычисляем по уравнению (6.4), приняв в качестве числа теоретических тарелок среднее значение для
пиков 1 и 2 ( N |
295 |
228 |
261,5 ): |
|
|
||||||
|
|
2 |
|
|
|
|
|
|
|
|
|
|
R |
|
|
261,5 |
|
1,36 1 |
|
|
|
8,87 |
0,96. |
|
|
|
4 |
1,36 |
1 |
8,87 |
|||||
|
|
|
|
|
|
|
|||||
Задания для практической работы
Задание 6.1. Получите у преподавателя хроматограмму смеси двух веществ. Определите по хроматограмме времена выхода, число теоретических тарелок обоих пиков. Рассчитайте значения селективности и степени разделения пиков.
Задание 6.2. Времена выхода двух компонентов смеси состав-
ляют (мин): а) 3,24 и 4,07; б) 6,47 и 7,03; в) 10,04 и 12,16. Мертвое время составляет 2,49 мин. Определите, каким числом теоретических тарелок должна обладать хроматографическая система, чтобы обеспечить полное разделение смеси.
Задание 6.3. Известно, что коэффициент распределения β-нафтола на адсорбенте Zorbax-C18 из растворителя состава метанол – вода (60:40) составляет 9,56 мл/мл. Предскажите время выхода β-нафтола из колонки с размерами 250 мм × 4,6 мм, заполненной указанным адсорбентом, при объемной скорости подвижной фазы 1 мл/мин, если при таком потоке мертвое время 2,54 мин, а внеколоночный объем хроматографа 0,03 мл.
Контрольные вопросы
1.Что такое мертвое время (объем)?
2.Зависит ли коэффициент удерживания от скорости подвижной фазы?
3.Чем различаются селективность колонки и степень разделения пиков?
4.Какие факторы влияют на размывание хроматографического
пика?
31
Практическая работа № 7 ГЕЛЬ-ФИЛЬТРАЦИОННАЯ ХРОМАТОГРАФИЯ
Цель работы: освоить типовые расчеты в гель-фильтрационной хроматографии.
Теоретическое введение
Метод гель-фильтрационной хроматографии (ГФХ) основан на явлении исключения из пор неподвижной фазы молекул, размер которых превышает размер пор. Молекулы, которые входят в поры гель-матрицы, удерживаются в колонке дольше, чем крупные молекулы, и тем дольше, чем меньше их размер. Исключенным молекулам доступен только внепоровый объем насадки, который будем обозначать V0. Полный объем свободного пространства в колонке Vt тождественен мертвому объему в обычной хроматографии.
Удерживание полимеров в ГФХ характеризуется объемом выхода Ve и коэффициентом распределения
Kav Ve V0 . |
(7.1) |
Vt V0 |
|
Неудерживаемые крупные полимеры имеют Ve = V0 и Kav = 0. Для низкомолекулярных соединений, легко заполняющих поры гель-
матрицы, Ve = Vt и Kav = 1.
Эмпирически установлено, что для гель-матрицы с данным размером пор существует в определенном диапазоне молекулярных масс линейная зависимость между Ve полимерных молекул и логарифмом их молекулярной массы. Линейность нарушается вблизи объемов V0 и Vt. Зависимость Vе от lg(Mr) используется для определения молекулярных масс полимерных веществ. Для этого предварительно должен быть получен калибровочный график по высокомолекулярным соединениям с известной молекулярной массой.
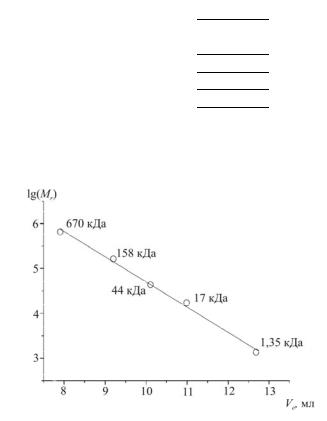
Пример 7.1. Определите молекулярную массу белка, элюируемого с колонки Bio-Sil SEC 400 (300 мм × 7 мм) с удерживаемым объемом 10,4 мл. Данные для построения калибровочного графика приведены в табл. 7.1.
32
|
|
|
Таблица 7.1 |
|
Объемы выхода белковых стандартов |
||||
|
|
lg(Mr) |
|
|
Стандарт |
Mr, кДа |
Ve, мл |
||
Тироглобулин |
670 |
5,83 |
7,9 |
|
γ-Глобулин |
158 |
5,20 |
9,2 |
|
Овальбумин |
44 |
4,64 |
10,1 |
|
Миоглобин |
17 |
4,23 |
11,0 |
|
Витамин В12 |
1,35 |
3,13 |
12,7 |
|
Решение. По приведенным данным строим калибровочный график, как показано на рис. 7.1. Визуально убеждаемся в наличии линейности зависимости.
Рис. 7.1. Калибровочный график для определения молекулярной массы
По методу наименьших квадратов определяем уравнение калибровочной прямой. Оно имеет следующий вид: lg(Mr) = –0,561Ve + + 10,3. Подставляя в это уравнение величину Ve = 10,4 мл, получаем
для логарифма молекулярной массы искомого белка значение 4,49, откуда Mr = 104,49 = 30,9 кДа.
33
Задания для практической работы
Задание 7.1. Колонка длиной 300 мм и внутренним диаметром 10 мм заполнена гелевой насадкой. Известно, что при объемной скорости подвижной фазы 1 мл/мин время выхода нитрита натрия составляет 16,5 мин. Время выхода неудерживаемого полимера 10,1 мин. Определите общий объем свободного пространства в колонке и внешний объем.
Задание 7.2. Образец водорастворимых полисахаридов хроматографировали на колонке Sepharose 4B (42 см 2 см). Элюат собирали фракциями по 3 мл, которые последовательно нумеровали. Было обнаружено, что распределение полисахаридов по фракциям имеет два пика. Максимальное содержание вещества обнаружено во фракциях № 25 и № 43. Маркер неудерживаемого полимера элюировался с фракцией № 16. Полный свободный объем колонки составлял 90 мл. Рассчитайте кажущиеся коэффициенты распределения для полисахаридов обеих фракций. Почему для второй фракции Kav > 1?
Задание 7.3. Выделенный из клеточной культуры белок очищали на колонке Sephacryl S-200 HR (90 см 1,6 см). Оцените молекулярную массу белка, если его объем выхода равен 105,0 мл. Данные
для построения калибровочного графика приведены ниже: |
|
||||
Mr стандарта, кДа: |
12,4 |
29 |
66 |
150 |
200 |
Ve, мл: |
119,3 |
107,9 |
92,5 |
81,7 |
73,7 |
Контрольные вопросы
1.В чем состоит принцип гель-фильтрационнойхроматографии?
2.Что такое внепоровый объем насадки?
3.Как объемвыходаполимера связан сего молекулярноймассой?
34
Практическая работа № 8 ГЕЛЬ-ЭЛЕКТРОФОРЕЗ
Цель работы: освоить методы расчетов в гель-электрофорезе.
Теоретическое введение
Метод гель-электрофореза основан на различии в скорости миграции заряженных частиц под действием разности потенциалов в пористой среде. Соответственно подвижность частиц в гельматрице определяется двумя факторами: электрической силой F, действующей на ион, и сопротивлением среды, которое замедляет движение заряженных частиц. Сопротивление трения характеризуют коэффициентом трения f, который зависит как от размера пор гельматрицы, так и от размера молекулы.
Электрическая сила определяется через напряженность электрического поля Е и заряд частицы q, т.е. F = Eq. В свою очередь, напряженность E – это градиент потенциала U/l0, где U – разность потенциалов на электродах электрофорезной камеры, а l0 – расстояние между ними, равное длине пластинки геля. Связь скорости v мигрирующей частицы с условиями электрофореза, пористой структурой гель-матрицы и природой частицы выражается уравнением
v |
Eq |
. |
(8.1) |
|
|||
|
f |
|
|
Отсюда видно, что два иона будут разделяться, если отличаются их заряды и/или коэффициенты трения.
Отношение v/E называют электрофоретической подвижностью μ. Как следует из уравнения (8.1), это постоянная, равная q/f. Она связана простым соотношением с расстоянием lx, которое вещество проходит по гелю за время электрофоретического эксперимента. Обычно это время t0, за которое фронт буфера проходит полную длину пластинки геля l0. Тогда
35

lx |
Ut0 . |
(8.2) |
|
l0 |
|
Удобной характеристикой скорости миграции в гельэлектрофорезе является относительная подвижность Rf, определяемая непосредственно по пластинке геля (электрофореграмме):
Rf |
lx , |
(8.3) |
|
l0 |
|
где lx – расстояние от старта до зоны аналита.
Измерение длин lx и l0 на электрофореграмме проиллюстрировано на рис. 8.1 (расстояние lx отмеряется от середины полосы аналита).
Величина Rf связана с размером частиц аналита обратной зависимостью: она тем больше, чем меньше этот размер. Эмпирические данные показывают, что для линейных полимерных молекул Rf является монотонной функцией логарифма молекулярной массы. Это наблюдение положено в основу определения молекулярной массы белков и нуклеиновых кислот. Корректное определение данного параметра у белков возможно только в денатурирующих условиях, предотвращающих свертывание белковых молекул.
Пример 8.1. Для определения молекулярной массы белка лакказы был проведен
электрофорез образца белка и набора белковых стандартов на пла-
36
стинке геля длиной 128 мм. Расстояние lx для лакказы равно 24 мм. Определите молекулярную массу белка, используя для построения калибровочного графика следующие данные:
Mr стандарта, кДа: |
97,4 |
66,2 |
45,0 |
31,0 |
21,5 |
14,4 |
lx, мм: |
8,0 |
15,5 |
28,0 |
55,0 |
84,0 |
117,5 |
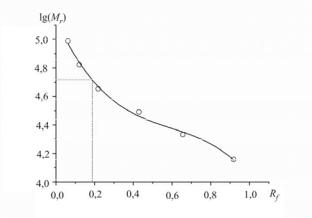
Решение. Рассчитаем десятичные логарифмы значений молекулярных масс стандартных белков и по уравнению (8.3) значения относительной подвижности Rf для каждого стандарта. Построим калибровочный график в координатах lg(Mr) – Rf. Полученная зависимость, показанная на рис. 8.2, имеет форму кубической параболы.
Аппроксимируем данные на графике кубической функцией, используя средства регрессионного анализа программы Excel. Полученное калибровочное уравнение имеет вид
y = –2,386x3 + 4,251x2 – 2,965x + 5,14,
где y обозначает lg(Mr), а x – Rf.
Подставляя в это уравнение значение Rf лакказы (24/128 = 0,19), получим для lg(Mr) значение 4,71, которое можно проверить графическим методом, как показано на рис. 8.2. Извлекая подлогарифменную величину, находим ответ: Mr = 51,3 кДа.
Рис. 8.2. Калибровочный график для определения молекулярной массы белка лакказы
37
Пример 8.2. При электрофорезе образца белка на пластинке геля длиной 10 см получена полоса шириной 0,2 см, центр которой находится на расстоянии 7,5 см от стартовой линии. Зависимость логарифма молекулярной массы от относительной подвижности для данной системы имеет вид lg(Mr) = –2,074Rf + 2,80. Оцените неопределенность измерения молекулярной массы.
Решение. Неопределенность измерения молекулярной массы связана с тем, что позиция полосы может быть определена с точностью до ее ширины. Если номинальное значение расстояния lx относится к центру полосы, то границы неопределенности находятся как lx ± 0,5 , где – это ширина полосы. Таким образом, молекулярной массе образца может отвечать любая точка в диапазоне от (7,5 – 0,1) до (7,5 + 0,1) см. Границам полосы соответствуют значения относительной подвижности 0,74 и 0,76. Подставляя эти числа в калибровочную формулу и потенцируя ответ, получаем для верхней и нижней границ молекулярной массы белка значения 18,4 и 16,7 кДа.
Задания для практической работы
Задание 8.1. При проведении электрофореза некоторого образца на пластинке геля длиной 10 см при напряжении 120 В фронт буфера достигает конца пластинки за 30 мин, при этом полоса анализируемого вещества обнаруживается на расстоянии 4 см от точки старта. Рассчитайте подвижность буфера и аналита. Сколько времени должен длиться электрофорез, чтобы получить такую же электрофореграмму при напряжении 100 В?
Задание 8.2. При анализе образца ДНК на пластинке геля длиной 6,5 см обнаружили две полосы на удалении 2,4 и 4,0 см от точки старта. Определите число n пар оснований в молекулах нуклеиновых кислот. Калибровочные данные, полученные по набору стандартов
ДНК, приведены ниже: |
|
|
|
|
|
n · 10–3: |
5,43 |
3,33 |
1,24 |
0,95 |
0,20 |
lx, см: |
1,0 |
1,8 |
2,9 |
3,4 |
5,0 |
38
Задание 8.3. При электрофорезе образца белка на пластинке геля длиной 8,0 см получена полоса шириной 0,2 см, центр которой находится на расстоянии 4,5 см от стартовой линии. Зависимость логарифма молекулярной массы от относительной подвижности для данной системы имеет вид lg(Mr) = –1,998Rf + 3,05. Оцените неопределенность измерения молекулярной массы.
Контрольные вопросы
1.Что такое гель-электрофорез?
2.От каких факторов зависит скорость миграции вещества в гель-электрофорезе?
3.Почему определение молекулярной массы методом гельэлектрофореза возможно только для полимеров линейного строения?
4.Зависит ли расстояние между полосами двух веществ в данной электрофоретической системе от напряжения, от длины пластинки геля?
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
1.ГОСТ Р 8.736–2011. Измерения прямые многократные. Методы обработки результатов измерений. Основные положения. – М.: Стандартинформ, 2013. – 24 с.
2.Инструментальный анализ. Избранные методы: учеб. пособие / под ред. В.Н. Басова. – Пермь: Изд-во Перм. нац. исслед. поли-
техн. ун-та, 2011. – 165 с.
3.Лебедев А.Т. Масс-спектрометрия в органической химии. –
М.: Бином, 2003. – 493 с.
39

Приложение А t-Коэффициенты Стьюдента (двусторонние)
n |
Доверительная вероятность |
n |
Доверительная вероятность |
|||||
0,9 |
0,95 |
0,99 |
0,9 |
0,95 |
0,99 |
|||
|
|
|||||||
2 |
6,31 |
12,71 |
63,66 |
16 |
1,75 |
2,13 |
2,95 |
|
3 |
2,92 |
4,30 |
9,92 |
17 |
1,75 |
2,12 |
2,92 |
|
4 |
2,35 |
3,18 |
5,84 |
18 |
1,74 |
2,11 |
2,90 |
|
5 |
2,13 |
2,78 |
4,60 |
19 |
1,73 |
2,10 |
2,88 |
|
6 |
2,02 |
2,57 |
4,03 |
20 |
1,73 |
2,09 |
2,86 |
|
7 |
1,94 |
2,45 |
3,71 |
30 |
1,70 |
2,05 |
2,76 |
|
8 |
1,89 |
2,36 |
3,50 |
40 |
1,68 |
2,02 |
2,71 |
|
9 |
1,86 |
2,31 |
3,36 |
50 |
1,68 |
2,01 |
2,68 |
|
10 |
1,83 |
2,26 |
3,25 |
60 |
1,67 |
2,00 |
2,66 |
|
11 |
1,81 |
2,23 |
3,17 |
70 |
1,67 |
1,99 |
2,65 |
|
12 |
1,80 |
2,20 |
3,11 |
80 |
1,66 |
1,99 |
2,64 |
|
13 |
1,78 |
2,18 |
3,05 |
90 |
1,66 |
1,99 |
2,63 |
|
14 |
1,77 |
2,16 |
3,01 |
100 |
1,66 |
1,98 |
2,63 |
|
15 |
1,76 |
2,14 |
2,98 |
∞ |
1,64 |
1,96 |
2,58 |
|
40
