
Аналитические методы в биохимии и биотехнологии
..pdf
|
|
n |
(xi |
|
)( yi |
|
|
) |
|
|
r |
n |
x |
y |
, |
(2.2) |
|||||
xi |
x 2 |
n yi y 2 |
||||||||
|
|
i 1 |
|
|
|
|
|
|
|
|
|
i 1 |
|
|
|
i 1 |
|
|
|
|
|
где y – среднее арифметическое значение зависимой переменной.
Для расчета коэффициента корреляции в Excel существует функция КОРРЕЛ (см. табл. 2.1). Чем ближе значение r к единице, тем выше вероятность наличия линейной связи. Часто пользуются квадратом коэффициента корреляции, который называют коэффициентом детерминации и обозначают r2. Если r2 > 0,96, то можно принять существование линейной зависимости в пределах погрешности эксперимента.
Для определения параметров линейной зависимости используется метод наименьших квадратов, который предлагает следующие формулы для их расчета:
b |
n |
xi x yi y |
(2.3) |
|
i 1 |
|
; |
||
|
|
|||
|
|
n xi x 2 |
|
|
|
|
i 1 |
|
|
|
a y bx. |
(2.4) |
||
Для вычисления этих параметров в Excel служат функции ОТРЕЗОК и НАКЛОН (см. табл. 2.1).
Для выполнения линейного регрессионного анализа также служит макрос «Регрессия», входящий в состав надстройки «Пакет анализа» (вызывается из пункта меню «Данные»). Диалоговое окно макроса имеет поля для ввода интервалов значений у и х и указания доверительной вероятности (уровень надежности). Поле «Константа – ноль» отмечается, если выполняют расчет для линейной модели со свободным членом, равным нулю.
Макрос рассчитывает параметры линейной модели и их доверительные границы для заданного значения доверительной вероятности, коэффициенты корреляции и детерминации и остатки (разность
11
между экспериментальным значением y и предсказанным по найденной линейной модели). График остатков выводится в отчете, если отмечено соответствующее поле в окне макроса.
Нелинейный регрессионный анализ. В тех случаях, когда зависи-
мость между двумя переменными не является линейной, применяют методы нелинейной регрессии для нахождения функциональной связи между этими переменными.
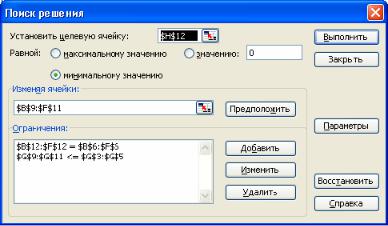
Регрессионная модель должна быть задана заранее. Она подбирается исходя из физических соображений или на основании визуального анализа графика зависимости. Подбор коэффициентов регрессионного уравнения можно осуществить с помощью команды «Поиск решения», которая предназначена для решения задачи оптимизации. Данная команда находит минимальное либо максимальное значение зависящего от некоторых параметров функционала путем подбора значений этих параметров.
Рис. 2.1. Диалоговое окно команды «Поиск решения»
Обозначим регрессионную модель как yˆ f (b0 ,b1, ,bk , x) , где
b0, b1,…, bk – регрессионные коэффициенты. Составим функционал из суммы квадратов отклонений:
12
|
|
n |
ˆ |
|
|
|
SE |
|
yi |
2 |
, |
(2.5) |
|
|
yi |
|
i 1
ибудем искать такие значения параметров модели, чтобы сумма SE приняла минимальное значение. В макросе команды «Поиск решения» предлагается выбор из двух альтернативных алгоритмов оптимизации: алгоритма Ньютона и алгоритма сопряженных градиентов. Какой из указанных алгоритмов лучше подходит для решения конкретной задачи, определяется методом проб и ошибок.
Команда «Поиск решения» вызывается из пункта меню «Данные». Внешний вид диалогового окна команды показан на рис. 2.1. Окно включает поле целевой ячейки, в которой содержится значение функционала, поле изменяемых ячеек, в которых содержатся значения параметров модели, и поле ограничений, где можно задать ограничения на модель. У поля целевой ячейки имеются три опции: максимального, минимального и заданного значений. В нашем случае выбирается опция минимального значения. Выбор алгоритма оптимизации осуществляется через кнопку «Параметры» диалогового окна.
Задания для практической работы
Задание 2.1. Для определения рибофлавина методом абсолютной калибровки были выполнены измерения оптической плотности D стандартных растворов рибофлавина различной концентрации:
C, мкмоль/л: |
31,76 |
39,31 |
47,66 |
54,65 |
62,12 |
D, у.е.: |
0,396 |
0,49 |
0,594 |
0,681 |
0,774 |
По приведенным данным постройте калибровочный график. Определите концентрацию раствора рибофлавина, если его оптическая плотность равна 0,580 у.е.
Задание 2.2. Для определения общего содержания фенольных веществ в экстракте алое вера методом Фолина–Чокальтеу был построен калибровочный график по четырем стандартным растворам галловой кислоты и холостому опыту. Каждое измерение повторяли три раза. Результаты приведены в табл. 2.2. Рассчитайте среднее зна-
13
чение и СКО для каждого измерения. Определите уравнение калибровочной зависимости.
Таблица 2.2 Оптическая плотность стандартных растворов галловой кислоты
С, мг/мл |
|
Параллельные измерения |
|
||
D(1), у.е. |
|
D(2), у.е. |
|
D(3), у.е. |
|
|
|
|
|||
0,00 |
–0,022 |
|
–0,019 |
|
–0,032 |
0,02 |
0,038 |
|
0,026 |
|
0,033 |
0,05 |
0,11 |
|
0,103 |
|
0,103 |
0,10 |
0,194 |
|
0,221 |
|
0,241 |
0,15 |
0,394 |
|
0,394 |
|
0,378 |
Задание 2.3. Толуол в водно-метанольном растворе определяли методом жидкостной хроматографии. Для построения калибровочной кривой в хроматограф вводили стандартные растворы толуола с концентрацией 0,06–7,56 г/л и определяли площадь пика толуола A. Объем пробы составлял 20 мкл. Полученные результаты приведены в табл. 2.3.
Tаблица 2.3 Данные для построения калибровочного графика для толуола
С, г/л |
m, мкг |
A, у.е. ·с |
0,06 |
|
27,70 |
0,20 |
|
85,63 |
0,41 |
|
165,20 |
0,78 |
|
285,70 |
1,52 |
|
470,80 |
С, г/л |
m, мкг |
A, у.е.·с |
3,44 |
|
750,00 |
5,81 |
|
964,10 |
6,24 |
|
998,70 |
6,98 |
|
1052,00 |
7,56 |
|
1090,00 |
Рассчитайте массу толуола m в каждой пробе и занесите в табл. 2.3. Постройте калибровочный график в координатах A– m. Определите параметры калибровочной зависимости m = aA + bAn . Определите концентрацию толуола в растворе, если его площадь пика равна 1000 у.е.·с.
14
Контрольные вопросы
1.Чемотличаетсялинейныйрегрессионныйанализотнелинейного?
2.С помощью каких инструментов Excel можно выполнить линейный регрессионный анализ?
3.Как выбирается предварительная модель для нелинейной регрессии?
4.Какие математические алгоритмы использует Excel для решения задачи оптимизации?
Практическая работа № 3 ПОЛЯРОГРАФИЧЕСКИЙ АНАЛИЗ
Цель работы: освоить методы расчетов в качественном и количественном полярографическом анализе.
Теоретическое введение
Качественной характеристикой аналита (определяемого вещества) в полярографии является потенциал полуволны Е1/2. Эта характеристика связана со стандартным окислительно-восстановительным потенциалом электродной реакции на ртутном электроде Е0 и потенциалом электрода сравненияЕср простым приближеннымсоотношением
E1/2 ≈ Е0 – Eср. |
(3.1) |
Величина Е0 пар Меn+/Me на ртутном электроде отличается от величины стандартного потенциала для реакции на твердом электроде, поскольку сопровождается образованием амальгамы восстановленного металла. Поэтому предсказать значение Е1/2 по уравнению (3.1), пользуясь обычными таблицами стандартных потенциалов, нельзя. Для этих целей используют таблицы окислительновосстановительных потенциалов на ртутном капельном электроде (относительно насыщенного каломельного электрода (нас. к. э.)) (прил. Б).
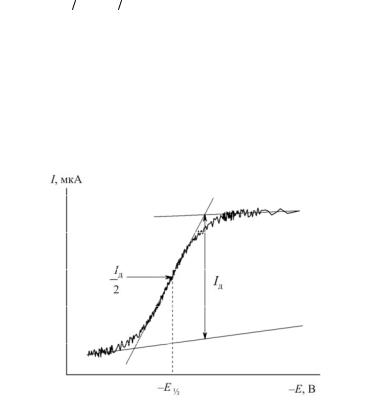
Способ определения потенциала полуволны по полярограмме показан на рис. 3.1. Его величина, помимо природы аналита, зависит
15
от состава электролита в тех случаях, когда компоненты электролита являются участниками электродной реакции аналита. Так, например, если восстановление катионов металлов протекает в присутствии комплексообразователя, то величина Е1/2 будет зависеть от концентрации последнего Сс согласно следующему уравнению:
E1 2 |
|
E1 2 |
|
0,0592 lg KN |
0,0592x lgCс, |
(3.2) |
|
c |
|
|
n |
n |
|
|
|
|
|
|
|
где (Е1/2)с, Е1/2 – потенциалы полуволны в присутствии комплексообразователя и без него соответственно; KN – константа нестойкости комплекса; n – заряд катиона; x – число молекул лиганда, взаимодействующих с катионом.
Характеристикой полярограммы, связанной с концентрацией аналита C, является величина диффузионного тока Iд. Ее определяют по полярограмме, как показано на рис. 3.1.
Рис. 3.1. Определение потенциала полуволны и предельного тока по полярограмме
Значение Iд должно быть скорректировано на величину остаточного тока, поскольку последний не связан с разрядом аналита на электроде, а обусловлен электрохимическими превращениями дру-
16
гих компонентов пробы и/или емкостным током. Емкостный ток обусловлен заряжением двойного электрического слоя в процессе роста ртутной капли. Считается, что в условиях обратимой электродной реакции скорректированная величина диффузионного тока прямо пропорциональна концентрации, т.е. справедливо уравнение:
Iд kC, |
(3.3) |
где k – коэффициент пропорциональности.
Пример 3.1. В 1М растворе KNO3 потенциал полуволны Cd2+ Е1/2 = –0,59 В. Как изменится эта величина, если раствор будет содержать 0,1 моль/л ЭДТА? Константа нестойкости комплекса
[CdЭДТА]2– KN = 3,4·10–17.
Решение. В комплексном ионе [CdЭДТА]2– число молекул лиганда х = 1, а заряд катиона n = 2. Подставляя эти значения, а также величину константы нестойкости и концентрацию лигандов Cс =
=0,1 моль/л в уравнение (3.2), получим, что сдвиг потенциала полу-
волны (Е1/2)с – Е1/2 = –0,46 В. Таким образом, (Е1/2)с = –0,59 + (–0,46) =
=–1,05 В.
Пример 3.2. Содержание свинца в 1М растворе НNO3 определяли полярографически на ртутном капающем электроде. Предельный ток измеряли при потенциале –0,600 В относительно нас. к. э. Рассчитайте содержание свинца в растворе неизвестной концентрации, если значение Iд для этого раствора составляет 13,04 мкА. Для построения калибровочного графика используйте следующие данные:
С(Pb2+), ммоль/л: |
1,00 |
2,00 |
3,00 |
5,00 |
8,00 |
12,00 |
Iд, мкА: |
4,37 |
8,67 |
12,87 |
21,54 |
34,35 |
51,25 |
Решение. Строим график калибровочной зависимости в координатах C–Iд и визуально убеждаемся в линейности зависимости. По методу наименьших квадратов рассчитываем свободный член а и наклон b калибровочной кривой: а = 0,14 и b = 4,266. Отсюда Iд 0,14 4,266C . Обращая это уравнение относительно концентра-
ции, получаем выражение для расчета неизвестной концентрации по известному значению предельного тока: C Iд 0,14 / 4,266 .
17
По этому уравнению искомое значение концентрации свинца, соответствующее силе тока 13,04 мкА, равно 3,02 ммоль/л.
Задания для практической работы
Задание 3.1. Получите у преподавателя полярограмму. По выданной полярограмме определите качественный катионный состав смеси, используя таблицу стандартных потенциалов на ртутном капельном электроде.
Задание 3.2. В 1М растворе KCl волны катионов Tl+ и Pb2+ сли-
ваются. По отношению к нас. к. э. для Т1+ Е1/2 = –0,48 В, для Pb2+ Е1/2 = –0,43 В. Разделить волны этих катионов можно в щелочной
среде, поскольку таллий не образует гидроксокомплексов, а свинец образует комплексный ион PbOH+ (KN = 6·10–7). Рассчитайте минимальную концентрацию щелочи, необходимую для разделения волн Tl+ и Pb2+ на величину 0,1 В, допуская, что потенциал полуволны таллия не изменяется в щелочной среде.
Задание 3.3. При полярографическом определении содержания кадмия в 1М растворе HCl при значении потенциала –0,75 В (относительно нас. к. э.) было получено значение диффузионного тока Iд = 24,32 мкА. Значение остаточного тока, определенного по холостой пробе, составляло 0,14 мкА. Рассчитайте концентрацию Cd2+ в пробе, используя следующие калибровочные данные, скорректированные на значение остаточного тока:
С(Cd2+), ммоль/л: |
0,50 |
1,00 |
2,00 |
3,00 |
4,00 |
5,50 |
6,50 |
Iд, мкА: |
4,37 |
8,67 |
17,49 |
25,75 |
34,35 |
47,10 |
55,70 |
Контрольные вопросы
1.Что такое потенциал полуволны?
2.От каких факторов зависит величина Е1/2?
3.Как определяют величину диффузионного тока?
4.Как величина Iд связана с концентрацией аналита?
18
Практическая работа № 4 СПЕКТРОФОТОМЕТРИЧЕСКИЙ АНАЛИЗ
Цель работы: освоить методы расчетов в спектрофотометрическом анализе.
Теоретическое введение
Основным уравнением количественного спектрофотометрического анализа является уравнение Бугера–Ламберта–Бера, которое устанавливает пропорциональность между концентрацией аналита С, длиной оптического пути l и оптической плотностью D анализируемого раствора:
D = ελlC. |
(4.1) |
Коэффициент пропорциональности ελ называется коэффициентом экстинкции и зависит от длины волны λ проходящего через раствор света. Его размерность зависит от выбранной размерности концентрации. Различают молярный (ε, л/(моль·см)) и удельный (Е1%, 100мл/(г·см)) коэффициенты. Величина Е1% по определению представляет собой оптическую плотность раствора с концентрацией 1 г/100 мл. Значения ε и Е1% связаны простым соотношением:
|
E1% 10 |
, |
(4.2) |
|
|||
|
M r |
|
|
где Мr – молекулярная масса.
Тот факт, что абсорбционные спектры разных соединений могут отличаться друг от друга, широко используется для одновременного спектрофотометрического определения двух и более компонентов в смеси.
Рассмотрим применение этого метода на примере анализа двухкомпонентной пробы. При условии существенного различия спектров абсорбции для индивидуальных компонентов можно подобрать две такие длины волны λ1 и λ2, чтобы выполнялись условия
1,1 1,2 |
и 2,1 2,2 , где второй индекс обозначает компонент |
19
1 или 2. Тогда можно записать систему уравнений для расчета значений оптической плотности для двух выбранных длин волн:
D |
|
lC |
|
1,2 |
lC |
; |
|
|
1 |
|
1,1 1 |
|
2 |
|
|
(4.3) |
|
D 2 |
2,1lC1 |
2,2lC2 |
|
|||||
. |
|
|||||||
|
|
|
|
|
|
|
|
|
Решение этой системы дает выражения для вычисления концентраций С1 и С2 по известным значениям коэффициентов экстинкции и измеренным на двух длинах волн величинам оптической плотности:
C |
2,2 D 1 |
|
1,2 D 2 |
; |
(4.4) |
|||||
|
|
|
||||||||
1 |
|
|
lz |
|
|
lz |
|
|
|
|
|
|
|
|
|
|
|
|
|||
C2 |
|
2,1D 1 |
|
|
1,1D 2 |
, |
(4.5) |
|||
lz |
|
lz |
||||||||
|
|
|
|
|
|
|
|
|||
где z = 1,2 2,1 1,1 2,2 .
Пример 4.1. Содержание в растениях желтого пигмента β-каротена определяется методом УФ-спектрометрии на длине волны 450 нм. Удельный коэффициент экстинкции β-каротена в гексане
E1450% = 2592. Оптическая плотность разбавленного в 50 раз расти-
тельного экстракта, измеренная в кювете длиной l = 1 см, составляла 0,5 у.е. Рассчитайте концентрацию пигмента в экстракте (выразите концентрацию в мкг/мл).
Решение. Поскольку в задаче указан удельный коэффициент экстинкции, концентрация должна быть выражена в г/100 мл. По уравнению (4.1) для концентрации разбавленного экстракта получаем:
C |
|
D |
|
0,5 |
1,93 10 4 |
г |
. |
|
|
|
|||||
1% |
lE1% |
1 см 2592 100 мл/(г см) |
|
100 мл |
|||
|
|
|
|||||
Так как 1 г/100 мл = 104 мкг/мл, то с учетом 50-кратного разбавления получаем ответ: 50 · 1,93·10–4 · 104 = 96,5 мкг/мл.
Пример 4.2. Для определения содержания хлорофиллов a и b
вберезовых листьях определяли оптическую плотность лиственных экстрактов в диэтиловом эфире на длинах волн 642,2 и 660,6 нм
вкювете длиной l = 1 см. Получены следующие результаты: D642,6 = = 0,252; D660,6 = 0,484. Рассчитайте концентрации хлорофиллов в экс-
20
