
Аналитические методы в биохимии и биотехнологии
..pdfтракте и оцените их соотношение в листьях. Значения ελ возьмите в табл. 4.1.
Решение. Рассчитав значения коэффициентов при D в уравнениях (4.4) и (4.5), получим следующие выражения для концентраций хлорофилла а (Са) и хлорофилла b (Cb):
Ca = –0,97D642,2 + 10,05D660,6;
Cb = 16,36D642,2 – 2,43D660,6.
Подставляя в эти выражения соответствующие значения оптических плотностей, получим: Са = 4,62 мг/л и Сb = 2,95 мг/л, отноше-
ние a/b = 1,57.
Задания для практической работы
Задание 4.1. Коэффициент экстинкции миоглобина в фосфатном буферном растворе (рН = 6,8) при λ = 525 нм равен 7,6 л/(ммоль·см). Рассчитайте концентрацию миоглобина в растворе, если значение оптической плотности при измерении в кювете длиной l = 1 см равно
0,34 у.е.
Задание 4.2. Из листа растения Сarpinus betulus (граб) вырезали диск диаметром 1,5 см и экстрагировали из него хлорофиллы органическим растворителем в объеме 10 мл. Рассчитайте содержание хлорофилла а и хлорофилла b на 1 м2 поверхности листа по результатам измерений, приведенным в табл. 4.1.
Таблица 4.1
Параметры экстрактов хлорофиллов в различных растворителях
|
Вариант 1 |
Вариант 2 |
Вариант 3 |
||||
Параметры |
Диэтиловый |
Ацетон |
Метанол |
||||
эфир |
|||||||
|
|
|
|
|
|||
|
1 |
2 |
1 |
2 |
1 |
2 |
|
λ, нм |
642,2 |
660,6 |
644,8 |
661,6 |
652,4 |
665,2 |
|
D, у.е. |
0,145 |
0,475 |
0,230 |
0,653 |
0,089 |
0,370 |
|
ε (а), л/(мг·см) |
0,015 |
0,101 |
0,0193 |
0,0925 |
0,0355 |
0,0792 |
|
ε (b), л/(мг·см) |
0,062 |
0,006 |
0,0516 |
0,0094 |
0,0213 |
0,0389 |
|
21
Задание 4.3. Для определения коэффициента экстинкции цистеина в водном буферном растворе (рН = 7) измеряли оптическую плотность раствора с концентрацией 1 ммоль/л в кюветах разной длины: l1 = 1 см, l2 = 2 см. Каждое измерение повторяли 4 раза. Были
получены следующие результаты: |
|
|||
D1, у.е.: |
0,298 |
0,298 |
0,301 |
0,297 |
D2, у.е.: |
0,694 |
0,689 |
0,690 |
0,688 |
Рассчитайте значения ε и оцените погрешность его определения. Зависит ли коэффициент экстинкции от длины волны согласно полученным данным? Ответ объясните.
Контрольные вопросы
1.Как зависит оптическая плотность от концентрации раствора, от длины кюветы?
2.Зависит ли от выбора единиц измерения концентрации величина оптической плотности, коэффициента экстинкции?
3.Как связаны между собой коэффициенты ε и Е1%?
4.Сформулируйте принцип аддитивности оптической плотности.
Практическая работа № 5 ИНТЕРПРЕТАЦИЯ МАСС-СПЕКТРОВ
Цель работы: освоить основные приемы идентификации простых соединений по масс-спектрам.
Теоретическое введение
Масс-спектрометрия – метод анализа, основанный на различии в скорости или направлении движения заряженных частиц в электромагнитном поле. Поэтому для выполнения анализа вещество ионизируют. Процесс ионизации часто сопровождается фрагментацией молекулы на более мелкие частицы, каждая из которых может характеризоваться уникальным отношением ее массы к ее заряду (m/z).
22
Выход заряженных частиц из массоанализатора происходит в порядке увеличения отношения m/z. Эта последовательность, зафиксированная детектором, называется масс-спектром. Анализ масс-спектра дает информацию о природе анализируемого соединения и в большом числе случаев позволяет идентифицировать вещество.
Молекулярный ион. Анализ масс-спектра начинается с поиска молекулярного иона (МИ). Это катион-радикал (М+ ), полученный удалением от молекулы одного электрона. Таким образом, МИ имеет молекулярный вес анализируемого вещества. МИ должен соответствовать четырем условиям:
1)иметь самую большую массу в спектре (с учетом сателлитных изотопных пиков);
2)иметь нечетное число электронов;
3)быть способным к выбросу реальных нейтральных частиц;
4)включать все элементы, присутствующие в образце.
Эти условия, являясь необходимыми, не являются достаточными, однако в большинстве случаев позволяют надежно идентифицировать МИ на масс-спектрах простых соединений. Особенно полезными при первичном анализе являются условия 1 и 3. Так, можно отвергнуть гипотезу о МИ, если перед пиком предполагаемого МИ стоят пики фрагментов, масса которых меньше на 5–14 или 21– 25 а.е.м. Такие фрагменты не могут возникнуть в результате отщепления нейтральных частиц, а следовательно, исследуемая частица не молекулярный ион, а продукт его разрушения, сам же ион М+ не регистрируется в спектре.
Изотопные пики. Большинство элементов существуют в природе в виде нескольких изотопов. Распространенность изотопов некоторых химических элементов приводится в прил. В. Многие важные элементы характеризуются уникальным соотношением изотопов, что оказывается полезным идентифицирующим признаком. Например, изотопы брома, 79Br и 81Br, встречаются практически в равном соотношении. Таким образом, появление в спектре дублета А и (А+2) с пиками равной интенсивности с высокой вероятностью указывает на присутствие атома брома в соединении.
23
Соотношение изотопов 12С и 13С составляет 98,9:1,1. В органических соединениях, как правило, содержится несколько атомов углерода, что приводит к появлению мультиплетов. Интенсивность I (%) пиков в таком мультиплете определяется следующей формулой:
I 100 Cnm 0,011m , |
(5.1) |
гдеCnm – число сочетаний из n (число атомов углерода во фрагмен-
те) по m (число изотопов 13С во фрагменте).
Использование этой формулы приводит к простому правилу для определения числа атомов углерода в МИ. Оно не может быть больше частного от деления интенсивности пика (М+1), выраженной в процентах от основного пика, на 1,1. Поскольку в интенсивность этого пика могут вносить вклад другие элементы, имеющие изотоп (А+1) (азот, кремний, сера), то это отношение может быть не целочисленным. На основании выражения (5.1) составлена таблица интенсивностей пиков изотопных ионов с различным числом атомов углерода (прил. Г).
Пик (М+2) также предоставляет важную информацию. Если амплитуда этого пика меньше 3 % от интенсивности пика М, соединение не содержит атомов элементов (А+2) (Cl, Br, Si, S). C другой стороны, наличие n атомов элемента (А+2) приводит к появлению мультиплета из (n + 1) пиков, интенсивность которых подчиняется формуле биномиального распределения (a и b – природное соотношение изотопов данного элемента):
a b n an nan 1b |
n n 1 an 2b2 |
|
n n 1 n 2 an 3b3 |
(5.2) |
|
|
|||
2! |
3! |
|
||
Азотное правило. Если вещество не содержит атомов азота или в его составе их четное число, то его молекулярная масса четная; если число атомов азота нечетное, то и молекулярная масса будет нечетной.
Масс-спектрометрия высокого разрешения. При измерении атомной массы за стандарт взят основной изотоп углерода 12С, атомная масса которого принята равной 12,000000 Да. Атомные массы
24
всех остальных элементов не целочисленные. Ниже приведены их значения для важнейших элементов:
1H 1,007825
12C 12,000000
14N 14,003074
16O 15,994915
32S 31,972072
Метод масс-спектрометрии высокого разрешения позволяет определять массу ионов с точностью до 4–5 знаков после запятой. Любому целочисленному значению молекулярной массы может соответствовать несколько брутто-формул, например N2 (28) и CO (28). Однако совпадение этой характеристики в 4-м и даже 3-м десятичном разряде маловероятно. Поэтому точная масса является важным идентификационным признаком.
Пример 5.1. Определите, какая из двух последовательностей фрагментов начинается с МИ:
а) 130, 129, 117, 114, 102, 101,…; б) 180, 179, 177, 154, 153,…
Решение. В последовательности а фрагмент 117 отличается от первого фрагмента 130 на 13 а.е.м. Частиц с такой молекулярной массой не существует, т.е. фрагмент 117 не может быть продуктом молекулярного иона. В серии б все фрагменты, начиная со второго, могут быть продуктами деструкции МИ: 179 (–Н), 177 (–2Н), 154 (–С2Н2), 153 (–С2Н3). Следовательно, с молекулярного иона начинается последовательность б.
Пример 5.2. Установите элементный состав МИ по интенсивности изотопных пиков для следующего спектра: 79 (100); 80 (5,9); 81 (0,1). В скобках указана интенсивность в процентах от пика МИ.
Решение. Пик (М+1) (m/z = 80) составляет несколько процентов от пика МИ при очень слабом пике (М+2), что характерно для содержания нескольких атомов углерода в молекуле. По таблице в прил. Г находим, что ближайшая к I = 5,9 % величина 5,5 % соответствует 5 атомам углерода, что подтверждается интенсивностью пика (М+2) (для 5 атомов углерода она должна быть 0,12 %). В интенсивности пика (М+1) остается еще 0,4 % (5,9 – 5,5 = = 0,4). Такая величина интенсивности характерна для 15N. Находим
25
для пика М сумму молекулярных масс 12С и 14N: 5 · 12 + 14 = 74 Да. Осталось 5 а.е.м. (79 – 74 = 5). Их логично отнести к водороду. Таким образом, брутто-формула вещества – C5H5N.
Пример 5.3. Идентифицируйте соединение по масс-спектру: 32 (14,2); 33 (0,2); 34 (0,8); 38 (4,8); 39 (0,4); 44 (16,3); 45 (0,4); 46 (0,7); 76 (100); 77 (2,8); 78 (7,6); 80 (0,2). В скобках указана интен-
сивность в процентах от максимального пика.
Решение. Допустим, что самый интенсивный пик соответствует МИ; он удовлетворяет условиям 1, 3 и 4 молекулярного пика. На основании относительно высокой интенсивности пика (М+2) заключаем, что соединение может содержать S, Cl или Br. Однако характерных мультиплетов хлора и брома в спектре не содержится, а мультиплет (76, 78, 80) близок по структуре мультиплету серы. На наличие серы указывает относительно интенсивный пик c m/z = 32 и сателлитный пик с m/z = 34 при отношении их интенсивностей, близком
ктаковому для изотопов 32S и 34S. Молекулярная масса иона М+• указывает на то, что в нем содержится два изотопа 32S. Разность между
Mr(М+•) и двумя массами легкого изотопа серы, равная 12 а.е.м., подсказывает наличие в МИ атома углерода. Это предположение под-
тверждается интенсивностью пика (М+1) (m/z = 77). Поскольку МИ может включать как изотоп 13С, так и изотоп 33S, интенсивность его
пика складывается из распространенностей этих двух изотопов, причем в случае серы с учетом того, что вторым изотопом будет 32S. Находим эту интенсивность: 1,1 + 2 · 0,95 · 0,0075 = 2,5 %. Это близко
кнаблюдаемой величине.
Пики с m/z = 44 и m/z = 38 объясняются образованием ионов CS+• и СS22+•. Таким образом, спектр получает полное объяснение, если принять, что идентифицируемое соединение – это CS2.
Задания для практической работы
Задание 5.1. Установите, может ли указанная последовательность фрагментов начинаться с МИ:
а) С10H22, C8H17, C7H15, C6H13, C5H11, C4H9, C3H7;
б) С10H22, C9H18, C8H17, C7H15, C6H13, C5H11, C4H9, C3H7; в) C6H12O, C6H11O, C6H12, C6H9, C3H5O;
26
г) C6H12O, C6H11O, C6H9, C5H12, C3H5O.
Задание 5.2. Установите элементный состав МИ по интенсивности изотопных пиков (в скобках указана интенсивность пика в процентах от пика МИ):
а) 176 (100), 177 (11,2), 178 (32,9); б) 60 (100), 61 (2,2), 62 (0,3).
Задание 5.3. Получите у преподавателя масс-спектрограмму. Расшифруйте. Идентифицируйте вещество.
Задание 5.4. Молекулярная масса МИ, определенная на массспектрометре высокого разрешения, равна 60,06854 а.е.м. Анализ масс-спектра указывает на наличие в молекуле двух атомов углерода. Предположительные формулы: С2Н4О2 и C2H8N2. Определите, какое из этих двух соединений было проанализировано.
Контрольные вопросы
1.Что такое молекулярный ион?
2.Перечислите признаки молекулярного иона.
3.Как можно оценить число атомов углерода в молекуле по масс-спектру?
4.В чем заключается азотное правило?
Практическая работа № 6 ХАРАКТЕРИСТИКИ ЭЛЮИРОВАНИЯ И РАЗДЕЛЕНИЯ
В ХРОМАТОГРАФИИ
Цель работы: научиться определять характеристики удерживания, селективности и эффективности хроматографической системы по хроматограммам.
Теоретическое введение
Характеристиками удерживания компонента являются время tR или объем VR удерживания и коэффициент удерживания k'. Величина tR находится по хроматограмме (рис. 6.1), VR может быть измерен сбором подвижной фазы на выходе из колонки.
27
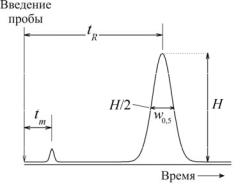
Рис. 6.1. Определение параметров пика по хроматограмме
Коэффициент удерживания рассчитывают по формуле
k |
|
|
tR tm |
|
VR Vm |
. |
(6.1) |
|
|
t |
m |
V |
|||||
|
|
|
|
|
m |
|
|
|
В этом уравнении параметр tm – это так называемое мертвое время, т.е. время, необходимое подвижной фазе, чтобы пройти через хроматографическую колонку. Обычно его отождествляют со временем выхода неудерживаемого вещества. Соответственно Vm – это объем подвижной фазы в колонке.
Очевидно, что VR = FV·tR, где FV – объемная скорость подвижной фазы.
Коэффициент удерживания связан с постоянной K распределения адсорбируемого вещества между подвижной и неподвижной фазами следующим соотношением: k' = βK, где β есть соотношение объемов неподвижной и подвижной фаз в колонке. Указанная связь позволяет использовать хроматографический метод для изучения механизмов адсорбционных процессов.
Отношение коэффициентов k' двух веществ для одной хроматографической колонки называется селективностью колонки:
k2 . |
(6.2) |
k1
28
Как правило, индексами 1 и 2 обозначают соответственно слабее и сильнее удерживаемые вещества. Тогда α > 1.
Селективность характеризует способность насадки колонки к разделению двух компонентов, однако реализация этой способности зависит кроме адсорбционных свойств неподвижной фазы и температуры от гидродинамических условий в колонке и от кинетических свойств насадки. Последние факторы определяют размывание хроматографического пика, а чем шире пики, тем большее расстояние между ними требуется для их разделения. Полнота разделения характеризуется степенью разделения пиков R. По определению R – это отношение разности времен удерживания разделяемых компонентов к средней ширине оснований пиков, обозначенных w1 и w2 соответственно:
R 2 |
tR,2 |
tR,1 |
. |
(6.3) |
w |
|
|||
|
w |
|
||
1 |
2 |
|
|
|
Полному разделению двух пиков на уровне нулевой линии соответствуют значения R ≥ 1. Для перекрывающихся пиков этот показатель всегда будет меньше 1.
Допуская, что пики имеют гауссову форму, можно вывести уравнение, связывающее R с величинами α, k' и N (число теоретических тарелок):
R |
N 1 |
k2 |
. |
(6.4) |
||
|
|
|
||||
4 |
1 k2 |
|||||
|
|
|
||||
Параметр N учитывает размывание хроматографического пика. Он зависит от динамики массопереноса в хроматографической колонке. Чем выше скорость процессов адсорбции/десорбции и чем меньше размывание зоны массопереноса, обусловленной процессами аксиальной дисперсии, тем больше число теоретических тарелок и уже хроматографический пик. Для гауссова пика число теоретических тарелок рассчитывается по уравнению
|
|
t |
R |
2 |
|
|
N 5,54 |
|
|
|
, |
(6.5) |
|
|
|
|||||
|
w |
|
|
|
||
|
|
|
0,5 |
|
|
|
29
где w0,5 – ширина пика на половине высоты Н (см. рис. 6.1).
В уравнение (6.4) подставляется среднее значение N для двух разделяемых пиков.
Пример 6.1. Хроматографическая колонка длиной L = 25 см, внутренним диаметром d = 0,46 см заполнена алкилированным силикагелем. Время выхода нитрита натрия, используемого в качестве неудерживаемого трейсера, составляет 2,908 мин при объемной скорости подвижной фазы 1 мл/мин. Объем внеколоночных коммуникаций хроматографа 0,032 мл. Определите фазовое отношение β.
Решение. Находим удерживаемый объем NaNO2: VR = FV tR = = 2,908 мл. Эта величина включает в себя и внеколоночный объем, поскольку проба проходит как колонку, так и внеколоночные линии. Таким образом, скорректированный мертвый объем Vm = 2,908 –
– 0,032 = 2,876 мл. Геометрический объем колонки определяется как
объем цилиндра: Vкол = 0,25πd2L, т.е. Vкол = 0,25·π·0,462·25 = 4,155 мл.
Отсюда находим объем неподвижной фазы: 4,155 – 2,876 = 1,279 мл. Отношение объемов неподвижной и подвижной фаз β = 1,279/2,876 = = 0,445.
Пример 6.2. При разделении смеси двух компонентов (1 и 2) определены их времена выхода (tR(1) = 7,52 мин; tR(2) = 9,87 мин) и значения ширины пика на половине высоты (w0,5(1) = 1,03 мин; w0,5(2) = 1,54 мин). Мертвое время tm = 1,00 мин. Рассчитайте коэффициенты удерживания обоих компонентов, значения N для обоих пиков, селективность и степень разделения.
Решение. Значения коэффициентов удерживания найдем по формуле (6.1):
k1 |
7,52 1,00 |
6,52 ; |
k2 |
9,87 1,00 |
8,87. |
|
1,00 |
|
|
1,00 |
|
Селективность рассчитываем по уравнению (6.2):
α = 8,87/6,52 = 1,36.
Число N определяем по уравнению (6.5):
N1 |
|
7,52 |
2 |
295 ; |
N2 |
|
9,87 |
2 |
228. |
5,54 |
1,03 |
|
5,54 |
1,54 |
|
||||
|
|
|
|
|
|
|
|
30
