
Расчет химического равновесия многокомпонентной смеси (90
..pdf
Цель работы: провести расчет равновесия реакции С8Н10С8Н8 + Н2 в интервале следующих мольных отношений, температур, давлений:
- мольные отношения С8Н8 / Н2 = 1/1 (мол.) и
С8Н8 / Н2 = 1/2 (мол.)
-температуры 500 – 750 К с шагом 50 К
-давления 1 –5 атм . С шагом 1 атм.
На основе полученных расчетных данных построить в программе «Excel» графическую зависимость степени превращения от температуры и давления. Определить оптимальные условия реакции.
Зависимостьконстантыравновесияоттемпературыидавления
константа равновесия Кр
1,400000E-02
1,200000E-02
1,000000E-02
8,000000E-03
6,000000E-03
4,000000E-03
2,000000E-03
0,000000E+00  450 500 550 600 650 700 750 800
450 500 550 600 650 700 750 800
-2,000000E-03
температура, К
 давление1атм.
давление1атм.
 давление2атм.
давление2атм.
 давление3атм.
давление3атм.
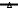 давление4атм.
давление4атм.
 давление5атм.
давление5атм.
41

Зависимостьстепенипревращенияоттемпературыидавления(графикидля различныхдавленийналожилисьдругнадруга, степеньпревращенияпостоянна)
7,800000E-06
7,600000E-06

степень превращения
7,400000E-06
7,200000E-06
7,000000E-06
6,800000E-06
6,600000E-06
6,400000E-06
6,200000E-06
6,000000E-06
450 |
500 |
550 |
600 |
650 |
700 |
750 |
800 |
температура,К
Вывод. Из расчетных данных (таблица 1) следует, что степень превращения в исследуемых областях, от давления и температуры не зависит и очень мала 7,629438·10-6, следовательно, реакция в данных условиях практически не идет. Так как исследуемая нами реакция идет с увеличением объема продуктов по отношению к исходным реагентам, то оптимальными условиями для данной реакции является пониженное давление (ниже 1 атм.).
42
СОДЕРЖАНИЕ
1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ………………………………… |
3 |
1.1. Понятие "равновесия химической реакции"…………….. |
3 |
1.2. Закон равновесных концентраций……………………….. |
4 |
1.3. Константа равновесия и энергия Гиббса. |
|
Уравнение изотермы Вант-Гоффа………………………... |
6 |
1.4. Химическое равновесие в гетерогенных реакциях……… |
8 |
1.5. Способы смещения равновесия…………………………... |
9 |
1.5.1. Влияние давления……………………………………….. |
10 |
1.5.2. Влияние инертного газа…………………………………. |
11 |
1.5.3. Влияние концентрации………………………………….. |
11 |
1.5.4. Влияние температуры…………………………………… |
12 |
1.6. Зависимость константы равновесия от температуры…… |
12 |
1.7. Расчет констант равновесия для идеальных газов по |
|
термодинамическим данным………………………………….. |
14 |
1.8. Приближенные методы расчета G0 и константы |
|
равновесия………………………………………………………. |
19 |
1.9. Равновесие в системе реальных газов……………………. |
21 |
1.10. Экспериментальное определение равновесий………….. |
23 |
1.11. Расчет равновесия простых реакций……………………. |
25 |
1.12. Расчет равновесия сложных реакций…………………… |
26 |
1.13. Равновесие жидкофазных реакций……………………… |
27 |
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ………………………… |
32 |
2.1. Общие правила пользования комплексом программ……. |
32 |
2.2. Алгоритм расчета равновесия…………………………….. |
32 |
2.3. Исходные данные для расчета равновесия………………. |
34 |
2.4. Результаты расчета………………………………………… |
35 |
ЗАДАНИЯ………………………………………………………. |
36 |
БИБЛИОГРАФИЧЕСКИЙ СПИСОК…………………………. |
39 |
ПРИЛОЖЕНИЕ……………………………………………...…… |
40 |
43
РАСЧЕТ ХИМИЧЕСКОГО РАВНОВЕСИЯ МНОГОКОМПОНЕНТНОЙ СМЕСИ
Составители:
Э.А. Ефанова
И.А. Суворова
Редактор Т.М. Петрова
|
Лицензия № 020404 от 06.03.97 |
|
|
Подписано в печать |
Формат 60х84 1/16. |
||
Бумага писчая. |
Печать RISO. |
|
усл.печ.л. |
уч.-изд.л. |
Тираж 100 экз. |
Заказ |
«С» |
Издательство Казанского государственного технологического университета
Офсетная лаборатория Казанского государственного технологического университета
420015, Казань, К.Маркса, 68
