
- •1 Точка 1 семестр Методы объемного анализа.
- •Зависимость эквивалента вещества от реакции.
- •Понятие об эквиваленте. Объемные методы анализа. Методы расчета в объемном методе анализа.
- •Понятие об эквиваленте. Объемные методы анализа. Эквивалент простых и сложных веществ.
- •2 Точка 1 семестр Молекулярность и порядок реакций
- •Зависимость скорости реакции от концентраций реагирующих веществ.
- •Зависимость скорости реакции от температуры.
- •Гомогенный, гетерогенный и микрогетерогенный катализ.
- •Химическая термодинамика Первое начало термодинамики. Закон Гесса.
- •Химическая термодинамика. Основные термодинамические понятия.
- •Химическая термодинамика Второй закон термодинамики. Свободная энергия.
- •Принцип Ле-Шателье.
- •Костанта равновесия.
- •Химическая связь.
- •Современное представление о строении атома.
- •2 Точка 2 семестр
- •Комплексные соединения.
- •3 Точка 1 семестр Учения о растворах Теория электролитической диссоциации. Сильные и слабые электролиты.
- •Учение о растворах Коллигативные свойства растворов.
- •Учения о растворах Коллоидная химия
- •Учения о растворах. Буферные системы
- •Учения о растворах Ионное произведение воды и водородный показатель.
- •Учения о растворах Гидролиз солей.
- •Учения о растворах Способы выражения концентрации растворов.
- •3 Точка 2 семестр
Зависимость скорости реакции от температуры.
1. Задание {{ 165 }} ТЗ № 165
Температурный коэффициент скорости реакции по правилу Вант-Гоффа можно рассчитать
+
![]()
+
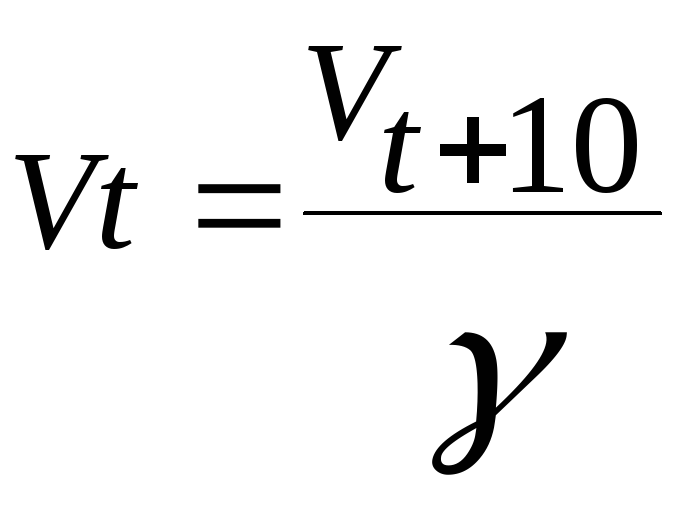
-
![]()
+
![]()
2. Задание {{ 166 }} ТЗ № 166
Математически правило Вант-Гоффа записывается
-
![]()
+
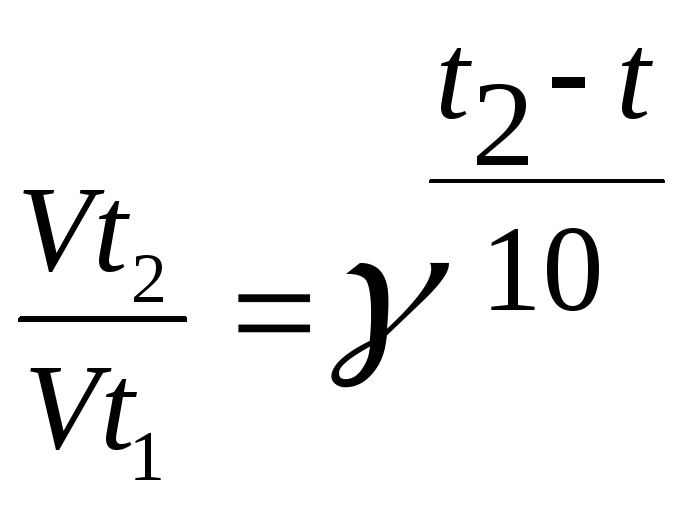
+
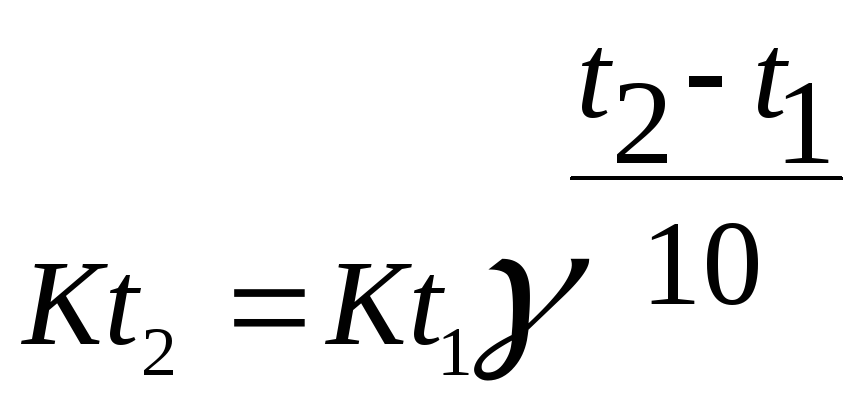
-
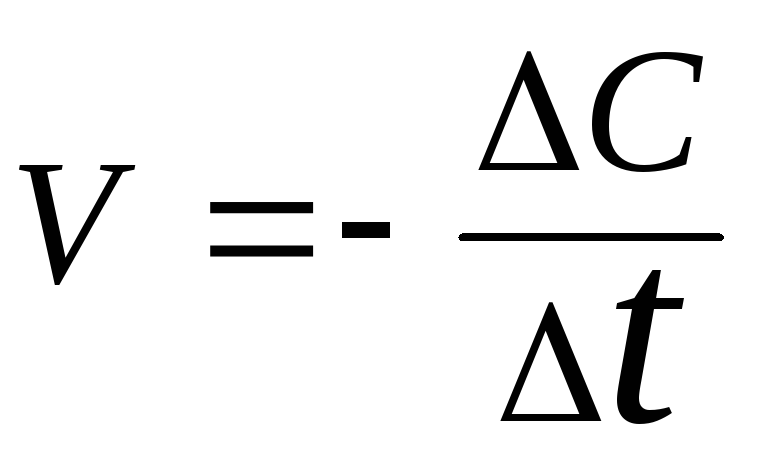
3. Задание {{ 167 }} ТЗ № 167
Зависимость скорости реакции от температуры по уравнению Аррениуса определяется по формулам
-
![]()
+
![]()
+
![]()
-
![]()
4. Задание {{ 537 }} ТЗ № 537
Отметьте правильный ответ.При повышении температуры скорость химической реакции
+ увеличивается
- уменьшается
- увеличивается затем уменьшается
- уменьшается затем увеличивается
- не изменяется
5. Задание {{ 538 }} ТЗ № 538
При понижении температуры скорость экзотермической реакции
+ увеличивается
- уменьшается
- не изменяется
6. Задание {{ 539 }} ТЗ № 539
При повышении температуры скорость эндотермической реакции
+ увеличивается
- уменьшается
- не изменяется
7. Задание {{ 540 }} ТЗ № 540
Температурный коэффициент скорости реакции равен 2. Чтобы скорость реакции возросла в 8 раз следует повысить температуру на
-
20![]()
+
30![]()
-
40![]()
-
60![]()
8. Задание {{ 541 }} ТЗ № 541
Температурный
коэффициент скорости реакции равен 3.
При повышении температуры на 30![]() скорость реакции возрастает в
скорость реакции возрастает в
- 9 раз
+ 27 раз
- 64 раза
- 81 раз
9. Задание {{ 542 }} ТЗ № 542
Температурный
коэффициент скорости реакции равен 2.
При повышении температуры на 40![]() константа скорости реакции увеличится
в
константа скорости реакции увеличится
в
- 4 раза
+ 16 раз
- 18 раз
- 64 раза
10. Задание {{ 543 }} ТЗ № 543
Температурный
коэффициент скорости реакции равен 4.
При уменьшении температуры на 40![]() скорость химической реакции уменьшится
в
скорость химической реакции уменьшится
в
- 4 раза
- 8 раз
+44 раз
- не изменится
11. Задание {{ 544 }} ТЗ № 544
Чтобы скорость реакции, с температурным коэффициентом равным 7, увеличилась в 49 раз следует повысить температуру на
-
4![]()
+
20![]()
-
70![]()
-
280![]()
12. Задание {{ 545 }} ТЗ № 545
Температурный коэффициент скорости реакции равен 2. Чтобы скорость реакции увеличилась в 16 раз надо повысить температуру на
-
4![]()
-
8![]()
-
32![]()
+
40![]()
-
256![]()
13. Задание {{ 546 }} ТЗ № 546
При
увеличении температуры на 20![]() скорость реакции возрастает в 9 раз.
Температурный коэффициент такой реакции
равен
скорость реакции возрастает в 9 раз.
Температурный коэффициент такой реакции
равен
- 1
- 2
+ 3
- 4
- 5
14. Задание {{ 547 }} ТЗ № 547
Повышение температуры скорость экзотермической реакции
- повышает
+ понижает
- не изменяет
15. Задание {{ 548 }} ТЗ № 548
Зависимость скорости реакции от температуры выражается уравнениями
+
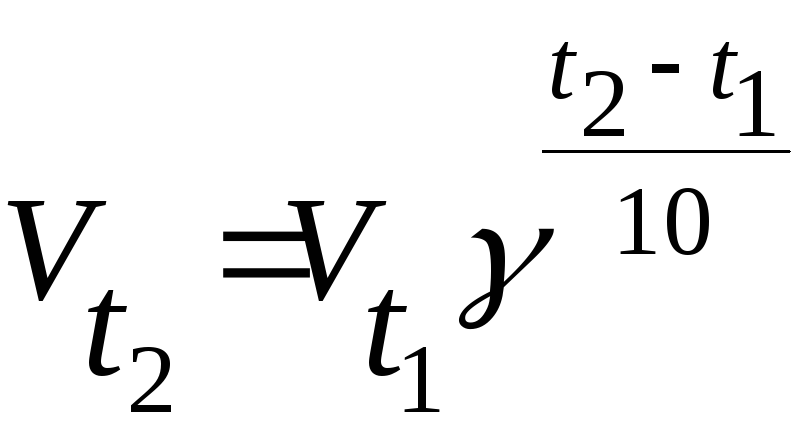
+
![]()
+
![]()
-

16. Задание {{ 549 }} ТЗ № 549
Зависимость константы скорости реакции от энергии активации Еа выражается уравнением Аррениуса:
+
![]()
+
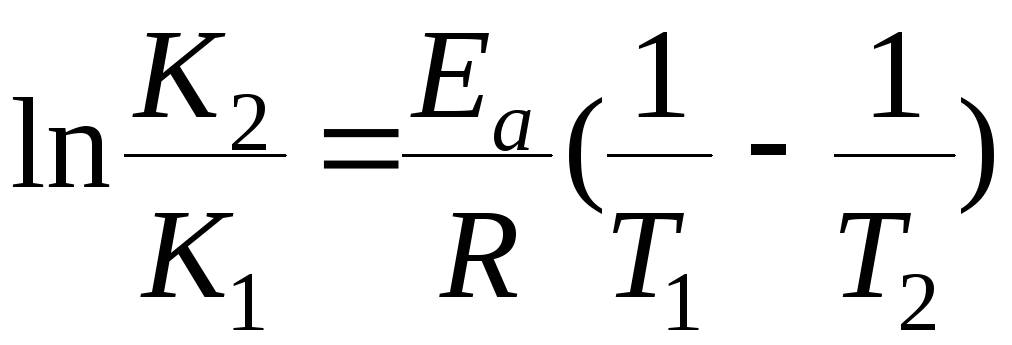
+
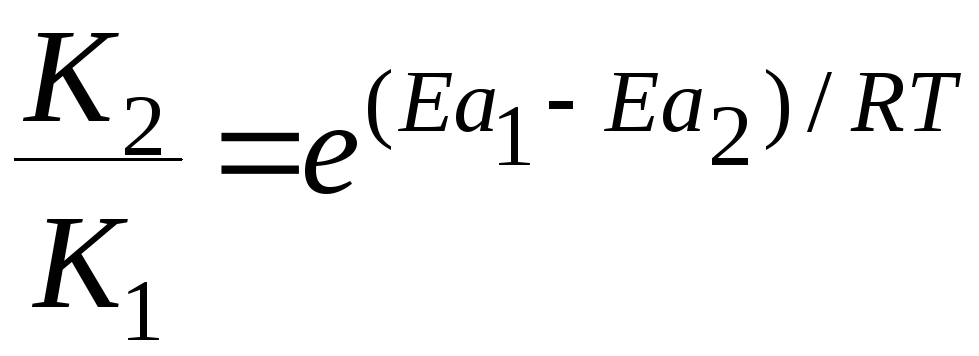
-
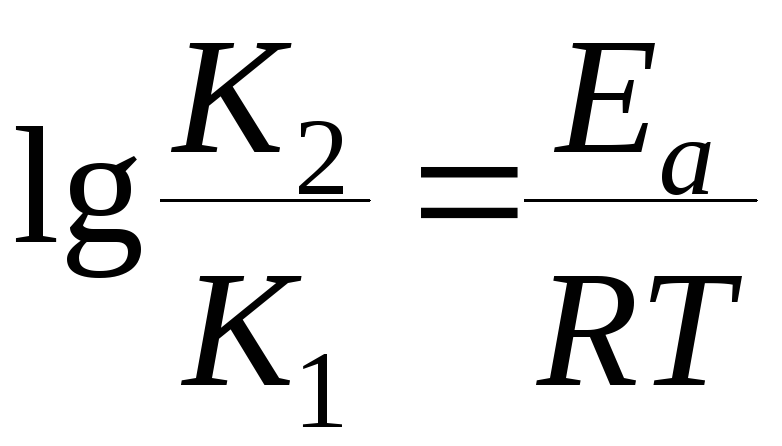
17. Задание {{ 550 }} ТЗ № 550
Температурный
коэффициент скорости равен 2. При
повышении температуры от 40 до 60![]() С
скорость реакции увеличится в
С
скорость реакции увеличится в
+ 4 раза
- 8 раз
- 16 раз
- 32 раза
