
14
(анион) в именительном падеже, а затем электроположительная (катион) в родительном падеже. При этом в случае одноэлементного аниона используют суффикс – ид, а в случае многоэлементного аниона суффикс – ат (если элемент имеет постоянную степень окисления или элемент с переменной степенью окисления находится в высшей степени окисления) или суффикса – ит (если элемент находится в низшей степени окисления). Например:
CO – оксид углерода (II),
CO2 – оксид углерода (IV),
HCl – хлорид водорода (хлороводород), NaH – гидрид натрия,
Fe2(SO4)3 – сульфат железа (III), NaNO2 – нитрит натрия,
KJ – иодид калия, KJO3 – иодат калия.
Традиционные названия кислых солей образуют, добавляя к названию аниона соответствующей средней соли приставку гидро-, например:
KHSO4 – гидросульфат калия, NaH2PO4 – дигидросульфат натрия.
Названия основных солей образуют, добавляя к наименованию аниона соответствующей средней соли приставку гидроксо-, например:
FeOHNO3 – гидроксонитрат железа (II), (CoOH)2SO4 – гидроксосульфат кобальта (II), BiOCl – оксохлорид висмута (III).
Задания по теме «Номенклатура неорганических соединений» сведены в табл. 1.2.
Таблица 1.2
Номенклатура неорганических соединений
№ |
Дайте название |
№ |
Напишите формулу соединения |
|
п/п |
соединению |
п/п |
||
|
||||
|
|
|
|
|
1.1. |
Ca3(PO4)2 |
1.1. |
Гидросульфит натрия |
|
1.2. |
CuOHCl |
1.2. |
Сульфат бария |
|
|
|
|
|
15
1.3. |
NaJO |
1.3. |
Тиосульфат натрия |
|
|
|
|
1.4. |
Ca(HSO4)2 |
1.4. |
Иодат натрия |
|
|
|
|
1.5. |
KBrO3 |
1.5. |
Гидроксосульфат железа (III) |
|
|
|
|
1.6. |
Cr2(SO4)3 |
1.6. |
Дихромат калия |
1.7. |
Al2O3 |
1.7. |
Гипоиодит натрия |
|
|
|
|
1.8. |
NaH2AsO3 |
1.8. |
Гидроксид бария |
1.9. |
Na2O2 |
1.9. |
Нитрат алюминия |
|
|
|
|
1.10. |
AlOHSO4 |
1.10. |
Дигидрофосфат кальция |
|
|
|
|
1.11. |
(NiOH)2SO4 |
1.11. |
Иодид аммония |
|
|
|
|
1.12. |
FeS |
1.12. |
Гидросульфат кальция |
|
|
|
|
1.13. |
NO2 |
1.13. |
Гидроксосульфат меди (II) |
1.14. |
NaH2AsO4 |
1.14. |
Гидрид кальция |
|
|
|
|
1.15. |
AgCN |
1.15. |
Сульфат гидроксомеди (II) |
|
|
|
|
1.16. |
CuCrO4 |
1.16. |
Сульфит серебра |
|
|
|
|
1.17. |
(CuOH)2CO3 |
1.17. |
Хромат серебра |
|
|
|
|
1.18. |
AgNCS |
1.18. |
Сульфид висмута (III) |
|
|
|
|
1.19. |
Pb(JO3)2 |
1.19. |
Гидроксид кальция |
|
|
|
|
1.20. |
KJO4 |
1.20. |
Сульфид серебра |
|
|
|
|
1.21. |
CrPO4 |
1.21. |
Иодид серебра |
|
|
|
|
1.22. |
KNO2 |
1.22. |
Перманганат серебра |
1.23. |
Fe(OH)2Cl |
1.23. |
Тиоцианат меди |
|
|
|
|
1.24. |
Mg3(AsO4)2 |
1.24. |
Бромид гидроксосвинца (II) |
|
|
|
|
1.25. |
CuNCS |
1.25. |
Тиосульфат серебра |
|
|
|
|
1.26. |
Mg(ClO4)2 |
1.26. |
Тетраборат натрия |
|
|
|
|
1.27. |
Na2Cr2O7 |
1.27. |
Гидросульфит натрия |
|
|
|
|
1.28. |
Na2S2O3 |
1.28. |
Фосфат цинка |
|
|
|
|
1.29. |
MgSO3 |
1.29. |
Цианид меди |
1.30. |
PbS |
1.30. |
Гидроксид железа (II) |
|
|
|
|
16
Тема 2. Строение атома. Периодический закон и периодическая система элементов Д.И. Менделеева
При выполнении задания по этой теме необходимо дать характеристику одному из элементов периодической таблицы Д.И. Менделеева (в соответствии с номером задания в Вашем варианте):
-напишите электронную формулу химического элемента;
-укажите принадлежность к s-, p-, d- семейству;
-укажите валентные электроны;
-укажите характерные степени окисления элементов;
-укажите на окислительно-восстановительные свойства элемента в виде простых и сложных веществ;
-напишите формулы оксидов и соответствующих гидроксидов или кислот;
-укажите, образует ли этот элемент гидриды.
2.1. Na |
2.13. |
Ni |
2.25. Mn |
2.2. Mg |
2.14. |
Br |
2.26. Sn |
2.3. Cu |
2.15. |
Cl |
2.27. Pb |
2.4.Ag |
2.16. |
J |
2.28. Bi |
2.5. K |
2.17. |
Zn |
2.29. Sr |
2.6. S |
2.18. |
Cd |
2.30. F |
2.7. Cr |
2.19. |
Ca |
2.31. C |
2.8. As |
2.20. |
Ba |
2.32. Al |
2.9. Sb |
2.21. |
B |
2.33. H |
2.10. Pt |
2.22. |
Si |
2.34. Hg |
2.11. Fe |
2.23. |
P |
2.35. Au |
2.12. Co |
2.24. |
N |
|
Тема 3. Химическая связь и строение молекул
При изучении этой темы следует уяснить современные представления о природе химической связи. Так, механизм образования химической связи удобнее рассмотреть с позиций метода валентных связей. На основе современных представлений о строении атома объяснить свойства химиче-
17
ской связи: энергию, длину, насыщаемость, направленность, полярность. Разберитесь в особенностях ионной, металлической и водородной связи.
3.1.По какому механизму образования ковалентной связи построены молекулы J2 и NH3?
3.2.По какому механизму образования ковалентной связи построены молекулы F2, H2O? В какой из молекул связь является полярной? Почему?
3.3.На основании сравнения величин относительной электроотрицательности для p-элементов, проследите, как изменяется полярность связи в молекулах NH3 и PH3.
3.4.Приведите схему образования молекулы N2 (с учетом перекрывания электронных облаков, соединяющихся атомов). Сколько сигма- и писвя- зей в молекуле азота?
3.5.Молекулы H2O и CO2 содержат по две полярные связи каждая. Почему молекула H2O полярна, а CO2 – неполярна?
3.6.По какому механизму образования ковалентной связи построен ион аммония NH4+?
3.7.Используя значения относительной электроотрицательности, укажите и объясните направление общей электронной пары для соединений
HF и CF.
3.8.Дипольные моменты H2O и H2S равны 1,84 Д и 0,93 Д соответственно. В какой молекуле связь более полярна?
3.9.Сколько сигма- и писвязей в молекулах O2, N2, Br2?
3.10.Исходя из метода валентных связей, сделайте вывод о возможных валентностях серы в стационарном и возбужденном состоянии.
3.11.Дипольный момент CO2 равен нулю, а H2O – 1,84 Д. Как построены эти молекулы?
3.12.По какому механизму образования ковалентной связи построен ион оксония H3O+?
3.13.Приведите примеры молекулы, между атомами которых возникает водородная связь. Как влияет водородная связь на свойства веществ?
3.14.Какие атомные орбитали участвуют в образовании химической связи сероводорода H2S? Полярна ли эта молекула?
3.15.Какой тип связи в галогенидах щелочных металлов? Почему?
18
3.16.Почему молекула Cl2 неполярна, а JCl полярна?
3.17.Объясните, в каких молекулах CO, CO2, HBr, Br2 связь полярная, в каких неполярная?
3.18.По какому механизму образования ковалентной связи построены молекулы N2, HCl, H2O?
3.19.В каких молекулах возникает ионная связь? Приведите примеры.
3.20.Чем отличается металлическая связь от ковалентной?
Тема 4. Гидролиз солей
Для предложенных водных растворов солей Вашего варианта определите возможность протекания реакции гидролиза. Необходимо вспомнить, что реакция между солью и водой протекает только в том случае, если образуются слабые (в том числе малорастворимые) электролиты. Это приводит к смещению равновесия в диссоциации воды и, следовательно, к изменению рН среды. Таким образом, чтобы выполнить это задание, надо знать сильные и слабые кислоты и основания, а также шкалу рН в водных растворах. Соли, образованные сильной кислотой и сильным основанием, не приводят к смещению равновесия и изменению рН среды.
В случае протекания реакции гидролиза запишите соответствующие уравнения реакции, определите тип гидролиза (по катиону или аниону) и определите реакцию среды (рН>7; рН=7; рН<7).
4.1.Bi(NO3)3, KCl, K2SO4, BaCl2.
4.2.KJ, Na2HPO4, SnCl2, NaCl, NaNO3.
4.3.MgCl2, FeCl2, Na2S, Na2SO4, NaCl.
4.4.K2CO3, NaBr, AlCl3, KCl, Ba(CH3COO)2.
4.5.AgNO3, Fe(NO3)3, Ca(NO3)2, NH4NO3, NH4NO2
4.6.LiCl, Ca(CH3COO)2, Na2SO4, BaCl2, (NH4)2SO4.
4.7.Na2SO4, (NH4)2SO4, Al2SO4, AgNO3, Na2SO3.
4.8.NaNO2, NH4NO2, CaCl2, KCl, NaNO3.
4.9.Na2SO3, K2SO4, K2S, NaNO3, BaCl2.
4.10.Ba(NO3)2, FeCl3, NaBr, K2SO4, (NH4)2S.
4.11.Na2SO4, Na2CO3, (NH4)2CO3, SrCl2, KJ.

19
4.12.K2SO3, BiCl3, NH4Cl, KJ, Al(NO3)3.
4.13.K2S, KCl, KCH3COO, MgSO4, NaNO3.
4.14.CuCl2, NH4NO3, CaCl2, NaBr, Mg(NO3)2.
4.15.NaCl, NH4Cl, KNO3, BaCl2, FeSO4.
4.16.NaH2PO4, KBr, Sn(NO3)2, KCl, NaNO3.
4.17.Na2CO3, Fe(NO3)3, CuSO4, NaBr, CaCl2.
4.18.Na2S, NH4NO3, K2SO3, NaCl, K2SO4.
4.19.NH4NO3, KBr, NH4CH3COO, K2S, K2SO4.
4.20.(NH4)2S, NH4Cl, NaCl, Na2SO3, K2SO4.
Тема 5. Малорастворимые электролиты
Задания по этой теме представлены в виде задач, для решения необходимо знать правило произведения растворимости и растворимость малорастворимых электролитов с ионным типом кристаллической решетки.
Осадок малорастворимого электролита выпадает, если произведение концентрации его ионов (ПИ) в растворе больше величины произведения растворимости (ПР).
Пример 1. Выпадает ли осадок AgCl при сливании равных объемов 0,01
Мраствора AgNO3 и 0,02 М раствора NaCl? ПР (AgCl) =1,78·10-10. Решение. При сливании равных объемов общий объем раствора увели-
чивается вдвое, следовательно, первоначальная концентрация ионов уменьшается вдвое. Находим произведение концентрации ионов, образующих малорастворимое соединение.
Ag+ + Cl- = AgCl
ПИ = [Ag] [Cl] = 5·10-3·1·10-2 = 5·10-5. 5·10-5 > 1,78·10-10, следовательно оса-
док выпадает.
Взаимосвязь произведения растворимости (ПР) с растворимостью (Р) в моль/дм3 для электролита AmBn выражается формулой
PA m B n |
= |
m+n |
ПР m n |
|
|
|
|
mm nn |
|
||
|
|
|
|
|
|
Для бинарных электролитов P = |
ПР . |
|
|
||
Растворимость в г/ дм3 (  ) находят по формуле
) находят по формуле 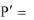
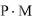

20
Пример 2. Какова растворимость оксалата кальция, если ПР(CaC2O4) =
2,29·10-9?
Решение: P CaC2 O 4 = [Ca2+] = [C2O42-] = 
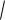 ПР(CaC2O4 ) =
ПР(CaC2O4 ) = 
 2,29
2,29  10 9 = 4,78·10-5.
10 9 = 4,78·10-5.
Для выражения растворимости в г/дм3 полученное значение умножают на молярную массу соли.
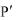 = 4,78·10-5 моль/дм3×128,1 г/моль = 6,12·10-3 г/дм3.
= 4,78·10-5 моль/дм3×128,1 г/моль = 6,12·10-3 г/дм3.
Необходимые значения величин произведения растворимости приведены в Приложении 1.
5.1.Каким из реагентов: NaCl, KJ или NaBr можно полнее осадить ион серебра из раствора его соли?
5.2.Образуется ли осадок PbCl2 при смешивании равных объемов 0,02 М
HCl и 0,01М Pb(NO3)?
5.3.К раствору, содержащему ионы Fe2+, Mg2+ и Zn2+ в равных концентрациях, по каплям прибавляли раствор NaOH. Какой из малорастворимых гидроксидов образуется в первую очередь?
5.4.В насыщенном растворе какого из сульфидов CuS, PbS или ZuS будет меньше концентрация иона металла? Какой из перечисленных ионов будет осажден в виде сульфида наиболее полно?
5.5.Произведение растворимости (ПР) оксалата кальция CaC2O4 равно 2·10-9. Найти растворимость этой соли.
5.6.Сколько граммов CaCO3 содержится в 2 дм3 насыщенного раствора?
5.7.На раствор, содержащий 0,2 моль/дм3 ионов Ba2+ и 0,01 моль/дм3 ионов Ca2+, подействовали раствором оксалата аммония (NH4)2C2O4. Какой из катионов будет осаждаться первым?
5.8.Растворимость AgJ равна 1,2·10-8 моль/дм3. Вычислите произведение растворимости AgJ.
5.9.Сколько граммов PbSO4 можно растворить при 250С в 1дм3 воды?
5.10.Пользуясь произведением растворимости AgCl и AgBr, определите, в каком из насыщенных растворов этих солей содержится больше ионов серебра?
5.11.Будет ли выпадать осадок CaSO4 при сливании равных объемов растворов 0,01 М CaCl2 и 0,1 М Na2SO4?
21
5.12. Вычислите произведение растворимости BaCO3, если его растворимость составляет 8,8·10-3 г/дм3.
5.13. Растворимость AgNCS в воде при 250С составляет 8,38·10-7 моль/дм3. Вычислить произведение растворимости при этих условиях.
5.14.Образуется ли осадок Ca(OH)2 при сливании равных объемов 0,01 М
CaCl2 и 0,02 М NaOH?
5.15.В какой последовательности будут осаждаться из раствора ионы CO32-, C2O42-, CrO42-, находящиеся в равных концентрациях, при добавлении раствора BaCl2?
5.16.При 250С в 500 см3 воды растворяется 1,63·10-3 г BaCrO4. Чему равно при тех же условиях произведение растворимости этой соли?
5.17.Сколько граммов CaCO3 можно растворить при 250С в 2 дм3 воды?
5.18.Какова растворимость в г/дм3 PbSO4?
5.19.В насыщенном растворе какого электролита BaC2O4 или BaCrO4 содержится меньше ионов бария?
5.20.К раствору, содержащему ионы Ba2+ и Ca2+ в равных концентрациях, добавляли по каплям раствор (NH4)2C2O4. Какой из катионов будет осаждаться первым?
Тема 6. Окислительно-восстановительные реакции
В заданиях на эту тему следует определить окислитель и восстановитель в левой части уравнения и с помощью ионно-электронного баланса или электронного метода уравнять окислительно-восстановительную реакцию.
6.1.CrCl3 + H2O2 + KOH – K2CrO4 + KCl + H2O.
6.2.Al + KNO2 + KOH = K3AlO3 + NH3 + H2O.
6.3.MnO2 + KClO3 + KOH = K2MnO4 + KCl + H2O.
6.4.CrCl3 + KMnO4 + H2O = H2CrO4 + MnO2 + KCl + HCl.
6.5.Zn + KClO3 + H2SO4 = ZnSO4 + KCl + H2O.
6.6.Mn(NO3)2 + NaBiO3 + HNO3 = HMnO4 + Bi(NO3)3 + H2O + NaNO3.
6.7.Na2SO3 + KMnO4 + H2O = Na2SO4 + MnO2 + KOH.
6.8.KMnO4 + KJ + H2SO4 = MnSO4 + KJO3 + H2O.
6.9.CuS + HNO3 = Cu(NO3)2 + S + NO + H2O.
22
6.10.KMnO4 + H2O2 + H2SO4 = MnSO4 + O2 + K2SO4 + H2O.
6.11.KBrO3 + KBr + HCl = Br2 + KCl + H2O.
6.12.Bi(OH)3 + Na2SnO2 = Na2SnO3 + Bi + H2O.
6.13.Cu + HNO3 = Cu(NO3)2 + NO + H2O.
6.14.Zn + HNO3 =NH4NO3 + Zn(NO3)2.
6.15.KMnO4 + FeCl2 + HCl = MnCl2 + FeCl3 + KCl + H2O.
6.16.K2Cr2O7 + H2S + H2SO4 = Cr2(SO4)3 + S + K2SO4 + H2O.
6.17.KMnO4 + NaNO2 + H2SO4 = MnSO4 + NaNO3 + K2SO4 + H2O.
6.18.NaBr + MnO2 + H2SO4 = Br2 + MnSO4 + Na2SO4 + H2O.
6.19.Zn + KNO2 + KOH = K2ZnO2 + NH3 + H2O.
6.20.FeSO4 + HNO3 + H2SO4 = Fe2(SO4)3 + NO + H2O.
6.21.K2Cr2O7 + KJ + H2SO4 = Cr2(SO4)3 + J2 + Cr2(SO4)3 + H2O.
6.22.KJO3 + KJ + HCl = J2 + KCl + H2O.
6.23.KMnO4 + Na2SO3 + H2SO4 = MnSO4 + Na2SO4 + K2SO4 + H2O.
6.24.FeSO4 + KMnO4 + H2SO4 = Fe2(SO4)3 + MnSO4 + K2SO4 + H2O.
6.25.AsH3 + AgNO3 + H2O = H3AsO3 + Ag + HNO3.
Тема 7. Комплексные соединения
В формуле комплекса [MLn] (молекула, ион) различают центральный атом – комплексообразователь (М) и лиганды (L). Название вещества строится из названия лиганда с предшествующей числовой приставкой, указывающей число n лигандах групп, и названия центрального атома.
Названия анионных лигандов всегда имеют соединительную гласную –о,
например: |
|
F- - фторо, |
CN- - циано, |
Cl- - хлоро, |
NCS- - тиоцианато. |
OH- - гидроксо, |
|
Некоторые нейтральные лиганды имеют специальные названия:
H2O – аква, |
CO – карбонил, |
NH3 – аммин, |
NO – нитрозил. |
В катионных комплексах в начале дается название аниона внешней сферы, затем комплексного катиона с указанием степени окисления комплексообразователя. Например, [Ag(NH3)2]Cl – хлорид диамминсеребра (I).
23
В анионных комплексах называют комплексный анион, имеющий окончание –ат, с указанием степени окисления, комплексообразователя, название которого образуют от латинского корня элемента, если таковой не совпадают с русским, затем называют катион. Например, K[Ag(CN)2] – дицианоаргентат (I) калия.
Названия нейтральных комплексов составляют по общим правилам систематических названий неорганических веществ. Например, [Pt(NH)2Cl2] - дихлородиамминплатина (II).
Назовите указанное в Вашем варианте комплексное соединение. Вычислите степень окисления и координационное число центрального атома
– комплексообразователя. Напишите уравнение диссоциации и выражение для константы нестойкости комплексного иона, как слабого электролита.
7.1. [Co(NH3)5Cl]Cl |
7.18. K[Pt(NH3)Cl3] |
7.2. [Cr(H2O)6]Cl3 |
7.19. [Co(NH3)5NO3]SO4 |
7.3. K[AuCl4] |
7.20. [Pt(NH3)2Cl4] |
7.4. (NH4)2[Co(NCS)4] |
7.21. [Co(NH3)5SO4]Br |
7.5. Na2[Zn(OH)4] |
7.22. [Cu(NH3)4]SO4 |
7.6. K[BiJ4] |
7.23. [Pt(NH3)5OH]Br3 |
7.7. K2[Cd(NO2)4] |
7.24. K[Au(CN)2Cl2] |
7.8. K[AgCl2] |
7.25. K2[PtCl2(NO2)4] |
7.9. H2[SnCl6] |
7.26. K[Sb(OH)6] |
7.10. [Hg(NH3)4]Cl2 |
7.27. Na3[Co(NO2)6] |
7.11. [Cd(NH3)4]SO4 |
7.28. K3[Fe(NCS)6] |
7.12. H[FeCl4] |
7.29. K3[AlF6] |
7.13. K[Cr(OH)4] |
7.30. K2[HgJ4] |
7.14. H3[SbCl6] |
7.31. K3[AgJ4] |
7.15. (NH4)2[Cu(NCS)4] |
7.32. K2[FeF5] |
7.16.[Co(NH3)4](OH)3 |
7.33. Na4[Cu(NO2)6] |
7.17. [Pb(NH3)4Cl2]Br2 |
7.34. K[Cr(OH)4] |
|
7.35. (NH4)2[Zn(NCS)4] |
Тема 8. Качественный анализ
По этому разделу аналитической химии необходимо привести реакции обнаружения заданного иона. При этом следует записать соответствующие
24
уравнения реакций, указать аналитический эффект (цвет, осадок, выделение газа, форма кристаллов под микроскопом) условия и способ выполнения реакции (если реакция проводится не в пробирке).
8.1. Нитрат-ион |
8.16. Ион железа (II) |
8.2. Ион серебра |
8.17. Ион магния |
8.3. Ион бария |
8.18. Ацетат-ион |
8.4. Ион кальция |
8.19. Ион марганца (II) |
8.5. Хлорид-ион |
8.20. Ион висмута (III) |
8.6. Ион натрия |
8.21. Фосфат-ион |
8.7. Ион калия |
8.22. Тиосульфат-ион |
8.8. Ион свинца |
8.23. Ион меди (II) |
8.9. Ион алюминия |
8.24. Ион кобальта (II) |
8.10. Сульфат-ион |
8.25. Ион кадмия |
8.11. Ион аммония |
8.26. Ион железа (III) |
8.12. Нитрит-ион |
8.27. Карбонат-ион |
8.13. Ион цинка |
8.28. Тетраборат-(борат)-ион |
8.14. Ион олова (II) |
8.29. Ион хрома (III) |
8.15. Сульфат-ион |
8.30. Нитрат-ион. |
Тема 9. Количественный титриметрический анализ
В этом задании необходимо привести уравнение реакции титриметрического определения заданного вещества указанным методом анализа; указать способ фиксирования точки эквивалентности и рассчитать фактор эквивалентности для определяемого вещества. Задания сведены в таблицу
9.1.
Таблица 9.1 Титриметрическое определение заданного вещества
№ |
Определяемое |
Метод титри- |
|
Определяемое |
Метод |
|
метрического |
№ п/п |
титриметри- |
||||
п/п |
соединение |
соединение |
||||
анализа |
|
ческого анализа |
||||
|
|
|
|
|||
|
|
|
|
|
|
|
9.1. |
Na2SO3 |
Иодометрия |
9.11. |
Na2CO3 |
Кислотно- |
|
|
|
|
|
|
основное тит- |
|
|
|
|
|
|
рование |
|
|
|
|
|
|
|
25
9.2. |
NaOH |
Кислотно- |
|
9.12. |
HCl |
Кислотно- |
|
|
основное |
тит- |
|
|
основное тит- |
|
|
рование |
|
|
|
рование |
|
|
|
|
|
|
|
9.3. |
NaHCO3 |
Кислотно- |
|
9.13. |
FeSO4 |
Пермангана- |
|
|
основное |
тит- |
|
|
тометрия |
|
|
рование |
|
|
|
|
|
|
|
|
|
|
|
9.4. |
NaCl |
Аргентомет- |
9.14. |
KCl |
Аргентомет- |
|
|
|
рия по Мору |
|
|
рия по Мору |
|
|
|
|
|
|
|
|
9.5. |
Na2C2O4 |
Пермангана- |
9.15. |
NaNO2 |
Пермангана- |
|
|
|
тометрия |
|
|
|
тометрия |
|
|
|
|
|
|
|
9.6. |
Na2S2O3 |
Иодометрия |
9.16 |
Na2SO3 |
Пермангана- |
|
|
|
|
|
|
|
тометрия |
|
|
|
|
|
|
|
9.7. |
Na2B4O7 |
Кислотно- |
|
9.17. |
H2S |
Иодометрия |
|
|
основное |
тит- |
|
|
|
|
|
рование |
|
|
|
|
|
|
|
|
|
|
|
9.8. |
CH3COOH |
Кислотно- |
|
9.18. |
H2SO4 |
Кислотно- |
|
|
основное |
тит- |
|
|
основное тит- |
|
|
рование |
|
|
|
рование |
|
|
|
|
|
|
|
9.9. |
KBr |
Аргентомет- |
9.19. |
H2C2O4 |
Пермангана- |
|
|
|
рия по Мору |
|
|
тометрия |
|
|
|
|
|
|
|
|
9.10. |
H2O2 |
Пермангана- |
9.20. |
КCl |
Аргентомет- |
|
|
|
тометрия |
|
|
|
рия по Мору |
|
|
|
|
|
|
|
Тема 10. Расчетные задачи по титриметриическому анализу
Задачи по титриметрии решаются с использованием формул, составленных на основе закона эквивалентов. Для решения задач необходимо уметь находить фактор эквивалентности определяемого вещества или титранта, молярную массу эквивалента, рассчитывать титр и титр соответствия, определять способ титрования (прямое обратное или заместительное), а также прием титрования (отдельных навесок или пипетирования).
Основные формулы перерасчета концентраций, расчета масс навесок, массового содержания или массовой доли (в %) определяемого вещества приведены в Приложениях 2, 3.

26
Чаще всего расчет содержания определяемого компонента в исследуемой пробе проводят через титр соответствия (по определяемому веществу) T ( / ), во всяком случае методики ГОСТов используют этот прием.
Пример 1. Навеску технического сульфита натрия растворили в мерной колбе на 250,0 см3. На титрование 25,00 см3 раствора, подкисленного серной кислотой, затрачено 45,20 см3 0,05200 н. KMnO4. Вычислить массу (г) Na2SO3 в образце М (Na2SO3)=126,04 г/моль.
Решение. Составляем уравнение реакции, лежащей в основе перманганатометрического определения сульфита натрия:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 +3 H2O, 2 MnO4- + 8H+ + 5ē = Mn2+ + 4H2O,
5 SO32- + H2O - 2ē = SO42- + 2H+.
По последней полуреакции находим фактор эквивалентности (f= 1z ) для
сульфит-иона, который равен 1/2. Соответственно молярная масса эквивалента сульфита натрия равна половине ее молярной массы (63,02 г/моль). Из условия задачи видно, что использовали метод пипетирования.
Решаем задачу через титр соответствия по формуле
m(Na |
2SO |
3 ) |
T(KMnO |
4 / Na 2SO3 ) V(KMnO 4 ) Vобщ |
|
Va |
|||
|
|
|
|
= |
с(1/ 5KMnO 4 ) M(1/ 2Na 2SO3 ) |
V(KMnO 4 ) Vобщ |
||
|
1000 |
|
Va |
|
|
|
|
||
|
= |
0,05200 63,02 45,20 250,0 |
|
1,48 г. |
|
1000 25,00 |
|
||
|
|
|
|
|
Пример 2. Чему равна молярная концентрация и титр раствора HNO3, если на титрование 20,00 см3 его раствора израсходовали 15,00 см3 0,1200 М раствора NaOH?
Решение. В условии задачи даны два объема и одна молярная концентрация раствора (f(HNO3) = f(NaOH) = 1), следовательно, для решения можно воспользоваться уравнением с1V1 = с2V2, тогда
с(HNO |
|
) |
с(NaOH) V(NaOH) |
0,1200 15,00 |
0,0900моль / дм 3 . |
||
3 |
|
|
|
||||
V(HNO3 ) |
20,00 |
||||||
|
|
|
|||||
|
|
|
|
||||
Затем находим титр HNO3:
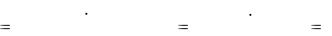
27
T(HNO |
|
) |
с(HNO |
3 M(HNO |
3 ) |
|
0,0900 63,013 |
0,005671г / см |
3 |
. |
|
3 |
|
1000 |
|
|
1000 |
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|||
Контрольные задания:
10.1.Чему равна молярная концентрация раствора HCl, если титр его ра-
вен 0,003592 г/см3?
10.2.Какова массовая доля (в %) H2C2O4·2H2O в данном препарате щавелевой кислоты, если на титрование навески массой 0,01500 г, растворенной
впроизвольном объеме воды, израсходовано 25,60 см3 0,09000 М раствора
KOH?
10.3.Какой объем 0,02000 н. раствора KMnO4 потребуется на титрование раствора FeSO4, содержащего 0,02000 г железа?
10.4.Определить массовую долю (в %) H2O2, если навеску массой 5,000 г развели в мерной колбе на 500,0 см3 и 25,00 см3 этого раствора оттировали 0,1142 н. раствором KMnO4, затратив 37,42 см3 его.
10.5.3,9050 г сульфида натрия растворили в мерной колбе на 500,0 см3. К 20,00 см3 полученного раствора прилили 40,00 см3 0,09324 н. раствора J2. На титрование избытка йода израсходовали 4,25 см3 0,09520 н. раствора Na2S2O3. Какова массовая доля (в %) Na2S в образце?
10.6.10,00 см3 рассола разбавили в мерной колбе на 500,0 см3. На титрование аликвоты 25,00 см3 затрачено 22,38 см3 0,1000 М раствора AgNO3. Вычислить массу NaCl в 10 см3 рассола.
10.7.Навеска серебряного сплава массой 1,7450 г растворена в азотной кислоте, раствор разбавлен в мерной колбе на 200,0 см3. На титрование аликвоты 10,00 см3 израсходовано 11,75 см3 0,04953 М раствора NH4NCS. Рассчитайте массовую долю (в %) серебра в сплаве.
10.8.В мерной колбе на 200,0 см3 растворили 1,2608 г химически чистой щавелевой кислоты H2C2O4·2H2O. На титрование аликвоты 20,00 см3 было израсходовано 20,26 см3 раствора KMnO4. Рассчитайте нормальную (эквивалентную) концентрацию раствора KMnO4 и его титр по Fe. (М
H2C2O4·2H2O = 126,07 г/моль).
28
10.9.При титровании навески массой 3,1900 г концентрированной HCl расходуется 32,90 см3 1,000 М раствора NaOH. Вычислить массовую долю (в %) HCl в кислоте.
10.10.Навеска йодида калия массой 1,5815 г растворена в мерной колбе на 200,0 см3. К 15,00 см3 полученного раствора добавлено 25,00 см3
0,05020 М AgNO3. Остаток непрореагировавшего AgNO3 оттирован 98,85 см3 0,05935 М раствора NH4NCS. Вычислить массовую долю (в %) KJ в образце.
10.11.5,00 см3 раствора пероксида водорода H2O2 (ρ = 1,035 г/см3) поместили в мерную колбу на 100,0 см3, объем довели до метки. К 20,00 см3 по-
лученного раствора добавили серную кислоту и KJ, на титрование выделившегося J2 пошло 10,30 см3 0,05120 М раствора Na2S2O3. Рассчитайте массовую долю (в %) H2O2 в пробе.
10.12.Навеску, содержащую NaCl, массой 1,5546 г растворили в мерной колбе на 500,0 см3. На титрование аликвоты 25,00 см3 приготовленного раствора затрачено 25,45 см3 стандартного раствора нитрата серебра с T(AgNO3/NaCl) – 0,005421 г/см3). Вычислить массовую долю (в %) NaCl в навеске.
10.13.7,6240 г KOH растворили в мерной колбе на 500,0 см3. На титрование аликвоты 25,00 см3 полученного раствора расходуется 14,96 см3 раствора HCl, титр которого равен 0,003592 г/см3). Какова массовая доля (в %) KOH в образце?
10.14.На титрование 0,1592 г химически чистого K2CO3 затрачено 22,35 см3 раствора H2SO4. Рассчитайте титр H2SO4 по K2CO3 (T(H2SO4/K2CO3) и
еенормальную (эквивалентную) концентрацию.
10.15.Какую массу навески соли Мора (NH4)2Fe(SO4)2·6H2O требуется взять, чтобы на титрование (Fe2+) ее пошло 20,00 см3 0,05 н. раствора
KMnO4? М (NH4)2Fe(SO4)2·6H2O = 392,13 г/моль.
10.16.К подкисленному раствору пероксида водорода H2O2 прибавили KJ, выделившейся йод оттировали 22,40 см3 0,1010 М раствора Na2S2O3. Рассчитайте массу H2O2 в растворе.
29
10.17.Какова нормальная (эквивалентная) концентрация H2SO4, если на титрование 0,2156 г химически чистого Na2CO3 идет 22,35 см3 этого раствора?
10.18.Навеска KOH, массой 14,000 г, растворена в мерной колбе на 250,0 см3. На 20,00 см3 полученного раствора расходуется при титровании 19,40 см3 0,09765 М раствора HCl. Рассчитайте массовую долю (в %) KOH в образце.
10.19.Определить массу йода в растворе, если на титрование его пошло 10,30 см3 раствора тиосульфата натрия. T(Na2S2O3/J2) = 0,01291 г/см3.
10.20.К 10,00 см3 подкисленного раствора H2S (ρ = 1,022 г/см3) добавили 25,00 см3 0,01005 н. раствора J2. Избыток йода оттировали 15,00 см3 раствора Na2S2O3 (K = 0,9981 к его 0,1 М раствору). Определить массовую долю (в %) H2S в образце.
10.21.Навеска химически чистого NaCl массой 2,9014 г растворена в мерной колбе на 100,0 см3. На 25,00 см3 этого раствора расходуется 25,80 см3 раствора нитрата серебра. Определите молярную концентрацию и титр раствора AgNO3.
10.22.Какова массовая доля (в %) серебра в сплаве, если после растворения навески массой 0,3000 г в азотной кислоте, на титрование полученного раствора израсходовано 23,80 см3 0,1000 М раствора NH4NCS?
10.23.Сколько граммов KCl содержится в 250,0 см3 раствора, если на титрование 25,00 см3 его затрачено 34,00 см3 0,1050 М раствора AgNO3?
10.24.Сколько граммов KOH содержится в 200,0 см3 0,0920 М раствора
его?
10.25.К навеске Na2CO3 массой 0,1032 г прилили 50,00 см3 0,09496 М раствора HCl, избыток кислоты оттировали 24,80 см3 0,1 М (K = 1,098)
раствора NaOH. Вычислите массовую долю (в %) индифферентных примесей в образце.
10.26.Вычислите массу навески KMnO4, необходимую для приготовления 2,0 дм3 0,05 н. раствора KMnO4 (f = 1/5).
10.27. Какой объем раствора HNO3 потребуется для нейтрализации NaOH, массой 0,02 г, если титр HNO3 равен 0,0006300 г/см3?
30
10.28.Какова массовая доля (в %) Na2CO3 в образце технической соды, если на титрование ее навески массой 0,2648 г затрачено 24,44 см3 0,1972 н. раствора H2SO4?
10.29.Какова молярная концентрация гидроксида калия, если
T(KOH/HCl) = 0,003466 г/см3?
10.30.Масса навески химически чистого KCl составляет 0,3782 г. Можно ли использовать такую навеску для стандартизации ~ 0,1 М раствора AgNO3 методом отдельной навески, пользуясь бюреткой на 50,0 см3?
31
Варианты контрольных работ
В каждом варианте имеются 10 заданий – по одному из всех вышеперечисленных тем. Первая цифра указывает номер темы, вторая – номер задания по теме.
Вариант 1
1.1.; 2.1.; 3.1.; 4.1.; 5.1.; 6.1.; 7.1.; 8.1.; 9.1.; 10.1.
Вариант 2
1.2.; 2.2.; 3.2.; 4.2.; 5.2.; 6.2.; 7.2.; 8.2.; 9.2.; 10.2.
Вариант 3
1.3.; 2.3.; 3.3.; 4.3.; 5.3.; 6.3.; 7.3.; 8.3.; 9.3.; 10.3.
Вариант 4
1.4.; 2.4.; 3.4.; 5.4.; 6.4.; 7.4.; 8.4.; 9.4.; 10.4.
Вариант 5
1.5.; 2.5.; 3.5.; 4.5.; 5.5.; 6.5.; 7.5.; 8.5.; 9.5.; 10.5.
Вариант 6
1.6.; 2.6.; 3.6.; 4.6.; 5.6.; 6.6.; 7.6.; 8.6.; 9.6.; 10.6.
Вариант 7
1.7.; 2.7.; 3.7.; 4.7.; 5.7.; 6.7.; 7.7.; 8.7; 9.7.; 10.7.
Вариант 8
1.8.; 2.8.; 3.8.; 4.8.; 5.8.; 6.8.; 7.8.; 8.8.; 9.8.; 10.8.
Вариант 9
1.9.; 2.9.; 3.9.; 4.9.; 5.9.; 6.9.; 7.9.; 8.9.; 9.9.; 10.9.
Вариант 10
1.10.; 2.10.; 3.10.; 4.10.; 5.10.; 6.10.; 7.10.; 8.10.; 9.10.; 10.10.
Вариант 11
1.11.; 2.11.; 3.11.; 4.11.; 5.11.; 6.11.; 7.11.; 8.11.; 9.11.; 10.11.
Вариант 12
1.12.; 2.12.; 3.12.; 4.12.; 5.12.; 6.12.; 7.12.; 8.12.; 9.12.; 10.12.;
Вариант 13
1.13.; 2.13.; 3.13.; 4.13.; 5.13.; 6.13.; 7.13.; 8.13.; 9.13.; 10.13.
Вариант 14
1.14.; 2.14.; 3.14.; 4.14.; 5.14.; 6.14.; 7.14.; 8.14.; 9.14.; 10.14.
32
Вариант 15
1.15.; 2.15.; 3.15.; 4.15.; 5.15.; 6.15.; 7.15.; 8.15.; 9.15.; 10.15.
Вариант 16
1.16.; 2.16.; 3.16.; 4.16.; 5.16.; 6.16.; 7.16.; 8.16.; 9.16.; 10.16.
Вариант 17
1.17.; 2.17.; 3.17.; 4.17.; 5.17.; 6.17.; 7.17.; 8.17.; 9.17.; 10.17.
Вариант 18
1.18.; 2.18.; 3.18.; 4.18.; 5.18.; 6.18.; 7.18.; 8.18.; 9.18.; 10.18.
Вариант 19
1.19.; 2.19.; 3.19.; 4.19.; 5.19.; 6.19.; 7.19.; 8.19.; 9.19.; 10.19.
Вариант 20
1.20.; 2.20.; 3.20.; 4.20.; 5.20.; 6.20.; 7.20.; 8.20.; 9.20.; 10.20.
Вариант 21
1.21.; 2.21.; 3.1.; 4.2.; 5.3.; 6.21.; 7.21.; 8.21.; 9.4.; 10.21.
Вариант 22
1.22.; 2.22.; 3.2.; 4.3.; 5.4.; 6.22.; 7.22.; 8.22.; 9.5.; 10.22.
Вариант 23
1.23.; 2.23.; 3.3.; 4.4.; 5.5.; 6.23.; 7.23.; 8.23.; 9.6.; 10.23.
Вариант 24
1.24.; 2.24.; 3.4.; 4.5.; 5.6.; 6.24.; 7.24.; 8.24.; 9.7.; 10.24.
Вариант 25
1.25.; 2.25.; 3.5.; 4.6.; 5.7.; 6.25.; 7.25.; 8.25.; 9.8.; 10.25.
Вариант 26
1.26.; 2.26.; 3.6.; 4.7.; 5.8.; 6.1.; 7.26.; 8.26.; 9.10.; 10.26.
Вариант 27
1.27.; 2.27.; 3.7.; 4.8.; 5.9.; 6.2.; 7.27.; 8.27.; 9.11.; 10.27.
Вариант 28
1.28.; 2.28.; 3.8.; 4.9.; 5.10.; 6.3.; 7.28.; 8.28.; 9.12.; 10.28.
Вариант 29
1.29.; 2.29.; 3.9.; 4.10.; 5.11.; 6.4.; 7.29.; 8.29.; 9.13.; 10.29.
Вариант 30
1.30.; 2.30.; 3.9.; 4.10.; 5.11.; 6.5.; 7.30.; 8.29.; 9.14.; 10.30.
33
Вариант 31
1.5.; 2.31.; 3.11.; 4.12.; 5.13.; 6.6.; 7.31.; 8.4.; 9.15.; 10.3.
Вариант 32
1.6.; 2.32.; 3.12.; 4.13.; 5.14.; 6.7.; 7.32.; 8.5.; 9.16.; 10.4.
Вариант 33
1.7.; 2.33.; 3.13.; 4.14.; 5.15.; 6.8.; 7.33.; 8.6.; 9.17.; 10.5.
Вариант 34
1.8.; 2.34.; 3.14.; 4.15.; 5.16.; 6.9.; 7.34.; 8.7.; 9.18.; 10.6.
Вариант 35
1.8.; 2.35.; 3.14.; 4.16.; 5.17.; 6.10.; 7.35.; 8.8.; 9.9.; 10.7.
Вариант 36
1.9.; 2.1.; 3.15.; 4.17.; 5.18.; 6.11.; 7.2.; 8.9.; 9.20.; 10.8.
Вариант 37
1.10.; 2.2.; 3.16.; 4.18.; 5.19.; 6.12.; 7.3.; 8.10.; 9.1.; 10.9.
Вариант 38
1.11.; 2.3.; 3.17.; 4.19.; 5.20.; 6.13.; 7.4.; 8.11.; 9.2.; 10.10.
Вариант 39
1.12.; 2.4.; 3.18.; 4.20.; 5.1.; 6.14.; 7.5.; 8.12.; 9.3.; 10.11.
Вариант 40
1.13.; 2.5.; 3.19.; 4.1.; 5.2.; 6.15.; 7.6.; 8.13.; 9.4.; 10.12.
Вариант 41
1.14.; 2.6.; 3.20.; 4.2.; 5.3.; 6.16.; 7.7.; 8.14.; 9.5.; 10.13.
Вариант 42
1.15.; 2.7.; 3.1.; 4.3.; 5.4.; 6.17.; 7.8.; 8.15.; 9.6.; 10.14.
Вариант 43
1.16.; 2.8.; 3.2.; 4.4.; 5.5.; 6.18.; 7.9.; 8.16.; 9.7.; 10.15.
Вариант 44
1.17.; 2.9.; 3.3.; 4.5.; 5.6.; 6.19.; 7.10.; 8.17.; 9.8.; 10.16.
Вариант 45
1.18.; 2.10.; 3.4.; 4.6.; 5.7.; 6.20.; 7.11.; 8.18.; 9.9.; 10.17.
Вариант 46
1.19.; 2.11.; 3.5.; 4.7.; 5.8.; 6.21.; 7.12.; 8.19.; 9.10.; 10.18.
34
Вариант 47
1.20.; 2.12.; 3.6.; 4.8.; 5.9.; 6.22.; 7.13.; 8.20.; 9.11.; 10.19.
Вариант 48
1.21.; 2.13.; 3.7.; 4.9.; 5.10.; 6.23.; 7.14.; 8.21.; 9.12.; 10.20.
Вариант 49
1.22.; 2.14.; 3.8.; 4.10.; 5.11.; 6.24.; 7.15.; 8.22.; 9.13.; 10.21.
Вариант 50
1.23.; 2.15.; 3.9.; 4.11.; 5.12.; 6.25.; 7.16.; 8.23.; 9.14.; 10.22.
35
ВОПРОСЫ К ЗАЧЕТУ
1.Основные стехиометрические законы химии: закон постоянства состава, закон сохранения массы веществ, закон эквивалентов.
2.Важнейшие классы и номенклатура неорганических веществ. Приведите примеры оксокислот и их средних солей.
3.Основные сведения о строении атома. Приведите пример строения электронной оболочки одного из атомов.
4.В чем заключается сущность Периодического закона Д.И. Менделеева.
5.Как изменяются свойства химических элементов в периодах и рядах Периодической системы Д.И. Менделеева?
6.Типы химической связи. Приведите примеры соединений с ковалентной и ионной связью.
7.Скорость химической реакции. От каких факторов зависит скорость химических реакций?
8.Влияние концентрации на скорость химической реакции. Закон действующих масс.
9.Необратимые и обратимые реакции. Химическое равновесие. Константа химического равновесия. Смещение химического равновесия.
10.Растворы электролитов. Теория электролитической диссоциации. Кислоты, основания и соли с позиций теории Аррениуса.
11.Сильные и слабые электролиты. Степень диссоциации.
12.Диссоциация воды. Водородный показатель. Шкала рН водных растворов.
13.Сильные и слабые кислоты и основания. Константы кислотности и основности. Приведите примеры сильных и слабых кислот и оснований.
14.Гидролиз солей. Определение рН растворов гидролизирующихся солей. Усиление и подавление гидролиза.
15.Малорастворимые электролиты. Правило произведения растворимости. Растворимость малорастворимых электролитов.
16.Окислительно-восстановительные реакции. Определение окислителя и восстановителя. Способы уравнения. Стандартные окислительновосстановительные потенциалы. Определение направления реакции.
36
17.Комплексные соединения. Строение, классификация номенклатура. Константа нестойкости.
18.Задачи аналитической химии. Общая характеристика методов анализа.
19.Аналитические реакции в качественном анализе. Предел обнаружения, селективность, специфичность реакций.
20.Реакции обнаружения ионов.
21.Характеристика количественного титриметрического анализа. Требования к реакциям. Классификация методов.
22.Аналитические весы, измерительная аналитическая посуда, требования к ним и правила работы с ними.
23.Стандартные (титрованные) растворы. Способы выражения их концентрации: молярная, нормальная, тир, титр соответствия.
24.Способы приготовления титрованных растворов. Первичные стандартные вещества, требования к ним.
25.Характеристика метода кислотно-основного титрования. Титранты метода, способы приготовления и их стандартизация.
26.Кислотно-основное титрование. Кривые титрования. Теория кислотноосновных индикаторов. Интервал перехода окраски индикатора. Выбор индикатора для фиксирования точки эквивалентности. Область применения метода.
27.Окислительно-восстановительное титрование. Требования к реакциям. Классификация.
28.Перманганатометрическое титрование. Титрант метода. Условия проведения титрования. Фиксирование точки эквивалентности. Область применения.
29.Йодометрическое титрование. Условия определения восстановителей и окислителей. Титранты метода. Фиксирование точки эквивалентности.
30.Аргентометрическое титрование по Мору. Индикатор метода, условия титрования, область применения.
37
Приложение 1
Произведение растворимости некоторых малорастворимых электролитов.
Формула |
ПР |
Формула |
ПР |
соединения |
|
соединения |
|
|
|
|
|
AgBr |
5,3·10-13 |
Ca(OH)2 |
5,5·10-6 |
AgCl |
1,78·10-10 |
CaSO4 |
2,5·10-5 |
AgJ |
8,3·10-17 |
CuS |
6,3·10-36 |
AgNCS |
1,1·10-12 |
Fe(OH)2 |
8,0·10-16 |
BaCO3 |
4,0·10-10 |
Mg(OH)2 |
6,0·10-10 |
BaC2O4 |
1,1·10-7 |
PbCl2 |
1,6·10-5 |
BaCrO4 |
1,2·10-10 |
PbS |
2,5·10-27 |
BaSO4 |
1,1·10-10 |
PbSO4 |
1,6·10-8 |
CaCO3 |
3,8·10-9 |
Zn(OH)2 |
1,2·10-17 |
CaC2O4 |
2,3·10-9 |
ZnS |
1,6·10-24 |
|
|
|
|
