
3748
.pdf22
6.13.K2S, KCl, KCH3COO, MgSO4, NaNO3.
6.14.CuCl2, NH4NO3, CaCl2, NaBr, Na2S.
6.15.NaNO2, NH4Cl, KNO3, BaCl2, FeSO4.
6.16.NaH2PO4, KBr, Sn(NO3)2, KCl, NaNO3.
6.17.Na2CO3, Fe(NO3)3, CuSO4, NaBr, CaCl2.
6.18.Na2S, NH4NO3, K2SO3, NaCl, K2SO4.
6.19.KBr, NH4CH3COO, K2S, K2SO4, Mg(NO3)2.
6.20.(NH4)2S, NaCl, Na2SO3, K2SO4, CaCl2.
6.21.BiCl3, KCl, NaNO3, Na2HPO4, Na2S.
6.22.(NH4)2SO4, Na3PO4, KNO3, KBr, FeCl3.
6.23.SnCl2, Na2S, NaBr, NaNO2, K2SO4.
6.24.NaCl, CuCl2, KJ, Na2SO3, Fe2(SO4)3.
6.25.Ni(NO3)2, BaCl2, K2SO4, Na2HPO4, NaCl.
Тема 7. Малорастворимые электролиты
Задания по этой теме представлены в виде задач, для решения которых необходимо знать правило произведения растворимости и растворимость малорастворимых электролитов с ионным типом кристаллической решетки.
Осадок малорастворимого электролита выпадает, если произведение концентрации его ионов (ПИ) в растворе больше произведения растворимости (ПР). Значения ПР приведены в Приложении 2.
Пример 1. Выпадет ли осадок AgCl при сливании равных объемов
0,01 М раствора AgNO3 и 0,02 М раствора NaCl? ПР(AgCl) = 1,78 ∙ 10-10.
Решение. При сливании равных объемов общий объем раствора увеличивается вдвое, следовательно, первоначальная концентрация ионов уменьшается вдвое. Находим произведение концентрации ионов, образующих малорастворимое соединение.
Ag+ + Cl- = AgCl↓
ПИ = [Ag+] [Cl-] = 5 ∙ 10-3 ∙ 1 ∙ 10-2 = 5 ∙10-5. полученное ионное произведение больше произведения растворимости, следовательно осадок выпадет.
Взаимосвязь произведения растворимости (ПР) с растворимостью (Р) в моль/дм3 для электролита АmBn выражается формулой
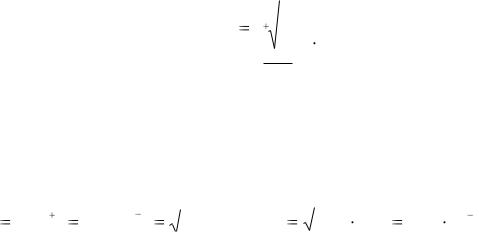
23
|
m n |
|
ПРAmBn |
|
|
|||
РAmBn |
|
|
m |
m |
n |
n . |
||
|
|
|
|
|
|
|
||
Для бинарных электролитов Р = 
 ПР.
ПР.
Растворимость в г/дм3 (Р') находят по формуле P' = P ∙ M.
Пример 2. Какова растворимость оксалата кальция, если ПР(CaC2O4)
= 2,29 ∙ 10-5?
Решение
|
|
|
2 |
|
|
|
|
|
|
|
|
|
P |
[Ca 2 ] [C |
O |
] |
ПР(CaC |
O |
4 |
) |
|
|
2,29 10-9 4,78 10 5. |
||
CaC2O4 |
2 |
|
4 |
|
2 |
|
|
|
|
|
|
|
Для выражения |
растворимости |
|
в |
г/дм3 полученное значение |
||||||||
умножают на молярную массу соли:
Р' = 4,78 ∙ 10-5 моль/дм3 ∙ 128,1 г/моль = 6,12 ∙ 10-3г/дм3.
7.1.Каким из реагентов: NaCl, KJ или NaBr можно полнее осадить ион серебра из раствора его соли?
7.2.Образуется ли осадок PbCl2 при смешивании равных объемов 0,02 М
HCl и 0,01 М Pb(NO3)?
7.3.К раствору, содержащему ионы Fe2+, Mg2+ и Zn2+ в равных концентрациях, по каплям прибавляли раствор NaOH. Какой из малорастворимых гидроксидов образуется в первую очередь?
7.4.В насыщенном растворе какого из сульфидов CuS, PbS или ZnS будет меньше концентрация иона металла? Какой из перечисленных ионов будет осажден в виде сульфида наиболее полно?
7.5.Произведение растворимости (ПР) оксалата кальция CaC2O4 равно 2 ∙10-9. Найти растворимость этой соли.
7.6.Сколько граммов CaCO3 содержится в 2 дм3 насыщенного раствора?
7.7.На раствор, содержащий 0,2 моль/дм3 ионов Ba2+ и 0,01 моль/дм3 ионов Ca2+, подействовали раствором оксалата аммония (NH4)2C2O4. Какой из катионов будет осаждаться первым?
7.8.Растворимость AgJ равна 1,2 ∙ 10-8 моль/дм3. Вычислите произведение растворимости AgJ.
7.9.Сколько граммов PbSO4 можно растворить при 250С в 1 дм3 воды?
24
7.10.Пользуясь произведением растворимости AgCl и AgBr, определите, в каком из насыщенных растворов этих солей содержится больше ионов серебра?
7.11.Будет ли выпадать осадок CaSO4 при сливании равных объемов растворов 0,01 М CaCl2 и 0,1 М Na2SO4?
7.12.Вычислите произведение растворимости BaCO3, если его растворимость составляет 8,8 ∙ 10-3 г/дм3.
7.13.Растворимость AgNCS в воде при 250С составляет 8,38 ∙ 10-7 моль/дм3. Вычислить произведение растворимости при этих условиях.
7.14.Образуется ли осадок Ca(OH)2 при сливании равных объемов 0,01 М
CaCl2 и 0,02 М NaOH?
7.15.В какой последовательности будут осаждаться из раствора ионы CO32-, C2O42-, CrO42-, находящиеся в равных концентрациях, при добавлении раствора BaCl2?
7.16.При 250С в 500 см3 воды растворяется 1,63 ∙ 10-3 г BaCrO4. Чему равно при тех же условиях произведение растворимости этой соли?
7.17.Сколько граммов CaCO3 можно растворить при 250С в 2 дм3 воды?
7.18.Какова растворимость в г/дм3 PbSO4?
7.19.В насыщенном растворе какого электролита BaC2O4 или BaCrO4 содержится меньше ионов бария?
7.20.К раствору, содержащему ионы Ba2+ и Ca2+ в равных концентрациях, добавляли по каплям раствор (NH4)2C2O4. Какой из катионов будет осаждаться первым?
7.21.Пользуясь произведением растворимости BaCO3 и CaCO3, определите, в каком из насыщенных растворов этих солей больше содержится карбонатионов.
7.22.Сколько граммов BaCO3 содержится в 2 дм3 насыщенного раствора?
7.23.Образуется ли осадок BaSO4 при сливании 20 см3 0,005 М раствора BaCl2 и 20 cм3 0,001 М раствора H2SO4?
7.24.Какова растворимость в г/дм3 PbCl2?
7.25.К раствору, содержащему ионы Cl-, Br- и J- в равных концентрациях, по каплям прибавляли раствор AgNO3. Какой из перечисленных галогенидов серебра образуется в первую очередь?
25
Тема 8. Комплексные соединения
Сложные соединения, у которых имеются ковалентные связи, образованные по донорно-акцепторному механизму, получили название комплексных или координационных соединений. В узлах кристаллической решетки таких соединений находятся комплексные ионы, способные к самостоятельному существованию в растворе, а в некоторых случаях и в газообразном состоянии.
Строение и свойства комплексных соединений объясняются координационной теорией А. Вернера.
В формуле комплекса [MLn] (молекула, ион) различают центральный атом – комплексообразователь (М) и лиганды (L). Название комплекс строится из названия лиганда с предшествующей числовой приставкой, указывающей число n лигандных групп, и названия центрального атома.
Названия анионных лигандов всегда имеют соединительную гласную – о,
например: |
|
F- - фторо, |
CN- - циано, |
Cl- - хлоро, |
NCS- - тиоцианато. |
OH- - гидроксо,
Некоторые нейтральные лиганды имеют специальные названия:
H2O – аква, |
NH3 – аммин, |
СO – карбонил, |
NO – нитрозил. |
Вкатионных комплексах вначале дается название аниона внешней сферы, затем комплексного катиона с указанием степени окисления комплексообразователя. Например, [Ag(NH3)2]Cl – хлорид диамминсеребра (I).
Ванионных комплексах называют комплексный анион, имеющий окончание –ат, с указанием степени окисления комплексообразователя, название которого образуют от латинского корня элемента, если таковой не совпадает с русским, затем называют катион. Например, K[Ag(CN)2] дицианоаргентат (I) калия.
Названия нейтральных комплексов составляют по общим правилам систематических названий неорганических веществ. Например, [Pt(NH3)2Cl2] – (NH3)2 дихлородиамминплатина (II).
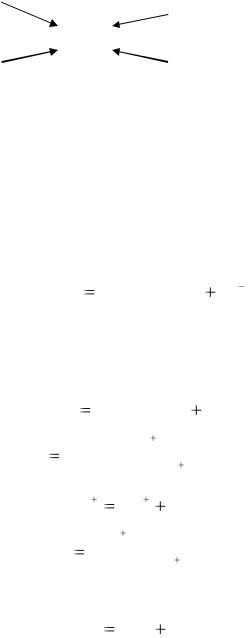
26
В зависимости от того, какое число вакантных орбиталей у комплексообразователя занимают лиганды (1 частица) они подразделяются на монодентатные (dentate - зубчатый) и полидентатные. Например, NH3, Cl-, OH- являются монодентатными лигандами, этилендиамин H2N-CH2-CH2-NH2 – бидентатным. Би- и полидентатные лиганды при взаимодействии с комплексообразователем образуют замкнутые циклы. Комплексы с такими лигандами называют клешневидными или хелатными. Например, при взаимодействии иона платины (II) с этилендиамином вокруг центрального атома замыкаются два пятичленных цикла, образуется заряженный хелат.
|
H2 |
H2 |
|
|
|
H2C — N |
N |
— CH2 |
2 + |
||
|
|||||
| |
|
Pt |
| |
|
|
H2C — N |
N |
— CH2 |
|
||
|
H2 |
H2 |
|
|
|
|
|
|
|
|
|
Ион бисэтилендиаминплатины (II).
В водных растворах комплексных соединений имеет место первичная диссоциация как сильного электролита (если комплексное соединение имеет внешнюю сферу), и вторичная диссоциация комплексной частицы как слабого электролита. Например, в хлориде диаммин серебра первичная диссоциация проходит как у любой соли на катион и анион.
[Ag(NH3 )2 ]Cl [Ag(NH3 )2 ] Cl .
Cl .
Затем комплексный ион по стадиям диссоциирует на составные части: центральный атом и лиганды. Каждая стадия описывается константой нестойкости (Кн).
[Ag(NH3 )2 ] [Ag(NH3 )]
[Ag(NH3 )] NH3 ,
NH3 ,
K |
|
[Ag(NH3 )] [NH3 ] |
, |
||
|
H(1) |
[Ag(NH3 )2 |
] |
|
|
|
|
|
|
||
[Ag(NH 3 )] |
Ag NH3 , |
|||
K |
|
[Ag |
][NH3 ] |
. |
|
H(2) |
[Ag(NH3 )] |
||
|
|
|||
Суммарно этот процесс записывают так:
[Ag(NH 3 )2 ] Ag
Ag  2NH3 ,
2NH3 ,

27
K H |
[Ag ][NH |
3 |
]2 |
. |
|
|
|
||||
[Ag(NH3 )2 |
] |
||||
|
|
||||
Назовите указанное в Вашем варианте комплексное соединение. Вычислите степень окисления и координационное число центрального атома – комплексообразователя. Напишите уравнение реакции диссоциации комплексного соединения как сильного электролита, затем – как слабого электролита. Составьте суммарное выражение для константы нестойкости комплексного иона.
8.1. [Co(NH3)5Cl]Cl |
8.10. [Hg(NH3)4]Cl2 |
8.19. [Co(NH3)5NO3]SO4 |
8.2. [Cr(H2O)6]Cl3 |
8.11. [Cd(NH3)4]SO4 |
8.20. [Pt(NH3)2Cl4] |
8.3. K[AuCl4] |
8.12. H[FeCl4] |
8.21. [Co(NH3)5SO4]Br |
8.4. (NH4)2[Co(NCS)4] |
8.13. K[Cr(OH)4] |
8.22. [Cu(NH3)4]SO4 |
8.5. Na2[Zn(OH)4] |
8.14. H3[SbCl6] |
8.23. [Pt(NH3)5OH]Br3 |
8.6. K[BiJ4] |
8.15. (NH4)2[Cu(NCS)4] |
8.24. K[Au(CN)2Cl2] |
8.7. K2[Cd(NO2)4] |
8.16. [Co(NH3)4](OH)3 |
8.25. K2[PtCl2(NO2)4] |
8.8. K[AgCl2] |
8.17. [Pb(NH3)]4Cl2]Br2 |
|
8.9. H2[SnCl6] |
8.18. K[Pt(NH3)Cl3] |
|
Тема 9. Смещение химического равновесия
В соответствии с принципом Ле-Шателье смещение химического равновесия в растворах возможно при изменении концентрации и температуры. Так, реакции гидролиза усиливаются при разбавлении раствора соли и нагревании; диссоциация слабой кислоты подавляется в присутствии сильного электролита, содержащего одноименный ион; комплексный ион разрушается, если его лиганды связываются в более слабый или малорастворимый электролит; малорастворимый электролит растворяется, если при действии реагента один из его ионов образует слабый электролит и т.п.
Пример 1. Как сместить равновесие вправо в системе
HCN = H+ + CN-.
Смесить равновесие вправо, то есть усилить диссоциацию слабой кислоты можно, связав ион водорода щелочью в еще более слабый электролит – воду.
H+ + OH- = H2O.
28
Пример 2. Как подавить гидролиз (то есть смесить равновесие влево) в реакции
Sn2+ + 2H2O = Sn(OH)2↓ + 2HCl.
Добавив ионы водорода (то есть кислоту), увеличим концентрацию продукта реакции, тем самым смесим равновесие влево.
Пример 3. Как смесить равновесие вправо в системе
[Ag(NH3)2]+ = Ag+ + 2NH3.
В данном случае из равновесия можно вывести ион серебра, связав его в малорастворимое соединение, например AgJ. Кроме того, аммиак можно связать в слабый электролит – NH4+ действием кислоты.
а) [Ag(NH3)2]+ + J- → AgJ↓ + 2NH3,
б) [Ag(NH3)2]+ + 2H+ → Ag++ 2NH4+.
Как сместить равновесие в равновесных системах
9.1. Сr3+ + 2H2O = CrO2- + 4H+. |
9.14. ZnO22- + 4H+ = Zn2+ + 2H2O. |
9.2. HCOOH = HCOO- + H+. |
9.15. CaSO3↓ = Ca2+ + SO32-. |
9.3. Cu2+ + 4NH3 = [Cu(NH3)4]2+. |
9.16. CH3COOH = CH3COO- + H+. |
9.4. [Al(OH)4] = Al3+ + 4OH-. |
9.17. NH4OH = NH4+ + OH-. |
9.5. FeCl3 + 3H3O = Fe(OH)3↓ + 3HCl. |
9.18. [Zn(OH)4]2- = Zn2+ + 4OH-. |
9.6. PbJ2↓ = Pb2+ + 2J- + ΔH. |
9.19. 2CrO42- + 2H+ = Cr2O72- + H2O. |
9.7. BiCl3 + 2H2O = Bi(OH)2Cl↓ + 2HCl. |
9.20. MgCO3↓ = Mg2+ + CO32-. |
9.8. CaCO3↓ = Ca2+ + CO32-. |
9.21. Al(OH)3↓ = Al3+ + 3OH-. |
9.10. Zn(OH)2↓ = Zn2+ + 2OH-. |
9.22. K2S + 2H2O = 2KOH + H2S↑. |
9.11. Sb3+ + 3H2O = Sb(OH)3 + 3H+. |
9.23. Co2+ + 6NCS- = [Co(NCS)6]4-. |
9.12. PbCl2↓ = Pb2+ + 2Cl- + ΔH. |
9.24. [Pb(OH)3]- = Pb2+ + 3OH-. |
9.13. [Co(NH3)4]2+ = Co2+ + 4NH3. |
9.25. Mg(OH)2↓ = Mg2+ + 2OH-. |
Тема 10. Окислительно-восстановительные реакции в растворах
Окислительно-восстановительные реакции в растворах сопровождаются переходом электронов от одних молекул или ионов к другим, что приводит к изменению степени окисления атомов, между которыми происходит такой переход. В окислительно-восстановительном процессе принимают участие две пары сопряженных окислителей и восстановителей. Для определения

29
направления реакции используют значения электродных потенциалов взаимодействующих редокс-пар. В качестве окислителя в реакции всегда будет выступать окислитель той пары, стандартный потенциал (Е0) которой больше, а в качестве восстановителя – восстановитель той пары, потенциал которой меньше. Реакция должна самопроизвольно пойти в том направлении, для которого разность потенциалов Е0 положительна.
Пример. Будет ли FeCl3 окислять KJ в стандартных условиях? Решение. По справочным таблицам (Приложение 3) находим
необходимые полуреакции и соответствующие им значения Е0.
Fe3+ + ē = Fe2+ |
E0 = 1,51 |
В |
J2 + 2ē = 2J- |
Е0 = 0,54 |
В. |
Так как стандартный потенциал пары железа больше Е0 пары иода, следовательно, ион Fe3+ является более сильным окислителем, чем J2. Очевидно, уравнение реакции будет следующим:
2FeCl3 + 2KJ = 2FeCl2 + J2 + 2KCl.
Проверим это предположение с помощью расчета электродвижущей
силы:
Е = Е0 Fe3 / Fe2 |
E0 J2 / 2J = 0,77 – 0,54 = 0,23 В. |
Положительное значение |
Е свидетельствует о возможности |
окисления иодид-ионов ионами Fe3+ в стандартных условиях.
В нижеследующих заданиях определите окислитель и восстановитель, уравняйте окислительно-восстановительную реакцию и рассчитайте ее электродвижущую силу.
10.1.CrCl3 + H2O2 + KOH = K2CrO4 + KCl + H2O.
10.2.Al + KNO2 + KOH = K3AlO3 + NH3 + H2O.
10.3.MnO2 + KClO3 + KOH = K2MnO4 + KCl + H2O.
10.4.CrCl3 + KMnO4 + H2O = H2CrO4 + MnO2 + KCl + HCl.
10.5.Zn + KClO3 + H2SO4 = ZnSO4 + KCl + H2O.
10.6.Mn(NO3)2 + NaBiO3 + HNO3 = HMnO4 + Bi(NO3)3 + NaNO3 + H2O. 10.7. Na2SO3 + KMnO4 + H2O = Na2SO4 + MnO2 + KOH.
10.8 KMnO4 + KJ + H2SO4 = MnSO4 + KJO3 + H2O.
10.9.CuS + HNO3 = Cu(NO3)2 + S + NO + H2O.
10.10.KMnO4 + H2O2 + H2SO4 = MnSO4 + O2 + K2SO4 + H2O.
30
10.11.KBrO3 + KBr + HCl = Br2 + KCl + H2O.
10.12.Bi(OH)3 + Na2SnO2 = Na2SnO3 + Bi + H2O.
10.13.Cu + HNO3 = Cu(NO3)2 + NO + H2O.
10.14.Zn + HNO3 = NH4NO3 + Zn(NO3)2.
10.15.KMnO4 + FeCl2 + HCl = MnCl2 + FeCl3 + KCl + H2O.
10.16.K2Cr2O7 + H2S + H2SO4 = Cr2(SO4)3 + S + K2SO4 + H2O.
10.17.KMnO4 + NaNO2 + H2SO4 = MnSO4 + NaNO3 + K2SO4 + H2O.
10.18.NaBr + MnO2 + H2SO4 = Br2 + MnSO4 + Na2SO4 + H2O.
10.19.Zn + KNO2 + KOH = K2ZnO2 + NH3 + H2O.
10.20.FeSO4 + HNO3 + H2SO4 = Fe2(SO4)3 + NO + H2O.
10.21.K2Cr2O7 + KJ + H2SO4 = Cr2(SO4)3 + J2 + K2SO4 + H2O.
10.22.KJO3 + KJ + HCl = J2 + KCl + H2O.
10.23.KMnO4 + Na2SO3 + H2SO4 = MnSO4 + Na2SO4 + K2SO4 + H2O.
10.24.FeSO4 + KMnO4 + H2SO4 = Fe2(SO4)3 + MnSO4 + K2SO4 + H2O.
10.25.KJ + H2O2 + HCl = J2 + KCl + H2O.
31
ВОПРОСЫ К ЭКЗАМЕНУ
1.Основные стехиометрические законы химии: закон постоянства состава, закон сохранения массы веществ, закон эквивалентов.
2.Важнейшие классы и номенклатура неорганических веществ. Приведите примеры оксокислот и их средних солей.
3.Основные сведения о строении атома. Приведите пример строения электронной оболочки одного из атомов.
4.В чем заключается сущность Периодического закона Д.И. Менделеева?
5.Как изменяется свойства химических элементов в периодах и рядах Периодической системы Д.И. Менделеева?
6.Типы химической связи. Приведите примеры соединений с ковалентной и ионной связью.
7.Скорость химической реакции. От каких факторов зависит скорость химических реакций?
8.Понятие об энтропии, энтальпии, свободной энергии Гиббса.
9.Влияние концентрации на скорость химической реакции. Закон действующих масс.
10.Необратимые и обратимые реакции. Химическое равновесие. Константа химического равновесия. Смещения химического равновесия.
11.Растворы электролитов. Теория электролитической диссоциации. Кислоты, основания и соли с позиции теории Аррениуса и Бренстеда-Лоури.
12.Сильные и слабые электролиты. Степень диссоциации.
13.Диссоциация воды. Водородный показатель. Шкала рН водных растворов.
14.Сильные и слабые кислоты и основания. Константы кислотности и основности. Приведите примеры сильных и слабых кислот и оснований.
15.Расчет рН сильных и слабых кислот и оснований.
16.Гидролиз солей. Определение рН растворов гидролизирующихся солей. Усиление и подавление гидролиза.
17.Малорастворимые электролиты. Правило произведения растворимости. Растворимость малорастворимых электролитов.
18.Окислительно-восстановительные реакции. Определение окислителя и восстановителя. Способы уравнивания. Стандартные окислительновосстановительные потенциалы. Определение направления реакции.
19.Комплексные соединения. Строение с позиций теории Вернера. Классификация, номенклатуры. Константа нестойкости.
