
- •Кроме того, с 1 января 2010 г. вступили в силу ещё два национальных стандарта на методы количественного определения ГМО.
- •Во всех рассмотренных случаях лабораторный контроль ГМО систематизирован по трём уровням в зависимости от цели, задач и методов исследования по следующим направлениям:
- •Обезвреживание реагентов, содержащих бромид этидия
- •Отбор образцов
- •Меры предосторожности
- •Конвенция о биологическом разнообразии
- •Картахенский протокол по биобезопасности к Конвенции о биологическом разнообразии 29 февраля 2000 года
когда пищевая продукция не содержит белок или ДНК, экспертиза на наличие ГМИ пищи проводится на основе представленной документации.
В случае обнаружения в исследуемом образце пищевой продукции ГМО пищи незарегистрированного в Федеральном реестре Российской Федерации, а также нарушений правил маркировки пищевой продукции, полученной с использованием ГМО, органы и учреждения Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека осуществляют внеплановые проверки по контролю данного вида пищевой продукции.
Во всех рассмотренных случаях лабораторный контроль ГМО систематизирован по трём уровням в зависимости от цели, задач и методов исследования по следующим направлениям:
- скрининг наличия рекомбинантной ДНК для предупреждения циркуляции нелегитимных ГМО в продуктах, состоящих из/или содержащих в своём составе компоненты растительного происхождения, имеющие зарегистрированные и незарегистрированные генетически модифицированные аналоги;
-качественная идентификация для подтверждения подлинности ГМО, разрешённых к реализации населению и использованию в пищевой промышленности РФ, а также для количественного определения генетически модифицированных сои и кукурузы, в том числе не зарегистрированных в РФ в растительных продуктах, состоящих из/или содержащих в своём составе ГМО, зарегистрированные в РФ;
–количественное определение и/или идентификация линий ГМО, разрешенных в РФ, для решения вопроса о маркировке, установления наличия случайных примесей в продовольственном сырье и пищевых продуктах со сложным сырьевым составом, переработанных продуктах [4].
Медико-биологическая оценка безопасности новых линий ГМО с целью их государственной регистрации в России представляет собой значительно более сложный процесс. На сегодняшний день она осуществляется в соответствии с методическими указаниями МУ 2.3.2.230607 «Медико-биологическая оценка безопасности генно-инженерно- модифицированных организмов растительного происхождения», утверждённых постановлением Главного государственного санитарного врача РФ от 30 ноября 2007 г. № 80. В её основе лежит упомянутый выше принцип существенной эквивалентности. Она состоит из следующих элементов:
-экспертный анализ (общая характеристика ГМО, оценка композиционной эквивалентности, анализ результатов токсикологических, аллергологических и другие исследований, пострегистрационный мониторинг);
-медико-генетическая оценка ГМО;
-оценка функционально-технологических свойств ГМО;
63
-медико-биологическая оценка безопасности ГМО (гигиенические, токсикологические, иммунологические, аллергологические, генотоксические исследования, исследования репродуктивной токсичности).
Медико-биологическая оценка ГМО основывается на накопленном научном опыте и анализе публикаций по проблеме безопасности ГМО. Она в сотвествии с современными научными подходами включает в себя широкий набор исследуемых показателей, что значительно усиливает ответственность заявителя при осуществлении процедуры государственной регистрации ГМО. Кроме того, методические указания содержат методы определения в пищевых продуктах всех зарегистрированных ГМО культур растительного происхождения и вводят
вдействие методы определения в пищевых продуктах генно-инженерно- модифицированных микроорганизмов. Требования, изложенные в методических указаниях, гармонизированы с требованиями Европейского союза.
Общая характеристика ГМО включает анализ информации, представленной заявителем, по следующей форме:
-позволяющей идентифицировать ГМО (вид, сорт, трансформационное событие);
-об исходном родительском организме (таксономическая характеристика, описание способа размножения и распространения; данные о токсических, аллергенных и других неблагоприятных свойствах);
-об организмах-донорах вносимых генов (таксономическая характеристика, история использования);
-о методе генетической модификации (описание метода модификации, структуры вектора, структуры вставки);
-о ГМО (описание свойств, приобретённых растением в результате модификации, описание структуры генетической конструкции и места её локализации, характеристика экспрессии встроенных генов, характеристика различий с родительским организмом, характеристика генетической и фенотипической стабильности в результате исследований нескольких поколений ГМО, характеристика способности к переносу генов в другие организмы).
Оценка композиционной эквивалентности проводится на основании сведений, представленных заявителем, о результатах сравнения химического состава ГМО с химическим составом его традиционного аналога по следующим параметрам:
-содержание белка;
-аминокислотный состав;
-содержание жира;
-жирнокислотный состав;
-углеводный состав;
-содержание витаминов;
64
-содержание макро- и микроэлементов;
-содержание биологически активных веществ;
-содержание аллергенов;
-содержание антропогенных и природных контаминантов (токсичных элементов, микотоксинов, пестицидов, радионуклидов, вредных примесей и др.);
-содержание антинутриентов (антипитательных веществ) и других веществ, характерных для растительных организмов данного вида.
Перечень показателей варьируется в зависимости от свойств изучаемого растительного организма.
Оценка композиционной эквивалентности ГМО и его традиционного аналога проводится с учётом биологических колебаний значений показателей, характерных для растений данного вида.
Анализ результатов токсикологических исследований проводится на основании сведений, представленных заявителем и включающих:
-результаты оценки безопасности одного или нескольких белков, определяющих проявление заданных признаков у ГМО (молекулярная и биохимическая характеристика белка; наличие или отсутствие гомологии с токсинами белковой природы, а также с белками, обладающими фармакологической или иной биологической активностью; изучение стабильности белка при обработке, хранении, технологической переработке; влияние температуры и pH; возможные модификации и/или образование стабильных белковых фрагментов в результате различных воздействий; устойчивость белка к обработке протеолитическими ферментами в эксперименте in vitro; исследования острой пероральной токсичности белка в эксперименте на грызунах и др.);
-результаты оценки безопасности нативного продукта (данные 90дневных исследований на грызунах, данные исследований на молодых быстро растущих животных (цыплятах-бройлерах, ягнятах и др.) в случае, если такие исследования проводились;
-результаты других токсикологических исследований.
Анализ результатов аллергологических исследований проводится на основании сведений, представленных заявителем, включающих:
-результаты оценки аллергенных свойств одного или нескольких белков, определяющих проявление заданных признаков у ГМО (сравнение
сизвестными аллергенами с использованием баз данных, содержащих информацию о трёхмерной структуре и функции известных аллергенов и родственных им белков); определение потенциальной аллергенности белка в иммунохимических исследованиях in vitro с использованием IgE (иммуноглобулина Е), выделенных из сыворотки крови пациентов, страдающих аллергией; определение устойчивости к воздействию протеолитических ферментов (пепсина); скрининговые исследования с использованием сывороток крови пациентов, страдающих аллергией; дополнительные исследования;
-результаты аллергологических исследований нативного продукта (сравнение набора аллергенов исследуемого ГМО с набором аллергенов
65
его традиционного аналога и др.) в случае, если имеются данные об аллергенных свойствах организма-донора.
Анализ результатов других исследований проводится в случае, если такие исследования были выполнены, на основании сведений, представленных заявителем, включающих:
-результаты определения пищевой ценности (так как заданные и незаданные эффекты генетической модификации могут являться причиной изменения баланса макро- и микронутриентов и, следовательно, вести к изменению пищевой ценности продукта);
-результаты применения новейших аналитических методов, таких как профильные технологии и др.
Анализ результатов пострегистрационного мониторинга в стране-
заявителе и других странах, осуществляемого с целью выявления незаданных эффектов генетической модификации, которые не могли быть обнаружены на стадии регистрационных исследований, проводится на основании сведений, представленных заявителем.
Медико-генетическая оценка генно-инженерно-модифицирован-
ных организмов включает проверку присутствия одной или нескольких синтетических генетических конструкций методом полимеразной цепной реакции (ПЦР). Медико-генетические исследования проводятся на основании сведений, представленных заявителем, включающих:
-описание молекулярной структуры одной или нескольких синтетических генетических конструкций (нуклеотидная последовательность);
-метод идентификации и количественного определения одного или нескольких трансформационных событий;
-протокол проведения анализа;
-описание праймеров;
-стандартные образцы состава и свойств.
Перечень и объём исследований функционально-технологических
свойств генно-инженерно-модифицированных организмов
определяются экспертными (учёными) советами соответствующих аккредитованных испытательных центров Российской Федерации на основании анализа представленных материалов. К сравниваемым функциональным свойствам относятся:
-pH водной суспензии;
-растворимость;
-реологические свойства водных дисперсий;
-водоудерживающая и жироудерживающая способность;
-критическая концентрация гелеобразования;
-эмульсионная стабильность и др.
Медико-биологическая оценка безопасности генно-инженерно- модифицированных организмов включает в себя гигиенические,
токсикологические, иммунологические, аллергологические, генотоксические исследования, а также исследования репродуктивной токсичности, перечень и объём которых определяются экспертными
66
(учёными) советами аккредитованных испытательных центров Российской Федерации на основании анализа представленных материалов.
Гигиенические исследования ГМО включают определение показателей качества и безопасности, определяемых в соответствии с санитарными правилами и нормами СанПиН 2.3.2.1078-01 «Гигиенические требования безопасности и пищевой ценности пищевых продуктов» для соответствующей группы продуктов:
-содержание токсичных элементов;
-содержание микотоксинов;
-содержание пестицидов;
-содержание радионуклидов;
-содержание вредных примесей;
-микробиологические показатели;
-другие показатели (при необходимости).
Перечень показателей качества при этом определяется на основании свойств соответствующего растительного организма, а также анализа представленных заявителем материалов. Если заявителем представлены исчерпывающие данные по оценке композиционной эквивалентности ГМО (содержание белка, аминокислотный состав, содержание жира, жирнокислотный состав, углеводный состав, содержание витаминов, макро- и микроэлементов, специфических компонентов, биологически активных веществ, антинутриентов и других веществ, характерных для растений данного вида), исследования могут быть ограничены определением влажности, золы, содержания белка, жира, углеводов, пищевых волокон.
Если генетическая модификация направлена на изменение химического состава ГМО, должны быть проведены исследования, подтверждающие заявленные изменения.
Токсикологические исследования ГМО проводятся в эксперименте на лабораторных животных – крысах линии Вистар. На протяжении эксперимента животные получают полусинтетический казеиновый рацион. Исследуемый ГМО и его традиционный аналог включают в состав корма в максимально возможном количестве, не нарушающем баланс основных пищевых веществ. Замена ингредиентов рациона должна быть проведена с учётом содержания белков, жиров и углеводов во вводимом продукте при соблюдении принципа изокалорийности.
Исследуемые при этом показатели делятся при этом на несколько групп:
-интегральные (общее состояние животных, поедаемость корма, масса тела, масса внутренних органов);
-гематологические (концентрация гемоглобина, гематокрит; общее количество эритроцитов, средний объём эритроцита, среднее содержание гемоглобина в эритроците, средняя концентрация гемоглобина в эритроците, общее количество тромбоцитов, общее количество лейкоцитов, дифференцированный подсчет лейкоцитов);
67
-биохимические (общий биохимический анализ крови, общий анализ мочи, системные биомаркеры – система антиоксидантной защиты, система ферментов метаболизма ксенобиотиков, система регуляции апоптоза;
-морфологические (исследования кожи, головного мозга, сердца, аорты, селезёнки, лёгких, лимфатических узлов, тимуса, щитовидной железы, гипофиза, желудочно-кишечного тракта, печени, поджелужочной железы, почек, семенников).
Иммунологические исследования ГМО проводятся в эксперименте на мышах линий СВА и С57В1/6 и включают изучение его иммуномодулирующих и сенсибилизирующих свойств по четырём тестам:
-действие на гуморальное звено иммунитета в тесте определения уровня гемагглютининов к эритроцитам барана;
-действие на клеточное звено иммунитета в реакции гиперчувствительности замедленного типа (ГЗТ) к эритроцитам барана;
-действие как сенсибилизирующего агента в тесте чувствительности к гистамину;
-действие на естественную резистентность мышей к Salmonella typhimurium (сальмонеллы мышиного тифа).
Исследования начинают через 21 день с момента перевода мышей на экспериментальные рационы. В течение эксперимента ведутся наблюдения за поедаемостью корма и общим состоянием животных.
Аллергологические исследования ГМО проводятся в эксперименте на лабораторных животных: потенциальную аллергенность оценивают, определяя тяжесть протекания системной анафилаксии и уровня циркулирующих сенсибилизирующих антител (субклассов IgG1 + IgG4) у крыс, получающих в составе рациона исследуемый ГМО (группа «опыт») и его традиционный аналог (группа «контроль»). Метод основан на количественной сравнительной оценке тяжести реакции системной анафилаксии, возникающей при внутрибрюшинной сенсибилизации взрослых крыс пищевым антигеном – овальбумином куриного яйца с последующим внутривенным введением сенсибилизированным животным разрешающей дозы того же белка.
Генотоксикологические исследования ГМО проводятся в эксперименте на лабораторных животных – мышах линии С57В1/6. Оценка потенциальной генотоксичности ГМО включает выявление повреждений ДНК и выявление мутагенной активности в эксперименте in vivo. Метод выявления мутагенной активности основан на учёте хромосомных аберраций в метафазных клетках пролиферирующих тканей. Регистрация повреждений ДНК предусматривает оценку целостности структуры ДНК методом щелочного гель-электрофореза изолированных клеток (метод ДНК-комет).
В основе метода выявления мутагенной активности лежит регистрация видимых структурных нарушений хромосом в клетках костного мозга на стадии метафазы. Анализируют 100 метафаз от каждого животного. Учитывают число одиночных и парных фрагментов, хроматидных и хромосомных обменов, ахроматических пробелов (гепов) и разрывов по
68
центромере, число клеток с множественными повреждениями и клеток с полной деструкцией хромосом. Оценку результатов цитогенетического анализа проводят путём сопоставления долей клеток с хромосомными аберрациями в контрольной и опытной группах.
Регистрация повреждений ДНК предусматривает оценку целостности структуры ДНК методом щелочного гель-электрофореза изолированных клеток (метод ДНК-комет). Метод основан на регистрации различной подвижности ДНК и возможных фрагментов ДНК лизированных клеток, заключенных в агарозный гель, в постоянном электрическом поле. При этом ДНК мигрирует к аноду, формируя электрофоретический след, напоминающий «хвост кометы», параметры которого зависят от степени повреждённости исследуемой ДНК. Общая схема метода включает получение гель-слайдов (подложки), получение микропрепаратов, лизис, щелочную денатурацию, электрофорез, нейтрализацию/фиксацию, окрашивание и микроскопический анализ.
Исследования репродуктивной токсичности ГМО проводятся в эксперименте на лабораторных крысах линии Вистар и включают изучение влияния на генеративную функцию (морфологические исследования семенников и яичников), изучение эмбриотоксического и тератогенного действий, регистрируемых в пренатальном и постнатальном периодах развития (визуальное исследование матки, плаценты, плодов, анализ эмбрионального материала, контроль рождения потомства, учёт величины помёта, учёт показателей физиологического развития крысят), а также интегральные показатели (общее состояние животных, поедаемость корма, масса тела).
Отчет по результатам исследований репродуктивной токсичности ГМО должен включать цифровые данные в форме таблиц, содержащих основные сведения, необходимые для суждения о наличии или отсутствии у исследуемого ГМО неблагоприятного действия на внутриутробное развитие и процессы репродукции [34].
По состоянию на 1 июня 2010 г. в Российской Федерации прошли полный спектр исследований и допущены к реализации и использованию в составе пищевых продуктов без ограничений 17 линий трансгенных растений, в том числе:
 соя линий 40-3-2 и MON 89788, устойчивая к глифосату («Monsanto Co» (США)); А2704-12, устойчивая к глюфосинату аммония («Bayer CropScience GmbH» (ФРГ)); А5547-127, устойчивая к глюфосинату аммония («Bayer CropScience GmbH» (ФРГ));
соя линий 40-3-2 и MON 89788, устойчивая к глифосату («Monsanto Co» (США)); А2704-12, устойчивая к глюфосинату аммония («Bayer CropScience GmbH» (ФРГ)); А5547-127, устойчивая к глюфосинату аммония («Bayer CropScience GmbH» (ФРГ));
 кукуруза линий MОN810, устойчивая к кукурузному бурильщику Ostrinia nubilatis; GA21, устойчивая к глифосату; NK-603, устойчивая к глифосату; MON863 и MON88017, устойчивые к жуку Diabrotica spp. («Monsanto Co» (США)); MIR 604, устойчивая к жуку диабротика
кукуруза линий MОN810, устойчивая к кукурузному бурильщику Ostrinia nubilatis; GA21, устойчивая к глифосату; NK-603, устойчивая к глифосату; MON863 и MON88017, устойчивые к жуку Diabrotica spp. («Monsanto Co» (США)); MIR 604, устойчивая к жуку диабротика
Diabrotica spp. (Syngenta Crop Protection AG (Швейцария)), кукуруза линии
3272, синтезирующая фермент альфа-амилазу (Syngenta Seeds Inc.); кукуруза линии Bt11, устойчивая к глюфосинату аммония и кукурузному бурильщику Ostrinia nubilalis (Syngenta Crop Protection AG); Т-25,
устойчивая к глюфосинату аммония («Bayer CropScience GmbH» (ФРГ));
69
 рис линии LL62, устойчивая к глюфосинату аммония («Bayer CropScience GmbH» (ФРГ));
рис линии LL62, устойчивая к глюфосинату аммония («Bayer CropScience GmbH» (ФРГ));
 картофель сортов Луговской 1210amk и Елизавета 2904/1 kgs (Центр «Биоинженерия РАН» (РФ));
картофель сортов Луговской 1210amk и Елизавета 2904/1 kgs (Центр «Биоинженерия РАН» (РФ));
 сахарная свёкла линии Н7-1, устойчивая к глифосату («Monsanto Co»
сахарная свёкла линии Н7-1, устойчивая к глифосату («Monsanto Co»
(США)).
У двух линий трансгенного картофеля, зарегистрированных на территоририи РФ ранее, срок действия регистрационного свидетельства истек (Рассет бурбанк ньюлив, устойчивый к колорадскому жуку; Супериор ньюлив, устойчивый к колорадскому жуку («Monsanto Co»
(США)).
Немногим больше трансгенных линий имеют регистрацию в Европейском союзе, где без ограничений разрешено использовать 21 вид ГМО, в том числе 1 линию сои, 11 – кукурузы, 4 – рапса, 5 – хлопка. Соединённые Штаты Америки на этом фоне выглядят значительно более либеральными. Там прошли государственную регистрацию 113 видов ГМО, в том числе 6 линий сои, 25 – кукурузы, 12 – рапса, 28 – картофеля, 3 – кабачков, 6 –томатов, 5 – риса, 3 – свёклы, 2 – дыни, 21 – хлопка, по одной линии папайи и пшеницы.
Таким образом, чёткая и последовательная реализация разработанного в Российской Федерации за последние годы алгоритма государственной регистрации, экспертизы и исследований ГМО позволяет:
–осуществлять эффективный контроль за оборотом всего спектра пищевых продуктов, полученных из генно-инженерно-модифицированных организмов растительного происхождения, представленных на мировом продовольственном рынке;
–исключить возможность несанкционированного использования в производстве пищевых продуктов и в питании населения РФ ГМО, не зарегистрированных в установленном порядке, безопасность которых не подтверждена;
–осуществлять государственный санитарно-эпидемиологический контроль и надзор за исполнением законодательства и нормативных актов РФ в области маркировки и информации для потребителей пищевых продуктов, произведённых из ГМО;
–осуществлять адекватный контроль за случайной или технически неустранимой примесью ГМО растительного происхождения в продуктах
исырье, имеющих генетически модифицированные аналоги.
2.4 Информационное обеспечение продукции, содержащей ГМО
В ст. 23 Картахенского протокола регламентировано, что страныучастники содействуют и способствуют информированию и просвещению общественности в отношении обеспечения безопасности при передаче, обработке и использовании живых изменённых организмов (ГМО) в связи с сохранением и устойчивым использованием биологического разнообразия, с учётом рисков для здоровья человека.
70

В соответствии с российским законодательством каждый потребитель имеет право знать о происхождении продукта, его ингредиентном составе, пищевой и энергетической ценности, наличии пищевых и биологически активных добавок. Применительно к ГМО можно выделить следующие сведения, входящие в понятие информационного обеспечения:
сущность генетической модификации; возможные преимущества и риски использования продукции, содержащей ГМО;
разрешённые к применению на территории страны проживания линии генетически модифицированных пищевых продуктов;
 наличие (отсутствие) в приобретаемом продукте компонентов, содержащих ГМО;
наличие (отсутствие) в приобретаемом продукте компонентов, содержащих ГМО;
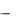 информация о результатах мониторинга оборота ГМО.
информация о результатах мониторинга оборота ГМО.
Что касается информированности населения о сущности генетической модификации, а также о преимуществах и рисках при употреблении трансгенных продуктов, то около 22% потребителей пока мало осведомлены или ничего не знают об этом (по результатам исследования аналитической компании «Harris Interactive», проведённого среди потребителей развитых стран) [103]. Наши исследования среди покупателей г. Хабаровска показывают, что 15% населения сознательно готовы приобретать продукты, содержащие ГМО, при условии снижения их стоимости, а 26% вовсе не знают о существовании генетически модифицированных организмов [2].
Кроме того, не все потребители правильно понимают сущность новой технологии, слепо веря запугивающим репортажам и интервью с малосведущими людьми в этой области. Отечественным и зарубежным СМИ следовало бы более объективно информировать потребителей о новых биотехнологиях, поскольку это сказывается как на экономике, так и на здоровье населения.
Информация о допущенных к применению на территории страны линиях трансгенных продуктов важна для специалистов, но мало что может сказать неподготовленному потребителю, хотя она является необходимым элементом информирования. В нашей стране она публикуются в постановлениях Главного государственного санитарного врача и на сайте Общероссийской ассоциации генетической безопасности. На сегодняшний день в Российской Федерации прошли все исследования и допущены к реализации и использованию в составе пищевых продуктов без ограничений 17 линий трансгенных растений (приложение Г).
Наличие или отсутствие в приобретаемом продукте компонентов, содержащих ГМО, должно быть отражено соответствующей маркировкой, наносимой на каждую единицу потребительской упаковки.
В мире существуют различные подходы к маркировке пищевых продуктов, полученных из ГМО. Так, в США, Канаде и Аргентине данные продукты особым образом вообще не маркируются. В Японии и Австралии принято маркировать продукцию с содержанием ГМО 5% и более (таблица
7).
71
Таблица 7 – |
Маркировка пищевой продукции, содержащей |
ГМО, |
||
в различных странах |
|
|
||
|
|
|
|
|
Страна |
|
Обязательная или |
Пороговое значение для маркирования, % ГМО |
|
|
|
добровольная |
|
|
|
|
маркировка |
|
|
Австралия и Новая |
|
Обязательная |
1,0 |
|
Зеландия |
|
|
|
|
Бразилия |
|
Обязательная |
4,0 |
|
Европейский союз |
|
Обязательная |
0,9 |
|
Канада |
|
Добровольная |
Указываются сведения только в том случае, |
если |
|
|
|
существуют данные о токсичности или аллергенности |
|
|
|
|
ГМО-линии |
|
КНР |
|
Обязательная |
1,0, обязательно указывается линия ГМО |
|
Южная Корея |
|
Обязательная |
Содержание ГМО указывается в том случае, если один |
|
|
|
|
или более компонентов пищевого продукта из пяти |
|
|
|
|
главных составляющих содержит более 3% ГМО |
|
Норвегия |
|
Обязательная |
2,0 |
|
США |
|
Добровольная |
Указываются сведения только в том случае, |
если |
|
|
|
существуют данные о повышенной токсичности или |
|
|
|
|
аллергенности ГМО-линии |
|
Таиланд |
|
Обязательная |
5,0 |
|
Япония |
|
Обязательная |
5,0 от общей массы продукта. Продукты в упаковке |
|
|
|
|
объёмом менее 30 см3 не маркируются |
|
В Европейском сообществе в 1997 г. Регламентом ЕС по новым пищевым продуктам и пищевым ингредиентам установлена обязательная маркировка, указывающая на генномодифицированную природу продукта. Маркировались продукты, сделанные на основе генно-модифицированных организмов, содержащие любые модифицированные белки либо ДНК, и не являющиеся эквивалентными обычным пищевым продуктам. Обязательной маркировке подлежала также комплексная по составу продукция, включающая более одного процента трансгенных компонентов. Маркировка не требовалась только на высокорафинированные пищевые продукты и ингредиенты (масла, сиропы, крахмал) по причине отсутствия в них ДНК или белка, при условии их существенной эквивалентности имеющимся пищевым аналогам.
Регламент ЕС 49/2000 впервые урегулировал ситуацию случайного присутствия генетически модифицированного материала в традиционных продуктах. Он ввёл однопроцентный порог минимума для случайного присутствия генномодифицированных остатков, при соблюдении которого обязательная маркировка не проводилась. При этом производители должны были продемонстрировать, что они предпринимали соответствующие усилия для преодоления случайного присутствия трансгенного материала.
Требования Регламента № 1829/2003 ужесточили правила маркировки генетически модифицированной продукции. Раньше это происходило по принципу обнаружения генномодифицированной ДНК или белка, теперь даже высокорафинированные продукты, полученные с применением ГМО, подлежат маркировке.
С 2004 г. в европейских странах обязательная маркировка продукции не требуется, если содержание трансгенного компонента не превышает
72
0,9%, или если в продукции обнаруживаются случайные следы генетически модифицированного белка, компоненты трансгенного сырья, присутствие которых технически непреодолимо. Производители при этом обязаны представить доказательства такой технической непреодолимости. В Регламенте 1829/2003 также предложено отказаться от критерия существенной эквивалентности.
Вто же время неоднозначные оценки европейской общественности получил вопрос о маркировке мяса, молока, яиц от сельскохозяйственных животных, потреблявших генетически модифицированные корма, лекарства или вакцины. Произведённые такими животными продукты не маркируется в обязательном порядке так же, как и все остальные, произведённые при участии ГМО как вспомогательного средства.
ВРоссийской Федерации усиление контроля над пищевыми продуктами, полученными из генно-инженерно-модифицированных организмов, переходит в разряд наиболее приоритетных задач Роспотребнадзора. Всё большее внимание уделяется вопросам нормирования, идентификации и количественного определения ГМО, совершенствуется законодательная и нормативная база.
Вчастности, в Российской Федерации за период с 1996 г., когда впервые был принят Федеральный закон «О государственном регулировании в области генно-инженерной деятельности», значительно изменились подходы к маркировке трансгенных продуктов (таблица 8).
Таблица 8 – Эволюция методов информирования потребителей о ГМО
Нормативный |
Установленные нормы |
|
|
Комментарий |
|
||||||
документ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
05.07.1996 г. |
|
|
|
|
|
|
|
Закон «О государственном |
Необходимость |
сертификации |
продукции, |
Декларировалось |
предоставление |
||||||
регулировании в области |
содержащей результаты генно-инженерной |
информации о ГМО только органам |
|||||||||
генно-инженерной |
деятельности, с указанием полной информации |
по сертификации и испытательным |
|||||||||
деятельности» |
о методах получения и свойствах данного |
лабораториям (центрам) |
|
|
|||||||
|
продукта |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14.11.2001 г |
|
|
|
|
|
|
|
СанПиН 2.3.2.1078-01 |
Для пищевых продуктов, содержащих |
Впервые установлен 5%-ный |
|||||||||
|
более 5% компонентов ГМИ, обязательна |
уровень |
содержания |
ГМИ |
в |
||||||
|
соответствующая информация, а также |
продукте, не нуждающийся в |
|||||||||
|
информация |
|
о |
государственной |
этикетировании, по аналогии |
с |
|||||
|
регистрации. |
|
|
|
|
|
Японией и Австралией |
|
|
||
|
Пищевые продукты, полученные из ГМИ |
|
|
|
|
|
|||||
|
и не содержащие ДНК и белок, в |
|
|
|
|
|
|||||
|
дополнительном |
|
этикетировании |
не |
|
|
|
|
|
||
|
нуждаются |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
26.07.2004 г. |
|
|
|
|
|
|
|
МУ 2.3.2.1917-04 |
Обязательная |
|
маркировка |
при |
Два указанных |
в |
документе |
||||
|
содержании в продукте более 5% ГМИ. |
|
уровня |
и рекомендательный |
|||||||
|
При содержании ГМИ от 0,9 до 5,0 % |
характер применения – следствие |
|||||||||
|
наносить |
специальную |
маркировку |
несовершенной |
лабораторной |
||||||
|
рекомендуется |
|
|
|
|
|
базы |
количественного |
|||
|
|
|
|
|
|
|
определения ГМИ |
|
|
|
|
|
|
|
|
01.10.2004 г |
|
|
|
|
|
|
|
МУ 2.3.2.1935-04 |
Предоставление информации о генно- |
Впервые появляется норма, связанная |
|||||||||
|
инженерно-модифицированных |
|
|
с предоставлением |
информации |
о |
|||||
|
микроорганизмах (термин приведен в |
генно-инженерно-модифицированных |
|||||||||
|
соответствие с СанПиН 2.3.2.2340-2008 – А.В. |
микроорганизмах (ГММ) |
|
|
|||||||
|
Алешков, А.И. Окара) |
|
|
|
|
|
|
|
|
||
73

21.12.2004 г.
Закон «О защите прав |
Предоставления |
потребителю |
Данная |
редакция |
подразумевала |
|||||
потребителей» |
|
(в |
информации о наличии в продуктах |
соответствующую |
маркировку |
|||||
редакции |
|
|
питания компонентов, полученных с |
независимо от количества ГМО в |
||||||
Федерального |
закона |
применением ГМО |
|
продукте |
|
|
|
|
|
|
№171-фз) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
01.09.2007 г |
|
|
|
|
|
|
СанПиН 2.3.2.2227-07 |
Обязательна соответствующая информация |
Содержание |
в |
|
пищевых |
|||||
(дополнения |
№5 |
к |
для пищевых продуктов, полученных с |
продуктах |
менее |
|
0,9 |
% |
||
СанПиН 2.3.2.1078 -01) |
применением ГМО, в том числе не содержащих |
компонентов, |
полученных |
с |
||||||
|
|
|
ДНК и белок. Пищевые продукты, содержащие |
применением |
ГМО, |
считается |
||||
|
|
|
менее 0,9% компонентов ГМО, при этом не |
случайной примесью. Возникают |
||||||
|
|
|
считаются содержащими компоненты ГМО |
трудности с |
идентификацией |
|||||
|
|
|
|
|
продукции, не содержащей ДНК |
|||||
|
|
|
|
|
и белок |
|
|
|
|
|
|
|
|
|
25.10.2007 г. |
|
|
|
|
|
|
Закон «О защите прав |
Предоставление |
потребителю |
Последняя |
|
действующая |
|||||
потребителей» |
|
(в |
информации о наличии в продуктах |
редакция обязывает маркировать |
||||||
редакции |
|
|
питания компонентов, полученных с |
продукты при содержании в их |
||||||
Федерального |
закона |
применением ГМО, в случае, если |
компонентах более 0,9% ГМИ, |
|||||||
№234-фз) |
|
|
содержание указанных организмов в таком |
даже если сами эти компоненты |
||||||
|
|
|
компоненте составляет более 0,9% |
находятся |
в |
|
минорном |
|||
|
|
|
|
|
количестве |
|
|
|
|
|
|
|
|
|
01.04.2008 г. |
|
|
|
|
|
|
СанПиН 2.3.2.2340-08 |
Для пищевых продуктов, полученных из |
Все требования к |
маркировке |
|||||||
(дополнения |
№6 |
к |
живых и нежизнеспособных ГММ, а также |
ГМО |
собраны |
в |
одном |
|||
СанПиН 2.3.2.1078 -01) |
с использованием ГММ, обязательна |
нормативном документе СанПиН |
||||||||
|
|
|
соответствующая информация |
2.3.2.1078-01 |
|
|
|
|
||
Сегодня подлежит этикетированию вся пищевая продукция с долей ГМО более 0,9% (ранее – 5%). После утверждения СанПиН 2.3.2.2227-07 «Дополнения и изменения №5 к СанПиН 2.3.2.1078-01» и внесения поправок в Закон «О защите прав потребителей» этот норматив гармонизирован с Директивой ЕС от 22.09.2003 г. №1829/2003.
Однако оставшиеся разночтения и недостаточно чёткая формулировка понятия ГМО в этих документах создают противоречия и трудности в расчётах и подходах к маркированию пищевых продуктов сложного состава, содержащих компоненты ГМО.
Так, согласно Закону «О защите прав потребителей», продукт считается содержащим ГМО, если хотя бы один из его компонентов содержит ГМО более чем 0,9%. В отличие от Закона, в СанПиН 2.3.2.222707 дано более четкое разъяснение. Содержание компонентов ГМО в продукте 0,9% и менее является случайной или технически неустранимой примесью, и такие пищевые продукты не требуют специального этикетирования. Но при этом подлежит маркированию продукция, полученная из ГМО, но не содержащая белок и ДНК, что представляется пусть и не таким очевидным, но всё же противоречием.
Вместе с тем ситуация в стране относительно эффективной защиты потребителей в этом аспекте остаётся неоднозначной. Всё ещё недостаточно количество испытательных лабораторий, и они сосредоточены в основном в Москве и в крупных региональных центрах. Невысока доля контролируемой продукции, отсутствует системность в методической и нормативной базе и т.д.
Из постановления Главного государственного санитарного врача РФ от 30 ноября 2007 г. № 80 следует, что количество продуктов, содержащих ГМО, на отечественном рынке неуклонно снижается (рисунок 4), однако это противоречит общемировой тенденции. Подобная статистика,
74
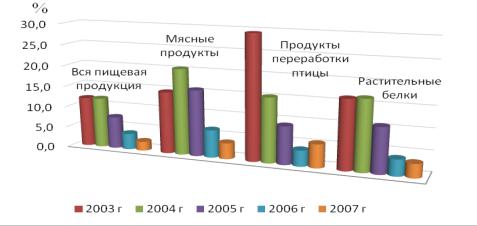
вероятно, обязана ужесточению контроля за ГМО в Москве, где и проводится большая часть исследований. Кроме того, на результатах сказалось расширение списка продукции, подлежащей этикетированию, за счёт заведомо не содержащей ГМО (ликероводочные изделия, растительные масла).
Рисунок 4 – Динамика содержания ГМО в пищевых продуктах в 2003 – 2007 годах Поэтому мы считаем, что даже наблюдаемое десятикратное увеличение за последние 5 лет объёма контролируемой продукции (до 40 тыс. проб в год), не
отражает реальной ситуации относительно распространения ГМО [3].
Г.Б. Леонов полагает, что в технических регламентах нужно предусмотреть правила предупредительной маркировки о наличии в составе продуктов питания ГМО и установить обязательные требования к содержанию такой маркировки, так как в принятых на сегодняшний момент документах эти нормы отсутствуют [28].
Например, в подп. 4 п. 3 ст. 7 Технического регламента на масложировую продукцию введено правило об указании состава пищевой масложировой продукции (в порядке уменьшения массовых долей ингредиентов с обязательным указанием пищевых добавок, биологически активных добавок к пище, витаминов, микронутриентов, ароматизаторов, компонентов из генно-инженерно-модифицированных организмов). При этом не уточняется, что сведения о ГМО приводятся в случае, если их в составе продукта содержится свыше 0,9 %. Нет также установленной формы нанесения специальной маркировки о наличии ГМО в продукте.
В Техническом регламенте на молоко и молочную продукцию (подп. 11 п. 25 ст. 36) указано, что молоко и продукты его переработки, расфасованные в потребительскую тару и реализуемые в оптовой и розничной торговле, должны иметь маркировку, содержащую информацию о наличии компонентов, полученных с применением ГМО (в случае их наличия в количестве более 0,9%). Из приведённой нормы неясно, о чём идёт речь: об указании на наличие ГМО в составе продукта или о предупредительной маркировке.
Сравнение указанных технических регламентов свидетельствует о различном правовом регулировании одного и того же вопроса. Представляется, что в тех случаях, когда вводится правовое регулирование маркировки пищевых
75

продуктов, следует устанавливать единые правила и при этом обязательно устранить недостатки действующего правового регулирования.
До сих пор не ясно, как же установить трансгенное происхождение компонента, не содержащего белок и ДНК, поскольку методы анализа трансгенной продукции основаны на выявлении рекомбинантной ДНК или специфических белковых последовательностей. Единственный вариант видится в контроле продукции на всех стадиях её жизненного цикла, как это предполагается в европейских странах, где развит институт прослеживаемости. Без этого контроль ГМО в пищевых продуктах исключительно по заявлениям производителей и поставщиков, как следует из постановления Главного государственного санитарного врача РФ от 30 ноября 2007 г. № 80, малоэффективен.
Обозначенные проблемы, не являясь исчерпывающими, свидетельствуют о необходимости усиления контроля над оборотом ГМО на всех стадиях жизненного цикла продукции, расширения числа испытательных лабораторий и увеличения зоны их покрытия. Следует также внести изменения и дополнения в соответствующие законодательные акты, модернизировать методическую базу и усилить ответственность заявителей за недостоверную информацию о происхождении продукции.
В стадии доработки находятся технический регламент «О требованиях к безопасности пищевых продуктов, производимых из сырья, полученного из генно-инженерно-модифицированных (трансгенных) растений и животных», общие технические регламенты «О биологической безопасности» и «О безопасности микробиологических и биотехнологических производств и их продукции».
Несовершенство действующего законодательства привело к тому, что постановлением правительства г. Москвы от 13 февраля 2007 г. № 88-ПП «О дополнительных мерах по обеспечению качества и безопасности пищевых продуктов, информированию потребителей в городе Москве» на московской территории введена добровольная маркировка продуктов питания, указывающая на отсутствие в их составе ГМО. Маркировка пищевых продуктов знаком «Не содержит ГМО!» (рисунок 5) осуществляется на основании специального разрешения, получаемого на каждый вид, наименование производимой или реализуемой пищевой продукции по результатам проведенного исследования качественным
методом в соответствии с национальными стандартами. Такое разрешение выдаётся Департаментом потребительского рынка и услуг г. Москвы, плата за его выдачу не взимается. Знак представляет собой круг, в нём на бледно-зелёном фоне нанесена надпись ярко-зеленого цвета «Не содержит ГМО!».
Рисунок 5 – Информационный знак
76
«Не содержит ГМО!»
Предполагается, что маркировка товара знаком «Не содержит ГМО!» стимулирует покупку. Об этом свидетельствует п. 2 указанного постановления правительства, в котором производителям, поставщикам и розничным продавцам рекомендовано воздержаться от производства, поставок и реализации пищевых продуктов, содержащих ГМО, на территории Москвы. Включение данного положения вначале привело к тому, что руководители отдельных сетевых компаний отказались от пролонгации (продления) ряда договоров на поставку продукции на основании отсутствия указанной маркировки на продуктах питания. За этим последовали обращения поставщиков в Департамент потребительского рынка и услуг г. Москвы, который письмом от 2 мая 2007 г. № 2/02-08-277 разъяснил, что введение данной маркировки не является основанием для отказа в пролонгации договоров с производителями и поставщиками пищевой продукции. В настоящий момент только 28 компаний получили право использовать такой знак.
2.5 Системы мониторинга оборота пищевой продукции, содержащей ГМО
Контроль оборота ГМО сегодня является одной из наиболее острых тем, имеющих и политическое звучание. В последнее десятилетие потребительские рынки многих стран, в том числе и России, испытывают проблему, связанную с распространением генетически модифицированных продуктов, истинная природа которых в подавляющем большинстве скрывается. Это диктует необходимость контролирующим органам разрабатывать собственные системы государственного пострегистрационного мониторинга ГМО. Такие системы, наряду с отслеживанием разрешённых для реализации на внутреннем потребительском рынке ГМО, должны обеспечивать контроль и защиту от потенциально опасных, не прошедших процедуру допуска и от нелегально поступающих в страну продуктов. Используемые при этом методы должны опережать развитие технологий создания ГМО и базироваться на современном молекулярно-генетическом анализе.
Органы здравоохранения и научное сообщество в России признаёт создание действенной системы контроля за оборотом ГМО, циркулирующих на потребительском рынке РФ, и её регулярное обновление приоритетным направлением биологической и медицинской науки.
По сведениям Роспотребнадзора, 11,9% исследованных в 2004 году пищевых продуктов содержали ГМО, из них 36,4% не имели декларации соответствующей информации [60]. Среди импортных продуктов эти цифры ещё выше: 14,8 и 47,8% соответственно. Чаще всего ГМО обнаруживаются в
77

продуктах, содержащих сою, в том числе в мясорастительных и мясосодержащих.
По данным общенациональной ассоциация генетической безопасности (ОАГБ), в мае 2006 г. трансгенная соя обнаружена в сосисках Черкизовского МПЗ, без соответствующей информации на этикетке. Незадекларированные генетически модифицированные компоненты были также идентифицированы в колбасных изделиях, паштетах и пельменях Микояновского, Останкинского и Царицынского мясокомбинатов, предприятий «КампоМос» и «Дарья» [50].
Учреждениями Роспотребнадзора установлено, что оборот пищевых продуктов, содержащих компоненты ГМО в количестве более 0,9%, не превышает 1% оборота всех пищевых продуктов, однако на маркировке 90% из них наличие ГМО не декларируется.
Следует отметить, что статистика по встречаемости ГМО в продуктах питания далеко не всегда открыта потенциальным потребителям и требует доступа, как минимум, к постановлениям главных государственных санитарных врачей по регионам РФ. Общие итоги по Российской Федерации подводятся Главным государственным санитарным врачом РФ Г.Г. Онищенко. Последнее изданное им постановление № 80 по этому вопросу от 30 ноября 2007 г., а из более новых документов – ежегодный Государственный доклад [41].
Согласно этому документу, в 2008 г. Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека на наличие ГМО было исследовано 47 935 проб пищевых продуктов, при этом трансгенные компоненты обнаружены в 296 пробах (0,62 %), при этом в импортируемых продуктах – в 0,35 % проб. Наиболее часто ГМО обнаруживались в группах «жировые растительные продукты» (4,61 %) и «мясные продукты» (1,08 %) (таблица 9).
Таблица 9 – Наличие ГМО в продуктах питания в 2005-2008 гг. (всего)
Наименование |
2005 |
2006 |
2007 |
2008 |
|||||
продукции |
|
|
|
|
|
|
|
|
|
всего |
содер- |
всего |
содер- |
всего |
содер- |
всего |
содер- |
||
|
|||||||||
|
исследо |
жат |
исследо |
жат |
исследо |
жат |
исследо |
жат |
|
|
вано |
ГМО, |
вано |
ГМО, |
вано |
ГМО, |
вано |
ГМО, % |
|
|
|
% |
|
% |
|
% |
|
|
|
Пищевые |
19 795 |
6,76 |
30 966 |
2,74 |
44 411 |
1,13 |
47 935 |
0,62 |
|
продукты, всего |
|
|
|
|
|
|
|
|
|
Мясные продукты |
5 978 |
14,42 |
7 641 |
6,30 |
11 575 |
2,47 |
10 726 |
1,08 |
|
|
|
|
|
|
|
|
|
|
|
Хлебобулочные и |
1 201 |
1,67 |
2 080 |
0,67 |
|
|
|
|
|
мукомольно- |
|
|
|
|
|
|
|
|
|
крупяные изделия |
|
|
|
|
|
|
|
|
|
Кондитерские |
|
|
|
|
3 965 |
0,13 |
4 518 |
0,07 |
|
изделия |
|
|
|
|
|
|
|
|
|
Прочие |
3 5S4 |
8,23 |
4 638 |
4,40 |
5 588 |
1,62 |
5 787 |
0,47 |
|
|
|
|
|
|
|
|
|
|
|
78
Зерно и |
806 |
1,36 |
1087 |
0,55 |
1 018 |
0,88 |
1 287 |
0,78 |
|
зернопродукты |
|
|
|
|
|
|
|
|
|
Продукты |
464 |
3,23 |
564 |
0,71 |
884 |
0,23 |
807 |
0 |
|
детского питания |
|
|
|
|
|
|
|
|
|
Молочные про- |
1 090 |
1,28 |
1 763 |
0,40 |
2 379 |
0,76 |
3 205 |
0 |
|
дукты, включая |
|
|
|
|
|
|
|
|
|
масло и сметану |
|
|
|
|
|
|
|
|
|
Овощи и бахчевые |
1439 |
0,69 |
1 996 |
0,40 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Овощи, столовая |
|
|
|
|
3 491 |
0,2 |
2 643 |
0 |
|
зелень |
|
|
|
|
|
|
|
|
|
Консервы |
1 986 |
2,67 |
3 632 |
0,80 |
5 962 |
0,6 |
6 714 |
0,01 |
|
|
|
|
|
|
|
|
|
|
|
Жировые |
860 |
1,28 |
3 614 |
1,11 |
2 495 |
0,33 |
2 800 |
4,61 |
|
растительные |
|
|
|
|
|
|
|
|
|
продукты |
|
|
|
|
|
|
|
|
|
Мукомольно- |
|
|
|
|
1 066 |
0,47 |
2 010 |
0,05 |
|
крупяные изделия |
|
|
|
|
|
|
|
|
|
Картофель |
459 |
0,22 |
637 |
1,26 |
742 |
0,54 |
965 |
0 |
|
|
|
|
|
|
|
|
|
|
|
Сахар и |
|
|
|
|
|
|
|
|
|
кондитерские |
1 201 |
1,58 |
1 728 |
0,98 |
|
|
|
|
|
изделия |
|
|
|
|
|
|
|
|
|
Птицеводческие |
343 |
6,12 |
496 |
3,43 |
923 |
2,82 |
1 122 |
0,36 |
|
продукты |
|||||||||
|
|
|
|
|
|
|
|
||
Рыбные и другие |
148 |
2,03 |
279 |
2-15 |
457 |
2,19 |
575 |
0,35 |
|
продукты моря |
|||||||||
|
|
|
|
|
|
|
|
79
При этом отмечаются следующие тенденции:
1.Количество проб пищевых продуктов, подвергнутых исследованию на наличие ГМО, ежегодно возрастает на фоне снижения удельного веса обнаруженных ГМО. Так, в 2005 г. в целом по Российской Федерации исследовано 19 795 проб, тогда как в 2008 г. – 47 935 (рост почти в 2,5 раза). При этом удельный вес обнаруженных ГМО уменьшился с 6,76 % в 2005 г. до 0,62 % в 2008 году.
2.Снижение удельного веса продукции, содержащей ГМО без соответвующей информации для потребителя (51,01 против 59,01 % в 2007
г.).
Наибольший удельный вес пищевых продуктов, содержащих ГМО, был отмечен в Южном (1,70 %) федеральном округе.
Удельный вес проб импортной продукции, содержащей ГМО, остаётся достаточно высоким (таблица 10).
Таблица 10 – Наличие ГМО в импортных продуктах питания в 2005 – 2008 годах
Наименование |
2005 |
2006 |
2007 |
2008 |
||||
продукции |
|
|
|
|
|
|
|
|
|
всего |
содер- |
всего |
содер- |
всего |
содер- |
всего |
содер- |
|
исслед |
жат |
исслед |
жат |
исслед |
жат |
исслед |
жат |
|
овано |
ГМО, |
овано |
ГМО, |
овано |
ГМО, |
овано |
ГМО, % |
|
|
% |
|
% |
|
% |
|
|
Импотрные пищевые |
4 374 |
5,40 |
6 941 |
2,18 |
10 472 |
0,66 |
9311 |
0,35 |
продукты, всего |
|
|
|
|
|
|
|
|
Мясные продукты |
56 |
3,57 |
50 |
6,0 |
305 |
0,0 |
129 |
0,78 |
|
|
|
|
|
|
|
|
|
Хлебобулочные и |
145 |
2,07 |
315 |
1,27 |
|
|
|
|
мукомольно-крупяные |
|
|
|
|
|
|
|
|
изделия |
|
|
|
|
|
|
|
|
Кондитерские изделия |
313 |
1,60 |
374 |
1,60 |
304 |
0,33 |
261 |
1,15 |
|
|
|
|
|
|
|
|
|
Зерно и зернопродукты |
195 |
2,56 |
396 |
0,51 |
285 |
2,45 |
336 |
2,68 |
|
|
|
|
|
|
|
|
|
Продукты детского |
125 |
9,60 |
145 |
0,69 |
198 |
0,5 |
807 |
0,0 |
питания |
|
|
|
|
|
|
|
|
Молочные продукты, |
39 |
0,0 |
76 |
1,31 |
122 |
2,46 |
174 |
0,0 |
включая масло и |
|
|
|
|
|
|
|
|
сметану |
|
|
|
|
|
|
|
|
Овощи и бахчевые |
810 |
0,62 |
1 080 |
0,37 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Овощи, столовая |
|
|
|
|
2 165 |
0,09 |
1 192 |
0,0 |
зелень |
|
|
|
|
|
|
|
|
Консервы |
805 |
2,73 |
1 454 |
0,34 |
1 973 |
0,0 |
2 016 |
0,0 |
|
|
|
|
|
|
|
|
|
Жировые растительные |
100 |
2,0 |
117 |
0,0 |
197 |
0,0 |
320 |
0,0 |
продукты |
|
|
|
|
|
|
|
|
Мукомольно-крупяные |
|
|
|
|
162 |
1,23 |
226 |
0,44 |
изделия |
|
|
|
|
|
|
|
|
Картофель |
151 |
0,0 |
209 |
0,0 |
191 |
0,0 |
282 |
0,0 |
|
|
|
|
|
|
|
|
|
Птицеводческие про- |
10 |
10,0 |
48 |
4,17 |
55 |
1,81 |
113 |
0,0 |
дукты |
|
|
|
|
|
|
|
|
Рыбные и другие |
15 |
0,0 |
27 |
0,0 |
36 |
5,55 |
27 |
0,0 |
продукты моря |
|
|
|
|
|
|
|
|
80
Прочие |
1 356 |
12,70 |
1 902 |
5,84 |
2 ПО |
2,36 |
2 102 |
0,76 |
|
|
|
|
|
|
|
|
|
Что касается ситуации в регионах, то статистическая информация по ним далеко не всегда доступна и редко обновляется. Те сведения, что были найдены нами, 2006 г. и ранее (таблица 11).
Таблица 11 – Встречаемость ГМО в продуктах питания в некоторых регионах РФ (2006 г.)
Регион |
Исследован |
Содержат |
|
В том числе |
|
|||
|
о проб |
|
ГМО |
|
|
|
|
|
|
|
Шт. |
|
% |
мясная |
растительная |
|
продукция |
|
|
|
|
|
продукция |
продукция |
|
птицеводства |
Санкт-Петербург |
630 |
21 |
|
3,3 |
2 |
|
|
|
Тамбовская область |
768 |
3 |
|
0,39% |
3 |
|
|
|
Ленинградская область |
207 |
20 |
|
9,7%, |
5 |
|
|
3 |
Волгоградская область |
464 |
11 |
|
2,4 % |
9 |
2 |
|
|
Орловская область |
503 |
0 |
|
0 |
|
нет данных |
|
|
Республика Татарстан |
1026 |
16 |
|
1,5% |
|
нет данных |
|
|
Республика Коми |
76 |
2 |
|
2,6% |
2 |
|
|
|
Республика Мордовия |
356 |
21 |
|
0,6% |
|
нет данных |
|
|
Хабаровский край |
373 |
5 |
|
1,3% |
5 |
|
|
|
Одним из главных недостатков этих документов является отсутствие информации, которая действительно могла бы заинтересовать потребителя, помочь ему определиться в своем выборе. Информация о видах продукции, марках, брендах и производителях, не маркирующих свою продукцию с ГМО, либо, наоборот, не использующих ГМО в производстве, постоянно должна быть достоянием общественности. К сожалению, официальные органы от этого пока устраняются, а изредка появляющиеся в печати и в интернете результаты исследований общероссийской ассоциации генетической безопасности и отдельных российских ученых (в том числе наши исследования) не в состоянии заполнить этот информационный вакуум.
В2005 – 2007 гг. нами по заказу министерства пищевой промышленности и потребительского рынка Хабаровского края был проведён мониторинг наличия ГМО в продуктах питания. Лабораторному исследованию при этом было подвергнуто 40 образцов, случайно отобранных в розничной торговой сети и на производственных предприятиях пищевых продуктов 12 видов.
Входе исследования устанавливали наличие соевых белковых препаратов, в том числе рекомбинантной ДНК (35-S промотор), а также идентификацию ДНК, свойственной генетически модифицированной сое сорта Roundup Ready (линия 40-3-2), разрешённой к использованию в пищевой промышленности России. Для этого был апробирован стандартизированный метод полимеразной цепной реакции (ПЦР), позволяющий успешно выявлять как генетически изменённые последовательности нуклеотидов, так и распознавать фальсификацию продуктов белковыми соевыми компонентами.
81
Результаты проведённых исследований представлены в таблице 12.
В таблице 13 представлены результаты исследования согласно форме, рекомендуемой постановлением Главного государственного санитарного врача РФ контролирующим органам.
Таблица 12 – Результаты мониторинга ГМО в пищевых продуктах
Наименование продукта |
Деклариров |
Деклари |
Наличие |
Наличие |
Наличие |
|
ание |
рование |
соевых |
35S |
ГМ сои |
|
соевых |
ГМО |
ингреди |
промото |
линии |
|
ингредиент |
|
ентов |
ра |
40-3-2 |
|
ов |
|
|
|
|
Соевое мясо Золотой белок (КНР) |
+ |
- |
+ |
+ |
+ |
Продукт из соевых белков (КНР) |
+ |
- |
+ |
- |
|
Соевое мясо (КНР) |
+ |
- |
+ |
+ |
- |
Соевое мясо «Овощи золотого слитка» (КНР) |
+ |
- |
+ |
- |
|
Соевое мясо «Союшка» (РФ) |
+ |
- |
+ |
+ |
- |
Текстурат Maxten R 60 (Бразилия) |
+ |
- |
+ |
+ |
+ |
Соевый текстурат Сойтекс TSP Natural |
+ |
- |
+ |
- |
|
Соевый изолят GPT 500 (КНР) |
+ |
- |
+ |
+ |
- |
Соевый изолят Supro 595 |
+ |
- |
+ |
- |
|
Функциональная смесь Supro |
+ |
- |
+ |
- |
|
Соевый белок «Добрыня» (РФ) |
+ |
- |
+ |
- |
|
Соевое мясо (Приморский край) |
+ |
- |
+ |
- |
|
Соевое мясо (Москва) |
+ |
- |
+ |
- |
|
Йогурт соевый (Комсомольск) |
+ |
- |
+ |
- |
|
Лапша «Доширак» (Ю.Корея) |
+ |
- |
+ |
- |
|
Чебуреки (ООО Мерилен), фарш |
- |
- |
- |
|
|
Пельмени Русские (ИП Печнов) |
- |
- |
+ |
- |
|
Котлеты Покровские (Кооператор-2) |
+ |
- |
+ |
+ |
- |
Котлеты Домашние (Кооператор-2) |
+ |
- |
+ |
- |
|
Котлеты по-домашнему (ООО «Примормясопродукт») |
+ |
- |
+ |
- |
|
Котлеты «Курочка ряба» (ХПК) |
+ |
- |
+ |
- |
|
Шницель Пряный (ООО Мерилен) |
+ |
- |
+ |
+ |
- |
Сосиски «Chack Wagon» (США) |
- |
- |
+ |
- |
|
Сосиски куриные Minuano (Бразилия) |
+ |
- |
+ |
- |
|
Колбаса Фермерская (ООО Григ) |
+ |
- |
+ |
- |
|
Колбаса вареная Сердечная (ООО «Ратимир») |
+ |
- |
+ |
- |
|
Колбаса вареная Невская (ООО «Мостовик-1») |
+ |
- |
+ |
- |
|
Колбаса вареная Студенческая (ООО «Ратимир») |
|
|
|
|
|
Колбаса вареная Фермерская (ООО «Мостовик-1») |
+ |
- |
+ |
- |
|
Колбаса вареная Чайная (ООО «Кооператор-2») |
- |
- |
+ |
- |
|
Консервы «Свинина тушеная» Деликон (ООО «Нива-К») |
- |
- |
+ |
+ |
+ |
Консервы «Говядина тушеная» в/с Деликон (ООО «Нива- |
- |
- |
+ |
+ |
+ |
К») |
|
|
|
|
|
Консервы «Говядина тушеная в/с (Мценск) |
- |
- |
+ |
- |
|
Консервы «Говядина тушеная» (Ставрополь) |
- |
- |
+ |
- |
|
Мясо соевое ИП Казина (Приморский край) |
+ |
- |
+ |
- |
|
Мясо соевое со вкусом грибов (Москва) |
+ |
- |
+ |
+ |
|
Салями Летняя сырокопчёная (ООО «Григ») |
+ |
- |
+ |
- |
|
Котлеты Дачные (ИП Боровикова) |
- |
- |
- |
- |
|
Котлеты Домашние (ИП Качина Е.С.) |
- |
- |
- |
- |
|
Котлеты Школьные (ООО «Кооператор-2») |
- |
- |
- |
- |
|
Всего: |
29 |
0 |
36 |
10 |
4 |
82
Из 40 испытанных образцов информация о наличии растительных ингредиентов (соевых белков) содержалась в 29. Фактически было установлено присутствие соевых добавок – в 36. Отсутствовали соевые ингредиенты только в фарше чебуреков (ООО Мерилен, Хабаровск), а также в котлетах ИП Боровикова, ИП Качина и ООО «Кооператор-2».
Таблица 13 – Соотношение пищевых продуктов, содержащих ГМО
Продовольственное |
Количество |
|
Из них содержат ГМО |
сырьё и пищевые |
исследованных проб |
всего |
из них без декларации о |
продукты |
|
|
наличии ГМО |
Всего |
40 |
10 |
10 |
из них импортируемые, |
12 |
4 |
4 |
в том числе: |
|
|
|
мясо и мясные продукты |
23 |
4 |
4 |
из них импортируемые, |
1 |
– |
– |
в том числе: |
|
|
|
соевые продукты |
17 |
6 |
6 |
из них импортируемые |
11 |
4 |
4 |
Недостоверной оказалась информация на маркировке следующих продуктов: сосиски (США); колбаса Чайная (ООО Кооператор-2); пельмени «Русские» (ИП Печнов), консервы «Говядина тушёная» (Приморский край; Орловская область; Ставрополь) и консервы «Свинина тушёная» (Приморский край). В двух образцах мясных консервов марки «Деликон» ООО Нива-К обнаружена генетически модифицированная соя семейства 40-3-2.
Полученные результаты свидетельствуют о грубом нарушении Закона «О защите прав потребителей» относительно достоверности потребительской информации.
В результате экспериментальных исследований генетически модифицированная соя обнаружена в 10 образцах из 40 (25%), причём во всех этих объектах отсутствовала информация о наличии ГМО. Наиболее высокая встречаемость ГМО (40%) наблюдалась в импортных продуктах из сои: в текстурате Maxten (Бразилия), изоляте GPT 500 (КНР) и в соевых аналогах мяса. Наличие ГМО в соевом мясе «Союшка» из Приморья и в продукте из Москвы скорее всего объясняется тем, что для производства было использовано импортное сырьё, хотя на упаковке такая информация отсутствовала.
Проведённый анализ информации, наносимой на потребительскую упаковку пищевых продуктов, показал, что она зачастую вводит потребителя в заблуждение относительно состава продукта. Однако можно допустить, что наличие ГМО в отечественных продуктах вызвано недостоверной информацией импортных поставщиков о природе соевых белковых продуктов. Поэтому первоочередная задача в рамках исключения фальсификации нам видится в контроле на наличие ГМО прежде всего импортных соевых белковых препаратов, в том числе использующихся в качестве ингредиентов для пищевых продуктов [48].
Таким образом, мониторинг показал, что на современном рынке мясных, мясосодержащих и соевых продуктов распространена фальсификация, связанная с непредоставлением потребителю информации об ингредиентах продуктов. В этой связи немаловажное значение придаётся поиску надёжных, доступных,
83

простых, воспроизводимых методов, применяемых экспертами на практике. Результаты мониторинга были представлены в Министерство пищевой
промышленности и потребительского рынка, обсуждены на совещании руководителей мясоперерабатывающих предприятий. Публикации результатов исследования в местных СМИ вызвали большой общественный резонанс.
Систему мониторинга пищевой продукции, содержащей ГМО, сегодня следует активно развивать в масштабе всей страны, существенно увеличивая количество проб, подвергаемых анализу, а результаты доводить до населения.
ГЛАВА 3 ОПРЕДЕЛЕНИЕ ГМО В ПИЩЕВЫХ ПРОДУКТАХ
3.1Классификация и стандартизация методов определения ГМО
впищевых продуктах
Совершенствование действующих методик определения ГМО в пищевых продуктах, наряду с увеличением числа контролируемых проб и созданием новых испытательных лабораторий, является залогом достоверного и своевременного информирования населения о генетически модифицированной продукции. Сложившаяся на отечественном и зарубежных рынках ситуация стимулирует развитие и применение самых современных аналитических методов, которые позволяли бы не только обнаруживать ГМО, определять их линию (то есть проводить скрининг), но и количественное содержание в продукте. Поэтому в настоящее время число аккредитованных лабораторий, способных тестировать генетически модифицированные источники, постоянно увеличивается.
Из сущности генетической модификации следует, что у исследователя есть три объекта, по которым он может судить, является ли данный организм или пищевой продукт генетически модифицированным. Этими объектами являются:
 встроенная (чужеродная для данного организма) последовательность ДНК и вспомогательные последовательности (промоторы);
встроенная (чужеродная для данного организма) последовательность ДНК и вспомогательные последовательности (промоторы);
мРНК, матрицей для синтеза которой служила встроенная ДНК; полипептидная цепь, код последовательности которой содержался во
встроенной ДНК (белок).
Наибольшее число методов основано на детекции именно нуклеиновых кислот, а общее количество методов определения ГМО превышает 200. Молекула ДНК представляет собой наиболее удобный объект для анализа на наличие ГМО. Основное её преимущество перед другими макромолекулами – стабильность. ДНК не разрушается даже при автоклавировании и переносит длительное хранение. Другим преимуществом является большая методическая база исследования ДНК. Самым распространённым методом качественного определения ГМО является полимеразная цепная реакция (ПЦР). Именно полимеразной цепной реакции (ПЦР) отдаётся предпочтение в качестве
84
основополагающего метода определения ГМО в России, гармонизированного с международными стандартами.
Помимо ПЦР, в некоторых западных лабораториях успешно используют
блоттинг и гибридизацию с олигонуклеотидами, комплиментарными части ДНК, трансформированной в трансгенное растение. Однако применение таких методов требует много времени и сотрудников высокой квалификации.
Кроме методов, основанных на анализе РНК и ДНК, большое распространение получили методы, основанные на определении белковых продуктов экспрессии генов, введённых в трансгенные растения. Один из популярнейших методов – ELISA (Enzime Linked Immunosorbent Assay),
позволяющий определять наличие в смеси определённого белка при помощи антител, конъюгированных с ферментом. Активность этого фермента определяет цветную реакцию с субстратом, а изменение окраски в системе регистрируется фотоколориметром. Это позволяет при наличии стандартных образцов (маркеров) проводить количественный анализ содержания белка в смеси. Однако данный метод, как и другие, основанные на определении белков, имеет ряд ограничений, в частности не позволяет анализировать продукты, подвергшиеся в процессе производства термической обработке.
Помимо перечисленных, существует целый ряд других методов, используемых для определения ГМО в продуктах питания. Однако для введения их в практику лабораторий, работающих в сфере контроля качества пищевой продукции, требуется проведение дополнительных метрологических оценок. В таблице 14 приведены характеристики методов, применяемых для анализа ГМО.
Таблица 14 – Сравнительная характеристика методов определения ГМО [51]
Параметр |
|
|
Белковые методы |
|
ДНК-методы |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
Перенос и |
ELISA |
Перенос и |
Качественн |
Конкурентн |
ПЦР в |
|
|
|
гибридизац |
|
гибридизац |
ый ПЦР |
ый ПЦР |
реальном |
|
|
|
ия Western |
|
ия Southern |
|
|
времени |
|
|
|
|
|
|
|
|
|
Простота использования |
|
Сложная |
Средней |
Сложная |
Сложная |
Сложная |
Сложная |
|
|
|
|
||||||
|
|
|
сложности |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Потребность |
|
в |
Да |
Да |
Да |
Да |
Да |
Да |
специальном |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Чувствительность |
|
|
Высокая |
Высокая |
Умеренная |
Очень |
Высокая |
Высокая |
|
|
|
||||||
|
|
|
высокая |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Затрачиваемое время |
|
|
2 дня |
30 – 90 |
6 часов |
8 часов |
8 часов |
8 часов |
|
|
|
минут |
|||||
|
|
|
|
|
|
|
|
|
Стоимость (дол. США) |
|
150 |
5 – 20 |
150 |
250 |
350 |
450 |
|
Количественный |
метод |
Нет |
Да |
Нет |
Нет |
Полуколич |
Да |
|
(Да/Нет) |
|
|
ественный |
|||||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
85
Возможность |
|
|
|
|
|
|
использования метода в |
Нет |
Да |
Нет |
Нет |
Нет |
Нет |
нелабораторных условиях |
|
|
|
|
|
|
Уровень лаборатории |
Академиче |
Тестовая |
Академиче |
Тестовая |
Тестовая |
Тестовая |
|
||||||
|
ская |
ская |
||||
|
|
|
|
|
||
|
|
|
|
|
|
|
В последние годы были разработаны и другие подходы к определению ГМО в пищевых продуктах, в том числе основанные на массспектрометрии, хроматографии, инфракрасной спектроскопии, технологии ДНК-чипов. Выбор конкретного метода и его внедрение должны сопровождаться обязательными метрологическими оценками и сличительными испытаниями с методами, общепринятыми на мировом уровне.
Как отмечают М.В. Патрушев и др. [52], одной из главных проблем в сфере регулирования ГМО в России является недостаточно развитая база национальных стандартов, лежащих в основе обеспечения исполнения законов и технических регламентов. Так, одним из главных вопросов при анализе ГМО является выбор аналитического метода. При этом в соответствии с требованиями ГОСТ Р ИСО/МЭК 17025-2005 «Общие требования к компетентности испытательных и калибровочных лабораторий», применяемом при аккредитации испытательных лабораторий в РФ, свобода в выборе метода практически не ограничивается. Однако следует учесть, что метод должен быть приведён в международном, региональном или национальном стандарте. Использование нестандартных методов допускается только в случае наличия их предварительной метрологической оценки. На сегодняшний день в России принято несколько стандартов на методы определения ГМО (таблица 15), в том числе документы, устанавливающие определения и регламентирующие общие требования к проведению анализа. Следует отметить отсутствие стандарта на обнаружение ГМО в продукте методами анализа белковых компонентов (Международной организацией по стандартизации такой стандарт принят еще в 2005 году).
Отметим, что на сегодняшний день до сих пор не создана методика, позволяющая во время одной унифицированной процедуры обнаружить все линии ГМО в пищевом продукте. Поэтому в мировой практике специалистам испытательных лабораторий постоянно приходится искать компромиссы между достоинствами и недостатками нескольких методик. Именно поэтому ГОСТ Р ИСО/МЭК 17025-2000 допускает возможность использования нестандартных методов.
Самым первым национальным стандартом, принятым в Российской Федерации, был ГОСТ Р 52173-2003 «Сырьё и продукты пищевые. Метод идентификации генетически модифицированных источников (ГМИ) растительного происхождения». Предлагаемый в нём метод основан на полимеразной цепной реакции с соответствующими праймерами. Главным
86
преимуществом этого метода является наличие апробации в международных межлабораторных испытаниях, проводимых IUPAC (Международный союз теоретической и прикладной химии). Стандарт предлагает максимально простой способ обнаружения ГМО в пищевых продуктах, однако имеющий существенные недостатки. Так, стандарт не позволяет количественно оценить наличие ГМО в продукте, что делает его практически бесполезным при вынесении решения о достоверности информации. Более того, он распространяется только на ДНКпоследовательности 35S-промотор и nos-терминатор, что, во-первых, ограничивает число определяемых генетически модифицированных объектов, содержащих другие структурные элементы, а во-вторых, даже при их обнаружении не позволяет говорить о наличии ГМО. Это связано с тем, что как 35S-промотор, так и nos-терминатор являются естественными генетическими элементами, достаточно часто встречающимися в природе.
Таблица 15 – Стандартизация методов определения ГМО в пищевых продуктах в Российской Федерации и на международном уровне
Международный стандарт |
|
|
|
Национальный стандарт |
|
|
|||
ИСО 21569-2005 Продукты пищевые. |
1. ГОСТ Р 52173-2003 Сырьё и продукты пищевые. |
||||||||
Методы анализа, предназначенные для |
Метод |
идентификации |
генетически |
модифицированных |
|||||
обнаружения генетически модифицированных |
источников (ГМИ) растительного происхождения. |
|
|||||||
организмов и полученных из них продуктов. |
2. ГОСТ Р 52174-2003 Биологическая безопасность. Сырьё и |
||||||||
Методы, основанные на качественном |
продукты пищевые. Метод идентификации генетически |
||||||||
определении нуклеиновых кислот |
|
модифицированных источников (ГМИ) растительного |
|||||||
|
|
|
происхождения с применением биологического микрочипа. |
||||||
|
|
|
3. ГОСТ Р 53214-2008* (ИСО 24276:2006) Методы |
||||||
|
|
|
анализа |
|
для |
обнаружения |
генетически |
||
|
|
|
модифицированных организмов и полученных из них |
||||||
|
|
|
продуктов. Общие требования и определения |
|
|
||||
ИСО 21570-2005 Продукты пищевые. |
1. ГОСТ Р 53244-2008* (ИСО 21570:2005) Методы анализа |
||||||||
Методы анализа, предназначенные для |
для обнаружения генетически модифицированных организмов |
||||||||
обнаружения |
генетически |
и полученных из них продуктов. Методы, основанные на |
|||||||
модифицированных |
организмов |
и |
количественном определении нуклеиновых кислот |
|
|||||
полученных из них продуктов. Методы, |
2. ГОСТ Р 53214-2008 (ИСО 24276:2006) Методы анализа для |
||||||||
основанные на количественном определении |
обнаружения генетически модифицированных организмов и |
||||||||
нуклеиновых кислот |
|
|
полученных из них продуктов. Общие требования и определения |
||||||
ИСО 21571-2005 Продукты пищевые. |
1. ГОСТ Р 52173-2003 Сырьё и продукты пищевые. |
||||||||
Методы анализа, предназначенные для |
Метод |
идентификации |
генетически |
модифицированных |
|||||
обнаружения |
генетически |
источников (ГМИ) растительного происхождения. |
|
||||||
модифицированных |
организмов |
и |
2. ГОСТ Р 52174-2003 Биологическая безопасность. |
||||||
полученных из них продуктов. Экстракция |
Сырьё и продукты пищевые. Метод идентификации |
||||||||
нуклеиновых кислот |
|
|
генетически |
модифицированных |
источников |
(ГМИ) |
|||
|
|
|
растительного происхождения с применением биологического |
||||||
|
|
|
микрочипа** |
|
|
|
|
|
|
ИСО 21572-2005 Продукты пищевые. |
Отсутствует |
|
|
|
|
|
|||
Методы анализа, предназначенные для |
|
|
|
|
|
|
|
||
обнаружения |
генетически |
|
|
|
|
|
|
|
|
модифицированных |
организмов |
и |
|
|
|
|
|
|
|
полученных из них продуктов. Методы, |
|
|
|
|
|
|
|
||
основанные на определении белков |
|
|
|
|
|
|
|
|
|
*Дата введения 1.01.2010 г. |
|
|
|
|
|
|
|
|
|
** Соответствующие разделы указанных стандартов |
|
|
|
|
|
|
|||
87
Национальный стандарт ГОСТ Р 52174-2003 «Биологическая безопасность. Сырьё и продукты пищевые. Метод идентификации генетически модифицированных источников (ГМИ) растительного происхождения с применением биологического микрочипа» до сих пор является достаточно противоречивым нормативным документом. Он также не позволяет говорить о количественном содержании ГМО. Аналогов этого нормативного документа нет ни в одной стране мира, ГОСТ Р 52174 регламентирует метод, не прошедший полную метрологическую аттестацию. Критический анализ метода показывает, что он не имеет никаких преимуществ по сравнению с ГОСТ Р 51173.
Стандарт ИСО 21569-2005 «Продукты пищевые. Методы анализа, предназначенные для обнаружения генетически модифицированных организмов и полученных из них продуктов. Методы, основанные на качественном определении нуклеиновых кислот» содержит подробное описание процедур анализа, позволяющих испытательным лабораториям давать заключения о наличии или отсутствии Г/МО наиболее распространенных линий в пищевых продуктах. Стандарт описывает процедуру скрининга на основе последовательностей 35S-промотор, nos-терминатор и гена, кодирующего неомицинфосфотрансферазу nptII, а также процедуру видовой идентификации ГМО, что отсутствует в национальных стандартах РФ. ИСО 21569 содержит подробное теоретическое описание каждого метода, что позволяет специалистам лабораторий не только обдуманно выполнять описанные процедуры, но и модифицировать их с учётом специфики аналитического образца.
ГОСТ Р 53214-2008 «Методы анализа для обнаружения генетически модифицированных организмов и полученных из них продуктов. Общие требования и определения» является модифицированным по отношению к международному стандарту ИСО 24276:2006 и описывает практически все термины и определения, встречающиеся в стандартах на методы, с учётом потребностей национальной экономики РФ. Необходимость этого стандарта в последнее время была очевидной.
ГОСТ Р 53244-2008 «Методы анализа для обнаружения генетически модифицированных организмов и полученных из них продуктов. Методы, основанные на количественном определении нуклеиновых кислот» является модифицированным по отношению к международному стандарту ИСО 21570:2005. Он устанавливает количественные методы определения ГМО в пищевых продуктах с использованием ПЦР и общие требования к специфической амплификации целевых последовательностей ДНК с целью определения количественного содержания ДНК из ГМО, а также для подтверждения идентичности амплифицированной последовательности ДНК.
88
Следующие два международных стандарта не имеют отечественных аналогов. ИСО 21571-2005 «Продукты пищевые. Методы анализа, предназначенные для обнаружения генетически модифицированных организмов и полученных из них продуктов. Экстракция нуклеиновых кислот» предлагает восемь методов выделения нуклеиновых кислот для последующего анализа методом ПЦР. Все вышеперечисленные национальные стандарты – только по одному, как правило, с применением цетилтриметилбромида аммония, что не отвечает существующему разнообразию потенциальных объектов исследования. Стандарт ИСО 21571 не только учитывает специфику продукта, из которого выделяется ДНК, но и содержит методы проверки качества выделенных нуклеиновых кислот, чего нет ни в одном из национальных стандартов России.
Стандарт ИСО 21572-2005 «Продукты пищевые. Методы анализа, предназначенные для обнаружения генетически модифицированных организмов и полученных из них продуктов. Методы, основанные на определении белков» также до сих пор не имеет аналогов в России. Данный стандарт содержит подробное описание принципов иммуноферментного анализа белков. Главным преимуществом метода, указанного в стандарте, является высокая скорость выполнения анализа и значительно меньшая, по сравнению с анализом ДНК, стоимость. Главный недостаток этого метода, как уже упоминалось – неприменимость к термически или химически обработанным продуктам, однако для испытательных лабораторий, спецификой которых является анализ первичного сырья, этот метод незаменим.
3.2 Полимеразная цепная реакция – перспективный способ качественного и количественного определения ГМО
Принципы полимеразной цепной реакции впервые были изложены профессором Корана в 1971 г., а в 1976 г. Гилберт и Максам в Гарвардском университете, а также Сэнгер разработали быстрый метод химического анализа ДНК. В 1982 – 1985 гг. Кэри Б. Мюллисом был создан прибор для автоматического анализа нуклеиновых кислот. Впоследствии американский журнал «Science» назвал эти работы самым выдающимся открытием последних лет.
С тех пор этот метод успешно применяется в медицине для диагностики широкого спектра возбудителей заболеваний: хламидий, микоплазм, клостридий, спирохет, кишечной палочки, сальмонеллы, вирусов гепатита, герпеса, папилломы, краснухи, геморрагической лихорадки и др. При этом биологический материал проверяется на наличие в его составе участка определённой генетической информации путём избирательной амплификации (amplification – увеличение, усиление) нужного участка ДНК в миллионы раз в течение нескольких часов [21]. В то же время
89
специфика применения метода в лечебно-диагностических учреждениях такова, что позволяет определять только вид возбудителя той или иной инфекции.
В 1997 г. швейцарский учёный Pietsch с немецкими коллегами апробировал метод и для пищевой продукции, впервые определив 35Sпромотор и nos-терминатор. Кроме того, за это время накоплен богатый опыт использования метода ПЦР для анализа видовой принадлежности и происхождения мяса, муки и других сырьевых ингредиентов, то есть для целей идентификации на стадии подтверждения соответствия продукции.
В качестве стартового материала при ПЦР могут использоваться сложные смеси любого ДНК-содержащего материала, как, например, в мясных и мясосодержащих рубленых полуфабрикатах или молочных продуктах.
Сущность метода заключается в подборе участков ДНК, характерных только для генетически изменённого организма (источника) и последующим цепным размножением этих участков в исследуемом генетическом материале – амплификацией. Такими участками являются структуры 35S промотор вируса мозаики цветной капусты, nos- и ocs-
терминаторы Agrobacterium tumefacience, маркерные гены gus и nptII
различного бактериального происхождения. Ограничиваются эти участки особыми олигонуклеотитидными фрагментами – праймерами, специфическими для каждого отдельного генетического изменения.
Анализ на наличие ГМО методом ПЦР осуществляется в три этапа:
1. Выделение ДНК из пробы (пробой может служить как непосредственно растительное сырьё, так и готовый продукт, независимо от технологии его производства);
2. Амплификация, то есть многократное увеличение содержания интересующих фрагментов ДНК в пробе под действием соответствующих ферментов;
3. Визуализация, или детекция, продуктов амплификации (обычно используются методы горизонтального электрофореза).
От начала анализа до получения результата проходит не более 4 – 6 часов. Метод может быть использован практически во всех испытательных лабораториях. На сегодняшний день ПЦР – самый удобный и распространённый метод для определения наличия ГМО в продукте, доступный как в качественном виде (есть или нет ГМО в пробе), так и в количественном (ПЦР в реальном времени, real-time PCR), со множеством модификаций, принятых в отдельных странах и испытательных лабораториях.
К ПЦР-лаборатории предъявляются довольно жёсткие требования, в частности необходимы три помещения (для пробоподготовки, амплификации и детекции методом электрофореза), не сообщающихся друг с другом, чтобы исключить возможность загрязнения реактивов и
90
оборудования фрагментами ДНК. Работать следует в одноразовых перчатках, заменять одежду и обувь при перемещении из одного помещения в другое.
Однако непосредственное проведение исследования не представляет никаких трудностей: в пробирке смешивают исследуемую ДНК, праймеры, нуклеотиды четырёх типов, буфер, термостабильную ДНК-полимеразу и ионы магния. Сверху добавляют минеральное масло для уменьшения испарения компонентов. На практике это ещё проще, так как применяются уже готовые к постановке ПЦР-тест-системы, поставляемые в наборе. Производством этих реактивов в РФ занимается ГУ ЦНИИ эпидемиологии Минздрава РФ.
Подготовка пробы продукта для ПЦР является наиболее трудоёмким этапом анализа, занимающим 2 – 3 часа (модификация метода для пищевых продуктов более сложна, нежели применяемая в медицине, где пробоподготовка может вообще не производиться). Этот этап сводится к специальной обработке исследуемого материала, во время которой происходит лизис (разрушение) клеток исследуемых образцов, устранение белковых и полисахаридных фракций. При этом используется метод твердофазной сорбции, заключающийся в обработке пробы лизирующим раствором (бромид гексадецилтриметиламмония, трис-НCl, NaCl, этилендиаминтетрауксусная кислота ЭДТА и деионизированная вода), осаждении ДНК на сорбенте (силикагеле), многократной отмывке хлороформом и ресорбции ДНК буферным раствором. Результатом такой обработки является очищенный раствор очищенный раствор, содержащий ДНК из пробы продукта, который в замороженном состоянии (-20ºС) можно хранить до 1 года.
Ключевой этап ПЦР – это амплификация, то есть многократная репликация фрагмента ДНК, находящегося между участками отжига (гибридизации) – праймеров. Пятью основными компонентами этапа амплификации являются:
1.Копируемая ДНК, выделенная из продукта на первом этапе ПЦР.
2.Фермент Taq-ДНК-полимераза, выделенный из бактерий-
термофилов, живущих в геотермических источниках. Он способен осуществлять синтез взаимно комплементарных цепей ДНК, начиная с двух олигонуклеотидных праймеров. При синтезе ДНК праймеры встраиваются в цепь новосинтезирующихся молекул ДНК. При этом каждая из синтезированных молекул ДНК может служить матрицей для синтеза комплементарной ДНК, для чего следует денатурировать образовавшиеся в результате первой стадии реакции двухцепочечные молекулы ДНК, дать возможность праймерам комплементарно присоединиться к ДНК и осуществить элонгацию. Эти три операции составляют цикл ПЦР и приводят к удвоению количества ДНК в образце. Поскольку любая из вновь синтезированных цепей ДНК служит матрицей для синтеза новых молекул ДНК, выбранных для амплификации, то ПЦР будет приводить к экспоненциальному росту количества именно таких, с
91
двух сторон ограниченных праймерами, молекул ДНК. Следовательно, теоретически за 20 циклов ПЦР можно получить амплификацию заданного участка до 2020 раз (на практике, конечно, меньше). Вследствие этого метод и получил название полимеразной цепной реакции.
Фермент Taq-ДНК-полимераза при оптимальных условиях ПЦР содержится в 50 – 100 мкл реакционной смеси в количестве 0,5 – 2 единицы и синтезирует цепь ДНК со скоростью до 1000 пар оснований в минуту. Большой избыток Taq-ДНК-полимеразы увеличивает образование неспецифических продуктов ПЦР.
3. Праймеры. Праймеры – это короткие (20 – 30 оснований) синтетические одноцепочечные олигонуклеотиды, комплементарные 3’- концам цепей копируемой ДНК-матрицы, ограничивающие фрагмент ДНК. В ходе амплификации происходит многократное копирование данного фрагмента ферментом Taq-ДНК-полимеразой, который присоединяется к 3’- концам праймеров и достраивает их до заданной длины в несколько сот или тысяч пар оснований.
Самым ответственным звеном в создании видоспецифичной тестсистемы для анализа пищевых продуктов на наличие ГМО является подбор праймера для ПЦР. Требуется найти такой фрагмент молекулы ДНК, который отличался бы генетической консервативностью и присутствовал бы только у определённой линии трансгенного продукта.
Поскольку праймеры каждый раз встраиваются в амплифицируемые фрагменты ДНК-матрицы (амплификоны), то в реакционной смеси ПЦР они присутствуют в избытке. Специфичность получаемого продукта ПЦР в значительной степени определяется так называемой температурой отжига праймеров, при которой они взаимодействуют с комплементарными участками ДНК-матрицы, образуя двухцепочечные структуры. Температура отжига определяется длиной праймера и содержанием ГЦпар и рассчитывается по формуле Т=[(А+Т)×2]+[(Г+Ц) ×4] – 5Ц.
Следует отметить, что в настоящее время для определения большинства линий трансгенных культур используются уже готовые праймеры, поставляемые вместе с тест-системами для ПЦР, поэтому для аккредитованных испытательных лабораторий нет необходимости в их подборе и определении температуры отжига.
4.Четыре типа дезоксинуклеотидтрифосфатов (аденозинтрифосфат,
гуанозинтрифосфат, цитидинтрифосфат, тимидинтрифосфат), содержатся в реакционной смеси в эквивалентных концентрациях (200-500 мкмоль), так как избыток любого из них увеличивает неспецифическое связывание нуклеотидов в ПЦР.
5.Ионы Mg++ необходимы для функционирования Taq-ДНК- полимеразы. Его оптимальную концентрацию устанавливают путём титрования, средние величины концентрации около 2-3 ммоль.
92

Вспомогательными компонентами ПЦР-смеси являются буферный раствор и минеральное масло. Буфер должен обеспечивать оптимальные условия для работы фермента. Наиболее распространён Трис-HCl-буфер, удерживающий рН во время ПЦР на уровне 6,8-7,8. Он содержит желатин или бычий сывороточный альбумин и неионные детергенты для стабилизации фермента, а также 50 мМ KCl. Минеральное масло наслаивают на поверхность реакционной смеси в количестве 10 – 40 мкл для предотвращения испарения смеси при нагревании.
Сам процесс амплификации включает в себя три стадии:
1.Денатурация двухцепочечной молекулы ДНК (расплетение двойной спирали, расхождение нитей ДНК), протекающая при температуре 93 – 95ºС
втечение 30 – 40 с.
2.Гибридизация (отжиг) праймеров с матричной ДНК, в результате чего образуются двухцепочечные комплексы «праймер-матрица», необходимые для инициациисинтеза ДНК (значения температуры отжига для различных праймеров располагаются в интервале 50 – 65ºС при экспозиции 20 – 60ºС).
3.Достраивание (элонгация) комплементарных цепей в направлении от 5'- конца к 3'-концу цепи, начиная с участков присоединения праймеров с помощью Taq-ДНК-полимеразы в течение 20 – 40 с при температуре 70 – 72ºС.
Многократное циклическое повторение этих трёх стадий приводит к экспоненциальному обогащению смеси молекулами ДНК-мишени. Обычно проводят 15 – 23 и более циклов ПЦР, при этом количество ДНК становится достаточным для определения его визуально.
Регистрацию результатов амплификации в подавляющем большинстве проводят методом электрофоретического разделения ПЦР-смеси на агарозном или полиакриламидном геле, окрашенным бромистым этидием. Специфичность полосы амплифицированной ДНК подтверждается её положением (размерами) по отношению к маркерам и стандартным образцам. Дополнительные доказательства специфичности амплификона можно получить путём расщепления рестриктазными ферментами или путём гибридизации с радиоактивным или флюоресцентным олигонуклеотидным зондом, что нашло применение при количественной модификации метода [25].
Поскольку чувствительность ПЦР может достигать математически возможного предела (детекции одной молекулы искомой ДНК1), то существует высокая вероятность получения ложноположительного результата из-за переноса через предметы и реагенты как самой ДНК-матрицы, так и
1 Jankiewicz с соавторами (1999) определили теоретический предел обнаружения ГМО, который составил 0,005% (30 копий гаплоидного генома гербицидоустойчивых соевых бобов или 9 копий генома кукурузы, устойчивой к насекомым-вредителям). На практике предел обнаружения в 20 раз меньше и соответствует 0,1% (596 и 185 копий трансгенной сои и кукурузы соответственно).
93
продуктов ПЦР (амплификонов), получаемых в больших количествах во многих пробирках в течение ежедневной работы. В этой связи к планировке и режиму работы ПЦР-лаборатории и были разработаны специальные требования [21].
ДНК, выделенная из продуктов питания, может быть недостаточно хорошо очищена от таких компонентов, как липиды, полисахариды или полифенолы. Кроме того, на последнем этапе выделения ДНК нужно тщательно удалить все ингредиенты используемых ранее растворов, поскольку Taq-полимераза, основной компонент в ПЦР, ингибируется полисахаридами, ЭДТА, фенолом и другими реагентами, применяемыми при выделении ДНК. На практике мы неоднократно наблюдали нехарактерные, неидентифицируемые полосы в электрофоретическом геле при анализе мясных фаршей. По всей видимости, значительное количество ДНК животного происхождения ингибировало ДНК сои, которая по ряду косвенных признаков содержалась в этом фарше [48]. Необходимо отметить, что точность метода и предел обнаружения зависят от конкретных последовательностей ДНК, выбранных для анализа. Несомненно, что непосредственно растительное сырьё анализировать легче, чем продукты питания.
Чувствительность качественной ПЦР, то есть стандартизированного по ГОСТ Р 52173-2003 метода определения ГМО на уровне есть/нет составляет 0,1%. Таким способом определяются любые дозы ГМО, превышающие указанный порог. Но подлежит ли продукция при этом обязательной маркировке или нет, вводится ли потребитель в заблуждение относительно состава продукта, сказать нельзя, так как неизвестно, сколько именно генетически изменённого материала в продукте [47]. Соответственно перед экспертами стоит задача не только доказывать присутствие трансгенов в пробе, что уже поставлено на поток в 35 аккредитованных российских лабораториях, но и отвечать на вопрос об их количестве. Поэтому 2004 г. было принято решение об укомплектовании территориальных управлений Роспотребнадзора необходимым оборудованием и о подготовке специалистов для проведения количественного метода определения ГМО как об одном из приоритетных направлений развития современной аналитической базы пищевой промышленности.
Сложность получения точной количественной информации является главным недостатком ПЦР-метода. Если эффективность реакции для каждого цикла амплификации оставалась бы постоянной, концентрация ДНК после ПЦР была бы пропорциональна количеству матрицы. К сожалению, эффективность амплификации меняется даже в рамках одной реакции, поэтому невозможно теоретически рассчитать ожидаемое количество, а наличие полосы при электрофоретическом разделении никак невозможно оценить количественно.
94
Одним из первых методов, позволяющих количественно определять содержание ДНК, стал количественный конкурентный ПЦР-анализ. Требуя минимального оборудования, необходимого при постановке качественной ПЦР, для определения ГМО он не прижился вследствие весьма трудоёмкой работы при детекции результатов.
На сегодняшний день наиболее приемлемым для контроля пищевых продуктов методом, хорошо апробированным в странах ЕС, является полимеразная цепная реакция в режиме реального времени (Real Time PCR). В его основе лежит определение выхода продукции после каждого цикла амплификации, построение по этим данным кинетической кривой и последующий ее анализ. С целью успешной реализации данного метода в Российской Федерации были утверждены методические указания МУК 4.2.191304 «Методы количественного определения генетически модифицированных источников (ГМИ) растительного происхождения в продуктах питания».
Поставляемая в Россию лабораторная база представлена тремя модификациями метода, различающимися по типу амплификатора и по способу обработки информации (совместимому программному обеспечению) (таблица
16).
Таблица 16 – Амплификаторы для количественного определения ГМО в пищевых продуктах
Наименование |
Производитель |
Программное обеспечение |
|
амплификатора |
|||
|
|
||
RotorGene 2000 и 3000 |
«Corbett Research» (Австралия) |
Rotor-Gene 6, ГМИ-квант (на базе |
|
|
|
MS Exсel) |
|
iCycler |
«Bio-Rad» (США) |
iCycler, ГМИ-квант (на базе MS |
|
|
|
Exсel) |
|
ABI-PRISM 7000 |
«Applied Biosistems» (США) |
ABI-PRISM 7000, ГМИ-квант (на |
|
|
|
базе MS Exсel) |
Реакционная среда метода включает две независимые системы для ПЦР, содержащие праймеры и меченый флуоресцентными красителями зонд. С помощью первой системы выявляют 35S промотор-последовательность, характерную, в частности, для трансгенной сои.
Ключевой для количественного анализа является вторая система. Она определяет ген, специфичный как для трансгенной, так и для нативной сои, что позволяет доказать факт наличия сои в продукте, например, там, где заявлено отсутствие соевых
95
ингредиентов. Однако, поскольку качественный метод обладает подобной же возможностью, для обнаружения растительных белковых добавок в составе пищевых продуктов рекомендуется применять именно его как более доступный.
Первый этап при количественной ПЦР (выделение ДНК), аналогичен таковому при постановке качественного метода. Различия в методиках начинаются на участке амплификации. Необходимо самостоятельно вносить в пробирки в строго определённых пропорциях, в зависимости от количества реакций, ПЦР-смесь (праймеры и нуклеотиды), термостабильную ДНКполимеразу и флюоресцентный ПЦР-буфер. Крышки пробирок должны быть оптически прозрачными. Помимо этого, для количественного определения ГМИ необходимы калибровочные стандарты 0,1%, 1% и 5%. В качестве них рекомендовано использовать сертифицированный материал – стандарты ГМИ, выпускаемые Институтом контрольных материалов и методов
(Institute for Reference Materials and Methods, Бельгия).
Этап амплификации является полностью автоматизированным и требует от специалиста только навыков обращения с компьютером. Он также включает в себя и обработку полученных результатов. Детекция полученной информации, как при качественном или конкурентном количественном методах, основанная на электрофорезе с применением токсичного красителя, не требуется.
Относительное количество ГМО определяют с использованием калибровочной прямой, импортируя столбцы с данными из специализированной программы Rotor-Gene 6, iCycler или ABI-PRISM 7000 в книгу Microsoft Exсel. Метод с точностью до 0,1% позволяет установить содержание ГМИ в продукте в диапазоне от 0,1% до 5%,
96
допуская получение значений «содержание ГМИ менее 0,1%» и «содержание ГМИ более 5%».
Мы полагаем, что на данном этапе для решения проблем, связанных с фальсификацией, этого достаточно. Так, установленный законодательными системами разных стран барьер для маркировки продукции, содержащей ГМИ, не превышает 5% (до 2004 года такой уровень был установлен и в РФ).
Наиболее вероятной ошибкой количественного метода являются , как и при постановке качественной ПЦР, ложноположительный результат, возникающий вследствие контаминации на различных стадиях жизненного цикла товара. Дополнительно к этому программа ГМИ-квант автоматически рассчитывает коэффициент корреляции. Если он составляет менее 0,97, рекомендуется переставить опыт с этапа амплификации. Помимо этого, программа не анализирует пробу, если в ней крайне низкое содержание ДНК, не позволяющее выявить 35S промотор.
Таким образом, несмотря на недостаточную апробацию метода Real Time ПЦР в отечественных лабораториях, считаем, что в ближайшем будущем он станет неотъемлемым элементом анализа безопасности пищевых продуктов на российском рынке.
97
Список использованных источников
1Алешков, А. В. Генетически модифицированные источники на региональном рынке пищевых продуктов / А. В. Алешков, А. И. Окара, Т. К. Каленик // Хранение и переработка сельхозсырья. 2008. № 5. С. 43 – 45.
2Алешков, А. В. Маркетинг поликомпонентных полуфабрикатов : региональный аспект / А. В. Алешков // Региональный рынок товаров и услуг : инновационные технологии и организация бизнеса : материалы международной научно-практической конференции. – Хабаровск : РИЦ ХГАЭП, 2008. – С. 209 –
212.
3Алешков, А. В. Нормативное и информационное обеспечение продукции, содержащей генноинженерномодифицированные организмы / А. В. Алешков, А. И. Окара // Пищевые биотехнологии : проблемы и перспективы в XXI веке : сб. материалов III Международного симпозиума. – Владивосток : ТГЭУ, 2008. С. 221 – 224.
4Анисимова, О. В. Разработка подходов к организации и проведению гигиенического контроля за оборотом пищевой продукции, полученной из генноинженерномодифицированных организмов : автореф. дис. … канд. мед. наук / О. В. Анисимова. – М., 2009. – 25 с.
5Баев, А. А. О времени и о себе. Автобиография / А. А. Баев. Comprehensive Biochemistry, Vol. 38. Amsterdam; Elsevier, 1995.
6Баранов, А. С. ГМО – главное не торопиться / А. С. Баранов // Методы оценки соответствия. 2006. № 10 (4). С. 4 – 6.
7Генетика как научный фундамент биотехнологии // http://afonin-59- bio.narod.ru/2_heredity/2_heredity_lec/2_heredity_lec.htm
8Тутельян, В. А. Генетически модифицированные источники пищи : оценка безопасности и контроль / В. А. Тутельян. – М. : РАМН, 2007 – 444 с.
9Гигиенические требования безопасности и пищевой ценности пищевых продуктов // Санитарно-эпидемиологические правила и нормативы СанПиН 2.3.2.1078-01 : утв. Главным государственным санитарным врачом РФ 6 ноября 2001 г. (с изм. от 31 мая 2002 г., 20 августа 2002 г., 15 апреля 2003 г., 25 июня 2007 г., 18 февраля, 5 марта, 21 мая, 16 июля, 1, 10 октября, 11 декабря 2008 г.) // СПС «Гарант».
10ГМО : Фундаментальные основы возможных экологических рисков. Опять штанга! // http://www.cbio.ru (дата обращения 05.06.2010 г.)
98
11 Тутельян, В. А. Госсанэпиднадзор за безопасностью продукции, полученной с использованием генноинженерномодифицированных организмов растительного (ГМО) происхождения. Методы лабораторного контроля : учеб.-метод. пособие для послевузовского образования специалистов Роспотребнадзора / В. А. Тутельян, Б. П. Суханов, М. Г. Керимова. – М. : Медицина для всех, 2007. – 128 с.
12 ГОСТ Р 52173-2003 Сырьё и продукты пищевые. Метод идентификации генетически модифицированных источников (ГМИ) растительного происхождения.
13 ГОСТ Р 52173-2003 Сырьё и продукты пищевые. Метод идентификации генетически модифицированных источников (ГМИ) растительного происхождения.
14 ГОСТ Р 52174-2003 Биологическая безопасность. Сырьё и продукты пищевые. Метод идентификации генетически модифицированных источников (ГМИ) растительного происхождения с применением биологического микрочипа.
15 ГОСТ Р 52174-2003 Биологическая безопасность. Сырьё и продукты пищевые. Метод идентификации генетически модифицированных источников (ГМИ) растительного происхождения с применением биологического микрочипа.
16 ГОСТ Р 53214-2008 (ИСО 24276:2006) Методы анализа для обнаружения генетически модифицированных организмов и полученных из них продуктов. Общие требования и определения.
17 ГОСТ Р 53214-2008 (ИСО 24276:2006) Методы анализа для обнаружения генетически модифицированных организмов и полученных из них продуктов. Общие требования и определения.
18 ГОСТ Р 53244-2008 (ИСО 21570:2005) Методы анализа для обнаружения генетически модифицированных организмов и полученных из них продуктов. Методы, основанные на количественном определении нуклеиновых кислот.
19 Елисеева, Л. Г. Анализ перспектив развития рынка пищевых продуктов, содержащих ГМ-источники / Л. Г. Елисеева, А. В. Рыжакова, Н. В. Ласькова // Управление торговлей : теория, практика, инновации : материалы II Международной научно-практической конференции, посвящённой 50летию кафедр товароведения, товарного консалтинга и аудита, коммерции и технологии торговли Российского университета кооперации. – М. :
Дашков и К°, 2009. – С. 82 – 84.
99
20 Зоны, свободные от ГМО. Опыт России / под ред. В. Б. Копейкиной. – Йошкар-Ола : Реклайн, 2008 – 56 с.
21Иванова, М. М. Современные методы ДНК-диагностики : лекция / М. М. Иванова. – М. : МГАВМиБ им. К.И. Скрябина, 1997. – 20 с.
22Игнатьев, И. Генетически модифицированные организмы и обеспечение биологической безопасности / И. Игнатьев, И. Тромбицкий, А. Лозан. – Кишинёв : Экоспектр-Бендеры, 2007. – 60 с.
23Каленик, Т. К. Товароведение и экспертиза пищевой продукции, полученной из генетически модифицированных источников. Качество и безопасность : учеб. пособие / Л. Н. Федянина, Т. В. Танашкина. – Владивосток : ТГЭУ, 2006. – 192 с.
24Картахенский протокол по биобезопасности к Конвенции о биологическом разнообразии. Монреаль, 29 января 2000 г. // URL: http://www.bellona.ru/Casefiles/kartahen (дата обращения 13.04.2010 г.)
25Комарова, И. Н. Полимеразная цепная реакция – современный метод выявления фальсификаций мясного сырья и продуктов / И. Н. Комарова, И. Г. Серегин, А. Ф. Валихов // Мясная индустрия. 2004. № 2. С.
37 – 41.
26Кочетов, А. В. Генная инженерия и растения // Природа. № 6. 2007.
27Кузнецов, В. В. Биобезопасность генетически модифицированных организмов : проблемы и решения // В сб. : На пути к устойчивому развитию России. 2008. С. 17 – 20.
28Леонов, Г. Б. Маркировка пищевых продуктов (некоторые аспекты правового регулирования) // Законодательство. 2009. № 7. С. 21 – 24.
29Международный стандарт ИСО 21569-2005 Продукты пищевые. Методы анализа, предназначенные для обнаружения генетически модифицированных организмов и полученных из них продуктов. Методы, основанные на качественном определении нуклеиновых кислот.
30Международный стандарт ИСО 21570-2005 Продукты пищевые. Методы анализа, предназначенные для обнаружения генетически модифицированных организмов и полученных из них продуктов. Методы, основанные на количественном определении нуклеиновых кислот.
31Международный стандарт ИСО 21571-2005 Продукты пищевые. Методы анализа, предназначенные для обнаружения генетически модифицированных организмов и полученных из них продуктов. Экстракция нуклеиновых кислот.
100
32 Международный стандарт ИСО 21572-2005 Продукты пищевые. Методы анализа, предназначенные для обнаружения генетически модифицированных организмов и полученных из них продуктов. Методы, основанные на определении белков.
33 МУ 2.3.2.1917-04 Порядок и организация контроля за пищевой продукцией, полученной из/или с использованием сырья растительного происхождения, имеющего генетически модифицированные аналоги : методические указания. – М. : Федеральный центр Госсанэпиднадзора Минздрава России, 2004.
34 МУ 2.3.2.2306-07 Медико-биологическая оценка безопасности генноинженерномодифицированных организмов растительного происхождения. – М. : Федеральный центр Госсанэпиднадзора Минздрава России, 2007.
35 МУК 4.2.1902-04 Методы количественного определения генетически модифицированных источников (ГМИ) растительного происхождения методом полимеразной цепной реакции : методические указания по контролю. – М. : Федеральный центр Госсанэпиднадзора Минздрава России,
2004.
36 МУК 4.2.1913-04 Методы количественного определения генетически модифицированных источников (ГМИ) растительного происхождения в продуктах питания : методические указания по контролю. – М. : Федеральный центр Госсанэпиднадзора Минздрава России, 2004.
37 О государственном регулировании в области генно-инженерной деятельности : ФЗ от 5 июля 1996 г. №86-ФЗ (в ред. от 12 июля 2000 г.) // СПС «Консультант плюс».
38 О дополнительных мерах по обеспечению качества и безопасности пищевых продуктов, информированию потребителей в городе Москве : постановление правительства г. Москвы от 13 февраля 2007 г. № 88-ПП // СПС «Гарант».
39 О надзоре за оборотом пищевых продуктов, содержащих ГМО : постановление Главного государственного санитарного врача РФ от 30 ноября 2007 г. № 80 // СПС «Гарант».
40 О порядке проведения санитарно-эпидемиологической экспертизы пищевой продукции, полученной из генетически модифицированных источников : постановление Главного государственного санитарного врача Российской Федерации № 14 от 8 ноября 2000 г. // СПС «Гарант».
101
41О санитарно-эпидемиологической обстановке в Российской Федерации в 2008 году: Государственный доклад. - М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2009. - 467 с.
42О совершенствовании надзора за пищевыми продуктами, содержащими ГМО и ГММ // Письмо Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека от 20 августа 2008 г. N 01/9044-8-32 // СПС «Гарант».
43Об усилении надзора за пищевыми продуктами, содержащими ГМО : постановление главного государственного санитарного врача по Тамбовской области от 7 марта 2007 г. № 2 // СПС «Гарант».
44Об усилении надзора за пищевыми продуктами, содержащими ГМО : постановление главного государственного санитарного врача по г. СанктПетербургу от 23 марта 2007 г. № 5 // СПС «Гарант».
45Образцов, П. Франкенштейн отменяется? // URL: http://www.izvestia.ru/science/article3132081 (дата обращения 18.02.2010 г.).
46Окара, А. И. Качество мясосодержащих полуфабрикатов с включением трансгенных соевых текстуратов / А. И. Окара, А. В. Алешков, Т. К. Каленик // Мясная индустрия. 2009. № 2. – С. 58 – 60.
47Окара, А. И. Real Time ПЦР – перспективный метод контроля генетически модифицированных объектов / А. И. Окара, А. В. Алешков, И. П. Кольцов, Т. К. Каленик // Методы оценки соответствия. 2007. № 6. С. 29 – 32.
48Окара, А. И. Генетически модифицированные ингредиенты в мясных продуктах : декларация и реальность / А. И. Окара // Мясная индустрия. 2006. № 5. С. 22 – 24.
49Опасные, содержащие ГМИ, не соответствующие качеству продукты : список ОАГБ // URL: www.geneticsafety.org (дата обращения 10.05.2010 г.).
50Официальный сайт Общероссийской ассоциации генетической безопасности // URL: www.oagb.ru (дата обращения 15.06.2010 г.).
51Патрушев, М. В. Генетически модифицированные источники пищи : введение в проблему анализа / М. В. Патрушев, М. В. Возняк, В. М. Возняк // Партнёры и конкуренты. 2004. № 6. С. 13 – 21.
52Патрушев, М. В. Генномодифицированный «психоз» / М. В. Патрушев, М. В. Возняк // Методы оценки соответствия. 2008. № 10. С. 21
–28.
53Патрушев, Л. И. Искусственные генетические системы / Л. И. Патрушев. – М. : Наука, 2004. Т. 1.
102
54 Сайт международного социально-экономического союза // URL: http://www.seu.ru/cci/campaign/gen/vnsoh.htm (дата обращения 25.03.2010 г.).
55 Сельскохозяйственная биотехнология : векторные системы молекулярного клонирования / пер. с англ. Г. И. Эйснер; под ред. и предисл. В. И. Негрука. – М. : Агропромиздат, 1991. – 534 с.
56Сергеев, Ю. Д. Генномодифицированные организмы, пища и корма
взаконодательстве Европейского союза / Ю. Д. Сергеев, Ю. Р. Храмова, И. Г. Галь // В сб. : Научные труды II Всероссийского съезда (Национального конгресса) по медицинскому праву. – М., 2005.
57Сингер, М. Гены и геномы / М. Сингер, П. Берг. – М. : Мир, 1998.
58Спейерс, Г. Проблемы и возможности оценки безопасности новых пищевых продуктов / Г. Спейерс // Вопросы питания. 2002. № 1. С. 40 – 41.
59Тутельян, В. А. Медико-биологическая оценка безопасности белкового концентрата, полученного из генетически модифицированной сои / В. А. Тутельян, Л. В. Кравченко, Н. В. Лашнева // Вопросы питания. 1999. № 5 – 6. С. 9 – 12.
60Тутельян, В. А. Мониторинг оборота пищевой продукции из генетически модифицированных источников в Москве / В. А. Тутельян // Вопросы питания. 2003. № 3. С. 20 – 23.
61Тышко, Н. В. ГМИ пищи : создание, мировое производство / Н. В. Тышко // Пищевая промышленность. 2003. № 6. С. 6 – 11.
62Цыдендамбаев, В. Д. ГМО : фундаментальные основы возможных экологических рисков // Методы оценки соответствия. 2008. № 2. С. 14 – 18.
63Шульгин, Ю. П. Ускоренная биотис-оценка качества и безопасности сырья продуктов из водных биоресурсов : монография / Ю. П. Шульгин, Л. В. Шульгина, В. А. Петров. – Владивосток. : ТГЭУ, 2006. – 124 с.
64Реестры Роспотребнадзора и сан.-эпид. службы России // URL: http://fp.crc.ru/ (дата обращения 01.06.2010 г.).
65A 90-day toxicology study of transgenic lysine-rich maize grain (Y642) in Sprague-Dawley rats., Food Chem Toxicol., 2008, Dec 6.
66The impact of genetic modification on agriculture, food and health. An interim statement. British Medical Association: London. 1999.
67Bøhn T., Primicerio R., Hessen D.O., Traavik T. (2008) Reduced Fitness of Daphnia magna Fed a Bt-Transgenic Maize Variety. Arch. Environ. Contam. Toxicol. 55:584-92.
68Botanical center of Moscow State Univercity (http://herba.msu.ru).
103
69 Brenner C., 2004. Telling Transgenic Technology Tales: Lessons from the Agricultural Biotechnology Support Project (ABSP) Experience. International Service for the Acquisition of Agri-Biotech Applications. ISAAA Briefs No. 31 – 2004.
70 Chassy B.M., Giddings L.V, McHughen A., Moses V. Response to GM soybeans – revisiting a controversial format // Nature Biotechnology 25, 1356 - 1358 (2007).
71 Decourtye A.; Armengaud C., Renouc M.; Devillers J.; Cluzeau S.; Gauthier M. and Pham-Delègue M-H. (2004) Imidacloprid impairs memory and brain metabolism in the honeybee (Apis mellifera L.). Pesticide Biochemistry and Physiology 78: 83-92.
72 Federal Court of Appeal of Canada. Monsanto Canada Inc. v. Schmeiser (C.A.) [2003] 2 F.C. 165. Retrieved 25-Mar-2006.
73 Felsot A. 2000 Herbicide Tolerant Genes. Pt. 1: Squaring Up Roundup Ready Crops. Agrichemical and Environmental News, September, Is.173 (http://www.aenews.wsu.edu.
74Fernandez-Cornejo, J. & Caswell. April 2006. Genetically Engineered Crops in the United States. USDA/ERS Economic Information Bulletin n. 11.
75Fintan WTO Rules Europe Must Accept GM Foods) (8 февраля 2006, 15:29).
76Freese W. and Schubert D. November 2004. Safety Testing and Regulation of Genetically Engineered Foods, in Biotechnology and Genetic Engineering Reviews, Vol. 21, pp. 299-324.
77Gaskell et al. 2006. Europeans and Biotechnology in 2005: Patterns and Trends. Eurobarometer 64.3.
78Gianessi, L.P., April 2000. Agriculture Biotechnology: Benefits of Transgenic Soybeans.National Center for Food and Agricultural Policy, p. 63.
79Gurr S.J., Rushton P.J. // Trends Biotechnol. 2005. №23. Р.275-282.
80Hardell L., Eriksson M. A 1999 Case-Control Study of Non-Hodgkin Lymphoma and Exposure to Pesticides, CANCER, vol.85, No.6, pр.1353–1360.
81Hilbeck A. and Schmidt J.E.U. (2006) Another View on Bt Proteins – How Specific are They and What Else Might They Do? Biopestic. Int. 2: 1-50.
82ISAAA Brief 39-2008: Executive Summary. Global Status of Commercialized Biotech/GM Crops: 2008, The First Thirteen Years, 1996 to 2008. - International Service for the Acquisition of Agri-BiotechApplications.
83ISI News no. J1/12 — Europe's Rules Could Sink All GMOs.
84Lang A. and Vojtech E. (2006) The effects of pollen consumption of transgenic Bt maize on the common swallowtail, Papilio machaon L. (Lepidoptera, Papilioni). Basic and Applied Ecology 7: 296-306.
104
85 Losey J.E. Rayor L.S.; Carter M.E. Transgenic pollen harms monarch larvae Nature 399: 214. 1999.
86 Lövei G.L. and Arpaia S. The impact of transgenic plants on natural enemies: a critical review of laboratory studies. Entomologia Experimentalis et Applicata 114: 1-14. 2005.
87 Miller H.I. 1983. Report on the World Health Organization Working Group on Health Implications of Biotechnology. Recomb. DNA Tech. Bull., vol.6, #2 pp.65 – 66; Petricciani J.C. 1983. An overview of safety and regulatory aspects of the new biotechnology. Regul. Toxicol. Pharmacol. vol. 3 , #4, pp.428 – 433.
88 Modern food biotechnology, human health and development: an evidencebased study ©World Health Organization 2005 отчет ФАО.
89 Office of Science and Technology Policy. 1986. Coordinated framework for regulation of biotechnology: announcement of policy and notice for public comment. U.S. Fed. Reg. Vol. 51, 23302 – 23350.
90 Oldroyd B. (2007) What's Killing American Honey Bees? PLoS Biol 5(6). 91 Ramirez-Romero R.; Desneux N.; Decourtye A.; Chaffiol A.; Pham-Delègue M.H. (2008)Does Cry1Ab protein affect learning performances of the honey bee
Apis mellifera L. (Hymenoptera, Apidae)? Ecotoxicol Environ Saf. 70:327-33.
92 Rosi-Marshall, E.J.; J. L. Tank; T. V. Royer; M. R. Whiles; M. EvansWhite; C. Chambers; N. A. Griffiths; J. Pokelsek and M. L. Stephen (2007) Toxins in transgenic crop byproducts may affect headwater stream ecosystems. Proc Natl Acad Sci USA 104: 16204 – 16208.
93 Warwick S.I., Légère A., Simard M.-J., James T. Do escaped transgenes persist in nature? The case of an herbicide resistance transgene in a weedy Brassica rapa population //Molecular Ecology. 2008. March.
94 Sabugosa-Madeira B.; Abreu I.; Ribeiro H. and Cunha M. (2007) Bt transgenic maize pollen and the silent poisoning of the hive Journal of Apicultural Research 46: 57-58.
95 Sambrook J., Russel D. W. Molecular Cloning, 3rd ed / CSH Laboratory Press, Cold Spring Harbor, NY, 2001.
96 Schmidt J.E.; Braun C.U.; Whitehouse L.P.; Hilbeck A. Effects of Activated Bt Transgene Products (Cry1Ab, Cry3Bb) on Immature Stages of the Ladybird Adalia bipunctata in Laboratory Ecotoxicity Testing. Arch Environ Contam Toxicol. 2008 Aug 20).
97 Times Higher Education Официальный сайт http://english.chosun.com.
98 Truth About Trade & Technology Modified Food's Moment? truthabouttrade.org (25 февраля 2009).
99 URL: http://pomorinfoeco.net.ru/ (дата обращения 25.03.2010 г.).
100 URL: http://www.croptrust.org/documents (дата обращения 12.12.2009 г.).
105
101 URL: http://www.fibkh.serpukhov.su (дата обращения 14.05.2010 г.). 102 URL: http://www.gmwatch.org (дата обращения 09.03.2010 г.).
103 URL: http://www.harrisinteractive.com / (дата обращения 25.03.2010 г.).
104URL: www.gmo-compass.org (дата обращения 13.12.2009 г.).
105URL: www.timeshighereducation.co.uk (дата обращения 07.04.2010 г.).
106Viladesau Palau, T., 2005. Soja Transgenica, Monsanto y Derechos Humanos en Paraguay in Vernet, E. (ed.), Observatorio de los Agronegocios, por una Agricultura Humana. Hoja Informativa. Ano 1, Edicion 001.
Приложения
Приложение А
Методика качественного определения генно-инженерно- модифицированных организмов в растительном сырье и пищевых продуктах, содержащих сою или кукурузу, методом полимеразной
цепной реакции с использованием набора реагентов «АмплиСенс ПЛАНТ-СКРИН»
Цель работы: выявление методом полимеразной цепной реакции (ПЦР) в растительном материале и продуктах его переработки последовательности промотора 35S, присутствие которой свидетельствует о генетической модификации генома сои или кукурузы. В ходе анализа также используются праймеры для амплификации генов сои и кукурузы, что позволяет контролировать наличие в образце ДНК этих растений.
Для проведения лабораторной работы используют тест-систему «АмплиСенс ПЛАНТ-СКРИН», включающую три комплекта реагентов:
 «ДНК-сорб-С» для выделения ДНК из образцов продуктов питания или растительного сырья;
«ДНК-сорб-С» для выделения ДНК из образцов продуктов питания или растительного сырья;
 «АмплиСенс-50-R» для амплификации участка последовательности промотора 35S, а также для амплификации генов сои и кукурузы;
«АмплиСенс-50-R» для амплификации участка последовательности промотора 35S, а также для амплификации генов сои и кукурузы;
 «ЭФ-200» для электрофоретичеcкого анализа амплифицированной ДНК. Не допускается использовать реактивы с истекшим сроком годности.
«ЭФ-200» для электрофоретичеcкого анализа амплифицированной ДНК. Не допускается использовать реактивы с истекшим сроком годности.
Методы отбора образцов
Материалом для проведения исследования служат:
-соевая мука-сырьё, концентрат соевого белка;
-мясные продукты, приготовленные с добавлением сои (фарш, варёные колбасы, сосиски, сардельки и т.д.);
-продукты, изготовленные из сои (колбаса соевая, паштет соевый, азу соевое, котлеты соевые и др., творог соевый, молоко соевое, соевые сухие напитки, сыр соевый, шоколад, детское питание (заменители женского молока на основе соевого белка));
106
-кукурузная крупа, кукурузная мука, печенье из кукурузной муки, детское питание на основе каш из кукурузной муки;
-другие продукты по указанию преподавателя.
От партии сырья или сыпучих продуктов отбирают общую пробу следующим образом:
-от исследуемой партии сырья или сыпучих продуктов отбирают не менее 10 образцов проб (по 5 – 10 г) в одноразовый плотный полиэтиленовый пакет размером 20х30 см с использованием одноразовых хирургических перчаток и перемешивают, формируя общую пробу (50 – 100 г);
-из общей пробы отбирают среднюю пробу в 10 – 20 г, помещают в полиэтиленовый пакет с застёжкой-молнией размером не более 10х15 см, который, в свою очередь, помещают в одноразовый плотный полиэтиленовый пакет размером 20х30 см, опечатывают и отправляют на анализ.
От партии продуктов плотной консистенции отбирают общую пробу весом 10 – 50 г в одноразовый плотный полиэтиленовый пакет с застёжкой-молнией размером не более 10x15 см, используя одноразовые перчатки и фламбированные (выдержанные в 96% этаноле и обожжённые
впламени газовой горелки) инструменты, опечатывают и отправляют на анализ.
Пробы жидких продуктов отбирают в чистые ёмкости из стекла или пластика с герметично закрывающимися крышками объёмом не более 50 мл, опечатывают и отправляют на анализ.
Пробоподготовка
Для подготовки проб необходимо использовать одноразовые полипропиленовые пробирки, ступки и пестики, предварительно обработанные хромовой смесью и фламбированные пинцеты, скальпели и ножницы.
Пробы сухих гранулированных и сыпучих продуктов отбирают в ступку по 3 – 5 г и растирают пестиком до гомогенного состояния. Для анализа необходимо 10 – 30 мг образца.
Пробы плотных продуктов (сырых или подвергшихся кулинарной обработке) весом 3 – 5 г помещают в ступку, измельчают ножницами, затем растирают пестиком до гомогенного состояния. Для анализа необходимо 10 – 30 мг образца.
Пробы продуктов консистенции крахмала весом 10 – 30 мг помещают в одноразовые пластиковые пробирки и добавляют 0,1 мл физиологического раствора. Для анализа необходимо 50 мкл образца.
107
Пробы жидкой консистенции отбирают автоматическими пипетками с одноразовыми наконечниками в одноразовые пробирки из полипропилена. Для анализа необходимо 50 мкл образца.
Из полученных гомогенатов и суспензий проводят выделение ДНК.
Условия хранения обработанных проб образцов
Образцы сырья и продуктов рекомендуется хранить в течение 1 месяца (при необходимости повторного анализа) согласно условиям, указанным производителем продукта питания. Образцы скоропортящихся продуктов рекомендуется хранить в замороженном состоянии (при температуре минус 20 C) в течение 1 месяца (при необходимости повторного анализа).
Меры предосторожности
Анализ проводится в три этапа в трёх отдельных помещениях (зонах), согласно Методическим рекомендациям по проведению работ в диагностических лабораториях, использующих метод полимеразой цепной реакции, утвержденным в 1995 г. ГК СЭН.
1.Работать только в одноразовых перчатках, использовать и менять при каждой операции одноразовые наконечники для автоматических пипеток с аэрозольным барьером.
2.При работе с включенным трансиллюминатором необходимо пользоваться защитным экраном или специальной защитной маской, так как ультрафиолетовый свет вызывает ожоги лица и слизистой глаз.
3.Всё лабораторное оборудование, в том числе пипетки, штативы, лабораторная посуда, а также все рабочие растворы должны быть строго стационарными. Запрещается их перенос из одного помещения в другое. Студенты, работающие в комнате для детекции продуктов амплификации (зона 3), не должны посещать помещения для обработки клинического материала (зона 1) и проведения реакции ПЦР-амплификации (зона 2) без смены верхней одежды и перчаток. Смена верхней одежды, головных уборов, обуви и перчаток является обязательным условием при выходе из помещения для электрофореза.
4.Поверхности столов, а также помещения, в которых проводится постановка ПЦР, до начала и после завершения работ необходимо облучать ультрафиолетовым светом в течение 10 минут. В помещении желательно наличие кондиционера.
Материалы и оборудование для ПЦР-анализа
108
ЗОНА 1 – выделение ДНК из исследуемого материала. Требуются:
1.Настольный бокс с бактерицидной лампой (например, «Циклотемп» фирмы СП «РТС» (Россия)) или стерильный ламинарный шкаф (БОВ-001- АМС (г. Миасс, Россия)).
2.Термостат для пробирок типа «Эппендорф» на 25-100 °С (например, «ТЕРМО-24» фирмы «Биоком» (Россия)).
3.Микроцентрифуга для пробирок типа «Эппендорф» до 16000 g (например, фирмы «Elmi» (Латвия), фирмы «Hettish» (Германия)).
4.Центрифуга/вортекс (например «Micro-Spin» (Германия), «ТЭТА-2» фирмы «Биоком» (Россия)).
5.Вакуумный отсасыватель медицинский с колбой-ловушкой для удаления надосадочной жидкости (например, ОМ-1 (г. Ульяновск, Россия)).
6.Отдельный набор автоматических пипеток переменного объёма (например, фирмы «Ленпипет» (Россия)).
7.Отдельный халат и одноразовые резиновые перчатки.
8.Одноразовые полипропиленовые завинчивающиеся или плотно закрывающиеся микропробирки на 1,5 мл (например, фирмы «Axygen» (США)).
9.Штативы для микропробирок на 1,5 мл (например, фирмы «Хеликон» (Россия)) и наконечников (например, фирмы «Ленпипет» (Россия)).
10.Одноразовые наконечники для пипеток переменного объёма до 200 мкл и до 1000 мкл (например, фирмы «Ленпипет» (Россия)).
11.Одноразовые наконечники для пипеток переменного объёма с аэрозольным барьером до 200 мкл и до 1000 мкл (например, фирмы «Axygen» (США)).
12.Холодильник с отделениями на 2- 8 °С и от минус 18 до минус 20 °С.
13.Ёмкость с дезинфицирующим раствором.
14.Реактивы – комплект «ДНК-сорб-С»:
Реактив |
Описание |
Объём |
Кол-во (шт.) |
||
(мл) |
|||||
|
|
|
|
||
Буфер для лизирующего реагента |
Прозрачная бесцветная жидкость |
20 |
1 |
флакон |
|
|
|
|
|
|
|
Лизирующий реагент |
Прозрачная бесцветная жидкость |
0,85 |
1 |
пробирка |
|
|
|
|
|
|
|
Раствор для отмывки 1 |
Прозрачная бесцветная жидкость |
15 |
1 |
флакон |
|
|
|
|
|
|
|
Раствор для отмывки 2 |
Прозрачная бесцветная жидкость |
50,0 |
1 |
флакон |
|
|
|
|
|
|
|
Сорбент универсальный |
Суспензия белого цвета |
1,25 |
1 |
пробирка |
|
|
|
|
|
|
|
ТЕ-буфер для элюции ДНК |
Прозрачная бесцветная жидкость |
5,0 |
1 |
пробирка |
|
|
|
|
|
|
|
ОКО – отрицательный контрольный |
Прозрачная жидкость соломенно- |
1,6 |
|
1 пробирка |
|
образец) |
желтого цвета |
|
|||
|
|
|
|||
ЗОНА 2 – амплификация ДНК. Требуются:
1. Амплификатор (например «Терцик», фирмы «ДНК-технология»
(Россия), «GeneAmp PSR System 2700», фирмы Perkin Elmer (США)).
109
2.ПЦР-бокс или отдельный стол, освещаемый УФ-лампой (например, «Циклотемп», фирмы СП «РТС» (Россия)).
3.Отдельный набор автоматических пипеток переменного объёма (например, фирмы «Ленпипет» (Россия)).
4.Штативы для микропробирок на 0,5 мл (например, фирмы «Хеликон» (Россия)).
5.Одноразовые полипропиленовые микропробирки для ПЦР на 0,5 мл (например, фирмы «Axygen» (США)).
6.Одноразовые наконечники для микропипеток в штативах (например, фирмы «Хеликон» (Россия)).
7.Одноразовые наконечники с аэрозольным барьером до 200 мкл (например, фирмы «Axygen» (США))
8.Холодильник на 2 – 8 °С; морозильник на минус 20 °С для хранения выделенной ДНК.
9.Отдельный халат и одноразовые перчатки.
10.Ёмкость для сброса наконечников.
11.Реактивы – комплект «АмплиСенс-50-R»:
Реактив |
Описание |
Объём |
Кол-во (шт) |
|
(мл) |
||||
|
|
|
||
|
|
|
|
|
ПЦР-смесь-1 ПЛАНТ- |
Прозрачная бесцветная жидкость под |
0,005 |
55 пробирок |
|
СКРИН |
воском |
|||
|
|
|||
ПЦР-смесь-2 red |
Прозрачная жидкость красного цвета |
0,6 |
1 пробирка |
|
|
|
|
|
|
Минеральное масло |
Бесцветная вязкая жидкость |
2,0 |
1 пробирка |
|
|
||||
|
|
|
|
|
ПКО ДНК соя |
Прозрачная бесцветная жидкость |
0,1 |
1 пробирка |
|
|
||||
|
|
|
|
|
ПКО ДНК кукуруза |
Прозрачная бесцветная жидкость |
0,1 |
1 пробирка |
|
|
||||
|
|
|
|
|
ТЕ-буфер |
Прозрачная бесцветная жидкость |
0,5 |
1 пробирка |
|
|
||||
|
|
|
|
ЗОНА 3 – электрофоретический анализ амплифицированной ДНК. Требуются:
1.Камера для горизонтального электрофореза объёмом не более 600 мл (например, SE-2 фирмы «Хеликон» (Россия)).
2.Источник постоянного тока с напряжением 150 – 460 В (например, «Эльф-4» фирмы «ДНК– технология» (Россия)).
3.Ультрафиолетовый трансиллюминатор с кабинетом для просмотра гелей (например фирмы «Биоком» (Россия)).
4.Видеосистема с цифровой камерой для регистрации и передачи изображения (например, «Биотест-1» ЦНИИ Эпидемиологии (Россия),
фирмы «Biorad» (США)).
5.Аквадистиллятор.
6.Холодильник на 2 – 8 °С для хранения продуктов амплификации.
7.Микроволновая печь для плавления агарозы.
8.Колба коническая из термостойкого стекла для плавления агарозы на 250 мл.
9.Мерный цилиндр на 1 литр.
110

10.Штатив для микропробирок на 0,5 мл (например фирмы «Хеликон» (Россия)).
11.Отдельная автоматическая пипетка объёмом 10 – 40 мкл (например, «Ленпипет» (Россия)).
12.Одноразовые наконечники до 200 мкл в штативе (например, «Ленпипет» (Россия)).
13.Пластиковая ёмкость на 5 л для дезактивации буфера и гелей, содержащих бромид этидия.
14.Отдельный халат и одноразовые резиновые перчатки.
15.Реактивы – комплект «ЭФ-200»:
|
Реактив |
|
Описание |
Объем (мл), |
Кол-во (шт.) |
||
|
|
|
|
масса (г) |
|||
|
|
|
|
|
|
|
|
Трис-боратный |
буфер |
(ТБЕ) |
Прозрачная |
жидкость |
50 мл |
1 |
флакон |
концентрированный с бромидом этидия |
оранжевого цвета |
|
|||||
|
|
|
|
||||
Агароза для электрофореза ДНК |
|
Порошок белого цвета |
1,8 г |
2 |
пробирки |
||
|
|
|
|
|
|
|
|
Проведение анализа
ЭТАП 1. ВЫДЕЛЕНИЕ ДНК ИЗ ОБРАЗЦОВ МАТЕРИАЛА, ПОДГОТОВЛЕННЫХ К ИССЛЕДОВАНИЮ
Выделение ДНК проводится в ЗОНЕ 1 – помещении для обработки исследуемого материала по следующему алгоритму:
1.Буфер для лизирующего реагента и раствор для отмывки 1 (если они хранились при 2-8оС) прогреть при 64оС до полного растворения кристаллов.
2.Отобрать необходимое количество одноразовых пробирок, включая отрицательный контроль выделения ДНК. В пробирки, предназначенные для исследуемых проб, внести образцы исследуемых проб (см. «Предобработка проб образцов»). В пробирку отрицательного контроля выделения ДНК (ОК) внести 100 мкл отрицательного контрольного образца (ОКО).
3.Отдельными наконечниками с аэрозольным барьером внести в каждую пробирку по 400 мкл буфера для лизирующего реагента и по 17
мкл лизирующего реагента. Тщательно перемешать содержимое пробирок.
4.Инкубировать пробирки при 64оС в течение 1 часа, периодически встряхивая на вортексе (5 раз через каждые 10 – 12 мин).
5.Осадить нерастворённые частицы образцов центрифугированием при
(12 – 14) 103 об/мин. в течение 5 минут.
6.Надосадочную жидкость в объёме 200 – 350 мкл очень аккуратно (так, чтобы не попали взвешенные частицы и капли жира) отобрать отдельными наконечниками с аэрозольными барьерами и перенести в новые пробирки.
7.Пробы центрифугировать в течение 5 сек при 5 103 об/мин. на микроцентрифуге для сброса капель с крышки пробирок.
111

8.Тщательно ресуспендировать сорбент на вортексе. В каждую пробирку отдельным наконечником добавить по 25 мкл ресуспендированного сорбента. Перемешать на вортексе, оставить в штативе на 10 – 15 мин., перемешивая через каждые 2 минуты.
9.Осадить сорбент в пробирках центрифугированием при 5 103 об/мин. в течение 1 минуты. Удалить супернатант (надосадочную жидкость), используя вакуумный отсасыватель и отдельный наконечник для каждой пробы.
10.Добавить в пробы по 300 мкл раствора для отмывки 1, перемешать на вортексе до полного ресуспендирования сорбента. Осадить сорбент
центрифугированием при 5 103 об/мин. на микроцентрифуге в течение 1 минуты. Удалить супернатант, используя вакуумный отсасыватель и
отдельный наконечник для каждой пробы. |
|
||||
|
11. Добавить в пробы по 500 мкл раствора для отмывки 2, перемешать |
||||
на |
вортексе |
до |
полного |
ресуспендирования |
сорбента, |
процентрифугировать |
1 мин при |
(10 – 12) 103 об/мин. на |
|||
микроцентрифуге. Отобрать супернатант, используя вакуумный отсасыватель и отдельный наконечник для каждой пробы.
12. Повторить |
процедуру |
отмывки, |
следуя |
пункту |
11, |
отобрать |
супернатант полностью. |
|
|
|
|
|
|
13. Поместить |
пробирки в |
термостат |
64ºС |
на 5 – |
10 |
мин. для |
подсушивания сорбента. При этом крышки пробирок должны быть открыты.
14.В пробирки добавить по 50 мкл ТЕ-буфера для элюции ДНК.
Перемешать на вортексе. Поместить в термостат 64ºС на 5 – 8 мин., периодически (1 раз в минуту) встряхивая на вортексе.
15.Процентрифугировать пробирки при (12 – 14) 103 об/мин. в течение 1 мин. на микроцентрифуге. Супернатант содержит очищенную ДНК. Пробы готовы к постановке ПЦР.
Очищенную ДНК допускается хранить в течение 1 недели при
температуре от 2 до 8 С и в течение 1 года – при температуре минус 20 С.
ЭТАП 2. АМПЛИФИКАЦИЯ УЧАСТКА ДНК
Амплификация участка ДНК проводится в ЗОНЕ 2 – комнате для подготовки и проведения ПЦР-амплификации).
В комплекте реактивов для амплификации семейства применяется «горячий старт», который обеспечивается разделением нуклеотидов и Taqполимеразы прослойкой воска. Плавление воска и перемешивание реакционных компонентов происходит только при 95 °С, что значительно снижает количество неспецифически затравленных реакций. Последовательность действий следующая:
112
1.Отобрать необходимое количество пробирок с ПЦР-смесью-1 и воском для амплификации ДНК исследуемых и контрольных проб.
2.На поверхность воска внести по 10 мкл ПЦР-смеси-2 («верхней»), при этом ПЦР-смесь-2 не должна проваливаться под воск и смешиваться с ПЦР-смесью-1.
3.Сверху добавить по 1 капле масла для ПЦР (около 25 мкл).
4.Взять подготовленные для ПЦР пробирки. Под масло или непосредственно на масло, используя наконечники с аэрозольными барьерами, внести по 10 мкл ДНК, выделенной из исследуемых или контрольных проб этапа выделения ДНК.
5.Поставить контроли этапа амплификации:
а) отрицательный контроль (К-): вместо ДНК-пробы внести в подготовленную пробирку 10 мкл ТЕ-буфера;
б) положительный контроль (K+ соя): в подготовленную для ПЦР пробирку внести 10 мкл ПКО ДНК соя;
в) положительный контроль (K+ кукуруза): в подготовленную для ПЦР пробирку внести 10 мкл ПКО ДНК кукуруза;
6. Запустить на амплификаторе нужную программу, в зависимости от его типа (таблица).
Таблица 1 – Программы для амплификации
|
Амплификаторы с |
|
Амплификаторы с активным |
Амплификатор с активным |
|||||||
|
регулированием |
|
регулированием (по объему |
регулированием (по объему |
|||||||
|
температуры по матрице |
раствора в пробирке): |
раствора в пробирке): |
||||||||
|
(скорость нагрева- |
«GeneAmp PCR System 2400» |
«GeneAmp PCR System 2700» |
||||||||
|
охлаждения не менее |
(Applied Biosystems), «Терцик» |
|
(Applied Biosystems) |
|||||||
цикл |
1оС/сек): «MiniCycler», |
(ДНК-технология) |
|
|
|
|
|||||
|
«PTC-100» (MJ Research), |
|
|
|
|
|
|
|
|||
|
|
Biometra |
|
|
|
|
|
|
|
|
|
|
температ |
|
|
цикл |
температ |
|
|
темп |
|
|
|
|
время |
|
время |
циклов |
ерату |
|
время |
циклов |
|||
|
ура |
|
ов |
ура |
|
||||||
|
|
|
|
|
ра |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
0 |
95оС |
пауза |
|
95оС |
пауза |
|
93оС |
|
пауза |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
95оС |
2 минуты |
|
1 |
95оС |
2 минуты |
1 |
93оС |
|
2 минуты |
1 |
2 |
95оС |
1 минута |
|
42 |
95оС |
10 секунд |
42 |
93оС |
|
10 секунд |
42 |
|
60оС |
1 минута |
|
|
60оС |
10 секунд |
|
61оС |
|
25 секунд |
|
|
72оС |
1 минута |
|
|
72оС |
10 секунд |
|
72оС |
|
25 секунд |
|
3 |
72оС |
1 минута |
|
1 |
72оС |
1 минута |
1 |
72оС |
|
1 минута |
1 |
4 |
10оС |
Хранение |
|
10оС |
Хранение |
|
4оС |
|
Хранение |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Программа запускается на подключенном к амплификатору персональном компьютере, по заранее написанному специалистами лаборатории алгоритму, который должен быть проверен по таблице до начала амплификации. До снятия программы с паузы необходимо также убедиться, что будет запущен именно требуемый блок амплификатора
113

(блоки амплификатора помечены цифрами от 1 до 4, соответственно в программе данные выставляются также по четырём блокам).
7. Когда температура в ячейке амплификатора достигнет 95 С (93 С – при использовании амплификатора «GeneAmp PCR System 2700», Perkin Elmer), необходимо поместить пробирки в ячейки амплификатора, закрыть крышку прибора и снять программу с паузы. При работе с амплификаторами «GeneAmp PCR System 2400» и «GeneAmp PCR System
2700», Perkin Elmer пауза устанавливается вручную.
Время амплификации на амплификаторе с регулированием температур по матрице приблизительно 2 ч. 30 мин., на амплификаторе с активным регулированием – 1 ч. 50 минут.
8. После окончания реакции собрать пробирки в специальный штатив и отправить в комнату для анализа продуктов ПЦР (ЗОНУ 3). Пробы после амплификации можно хранить 16 часов при комнатной температуре или в течение недели при температуре от 2 до 8 °С (в этом случае перед проведением электрофореза необходимо нагреть пробирки до комнатной температуры с целью размягчения воска).
Анализ продуктов амплификации проводится разделением фрагментов ДНК в агарозном геле электрофоретическим методом.
ЭТАП 3. ЭЛЕКТРОФОРЕТИЧЕСКИЙ АНАЛИЗ АМПЛИФИЦИРОВАННОЙ ДНК
Детекция амплифицированной ДНК проводится в ЗОНЕ 3 – помещении для анализа продуктов амплификации студентом или сотрудником, не производящим манипуляций в зоне 1 и зоне 2. Первоначально необходимо приготовить рабочий раствор электрофорезного буфера. В мерный цилиндр наливают 50 мл концентрированного ТБЕ, доводят до 1000 мл дистиллированной водой, после чего закрывают цилиндр парафильмом и перемешивают.
Обратите внимание, что бромид этидия – канцерогенное соединение, поэтому при работе с ним следует соблюдать правила безопасности: работать только в перчатках, избегать попадания на кожу и слизистые, при попадании на кожу или слизистые тщательно промыть соответствующий участок водой. Реагенты, содержащие бромид этидия, перед утилизацией следует подвергаются специальной обработке.
После приготовления буферного раствора агарозу из одного флакона пересыпают в стеклянную коническую колбу из термостойкого стекла на 250 мл, добавляют в нее 100 мл готового рабочего раствора электрофорезного буфера, перемешивают вращением колбы и плавят в микроволновой печи до полного растворения агарозы.
Время плавления агарозы в микроволновой печи мощностью 800 Вт при её загруженности 1 колбой – 1,5 минуты. Колбу с расплавленной агарозой вынимают из микроволновой печи, аккуратно перемешивают
114

вращательными движениями. После этого вновь помещают колбу с агарозой в микроволновую печь на 1,5 мин. (при мощности 800 Вт), и, доводя агарозу до кипения, вынимают колбу, а затем остужают агарозу путём вращения колбы до температуры 65 – 70 С. Агароза при этом должна быть однородной, прозрачной, не содержать комков и частиц, заметных невооружённым глазом.
При отсутствии микроволновой печи допускается плавить агарозу на водяной бане, погружая колбу в горячую (95 – 98 °С) воду, после плавления охлаждая до 65 – 70 С.
Далее следует выровнять столик для заливки гелей, залить расплавленный гель в форму камеры, установив гребёнки на расстоянии не менее 3 см друг от друга так, чтобы их зубцы не касались дна гелевой рамки. Толщина геля должна быть около 5 – 6 мм.
После полного застывания геля (20 – 30 мин. при комнатной температуре) осторожно, не повредив лунки, вынимают из него гребёнки. Подложку с готовым гелем помещают в камеру, лунки при этом должны располагаться ближе к отрицательному электроду. ДНК соответственно движется к положительному. В камеру заливают готового буфера столько, чтобы он покрывал гель на 5 мм сверху.
Порядок детекции результатов
1.Пробирки с продуктами амплификации последовательно выставить в штатив, отобрать пипетками с одноразовыми наконечниками из-под слоя масла по 10 – 15 мкл пробы и внести в лунки геля (если для нанесения разных проб используется один и тот же наконечник, то его необходимо промывать буфером из камеры после нанесения каждой пробы). В каждом ряду лунок геля должен быть обязательно представлен положительный контроль (К+) сои или кукуруза и желательно маркер молекулярных масс для электрофореза (при наличии).
2.Подключить камеру к источнику тока, соблюдая полярность (ДНК движется к положительному электроду), и включить источник. Если нет нарушения контактов, то при прохождении тока от электродов должны подниматься пузырьки. Оптимальное напряжение электрического поля 10 В/см. При использовании камеры SE-2 («Хеликон») и источника питания «Эльф- 4» («ДНК-технология») параметры источника следующие: напряжение 250 В, стабилизация по напряжению, время электрофореза – 18-20 минут. При использовании других приборов параметры могут несколько отличаться.
3.Когда краситель пройдет примерно половину длины геля (не менее 1 см, лучше около 1,5 см), выключить источник тока, извлечь столик для заливки геля, немного просушить и перенести гель на трансиллюминатор,
115

расположив полосы горизонтально лунками вверх, получить изображение геля на компьютере с помощью видеосистемы, отмечая порядок нанесения проб, занести в базу данных. При отсутствии компьютера произвести фотографирование на цифровую фотокамеру.
При просматривании геля и фотографировании следует соблюдать меры предосторожности: глаза и лицо должны быть защищены специальной маской или стеклянной пластиной, которая прилагается к трансиллюминатору.
Учёт результатов
Учёт результатов ПЦР-анализа проводится по наличию или отсутствию на электрофореграмме специфических полос амплифицированной ДНК следующей длины:
ДНК 35S промотор – 194 пары нуклеотидов (п.н.) ДНК соя – 400 п.н.
 ДНК кукуруза – 544 п.н.
ДНК кукуруза – 544 п.н.
Обратите внимание, что, чем длиннее фрагмент ДНК, тем он тяжелее, следовательно, тем ближе к лунке будет находиться специфичная для него полоса. Например, в соевой муке, полученной из трансгенной сои, полоса 35S промотора будет находиться примерно вдвое дальше от лунки, чем полоса, свойственная непосредственно ДНК сои.
В таблице представлены результаты амплификации и детекции контрольных образцов на различных этапах проведения анализа.
Таблица 2 – Оценка результатов амплификации и детекции контрольных образцов
Обозначен |
Этап |
Название |
Результат амплификации с праймерами |
|||
ие |
анализа |
реагента |
35S промотор |
ВК соя |
ВК кукуруза |
|
ОК |
Выделение |
ОКО |
отрицательный |
отрицательный |
отрицательный |
|
ДНК |
||||||
|
|
|
|
|
||
К+ соя |
|
ПКО ДНК соя |
положительный |
положительный |
отрицательный |
|
|
(194 п.н.) |
(400 п.н.) |
||||
|
|
|
|
|||
К+ кукуруза |
ПЦР |
ПКО ДНК |
положительный |
отрицательный |
положительный |
|
|
кукуруза |
(194 п.н.) |
(544 п.н.) |
|||
|
|
|
||||
К- |
|
ТЕ-буфер |
отрицательный |
отрицательный |
отрицательный |
|
Далее учитывают результаты амплификации исследуемых образцов. Для проб, содержащих только ДНК сои (или только ДНК кукурузы) и не содержащих последовательности 35S промотора, в дорожке геля должна быть отчётливо видна полоса амплифицированного участка ДНК, располагающаяся в геле на том же расстоянии от линии лунок, что и верхняя полоса положительного контрольного образца ПЦР (ПКО соя или ПКО кукуруза). Пробы, содержащие ДНК сои (или кукурузы) с последовательностью 35S промотора, должны содержать две полосы –
116
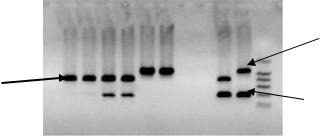
полосу 35S промотора и сои (или ВК кукурузы), располагающиеся в геле на том же расстоянии от линии лунок, что и обе полосы положительного контрольного образца ПЦР (таблица 3, рисунок 1).
Таблица 3 – Интерпретация результатов анализа исследуемых образцов
|
Результат амплификации с праймерами |
|||
Результат ПЦР-анализа |
35S |
ДНК сои |
ДНК кукурузы |
|
|
промотор |
|
|
|
Обнаружена ДНК сои, последовательность |
отрицательный |
положительный |
отрицательный |
|
35S не обнаружена |
(400 п.н.) |
|||
|
|
|||
Обнаружена ДНК кукурузы, |
отрицательный |
отрицательный |
положительный |
|
последовательность 35S не обнаружена |
(544 п.н.) |
|||
|
|
|||
Обнаружена ДНК сои, обнаружена |
положительный |
положительный |
отрицательный |
|
последовательность 35S |
(194 п.н.) |
(400 п.н.) |
||
|
||||
Обнаружена ДНК кукурузы, обнаружена |
положительный |
отрицательный |
положительный |
|
последовательность 35S |
(194 п.н.) |
(544 п.н.) |
||
|
||||
Обнаружена ДНК сои, обнаружена ДНК |
положительный |
положительный |
положительный |
|
кукурузы, обнаружена последовательность |
||||
(194 п.н.) |
(400 п.н.) |
(544 п.н.) |
||
35S |
||||
|
|
|
||
Не обнаружена ДНК сои и кукурузы, |
|
|
|
|
последовательность 35S обнаружена (в |
положительный |
|
|
|
образце могут присутствовать другие |
отрицательный |
отрицательный |
||
(194 п.н.) |
||||
растения, несущие последовательность 35S |
|
|
||
|
|
|
||
промотора) |
|
|
|
|
Не обнаружена ДНК сои и кукурузы, не |
отрицательный |
отрицательный |
отрицательный |
|
обнаружена последовательность 35S |
||||
|
|
|
||
1 2 3 4 5 6 ок к- К+соя |
К+кукуруза М |
|
||
ДНК кукурузы
ВК соя
35S
Рисунок 1 – Электрофореграмма результатов анализа исследуемых образцов на наличие генетически модифицированных ингредиентов
М – маркер для проведения электрофоретического анализа 1, 2 – соевая мука, не содержащая ГМ сои 3, 4 – соевая мука, содержащая ГМ сою
5, 6 – кукурузная крупа, не содержащая ГМ кукурузы ОК – отрицательный контроль выделения ДНК К- – отрицательный контроль ПЦР
7 – положительный контроль ПЦР – ГМ соя 40-3-2
117
