
- •И.А. Жарская
- •Н.Л. Мара
- •Химия
- •Хабаровск 2003
- •Министерство образования Российской Федерации
- •Хабаровская государственная академия экономики и права
- •Кафедра естественнонаучных дисциплин
- •Химия
- •Часть 1
- •Хабаровск 2003
- •Химия. Часть 1. Общая химия: Пособие для абитуриентов и учащихся школы «Юный товаровед-эксперт» очной и заочной форм обучения. / И.А. Жарская, Н.Л. Мара. – Хабаровск: РИЦ ХГАЭП, 2003. – с.
- •Редактор Г.С. Одинцова
- •Уч.-изд. _____. Тираж_______экз. Заказ №_____
- •680042, Хабаровск. ул. Тихоокеанская, 134, ХГАЭП, РИЦ
- •Обучающая задача 2
- •Решение:
- •Из закона Авогадро следует, что при одном и том же давление и одинаковых температурах масса (m) равных объемов газов относится как их молярные массы (М).
- •Состояние электрона в атоме
- •Форма и ориентация электронных орбиталей
- •Обучающая задача 1
- •Электронные
- •ХИМИЧЕСКАЯ СВЯЗЬ
- •ковалентная
- •связь
- •CuOHCl
- •основные
- •Способы выражения состава раствора
- •Важнейшие индикаторы
- •Твердый
- •Жидкий
- •Разбавленный
- •Написать уравнение диссоциации следующих электролитов
- •Тест 1
- •Тест 2
- •ТЕМА 2. СТРОЕНИЕ АТОМОВ
- •Тест 1
- •Тест 4
- •Тест 5
- •Тест 1
- •Тест 2
- •Тест 1
- •Тест 2
- •Тест 1
- •Тест 2
- •Тест 1
- •Тест 2
- •Тест 1
- •Тест 1
- •Кислоты
- •Тест 1
- •Соли
- •Тест 1
- •Комбинированные тестовые задания
- •Тест 1
- •Тест 2
- •Тест 1
- •Тест 2
- •Тест 3
17
15 |
4s2 |
4p6 |
20 |
4s2 |
3d1 |
16 |
2s2 |
2p5 |
21 |
4s1 |
3d5 |
17 |
2s2 |
2p1 |
22 |
4s2 |
3d6 |
3. ВАЛЕНТНОСТЬ. СТЕПЕНЬ ОКИСЛЕНИЯ. ХИМИЧЕСКАЯ СВЯЗЬ
Химические формулы
Эмпирические
формулы
отражают качественный и количественный состав молекулы.
Структурные
формулы
отражают последовательность соединения атомов в молекуле согласно их валентности.
Электронные
формулы
отражают тип химической связи между атомами в молекуле или ионе.
Валентность – способность атомов элемента образовывать химические связи. Валентность элементов определяется числом электронных пар, образующих прочную химическую связь (числом связей, образованных данным атомом с другими атомами).
Степень окисления – условный заряд атома в соединении, вычисленный, исходя из предположения, что молекула состоит только из ионов.
Определение степени окисления атома элемента
Алгебраическая сумма степеней окисления атомов в молекуле всегда равна нулю, а в ионе – заряду иона.
Например:
H3+1P+5O4-2 → (+1) · 3 + (+5) + (-2) · 4 = 0; [Сr2xO7-2]2- → 2x + (-2) · 7 = -2; x + 6

18
Степень |
Атомов элементов |
Примеры |
|
|||
окисления |
|
|||||
|
|
|
|
|
||
|
Атомы любого элемента в свободном |
S 02 , Fe0, C0, Cu0 |
||||
О |
состоянии |
|
|
|
|
|
Атомы элементов в молекулах простых |
|
H 02 , O 02 |
|
|||
|
|
|
||||
|
веществ |
|
|
|
|
|
+I |
Водород в большинстве соединений |
H 2 |
1 O, H+1NO3 |
|||
Щелочные металлы в соединениях |
Na+1Cl, Rb+1NO3 |
|||||
|
||||||
|
Фтор во всех соединениях |
|
NaF-1 |
|
||
|
Галогениды в бинарных соединениях |
KBr –1, KCl-1, KJ-1 |
||||
- I |
Водород в соединения с типичными ме- |
NaH-1, CaH2-1 |
||||
|
таллами (в гидридах) |
|
|
|
|
|
|
Кислород в пероксидах водорода и ме- |
H2O 2 |
1 , Na2O 2 |
1 |
||
|
таллов |
|
|
|
|
|
|
Металлы II группы периодической си- |
Ca+2Cl2, Zn+2O |
||||
+ 2 |
стемы в соединениях |
|
|
|
|
|
Кислород только в соединениях с фто- |
|
+2OF2-1 |
|
|||
|
|
|
||||
|
ром |
|
|
|
|
|
|
Кислород во всех соединениях, кроме |
|
|
|
|
|
- 2 |
H2O2, Na2O2, OF2 |
H2SO4-2, H2O-2 |
||||
Элементы VI группы в соединениях с |
H2S-2, H2Se-2 |
|
||||
|
водородом |
|
|
|
|
|
- 3 |
Элементы V группы в соединениях с |
|
3 |
3 |
|
|
водородом |
N H3 , P H3 |
|
||||
|
|
|||||
|
Элементы III группы периодической |
|
|
|
|
|
+ 3 |
системы в соединениях с более элек- |
Se2+3O3, Al+3(NO3)3 |
||||
|
троотрицательными элементами |
|
|
|
|
|
- 4 |
Элементы IV группы в соединениях |
|
4 |
4 |
|
|
водородом |
CH4 ,Si H4 |
|
||||
|
|
|||||
+ 4 |
Элементы IV группы в соединениях с |
|
4 |
4 |
|
|
более электроотрицательными ионами |
CO2 ,CCl4 |
|
||||
|
|
|||||
19
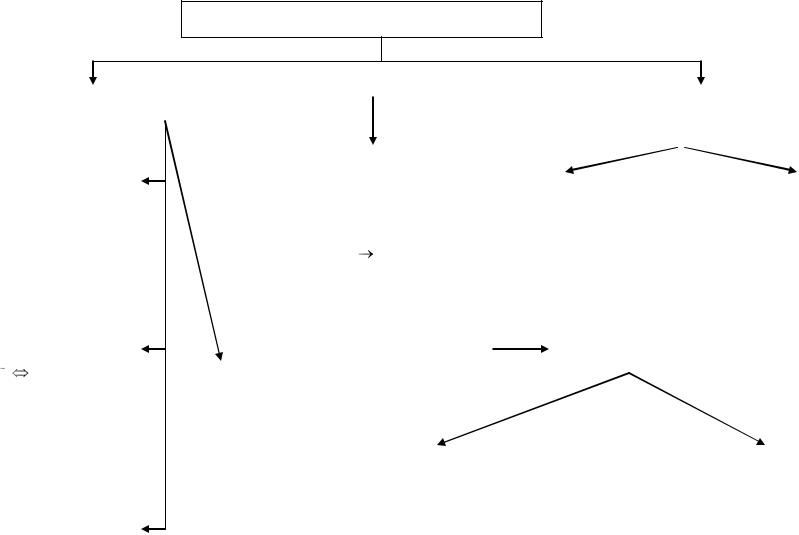
ХИМИЧЕСКАЯ СВЯЗЬ
|
|
|
по механизму образования |
|
|
|
|
|
|
|
|
по способам перекрывания |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
электронных |
облаков |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
металлическая |
связь |
осу- |
|
донорно-акцепторный механизм: |
|
|
|
|
|
|
|
|
|
|
||||||
|
один атом (донор) представляет в |
|
|
|
|
|
|
|
|
|
|
|||||||||
ществляется свободными элек- |
|
|
|
|
|
сигма |
|
|
|
пи |
||||||||||
|
общее пользование |
электронную |
|
|
|
|
|
|
|
|||||||||||
тронами |
между |
ионами |
или |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
σ-связь – перекрывание |
|
|
π-связь – боковое |
||||||||||||||
|
пару, а другой атом (акцептор) – |
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
атомами металлов в кристалли- |
|
|
|
электронных облаков |
|
|
|
перекрывание |
||||||||||||
|
свободную орбиталь: |
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
ческой решетке |
|
|
|
|
|
|
|
вдоль оси, соединяю- |
|
|
электронных об- |
|||||||||
|
|
|
|
H+ + : NH3 |
[NH4]+ |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
щей центры атомов |
|
|
|
лаков |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(s-s; s-p) |
|
|
|
(p-p) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
ионная |
связь |
осуществляется |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
между ионами, |
осуществляемая |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Обменный механизм: каждый атом |
|
|
|
|
|
|
|
|
|
|||||||||||
посредством |
электростатиче- |
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
ковалентная |
|
|
|
|||||||||||||
|
дает по одному электрону в общую |
|
|
|
|
|
|
|||||||||||||
ского притяжения: |
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
связь |
|
|
|
||||||||||||
|
|
электронную пару (ковалентная) |
|
|
|
|
|
|
||||||||||||
Na+ + Cl |
|
[Na+] [Cl-] |
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
полярная связь: электронное |
|
неполярная связь: электрон- |
|||
водородная связь – связь меж- |
|||||||
|
облако связи смещено в сто- |
|
ное облако связи распределе- |
||||
ду атомом водорода одной мо- |
|
|
|||||
|
рону |
более |
электроотрица- |
|
но в пространстве симметрич- |
||
лекулы и сильноэлектро отри- |
|
|
|||||
|
тельного атома (H2O, HCl, |
|
но относительно обоих атомов |
||||
цательными (F, O, N) атомами |
|
|
|||||
|
N2O5): |
.. |
.. |
|
(Н2, Cl2, N2): |
||
другой молекулы |
|
|
|||||
|
|
·H + ·Cl: → Н :Cl: |
|
·H + ·H → H : H |
|||
|
|
|
|
||||
|
|
|
. . |
. . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20
Обучающая задача 1
Определите валентность и степени окисления азота в соединениях: N2; NH3; NH 4 ; N2H4; NO2 HNO3. Составите графические формулы
формула |
N2 |
NH3 |
NH |
4 |
ион амми- |
|
N2H2 |
NO оксид |
HNO3 азот- |
||
азот |
аммиак |
|
ака |
гидразин |
азота (II) |
ная кислота |
|||||
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
||
валентность |
III |
III |
|
|
|
IV |
|
III |
II |
IV |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
степень |
0 |
-3 |
|
|
|
-3 |
|
-2 |
+2 |
+5 |
|
окисления |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Н |
Н |
|
|
O |
|
|
H |
|
|
H |
|
|
|
N = O |
|
|
графиче- |
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
| |
|
|
|
H O |
N |
||
ская фор- |
N ≡ N |
N |
H |
|
|
H |
|
|
|
||
|
N |
|
|
H O N |
O |
|
|||||
мула |
|
|
|
|
|
|
N |
O |
|
||
|
|
|
|
| |
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
H H |
|
|
H |
|
|
|
|
|
O |
|
|
|
|
|
|
|
H |
H |
|
|
|
Обучающая задача 2
Укажите тип химической связи в с молекулах следующих веществ: брома, бромистого водорода, бромида калия. Составьте эмпирические и электронные формулы их молекул.
Решение:
Эмпирические, структурные и электронные формулы молекул веществ строятся на основании валентности элементов.
Эмпирические формулы молекул:
Брома – Br2, бромистого водорода – HBr, бромид калия – KBr.
Вэлектронных формулах электроны, находящиеся на внешнем энергетическом уровне, обозначаются точками, расположенными вокруг химического символа атома. Общее для двух атомов электроны показывают точками, расположенные между их химическими символами.
Вмолекуле Br2 связь ковалентная неполярная, потому что она образована за счет общей электронной пары и не смещена, т. к. связывает атомы одного и того же элемента (Br : Br).
Вмолекуле HBr связь ковалентная полярная, потому что образована общей электронной парой, но смещена в сторону более электроотрицательного элемента брома (H : Br).
Вмолекуле KBr связь ионная, потому что осуществляется в результате электростатического притяжения ионов K+ и Br-, которые образуется в результате перехода внешнего электрона атома калия на свободную орбиталь более электроотрицательного атома брома.
Вструктурной формуле пара электров химической связи обозначается черточкой. Число черточек обозначает не только число электронных пар, но и валент-
ность элементов в данном соединении (Br – Br; H – Br; K – Br).

21
Задания для самоподготовки:
1.Определите валентность и степень окисления атомов элементов в молекулах предложенных веществ.
2.Составите структурные формулы.
3.Укажите класс соединений.
4.Дайте названия соединениям.
№ |
Формулы вещества |
|
варианта |
||
|
1Na2SiO3; CaHPO4; Fe(OH)3; Cl2O7; HNO2
2SO2; CdO; Be(OH)2; H3PO4; BaSO4
3RbOH, NiOHNO3; H2SO4; Al(H2PO4)3; Cr2O3
4AlCl3; NaHCO3; MgO; H2S; Cu(OH)2
5Zn(OH)2; H2SO3; N2O5 ; MnO; FePO4
6CaO; Cr(OH)3; PbSO4; H2CO3; AlOHCl2
7Li2O; CO2; Mg(OH)2; Zn(NO3)2; HMnO4
8V2O5; KMnO4; BeO; H2SiO3; KHSO3
9N2O3; Fe(OH)3; HClO4; KHS; Al2(SO4)3
10Ag2O; Na2S; HNO2; Fe(OH)3; CuOHCl
11P2O5; Mn(OH)2; HClO3; CaCO3; NaH2PO4
12NH4NO3; MnO2; Cu(OH)2; HJ; N2O5
13MnSO4; CrO; Be(OH)2; CaOHBr; H2CrO4
14HNO2; SnO2; B2O3; NH4Cl; Ca(HCO3)2
15K2S; NO2; Cr2O3; Ni(OH)2; CdOHNO3
16NaNO2; Al2O3; FeOHCl2; H2SiO3; NO
17CO2; Ni(OH)2; Mg(HSO3)2; H3PO4; Al(NO3)3
18H2S; CaO; HNO2; Mg(HCO3);CuSO4
19Zn(OH)2; H2SO4; Na2CrO4; NO; AgNO3
20Al(OH)2Cl; HF; Cu2O; Zn(NO3)2; H2S
21Mn2O7; MgO; HCN; Mn(NO3)2; KHCO3
22N2O3; K2SO3; H2SiO3; Ni(OH)2; Cu(HSO4)2
23CdSO4; RbOH; H2SiO3; Ni(NO)2; Cu(HSO4)2
24H3PO4; CuOHNO3; P2O5; Fe(OH)3; MnSO4
25CaCl2; HBr; ZnO; H2SO4; Mn(OH)4
