
Полезные материалы за все 6 курсов / Учебники, методички, pdf / Ферменты. Методичка. БХ-1
.pdfКФ 3.4.11. аминопептидазы КФ 3.4.13. дипептидазы
КФ 3.4.14. дипептидил-пептидазы и трипептидил-пептидазы КФ 3.4.15. пептидил-пептидазы КФ 3.4.16. сериновые карбоксипептидазы
КФ 3.4.17. металлокарбоксипептидазы КФ 3.4.18. цистеиновые карбоксипептидазы КФ 3.4.19. -пептидазы КФ 3.4.20. сериновые эндопептидазы
КФ 3.4.22. цистеиновые эндопептидазы КФ 3.4.23. аспартильные эндопептидазы КФ 3.4.24. металлоэндопептидазы КФ 3.4.25. треониновые эндопептидазы
КФ 3.4.99. эндопептидазы с неизвестным механизмом катализа
Лейцинаминопептидаза (КФ 3.4.11.1), относящаяся к подклассу 3.4. катализирует высвобождение N-терминальной аминокислоты, которая является преимущественно лейцином (а также другая аминокислота, но не аргинин и лизин), связанной с пролином. Фермент может также катализировать гидролиз амидов и метиловых эфиров аминокислот. Определение активности лейцинаминопептидазы в сыворотке крови используют в энзимодиагностике заболеваний печени.
Большинство протеиназ классифицируют в зависимости от строения активного центра. Различают металлоэндопептидазы – нейтрофильная коллагеназа (КФ 3.4.24.34), карбоксипептидаза А, содержащая Zn2+ (КФ 3.4.17.1); сериновые эндопептидазы – трипсин (КФ 3.4.21.4), плазмин (КФ 3.4.21.7), эластаза панкреатическая (КФ 3.4.21.36), лейкоцитарная эластаза (КФ 3.4.21.37), энтеропептидаза (КФ 3.4.21.9); аспартильные эндопептидазы – пепсин А (КФ
3.4.23.1), ренин (КФ 3.4.23.15), катепсин Д (КФ 3.4.23.5) и др.
Многие протеиназы синтезируются в виде неактивных предшественников. В результате ограниченного протеолиза, протекающего под действием специфических протеиназ, либо автокаталитически, происходит отщепление
пептидов, экранирующих |
активный центр протеиназы, и профермент переходит |
в активную форму. |
|
Протеиназы имеют |
субстратную специфичность, гидролизуя в белках |
строго определѐнные пептидные связи, что обусловлено структурой активного центра. Функции протеиназ разнообразные: пищеварительные ферменты, лизосомальные ферменты, факторы свѐртывания и фибринолиза, компоненты системы комплемента и др.
КФ 3.5. Действующие на углерод-азот связи, отличные от пептидных
Примером таких ферментов служит аргиназа (КФ 3.5.3.1) участвующая в синтезе конечного продукта распада азотсодержащих соединений (аминокислот, нуклеотидов) – мочевины.
21
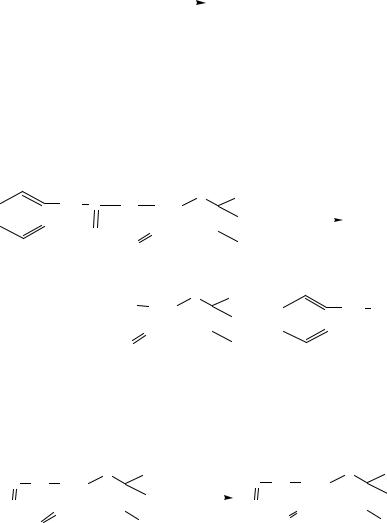
NH2 |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
NH |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH |
|
|
|
|
|
NH2 |
NH2 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
+ H2O |
|
|
|
CH2 |
+ |
C |
|
O |
||||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
CH |
|
NH2 |
||||||||
2 |
|
|
|
2 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
м о чевин а |
|||
CH2 |
|
|
|
|
CH2 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
CH |
|
NH2 |
|
CH |
|
NH2 |
|
|
|
|
|||||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
COOH |
|
COOH |
|
|
|
|
|||||||||
аргин ин |
|
î ðí èòèí |
|
|
|
|
|||||||||
Бактериальный фермент пенициллин амидаза (КФ 3.5.1.11) имеет синонимы пенициллин ацилаза, бензилпенилиллин ацилаза, семацилаза ампициллин ацилаза другие. Катализирует реакцию:
|
|
|
CH2 C |
NH |
|
|
|
|
|
S |
CH3 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
+ H2O |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
O |
|
C |
|
|
N |
|
|
|
COOH |
|||||||||
|
|
|
|
O |
|
|
|
|
|
|
|
||||||||||
áåí çèëï åí è öè ëëèí |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
NH2 |
|
|
|
|
|
|
|
S |
CH3 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
+ |
|
|
|
|
CH2 COOH |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
C |
|
|
N |
|
|
COOH |
|||||||||||
|
|
|
|
O |
|
|
|
|
|
|
|
||||||||||
|
|
|
6-ам ин о п ен ициллан о вая |
|
ф ен илуксусн ая кисло та |
||||||||||||||||
êè ñëî òà |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Пенициллин амидазу используют в качестве ферментного реагента при производстве пенициллинов.
Наличие лактамазы (КФ 3.5.2.6) у ряда бактерий также является причиной устойчивости к антибиотикам. Фермент катализирует реакцию:
R |
|
C NH |
|
|
|
|
|
S |
CH3 |
|
R |
|
C NH |
|
|
|
S |
CH3 |
|
|
|
O |
|
|
|
|
|
|
CH3 + H2O |
|
|
|
|
O |
|
|
|
|
CH3 |
|
|
C |
|
N |
|
|
|
|
|
|
C HN |
|
|
||||||
|
|
O |
|
|
COOH |
|
|
|
O |
|
COOH |
||||||||
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
п ен ицилли н |
п ен ицилли н о вая кисло та |
|
Лактамаза представляет собой группу бактериальных ферментов, гидролизующих -лактамы, некоторые из лактамаз более быстро действуют на пенициллины, другие с большей скоростью катализируют гидролиз цефалоспоринов.
22

КФ 4. ЛИАЗЫ
К классу лиаз относят ферменты, катализирующие разрыв связей С-С, С-О, С-N и других, а также обратимые реакции отщепления различных групп от субстрата негидролитическим путѐм. Эти реакции сопровождаются образованием двойной связи или присоединением групп к месту разрыва двойной связи. Различают 7 подклассов лиаз:
Номер |
Название подкласса |
КФ 4.1 |
С-С лиазы |
КФ 4.2 |
С-О лиазы |
КФ 4.3 |
С-N лиазы |
КФ 4.4 |
С-S лиазы |
КФ 4.5 |
С-галоген лиазы |
КФ 4.6 |
Р-О лиазы |
КФ 4.99 |
Другие лиазы |
КФ 4.1. Углерод-углерод лиазы
С-С-лиазы катализируют отщепление от молекулы субстрата СО2. Выделяют 4 подподкласса:
КФ 4.1.1 карбокси-лиазы КФ 4.1.2. альдегид-лиазы КФ 4.1.3. оксокислота-лиазы КФ 4.1.99 другие С-С лиазы
Подподкласс КФ.4.1.1 составляют ферменты, катализирующие отщепление СО2 от карбоновых кислот – декарбоксилазы. Важное значение имеют - декарбоксилазы, участвующие в синтезе биологически активных веществ – биогенных аминов, большинство из которых нейромедиаторы (ГАМК, гистамин, дофамин, норадреналин, адреналин, серотонин). Ниже приведена реакция синтеза дофамина при участии декарбоксилазы ароматических L-аминокислот (КФ 4.1.1.29), которая также катализирует образование серотонина из 5- гирокситриптофана:
HO |
|
NH2 |
HO |
|||||||||||||
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
CH2 |
|
NH2 + CO2 |
|||||
|
|
|
|
CH2 CH |
|
|
|
|
|
CH2 |
|
|
||||
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
COOH |
HO |
|||||||||||
HO |
||||||||||||||||
дио кси ф ен и лалан и н |
|
|
|
|
äî ô àì è í |
|
|
|
|
|||||||
Декарбоксилазы аминокислот в большинстве случаев являются пиридоксалевыми ферментами.
Фермент, участвующий в метаболизме кетоновых тел ацетоацетат декарбоксилаза (КФ 4.1.1.4) также относится к КФ.4.1.1 подподклассу лиаз и
23
катализирует реакцию образования ацетона:
CH3 C |
|
C |
|
C OH |
|
CH3 C |
|
CH3 + CO2 |
||
|
|
|||||||||
|
|
|
||||||||
|
|
H2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
O |
|
|
|
|
||||
O |
|
O |
||||||||
ацетоацетат |
|
ацетон |
||||||||
К подклассу альдегид-лиаз (КФ.4.1.2) катализирующих разрыв С-С связи, сопровождающийся возникновением альдегидной группы, относится фермент гликолиза – альдолаза (фруктозо-дифосфат альдолаза, КФ 4.1.2.13).
Фруктозо-1,6-дифосфат 3-фосфоглицериновый альдегид + диоксиацетонфосфат
Ещѐ одним важным представителем С-С лиазы является фермент цикла трикарбоновых кислот – цитратсинтаза (КФ 4.2.1.4), катализирующая присоединение ацетильного остатка ацетил-SКоА по карбонильной группе оксалоацетата с образованием лимонной кислоты.
Процесс сопровождается гидролизом тиоэфирной группы, связывающей карбоксиметильный фрагмент, произошедший из ацетильной группы, с коферментом А.
КФ 4.2. Углерод-кислород лиазы
Гидролиазы, относящиеся к подклассу С-О лиаз, чаще всего катализируют присоединение воды по двойной связи или реакции дегидратации оксисоединений с образованием двойной связи. Выделяют 4 подподкласса:
КФ 4.2.1. гидролиазы КФ 4.2.2 действующие на полисахариды
КФ 4.2.3 действующие на фосфаты КФ 4.2.99 другие С-О-лиазы
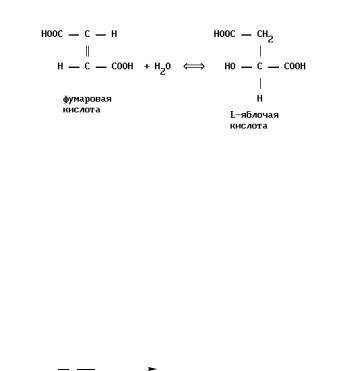
Примером С-О лиазы (подкласс 4.2) является фермент цикла трикарбоновых кислот – фумаратлиаза (КФ 4.2.1.2), катализирующая превращение фумарата в малат.
24
КФ 4.3. С-N-лиазы
Подкласс лиаз, действующих на C-N связи содержит 4 подподкласса ферментов:
КФ 4.3.1. аммиак-лиазы КФ 4.3.2. лиазы, действующие на амиды и др. КФ 4.3.3. амино-лиазы
КФ 4.3.99 другие С-N лиазы
Примером лиазы, действующей на С-N-связи является аргининсукцинат лиаза (КФ 4.3.2.1), катализирующая реакцию распада аргининянтарной кислоты на аргинин и фумаровую кислоту:
|
NH2 |
COOH |
NH2 |
+ |
COOH |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HC N |
CH |
|
|
C |
|
|
NH |
CH |
|||||||||
|
|
|
|
|
|||||||||||||
|
|
|
|||||||||||||||
|
NH H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
NH |
|
|
|
|
||||||||
|
CH2 |
|
CH |
||||||||||||||
|
CH2 |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
CH2 |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
COOH |
|
|
|
|
|
|
|
COOH |
|||||
|
CH2 |
|
|
|
|
CH2 |
|
ô óì àðî âàÿ |
|||||||||
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
CH2 |
|
|||||||||||
|
|
|
|
|
|
êè ñëî òà |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
NH2 |
|
|
|
|
CH |
|
NH2 |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
COOH |
|
|
|
|
COOH |
|
|
|
|
||||||||
аргин ин сукци н ат |
аргин ин |
|
|
|
|
||||||||||||
Аргининсукцинат лиаза является ферментом орнитинового цикла синтеза мочевины – основного процесса обезвреживания токсичного аммиака в организме человека.
КФ 4.6. Р-О лиазы
В качестве примера реакции, катализируемой лиазой, приводящей к образованию цикла, можно привести аденилатциклазу (АТФ-пирофосфатлиаза циклизующая, КФ 4.6.1.1) – фермент, катализирующий превращение АТФ в циклический АМФ (цАМФ):
АТФ цАМФ + пирофосфат цАМФ является вторичным посредником в передаче гормонального
сигнала в клетку для многих гормонов и нейромедиаторов.
25
КФ 5. ИЗОМЕРАЗЫ
Ферменты, относящиеся к этому немногочисленному классу ускоряют структурные изменения в пределах одной молекулы, то есть катализируют реакции изомеризации. К этому классу ферментов относят 6 подклассов:
Номер |
Название подкласса |
КФ 5.1 |
Рацемазы и эпимеразы |
КФ 5.2 |
Цис-транс-изомеразы |
КФ 5.3 |
Внутримолекулярные оксидоредуктазы |
КФ 5.4 |
Внутримолекулярные трансферазы |
КФ 5.5 |
Внутримолекулярные лиазы |
КФ 5.99 |
Другие изомеразы |
КФ 5.1. Рацемазы и эпимеразы
В этот подкласс входят ферменты, катализирующие превращения оптических изомеров, то есть осуществляется обращение конфигурации при хиральном атоме С. Если такой центр в молекуле один, то происходит обращение конфигурации молекулы в целом. В подкласс рацемаз и эпимераз входит 4 подподкласса:
КФ 5.1.1 действующие на аминокислоты и их производные КФ 5.1.2 действующие на гидроксикислоты и их производные КФ 5.1.3 действующие на карбоксигидраты и их производные КФ 5.1.99 действующие на другие вещества
К 5.1. подподклассу относят пиридоксальзависимый фермент рацемаза аминокислот (КФ 5.1.1.10), которые катализируют реакции превращения L- изомеров аминокислот в D-изомеры:
L-аминокислота D-аминокислота
В реакциях взаимопревращения моносахаров важную роль играют эпимеразы, катализирующие реакции обращения конфигурации при нескольких хиральных атомах С. В качестве примера эпимеразы можно привести D- рибулозо-5-фосфат-3-эпимеразу (КФ 5.1.3.22) – фермент неокислительного этапа пентозофосфатного пути окисления глюкозы, катализирующего реакцию взаимопревращения рибулозо-5-фосфат в ксилулозо-5-фосфат:
L-рибулозо-5-фосфат L-ксилулозо-5-фосфат.
5.2. Цис-транс-изомеразы
Отдельный подкласс образуют ферменты, катализирующие реакции цис- транс-изомеризации. В качестве примеров можно привести изомеразы, участвующие в метаболизме витамина А. Ретиналь изомераза (КФ 5.2.1.3) катализирует реакцию превращения полного транс-ретиналя в 11-цис-ретиналь.
26

CH3 |
CH |
|
CH3 |
CH3 |
|
CH |
3 |
|
CH3 |
3 |
|||
|
CH3 |
|
|
|
||
|
|
|
|
CHO |
|
|
|
CH3 |
|
|
|
CH3 |
H C |
|
|
|
|
|
3 |
|
|
|
|
|
|
|
CHO |
п о лн о стью тран сретин аль |
11-цис-ретин аль |
|||||
Ретинол изомераза (КФ 5.2.1.7) катализирует аналогичную реакцию, но субстратом служит другой витамер витамина А – ретинол.
Полный транс-ретинол 11-цис-ретинол
Фермент принимает участие в фоторецепторной сигнальной системе зрительного анализатора.
КФ 5.3. Внутримолекулярные оксидоредуктазы
К подклассу КФ 5.3 относятся ферменты, катализирующие внутримолекулярные процессы окисления-восстановления. Выделяют 5 подподклассов:
КФ 5.3.1. взаимопревращающие альдозы и кетозы КФ 5.3.2. взаимопревращающие кето- и енольные группы КФ 5.3.3 перемещающие C=C связи
КФ 5.3.4. перемещающие S-S связи
КФ 5.3.99 другие внутримолекулярные оксидоредуктазы
Примером изомераз, взаимопревращающие альдозы и кетозы, является фермент гликолиза глюкозо-6-фосфат изомераза (КФ 5.3.1.9), катализирующая реакцию:
|
CH2OPO3H2 |
|
CH2OPO3H2 |
|
|
|||||
|
|
|
O H |
|
CH2OH |
|||||
H |
|
|
|
O |
||||||
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
H |
OH |
|
|
|
H |
OH |
|
||
|
H |
|
|
|
|
|||||
|
|
|||||||||
|
|
|
|
|
|
|
|
|
||
OH |
|
OH |
|
H |
|
|
||||
|
|
|
|
|
|
|
|
|
OH |
|
|
OH |
H |
|
|
OH |
|||||
|
|
|
H |
|||||||
ãëþ êî çî -6-ô î ñô àò |
ф рукто зо -6-ф о сф ат |
|
||||||||
Глюкозо-6-фосфат изомераза является ферментом катаболизма глюкозы.
КФ 5.4. Внутримолекулярные трансферазы
Другим подклассом изомераз являются внутримолекулярные трансферазы
– ферменты, катализирующие перенос функциональных групп в молекуле субстрата. В зависимости от переносимой функциональной группы различают 5 подподклассов:
27
КФ 5.4.1 переносящие ацильные группы КФ 5.4.2 фосфотрансферазы (фосфомутазы) КФ 5.4.3 переносящие аминогруппы КФ 5.4.4 переносящие гидроксигруппы КФ 5.4.99 переносящие другие группы
Например, образование глюкозы-6-фосфата из глюкозы-1-фосфат происходит под действием трансферазы. Фосфоглюкомутаза (КФ 5.4.2.2), являющаяся одним из ферментов гликогенолиза катализирует реакцию изомеризации моносахаров:
α-D-глюкозо-1-фосфат D-глюкозо-6-фосфат
При катаболизме жирных кислот с нечетным числом углеродных атомов, аминокислот с разветвлѐнным углеродным скелетом на одной из заключительной стадии происходит изомеризация метилмалоновой кислоты в янтарную. Эта реакция необходима для включения разветвлѐнных углеводородных скелетов в общий путь катаболизма. При этом изомеризации подвергается не сама кислота, а еѐ производное кофермента А.
HOOC CH |
C |
|
SKoA |
|
COOH CH2 CH2 C |
|
SKoA |
|||||
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
O |
|
|
|
O |
|||||||
м етилм ало н и л-SКо А |
|
cукцин ил-Sо А |
||||||||||
Процесс катализируется метилмалонил-КоА-мутазой (КФ 5.4.99.2). Этот фермент, как и некоторые другие ферменты, катализирующие изомеризацию углеродного скелета, использует в качестве кофактора метилкобаламин – активную форму витамина В12.
КФ 6. ЛИГАЗЫ
Главной особенностью этого класса ферментов является сопряженность синтеза с распадом веществ, способных поставлять энергию для осуществления биосинтетических процессов. Лигазы – ферменты, катализирующие реакции конденсации или присоединения, сопряжѐнные с гидролизом одной из пирофосфатных связей в молекуле АТФ или ГТФ. Деление на подклассы основано по типу образуемой связи: лигазы, образующие С-О связи, образующие С-S связи, образующие С-N связи, образующие С-С связи и другие. Этот класс ферментов состоит из 6 подклассов:
Номер |
Название подкласса |
КФ 6.1 |
Формирующие С-О связи |
КФ 6.2 |
Формирующие С-S связи |
КФ 6.3 |
Формирующие С-N связи |
КФ 6.4 |
Формирующие С-С связи |
КФ 6.5 |
Формирующие эфиры фосфорной кислоты |
КФ 6.6 |
Формирующие связи между азотом и металлом |
28

КФ 6.1. Формирующие С-О связи
Этот подкласс состоит из единственного подподкласса (КФ 6.1.1), в который входят многочисленные аминоацил-тРНК-синтетазы, формирующих аминоацил-t-РНК. Эти ферменты катализируют реакцию конденсации аминокислоты, приводящую к присоединению еѐ в виде аминоацильного остатка по оксигруппе 3'-концевого аденозина одной или нескольких транспортных РНК (тРНК).
Аминокислота + тРНК + АТФ аминоацил-тРНК + АМФ + пирофосфат
В результате таких реакций, происходящих с каждой из 20 аминокислот, входящих в состав белков, аминокислоты оказываются рассортированными по соответствующими тРНК. Это имеет важное значение для последующего отбора аминокислот в синтезе белка на рибосомах.
КФ 6.2 Формирующие С-S связи
Подкласс лигаз, образующих С-S связи представлен ферментами, катализирующими образование тиоэфиров карбоновых кислот с коферментом А. Так, катаболизм жирных кислот в клетке начинается с их активации – превращения в ацилSКоА. Название фермента – ацилкофермент А-синтетаза
(КФ 6.2.1.3).
R |
|
C |
|
OH + HSKoA + ÀÒÔ |
|
R |
|
C |
|
SKoA + ÀÌ Ô + ï èðî ô î ñô àò |
|
|
|
||||||||
|
|
|
|
|
||||||
|
|
O |
|
|
|
O |
||||
АцилкоферментА-синтетаза действует на большое количество насыщенных и ненасыщенных жирных кислот, но ферменты из различных тканей показывают различие в специфичности. Субстратами для фермента печени являются жирных от С6 до С20 кислоты, тогда как фермент мозга показывает высокое сродство к жирным кислотам, содержащим до 24 атома углерода.
КФ 6.3. Формирующие С-N связи
Ферменты подкласса 6.3 катализируют в основном реакции введения азотсодержащих групп в органические соединения (органификации азота). В подкласс входят 5 подподклассов:
КФ 6.3.1. Амидсинтазы КФ 6.3.2 Пептидсинтазы КФ 6.3.3 Циклолигазы
КФ 6.3.4 Другие C-N лигазы
КФ 6.3.5 C-N лигазы с глутамином в качестве донора амидной группы
Примерами 6.3.1 подподкласса являются ферменты, катализирующие присоединение аммиака к дикарбоновым аминокислотам с формированием амидной связи – глутамат:аммиак лигаза (глутаминсинтетаза, КФ 6.3.1.2) и аспартат:аммиак лигаза (аспарагинсинтетаза, КФ 6.3.1.1):
29
|
|
COOH |
|
|
|
|
|
|
COOH |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2C |
|
NH2 |
|
|
|
|
|
H C |
|
|
NH |
2 |
|
||||||
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
||
|
|
|
|
+ |
ÀÒÔ + NH3 |
|
|
|
|
|
|
|
|
|
|
+ |
ÀÄÔ + ô î ñô àò |
||
|
|
CH2 |
|
|
|
|
|
|
CH |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
CH2 |
|
|
|
|
|
|
|
CH |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
COOH |
|
|
|
|
|
|
|
C |
|
|
|
||||||
глутам и н о вая кисло та |
|
|
O |
NH2 |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
глутам ин |
|
|
||||||
Синтез аспарагина протекает аналогично, однако, АТФ гидролизуется до |
|||||||||||||||||||
АМФ: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
COOH |
|
|
|
|
|
COOH |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2C |
|
NH2 |
|
|
|
|
H2C |
|
NH2 |
|
|
||||||||
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
||||||||||||
+ |
ÀÒÔ + NH3 |
|
|
|
|
|
CH2 |
|
+ |
ÀÌ Ô + ï èðî ô î ñô àò |
|||||||||
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|||||||||||||||
CH2 |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
COOH |
|
|
|
|
O |
C |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
NH2 |
|
|
||||
асп араги н о вая кисло та |
|
|
|
|
|
|
|
|
|||||||||||
асп араги н |
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
К этому подклассу относят ферменты, участвующие в нерибосомальном синтезе пептидов. Например, ключевой фермент синтеза трипептида глутатиона – глутатионсинтаза (КФ 6.3.2.3), катализирующая реакцию:
ATФ + γ-L-глутамил-L-цистеин + глицин - AДФ + фосфат + глутатион Трипептид глутатион является коферментом глутатионпероксидазы,
участвует в транспорте через цитоплазматическую мембрану аминокислот, образует коньюгаты с ксенобиотиками и лекарственными веществами, с целью последующего транспорта с помощью АТФ-транспортѐров из клеток. Глутатион является водорастворимым антиоксидантом.
Другой важный представитель 6.3.2. подподкласса убиквитинпротеинлигаза (КФ 6.3.2.19, убиквитин активирующий фермент), катализирующая реакцию:
ATФ + убиквитин + лизин белка AMФ + дифосфат + белок N-убиквитиллизин
Убиквитин связывается с белком пептидной связью между С- терминальным глицином убиквитина и -аминогруппами остатков лизина белковой молекулы. Убиквитинирование необходимо для последующей деградации белка протеасомами 26S.
КФ 6.4. Формирующие С-С связи
К синтетазам, образующим С-С связи в основном относятся ферменты, катализирующие присоединение СО2 к углеродному скелету. К их числу, в частности, относится, пируваткарбоксилаза (КФ 6.4.1.1) при участии которой
30
