- •5.Катализ: гомогенный и гетерогенный. Энергетический профиль каталитической реакции.
- •6.Химическое равновесие. Обратимые и необратимые по направлению реакции. Константа хим.Равновесия. Прогнозирование смещения хим.Равновесия.
- •7.Классификация растворов: по степени дисперсности; по степени насыщенности. Коллигативные свойства растворов: закон Рауля, понижение t замерзания р-ра, повышение t кипения р-ра.
- •8.Классификация дисперсных систем: по степени дисперсности; по агрегатному состоянию фаз; по силе межмолекулярного взаимодействия между дисперсной фазой и дисперсной средой.
- •10.Осмос, осмотическое давление, закон Вант-Гоффа. Осмоляльность и осмолярность биологических жидкостей.
- •11.Понятие о коллоидных растворах. Методы получения и очистки коллоидных растворов. Строение мицеллы. Коагуляция, порог коагуляции.
- •12.Факторы устойчивости коллоидных растворов. Механизм возникновения электрического заряда коллоидной частицы. Мицелла. Ядро. Гранула.
- •13.Ионное произведение воды. Методы определения рН растворов. Индикаторы.
- •14.Протолитические реакции. Понятия о кислотах и основаниях. Амфолиты. Ионизация слабых кислот и оснований. Константа кислотности и основности.
- •15.Буферные системы: определение, классификация, уравнение Гендерсона-Гассельбаха. Механизм действия буферных систем. Зона буферного действия и буферная емкость.
- •16.Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая, белковая. Взаимодействие буферных систем организма человека.
- •17.Понятие о кислотно-основном состоянии организма. Виды нарушения кос и способы коррекции.
- •18.Типы окислительно-восстановительных реакций, протекающих в организме.
- •19.Физико-химические принципы транспорта электронотранспортной цепи митохондрий.
- •20.Классификация комплексных соединений, их строение. Представления о строении металлоферментов и других биокомплексных соединений (гемоглобин, цитохромы ,кобаламины).
- •31.Изомерия моносахаридов: стереоизомерия, цикло-оксо-таутомерия, а- и в-аномерия на примере глюкозы.
- •34.Дисахариды: классификация (редуцируюище - мальтоза, целлобиоза, лактоза и нередуцирующие сахароза, трегалоза). Строение, химические свойства: гидролиз, окисление редуцирующих сахаров.
- •35.Классификация полисахаридов (гомо и гетерополисахариды ). Примеры.
- •36.Гомополисахариды: крахмал (амилоза и амилопектин), гликоген, декстран, целлюлоза. Структура, типы химических связей, гидролиз.
- •37.Липиды: определение, классификация.
- •39. Простые (нейтральные) липиды - триглицериды. Номенклатура, состав, строение, их гидролиз. Биологическая роль.
31.Изомерия моносахаридов: стереоизомерия, цикло-оксо-таутомерия, а- и в-аномерия на примере глюкозы.


32.Строение наиболее важных представителей пентоз (рибоза, ксилоза, рибулоза), гексоз (глюкоза, галактоза, манноза, фруктоза), дезоксисахаров (2-дезоксирибоза), 2-амигносахаров (глюкозамин, маннозамин, галактозамин).
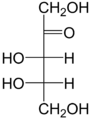
Пентозы - химическое название класса пятиуглеродных моносахаридов, то есть сахаров, общей формулой которых является C5(H2O)5, или C5H10O5.
Рибоза, ксилоза, рибулоза
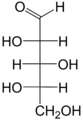 ,
, ,
,
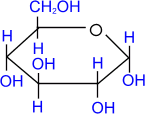
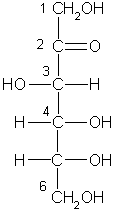
Гексозы, C6H12O6, простые сахара — моносахариды.
Глюкоза, галактоза, манноза, фруктоза
 ,
,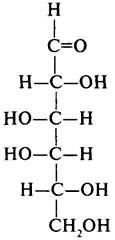 ,
,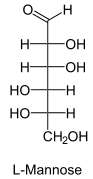 ,
,
Дезоксисахара (2-дезоксирибоза)
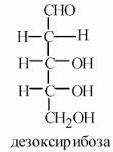
2-амигносахаров
глюкозамин, галактозамин, маннозамин
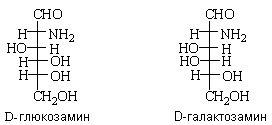 ,---
,---
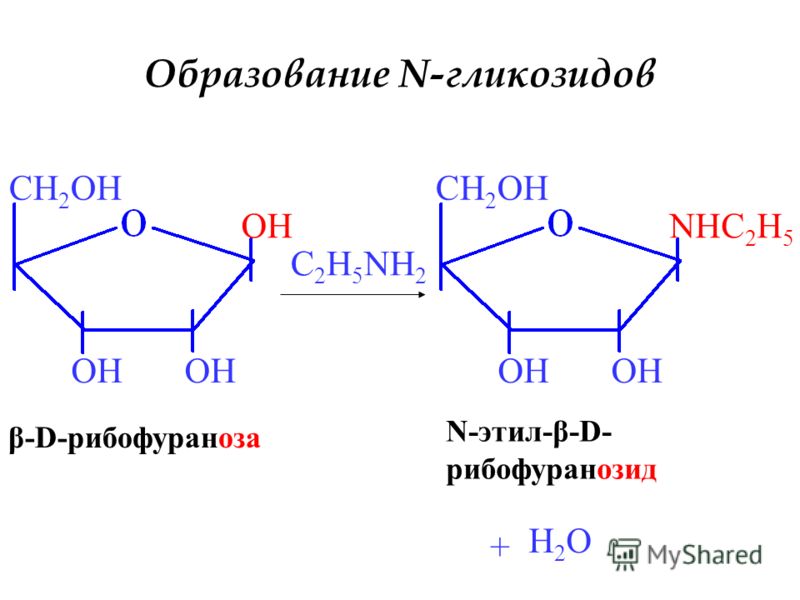
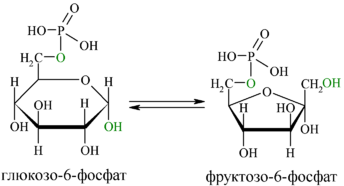
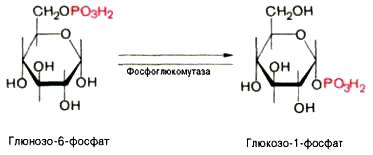
ЗЗ.Химические свойства моносахаридов: окисление моносахаридов (образование оновых, аровых, уроновых кислот); восстановление моносахаридов (образование ксилита, сорбита, маннита); реакции этерификации по спиртовой группе с образованием фосфорных эфиров; реакции изомеризации: превращение глю-6-фосфата во фруктозу-6-фосфат, глюкозу-1-фосфат, рибулозы-5-фосфата в ксилулозу-5-фосфат; образование О- N- гликозидов, условия их гидролиза.
Химические свойства глюкозы
Получение: (C6H10O5)n + nH2O t,H+→ nC6H12O6
1.Спиртовое брожение:
C6H12O6 → 2C2H5-OH + 2CO2↑
2. Молочнокислое брожение:
C6H12O6 → 2СH3-CH-COOH
│
OH молочная кислота
3. Маслянокислое брожение:
C6H12O6 → C3H7COOH + 2H2 ↑+ 2CO2↑
II. Свойства альдегидов
1. Реакция серебряного зеркала: Качественная реакция
СH2OH(CHOH)4-COH + Ag2O t.NH3→ СH2OH(CHOH)4-COOH + 2Ag↓(глюконовая кислота)
Или СH2OH(CHOH)4-COH + 2[Ag(NH3)2]OH → СH2OH(CHOH)4-COONH4 + 2Ag↓+ 3NH3 +H2O
2. Окисление гидроксидом меди (II):
СH2OH(CHOH)4-COH + 2Cu(OH)2 t → СH2OH(CHOH)4-COOH + Cu2O + 2H2O
3. Восстановление:
СH2OH(CHOH)4-COH + H2 t,Ni → СH2OH(CHOH)4-CH2OH (сорбит – шестиатомный спирт)
III. Свойства многоатомных спиртов
1. Образование простых эфиров со спиртами
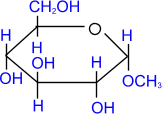
При действии метилового спирта в присутствии газообразного хлористого водорода атом водорода гликозидного гидроксила замещается на метильную группу.
α - глюкоза |
+ СH3ОН |
HCl(газ)→ |
|
+ H2О |
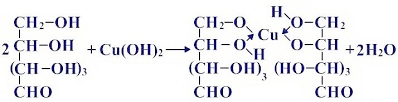
2. Качественная реакция многоатомных спиртов
Прильём к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт, образуя комплексное соединение – ярко синего цвета.
Превращение глю-6-фосфата во фруктозу-6-фосфат
превращение глю-6-фосфата в глюкозу-1-фосфат
рибулозы-5-фосфата в ксилулозу-6-фосфат