
- •5.Катализ: гомогенный и гетерогенный. Энергетический профиль каталитической реакции.
- •6.Химическое равновесие. Обратимые и необратимые по направлению реакции. Константа хим.Равновесия. Прогнозирование смещения хим.Равновесия.
- •7.Классификация растворов: по степени дисперсности; по степени насыщенности. Коллигативные свойства растворов: закон Рауля, понижение t замерзания р-ра, повышение t кипения р-ра.
- •8.Классификация дисперсных систем: по степени дисперсности; по агрегатному состоянию фаз; по силе межмолекулярного взаимодействия между дисперсной фазой и дисперсной средой.
- •10.Осмос, осмотическое давление, закон Вант-Гоффа. Осмоляльность и осмолярность биологических жидкостей.
- •11.Понятие о коллоидных растворах. Методы получения и очистки коллоидных растворов. Строение мицеллы. Коагуляция, порог коагуляции.
- •12.Факторы устойчивости коллоидных растворов. Механизм возникновения электрического заряда коллоидной частицы. Мицелла. Ядро. Гранула.
- •13.Ионное произведение воды. Методы определения рН растворов. Индикаторы.
- •14.Протолитические реакции. Понятия о кислотах и основаниях. Амфолиты. Ионизация слабых кислот и оснований. Константа кислотности и основности.
- •15.Буферные системы: определение, классификация, уравнение Гендерсона-Гассельбаха. Механизм действия буферных систем. Зона буферного действия и буферная емкость.
- •16.Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая, белковая. Взаимодействие буферных систем организма человека.
- •17.Понятие о кислотно-основном состоянии организма. Виды нарушения кос и способы коррекции.
- •18.Типы окислительно-восстановительных реакций, протекающих в организме.
- •19.Физико-химические принципы транспорта электронотранспортной цепи митохондрий.
- •20.Классификация комплексных соединений, их строение. Представления о строении металлоферментов и других биокомплексных соединений (гемоглобин, цитохромы ,кобаламины).
- •31.Изомерия моносахаридов: стереоизомерия, цикло-оксо-таутомерия, а- и в-аномерия на примере глюкозы.
- •34.Дисахариды: классификация (редуцируюище - мальтоза, целлобиоза, лактоза и нередуцирующие сахароза, трегалоза). Строение, химические свойства: гидролиз, окисление редуцирующих сахаров.
- •35.Классификация полисахаридов (гомо и гетерополисахариды ). Примеры.
- •36.Гомополисахариды: крахмал (амилоза и амилопектин), гликоген, декстран, целлюлоза. Структура, типы химических связей, гидролиз.
- •37.Липиды: определение, классификация.
- •39. Простые (нейтральные) липиды - триглицериды. Номенклатура, состав, строение, их гидролиз. Биологическая роль.
10.Осмос, осмотическое давление, закон Вант-Гоффа. Осмоляльность и осмолярность биологических жидкостей.
Осмос – самопроизвольный переход растворителя в р-р через полунепроницаемую перегородку.
Осмотическое давление – избыточное давление, которое необходимо приложить к раствору на высоте h=0, чтобы воспрепятствовать проникновению растворителя в раствор.
ЗАКОН ВАНТ-ГОФФА описывает зависимость ОСМОТИЧЕСКОГО ДАВЛЕНИЯ разбавленных растворов от температуры и молярной концентрации раствора.
Вант-Гофф выразил осмотическое давление формулой РV = iRT, где Р означает осмотическое давление вещества, растворенного в жидкости; V – объем; R – газовую постоянную; Т – температуру, i – коэффициент, который для газов часто равен 1, а для растворов, содержащих соли, – больше единицы.
Осмоляльность — это количество осмотически активных частиц в 1000г воды в растворе.
Осмолярность — это количество осмотически активных частиц в единице объема раствора.
1) Осмоляльность внеклеточной жидкости несколько выше, чем внутриклеточной, за счет белков плазмы.
2) Молекулы воды перемещаются в соответствии с осмотическим градиентом ионов так, что концентрации растворов выравниваются.
3) Осмоляльность определяют по снижению точки замерзания раствора. Существует также эмпирическое правило: осмоляльность = 2 [Na+], мэкв/л + АМК, мг% / 2,8 + глюкоза, мг% / 18. Осмоляльность мочи зависит от концентрационной способности почек. При минимальном объеме мочи ее осмоляльность максимальна. Максимальная осмоляльность мочи варьирует от 1200 мосмоль/кг у здорового ребенка (у грудных детей — 600—700 мосмоль/кг) до 300 мосмоль/кг при заболеваниях почек.
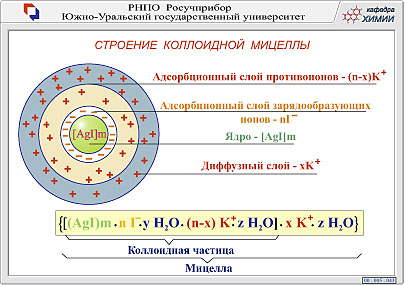
11.Понятие о коллоидных растворах. Методы получения и очистки коллоидных растворов. Строение мицеллы. Коагуляция, порог коагуляции.
Коллоидные растворы – высокодисперсные двухфазные системы, состоящие из дисперсионной среды и дисперсной фазы.
Методы очистки коллоидно -дисперсных систем:
А)Диализ — очистка золей от примесей с помощью полупроницаемых мембран, омываемых чистым растворителем.
Б)Электродиализ — диализ, ускоренный за счет электрического поля.
В)Ультрафильтрация — очистка путем продавливания дисперсионной среды вместе с низкомолекулярными примесями через полупроницаемую мембрану (ультрафильтр).
Дисперсионные методы получения золей:
механические
ультразвуковой
электрическое распыление в вольтовой дуге;
химическое диспергирование (пептизация):
Пептизация — переход осадка в золь под влиянием диспергирующих веществ — пептизаторов: электролитов, ПАВ, ВМС.
Адсорбционная пептизация. К осадку Fe(OH)3 добавляют раствор FeCl3. Ионы Fe3+ адсорбируются на кристаллах Fe(OH)3, достраивают кристаллическую решетку и образуют слой потенциалопределяющих ионов, ионы Cl– являются противоионами. Частицы приобретают заряд и переходят в золь
Диссолюционная пептизация –– обработка осадка электролитом, частично растворяющим его. В осадок Fe(OH)3 добавляется небольшое количество HCl.
Конденсационные методы получения золей:
Физический метод конденсации –– метод замены растворителя
Химические методы конденсации основаны на реакциях гидролиза, окисления, восстановления, обмена.
Коагуляция - это самопроизвольный физический процесс укрупнения частиц дисперсной фазы в результате потери агрегативной устойчивости под влиянием внешних факторов.
Порог коагуляции - наименьшее количество электролита, которое вызывает начало явной (заметной) коагуляции.
Следует отметить, что коагулирующая способность электролитов (ионов) неодинакова и может быть определена как величина, обратная порогу коагуляции: КС=1/ПК, где КС — коагулирующая способность электролитов; ПК — порог коагуляции, ммоль/л.
