
Svarovskaya_N.A._i_dr._Postroenie_diagrammy_azeotropnoy_smesi
.pdf
федеральное государственное автономное образовательное учреждение высшего образования «Российский государственный университет нефти и газа (национальный исследовательский университет) имени И.М. Губкина»
Кафедра физической и коллоидной химии
Сваровская Н.А., Бобкова Е.С.
ПОСТРОЕНИЕ ДИАГРАММЫ АЗЕОТРОПНОЙ СМЕСИ И РАСЧЁТ ЕЁ СВОЙСТВ
учебно-методическое пособие
Рекомендовано кафедрой физической и коллоидной химии РГУ нефти и газа (НИУ) имени И.М. Губкина в качестве учебно-методического пособия для студентов направлений 18.04.01 Химическая технология и 18.03.02 Энерго- и ресурсосберегающие процессы в химической технологии, нефтехимии и биотехнологии
Москва, РГУ нефти и газа (НИУ) имени И.М. Губкина,
2021
УДК 541
ББК 35.79
Г62
Сваровская Н.А. Построение диаграммы азеотропной смеси и расчёт её свойств [Электронный ресурс]: учебно-методическое пособие / Н.А. Сваровская, Е.С. Бобкова. – М.: РГУ нефти и газа (НИУ) имени И.М. Губкина, 2021. – 1,02 Мб – Электрон.дан. – 1 электрон.опт.диск (CD-ROM); 12 см. – Систем.требования: компьютер IBM-PC совместимый; монитор, видеокарта, поддерживающ. разреш.1024x768; привод CD_ROM; программа для чтения pdf-файлов. – Загл.с этикетки диска.
Рецензент: профессор РГУ нефти и газа (НИУ) имени И.М. Губкина, доктор химических наук, профессор В.Д. Стыценко.
Рассмотрена возможность применения закона Рауля к реальным жидким системам и условия их отклонения от свойств идеальных растворов. Обоснованы условия положительных и отрицательных отклонений от закона Рауля и условия существования азеотропных систем. Показана особенность правила фаз Гиббса, закона равновесия фаз при рассмотрении гетерогенных равновесий в точке азеотропа. Для конкретных модельных веществ приведен алгоритм выполнения домашнего задания для азеотропной системы.
Учебно-методическое пособие по курсу “Физическая химия растворов” соответствует требованиям ФГОС ВПО квалификации бакалавр и предназначены для студентов направлений 18.03.01 – Химическая технология и 18.03.02 – Энерго- и ресурсосберегающие процессы в химической технологии, нефтехимии и биотехнологии.
Минимальные системные требования:
Тип компьютера, процессор, частота: IBM-PC совместимый
Видеосистема: монитор, видеокарта, поддерживающая разрешение1024x768 Дополнительное оборудование: привод CD-ROM
Дополнительное программное обеспечение: программа для чтения pdf-файлов.
©РГУ нефти и газа (НИУ) имени И.М. Губкина, 2021
©Н.А. Сваровская, Е.С. Бобкова, 2021
1. Фазовые равновесия в реальных растворах жидких систем
Закон Рауля для реальных растворов не выполняется во всей области изменения концентраций веществ в растворе. Поэтому, для
реальных растворов диаграммы состояния “свойство – состав“, строят только на основе экспериментальных данных [1]. Опытные данные показывают, что закон Рауля достаточно хорошо выполняется для систем, в
которых молекулы компонентов А и В в чистом виде взаимодействуют друг с другом приблизительно с такой же силой (F), как и в смеси: FА-А ≈ FВ-В ≈ FА-В.
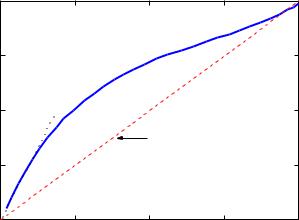
Если компоненты раствора существенно отличаются по физическим и химическим свойствам, то такие растворы подчиняются закону Рауля лишь в области очень малых концентраций, только при концентрациях, мольная доля которых стремится единице (хi →1), как показано на рисунке 1.
|
1,00 |
|
|
|
|
доля пара |
0,75 |
|
|
|
|
0,50 |
|
|
|
|
|
Mольная |
|
|
|
|
|
|
|
закон Рауля |
|
||
0,25 |
|
|
|
|
|
|
|
|
|
|
|
|
0,00 |
0,25 |
0,50 |
0,75 |
1,00 |
|
|
||||
|
|
Cостав, мольная доля жидкости |
|
||
Рис. 1 – Зависимости состава паровой фазы от состава жидкой реального раствора
Обратите внимание на то, что поведение жидкости в бинарном растворе, мольная доля которой изменяется в интервале 0,95<хi<1, условно подчиняется закону Рауля.
3
Поведение второй жидкости, мольная доля которой в растворе изменяется в интервале 0,00<хi<0,05, то есть для предельно разбавленных растворов (ПРР), подчиняется закону Генри, как показано на рисунке 2 [2].
|
p |
PBo |
|
область закона Рауля |
|
, Па |
PAo |
|
Давление |
идеальный |
|
раствор |
|
|
|
|
|
|
область закона Генри |
|
|
A |
B |
|
XB |
|
|
Состав, мольный % |
|
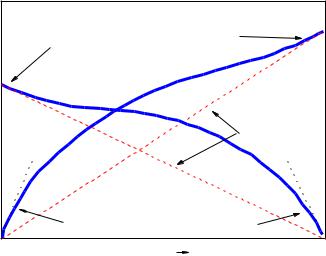
Рис. 2 – Области выполнимости законов Рауля и Генри |
||
Общее давление насыщенного пара и парциальные давления компонентов для реальных растворов не следуют закону Рауля. Значения их больше или меньше паров идеальных растворов, обозначены пунктирными линиями, показано на рисунке 2.
Если полученные в эксперименте давления паров (парциальные давления компонентов и общее давление над смесью) больше, чем вычисленные по закону Рауля, то такие отклонения называют
положительными, диаграмма приведена на рисунке 3 слева. Если же давления паров по экспериментальным данным оказываются меньше вычисленных, то это система с отрицательным отклонением от закона Рауля, диаграмма приведена на рисунке 3 справа.
4
|
|
T = const |
|
|
|
T = const |
|
||
РАо |
Р |
общ |
|
|
РАо |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Р |
о |
|
Робщ |
о |
|
|
|
|
|
|
|
|||
Па |
|
|
|
|
B |
|
РB |
||
, |
|
|
|
|
|
|
|
|
|
Давление |
РB |
|
|
|
|
Область малых |
|
|
|
|
Р |
|
|
концентраций, |
|
|
|
||
|
А |
|
при которой |
РА |
РB |
|
|||
|
|
|
|
|
|||||
|
|
|
|
|
выполняется |
|
|||
|
|
|
|
|
|
закон Рауля |
|
|
|
|
А Cостав, мольн. % |
|
B |
|
А Cостав, мольн. % |
B |
|||
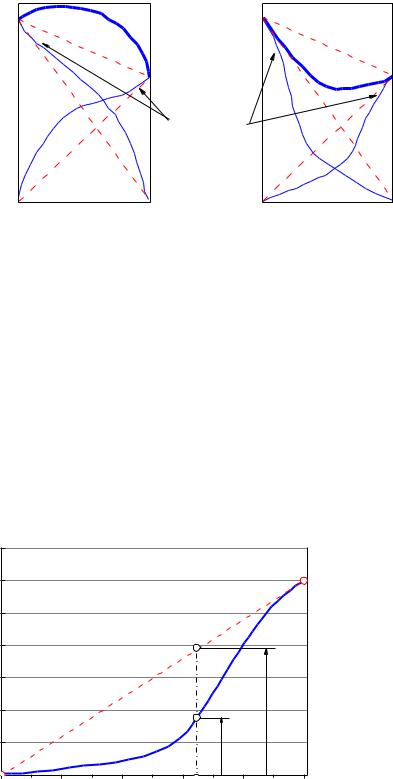
Рис. 3 – Отклонения от закона Рауля на диаграммах “давление –состав“: слева – положительные; справа – отрицательные
В области разбавленных растворов разница между давлением
насыщенного пара компонента в реальном и идеальном растворе обычно
мала, поэтому в области низких концентраций растворённого вещества закон
Рауля выполняется, как показано на рисунках 3 и 4. |
|||||
T = const |
|
|
|
РВо |
|
,Па |
|
|
|
|
|
Давление |
|
|
|
|
РВ(расч) |
|
|
|
|
|
|
|
|
|
|
РВ(эксп) |
|
0,0 |
0,2 |
0,4 |
0,6 |
0,8 |
1,0 |
|
Mольная доля компонента B |
|
|||
Рис. 4 – Зависимость парциального давления компонента В при отрицательном отклонении от закона Рауля
5
Положительные отклонения от закона Рауля характерны для систем, в которых силы взаимодействия между одинаковыми молекулами больше сил, действующих между молекулами, разными по природе:
FА-А > FА-В < FВ-В.
В системах с положительными отклонениями при смешении двух жидкостей межмолекулярные силы уменьшаются, и молекулам легче перейти в газовую фазу. Иногда говорят, что в таких системах “эффекты диссоциации, то есть разрушения ассоциатов, доминируют над эффектами сольватации”.
Растворы с положительными отклонениями образуются из компонентов и протекают с поглощением теплоты. Общий объём такого раствора больше, чем сумма исходных объёмов компонентов.
В случае, если силы взаимодействия между разнородными по природе молекулами больше сил, действующих между одинаковыми молекулами,
тогда эффекты сольватации доминируют над эффектами ассоциации:
FА-А<FА-В>FВ-В и в поведении раствора наблюдаются отрицательные отклонения от закона Рауля. Молекулы в этом случае с большей силой удерживаются в жидкости, что приводит к понижению давления пара над раствором. Эти растворы образуются с выделением теплоты и общий объём раствора оказывается меньшим, чем сумма исходных объёмов компонентов.
В случае чрезвычайно сильных отклонений, как, например, для смеси этиловый спирт-изооктан, (смотри рисунок 5), линия жидкости проходит через максимум. В случае чрезвычайно сильных отрицательных отклонений,
как, например, для смеси “четыреххлористое олово–бутилацетат“, (смотри рисунок 5), линия жидкости проходит через минимум.
6
|
100 |
|
|
|
25 |
о |
С |
400 |
90 |
о |
С |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
. ст. |
80 |
|
|
|
|
|
ст. |
300 |
|
|
|
|
|
|
|
|
Давление, мм рт |
|
|
|
|
|
Давление, мм рт. |
|
|
|
|
|
|
|
|
|
|
60 |
|
|
|
|
|
200 |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
100 |
|
|
|
|
|
|
|
|
||
400 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
20 |
40 |
60 |
80 |
|
100 |
|
|
|
|
|
|
|
|
|
|
|
изооктан |
|
Состав, мольн. % |
С2Н5ОН |
0 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
0 |
|
20 |
40 |
60 |
80 |
100 |
||||
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
бутилацетат |
|
|
|
SnCl |
4 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Состав, мольн. % |
|
|
|
|
Рис. 5 – Диаграмма “давление-состав“ для систем “этиловый спирт– изооктан“ (слева) и “четырёххлористое олово–бутилацетат“
Чем больше разность значений рАо и рВо , тем большими должны быть отклонения от закона Рауля и условия для образования экстремума –
максимума для положительных и минимума для отрицательных отклонений
соответственно [4].
На кривых зависимостей “температур кипения–состав“, минимум
определяет положительные отклонения, а максимум – отрицательные отклонения свойств растворов от закона Рауля. И чем разность значений между ТАкип и ТВкип больше, тем сильнее выражен экстремум. Для таких систем выполняется второй закон Коновалова, установленный им экспериментально в 1881 году.
Второй закон Коновалова гласит, что в точках экстремума на кривых общего давления насыщенного пара над раствором состав жидкости
и находящегося с ней в равновесии насыщенного пара одинаков.
По второму закону Коновалова на кривых “температуры кипения-
состав“ (“давления пара-состав“), дающих экстремумы, обе кривые – кривая пара и кривая жидкости должны касаться друг друга в точке экстремума.
7
Жидкие смеси, состав которых отвечает точкам экстремумов на диаграмме, называют нераздельно кипящими (постоянно кипящими) или
азеотропными смесями.
Азеотропы – растворы, обладающие экстремумами давления и температуры (греч.: а – приставка, означающая отрицание или отсутствие чего-либо, zeo – кипение и trope – изменение, поворот).
Смесь, состав жидкой фазы которой равен составу паровой фазы,
называется предельной смесью [5]. Азеотропная смесь не является химическим соединением, а является смесью с предельными отклонениями от свойств идеальных растворов. Азеотропные растворы кипят при постоянной температуре, а их состав при перегонке не изменяется.
Следовательно, в азеотропной точке на систему накладывается дополнительное условие: равенство составов жидкости и пара,
постоянство р и Т, что приводит к изменению вида правила фаз Гиббса
(закон равновесия фаз) в азеотропной точке. В азеотропной точке можно определять лишь условное число степеней свободы С*азеотр по формуле
С*азеотр = К – Ф + 0 = 2–2= 0.
Для всех других фигуральных точек диаграммы, построенной на плоскости (при р=const или Т= const), правило фаз устанавливает связь между числом степеней свободы (С), числом компонентов (К), числом
фаз (Ф) и числом внешних независимых интенсивных параметров (n),
воздействующих на систему произвольного состава, которая находится в равновесии и имеет вид: С = К– Ф+1.
Жидкие летучие смеси с азеотропом, свойства которых имеют положительные или отрицательные отклонения от свойств идеальных растворов, не поддаются разделению с помощью фракционной
перегонки. Причина заключается в наличие на кривых “температуры кипения-состав“ максимума либо минимума, в которых наблюдается
8
равенство химических потенциалов, вследствие чего движущая сила процесса разгонки (различие в составе фаз) становится равной нулю.
Азеотропные растворы с положительными отклонениями в азеотропной точке имеют самую низкую температуру кипения, как показано на рисунке 6, поэтому фракционная перегонка такого раствора приведёт к отгону азеотропной смеси. В конденсате (отгоне) будет всегда азеотропный раствор.
|
p = const |
|
|
|
кипения |
|
Пар |
|
Пар |
|
|
|
||
Температура |
Жидкость |
|
Жидкость |
|
|
|
|
||
|
|
|
|
|
|
С |
|
x |
D |
|
|
|
Чистый компонент В |
|
Чистый компонент А |
|
xВ |
||
|
|
|||
|
|
Состав, мольная доля |
||
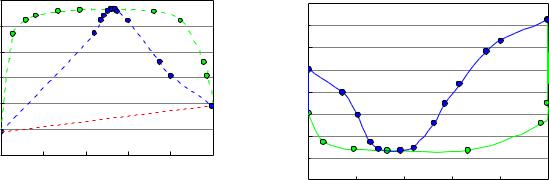
Рис. 6 – Фазовая диаграмма состояния с положительными отклонениями, имеющая минимальную температуру кипения
Например, для системы, представленной на рисунке 6, состав азеотропа представлен точкой (х) и он имеет самую низкую температуру кипения. В зависимости от исходного состава смеси, например, для состава,
отмеченного точкой С, (смотри рисунок 6), в кубовом остатке будет чистый
компонент А, а для исходного состава, отмеченного точкой D, в кубовом остатке будет чистый компонент В.
Перегонка растворов азеотропа с положительными отклонениями любого состава приведёт к концентрированию в кубовом остатке тех компонентов, которые в исходном растворе находились в избытке, по сравнению с составом азеотропной смеси – компонента В, в области
9

концентраций правее азеотропной точки, или компонента А, в области концентраций левее азеотропной точки.
Азеотропные растворы с отрицательными отклонениями от закона Рауля в азеотропной точке имеют самую высокую температуру кипения.
Перегонка растворов такого типа с максимумом температуры кипения на диаграммах состояния, которая приведена на рисунке 7, приведёт к обогащению в отгоне компонента А или В, которые находились первоначально в избытке по отношению к азеотропному раствору.
Рассмотрим диаграмму, приведённую на рисунке 7.
|
|
|
|
Состав пара, мол. % |
|
|
||
Tk |
|
|
|
|
в |
д |
б |
|
|
|
|
|
|
|
|
||
400 |
|
Пар |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
T2 |
|
|
|
|
|
|
|
|
390 |
|
Раствор |
|
|
O |
|
|
|
T3 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
380 |
|
|
|
|
|
|
|
|
T1 |
|
|
|
|
|
|
|
|
370 |
|
|
|
|
|
|
|
|
360 |
|
|
|
|
|
|
|
|
|
|
|
Азотропный |
|
|
|
|
|
|
|
|
состав |
|
|
|
|
|
350 |
|
20 |
|
40 |
60 |
80 |
B, |
|
|
A, |
|
||||||
(C |
H |
COOH) |
г |
е |
а |
|
(HNO5) |
|
2 |
5 |
|
|
|
|
|
|
|
|
|
|
|
Состав раствора, мол. % |
|
|
||
Рис. 7 – Диаграмма состояния азеотропа с отрицательными отклонениями
Азеотроп В:А (HNO3:C2H5COOH) имеет состав 32:68 мольных %. Для исходной смеси, например, для состава исходной смеси, отмеченной точкой
(а), концентрации компонентов В и А равны 59 и 41 мольных %. При температуре Т1 и будет выкипать компонент В до тех пор, пока состав пара,
смотри точку (b) не будет равен составу исходной смеси, отмеченной точкой
(а). При этом количество в жидкой фазе компонента В будет уменьшаться и определяться при температуре Т3 составом, определённой точкой (е), а при температуре Т2, почти 400 К, составом, определённой точкой (г). Состав
10
