
- •Поверхностные явления и адсорбция
- •Физический смысл поверхностного натяжения
- •Принцип минимума свободной энергии: в системах, обладающих избытком свободной энергии, могут самопроизвольно протекать
- •Адсорбция – процесс самопроизвольного изменения концентрации какого-либо вещества у поверхности раздела двух фаз
- •Адсорбция определяется природой поглощаемого вещества и поглотителя, ее величина зависит от температуры, давления
- •Теория мономолекулярной адсорбции Лэнгмюра
- •Типичная изотерма мономолекулярной адсорбции на твердой поверхности
- •Для адсорбции из растворов: Для адсорбции газов:
- •Уравнение Фрейндлиха
- •Изотерма адсорбции Фрейндлиха
- •Для экспериментального определения величины адсорбции на поверхности твердого тела используется уравнение:
- •Адсорбция на границе границе жидкость (раствор) – газ
- •Для разбавленных растворов активность равна концентрации, и уравнение
- •Зависимость поверхностного натяжения от концентрации вещества
- •Правило Дюкло-Траубе — поверхностная активность ПАВ одного и того же гомологического ряда в
- •Дисперсные системы
- •по агрегатному состоянию
- •По степени взаимодействия частиц дисперсной фазы (ДФ)
- •Методы получения лиофобных коллоидных систем
- •Условия для образования коллоидных растворов химическим методом
- •Химическая конденсация
- •Пептизация –заключающийся в
Поверхностные явления и адсорбция
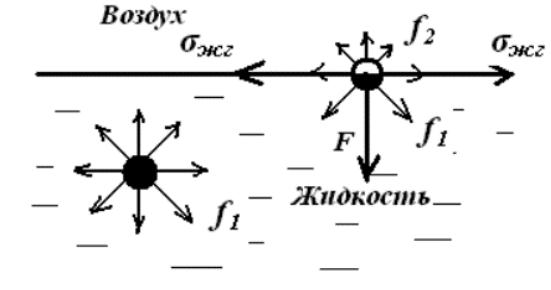
Поверхностные явления — это процессы, происходящие на границах раздела фаз, составляющих физико-химические системы, и обусловленные особенностями состава и строения поверхностного слоя.
Поверхностная фаза образована частицами, находящимися на поверхности каждой фазы. Поверхностная энергия Gs - разность средней энергии частицы, находящейся на поверхности, и частицы, находящейся в объеме фазы, умноженная на число частиц на
поверхности Ns: |
GS NS (gS gV ) |
|
|
GS S |
|
σ – поверхностное натяжение (отношение |
|
поверхностной энергии к площади поверхности |
|
раздела фаз); |
f1 >> f2 |
величина поверхностного натяжения зависит |
только от природы обеих фаз. |

Физический смысл поверхностного натяжения
Энергетический:
поверхностное натяжение – работа обратимого изотермического процесса, затраченная на образование единицы площади поверхности раздела фаз.
Знак минус говорит о том, что положительная работа совершается при уменьшении или сокращении поверхности.
GSS
Силовой:
поверхностное натяжение – сила, направленная тангенциально (параллельно) к поверхности и приходящаяся на единицу длины периметра, ограничивающего эту поверхность.
FlS
Принцип минимума свободной энергии: в системах, обладающих избытком свободной энергии, могут самопроизвольно протекать процессы, понижающие запас энергии.
Пути уменьшения свободной энергии:
Если GS (σ) < 0 находящиеся на поверхности частицы взаимодействуют с частицами этой же фазы слабее, чем с частицами другой фазы (gS < gV).
Уменьшение поверхностной энергии возможно в результате уменьшения площади поверхности S. Уменьшение суммарной поверхности для коллоидных частиц проявляется
всамоукрупнении – коагуляции, для чистых жидкостей – в шарообразной форме капель.
Если GS (σ) > 0 находящиеся на поверхности частицы взаимодействуют с частицами этой же фазы сильнее, чем с частицами другой фазы (gS > gV).
Уменьшение поверхностной энергии возможно в результате уменьшения поверхностного натяжения σ. Поверхностное натяжение может быть уменьшено за счет притяжения к поверхности коллоидной частицы молекул, атомов или ионов из
окружающей среды.
Адсорбция – процесс самопроизвольного изменения концентрации какого-либо вещества у поверхности раздела двух фаз называется.
Адсорбент – вещество, на поверхности которого происходит адсорбция.
Адсорбтив или адсорбат –вещество, которое адсорбируется на поверхности.
В зависимости от природы адсорбционных сил выделяют:
Физическая адсорбция возникает за счет ван-дер-ваальсовых взаимодействий. Обратима, уменьшается и при повышении температуры.
Химическая адсорбция (хемосорбция) осуществляется путем химического взаимодействия молекул адсорбента и адсорбата. обычно необратима; локализована, т.е. молекулы адсорбата не могут перемещаться по поверхности адсорбента. Увеличивается при повышении температуры.
Адсорбция определяется природой поглощаемого вещества и поглотителя, ее величина зависит от температуры, давления поглощаемого газа, концентрации раствора, из которого осуществляется адсорбция.
Для количественного описания адсорбционных процессов применяю две величины:
•Полная адсорбция (А) – полное количество адсорбата в поверхностном слое, отнесенное к единице площади поверхности или массы адсорбента (моль/м2, моль/г). Может принимать только положительные значения.
•Гиббсовская (избыточная) адсорбция (Г) – избыточное количество адсорбата в поверхностном слое по сравнению с его концентрацией в объемной фазе, отнесенное к единицы площади поверхности или массы адсорбента (моль/м2, моль/г). Может быть как положительной, так и отрицательной.
Теория мономолекулярной адсорбции Лэнгмюра
Адсорбция является локализованной и вызывается силами, близкими к химическим.
Адсорбция происходит не на всей поверхности адсорбента, а на активных центрах (выступы либо впадины на поверхности адсорбента). Активные центры независимы и (один активный центр не влияет на адсорбционную способность других) и тождественны.
Каждый активный центр способен взаимодействовать только с одной молекулой адсорбата; в результате на поверхности может образоваться только один слой адсорбированных молекул.
Процесс адсорбции является обратимым и равновесным .
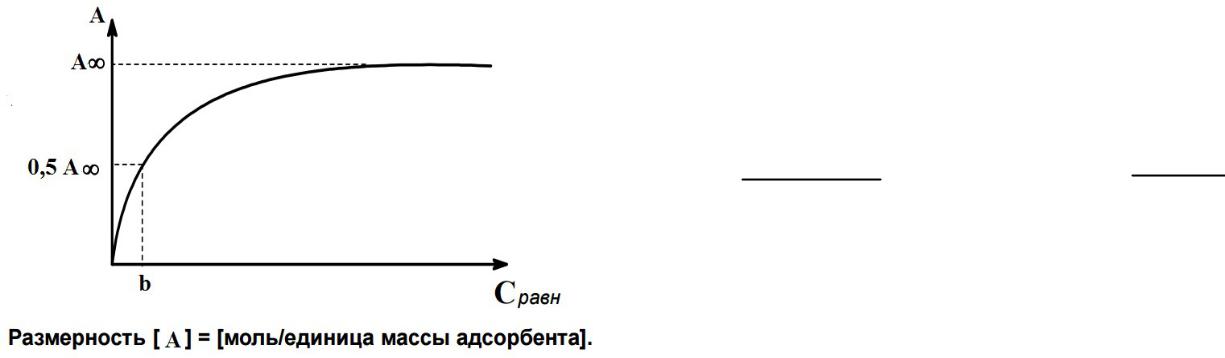
Типичная изотерма мономолекулярной адсорбции на твердой поверхности
Для адсорбции из |
Для адсорбции |
|||
растворов: |
газов: |
|||
|
|
Сравн |
р |
|
A A Сравн b |
А А b р |
|||
А |
x |
x – количество адсорбированного |
||
вещества (моль); |
||||
m |
||||
|
m – масса адсорбента (г, кг). |
|||
А – адсорбция в состоянии адсорбционного равновесия; А∞ — величина предельной
(максимальной) адсорбции, постоянная для всего гомологического ряда адсорбатов; b — постоянная для данного вещества, численно равная равновесной концентрации адсорбата при адсорбции, равной половине предельной, моль/л; Сравн ─ равновесная
концентрация адсорбата в фазе над адсорбентом; р - давление газа в состоянии адсорбционного равновесия (Па).

Для адсорбции из растворов: Для адсорбции газов:
|
k С |
|
|
|
|
|
k р |
|
А А 1 k С |
|
|
А А 1 k р |
|||||
десорбции |
|
адсорбции |
|
1 |
|
|||
b |
|
|
[моль/л] |
K |
|
|
|
[л/моль] |
|
|
|||||||
адсорбции |
|
десорбции |
|
b |
|
|||
Отклонение от теории Ленгмюра является результатом неоднородной поверхности, которая характеризуется наличием неодинаковых адсорбционных центров обладающих различным сродством с адсорбируемым веществом. Если поверхность энергетически неоднородна, используют эмпирическое уравнение Френдлиха.
Уравнение Фрейндлиха
для адсорбции из раствора |
для адсорбции газа |
|||||
А |
x |
a Cn |
А |
x |
a рn |
|
m |
m |
|||||
|
|
|
|
|||
А – удельная величина адсорбции, моль/г; х – количество адсорбированного вещества, моль; m – масса адсорбента, г;
С – равновесная концентрация после адсорбции, моль/л; a, n – константы (аппроксимационные параметры).
Константа a –количество вещества, адсорбированное 1 г адсорбента при С = 1моль/л. Для каждого адсорбатива a имеет свое значение при одном и том же адсорбенте, т.е. она характеризует способность данного адсорбата адсорбироваться определенным адсорбентом/
Константа n всегда меньше 1
