
- •Фазовые равновесия
- •Компонент - индивидуальное химическое вещество, которое является составной частью системы, может быть выделено
- •Число степеней свободы (С) – число параметров состояния системы, которые могут быть одновременно
- •уравнение Клапейрона–Клаузиуса:
- •Диаграммы однокомпонентных системы
- •Фазовая диаграмма воды
- •Растворы
- •Коллигативные свойства растворов неэлектролитов
- •2. Понижение давления пара растворителя над раствором
- •Если растворенное вещество летучее:
- •Зависимость общего и парциальных давлений компонентов от состава реального раствора
- •3. Температуры кипения и замерзания растворов
- •Коллигативные свойства растворов электролитов
- •Диаграммы двухкомпонентных системы
- •Состав фазы – это процентное содержание в данной фазе (жидкой или твердой) вещества
- •Изоморфные системы – системы, состоящие из компонентов, неограниченно растворимых друг в друге как
Фазовые равновесия
Фаза – часть гетерогенной системы, ограниченная поверхностью раздела фаз и в отсутствие внешних воздействий характеризующаяся одинаковыми физико- химическими свойствами во всех точках.
Классификация систем по числу фаз:
Однофазные
Двухфазные
Трехфазные
Многофазные
Условия фазового равновесия в гетерогенной системе: равенство температур и давлений во всех фазах системы.
Компонент - индивидуальное химическое вещество, которое является составной частью системы, может быть выделено из нее и существовать самостоятельно.
Число независимых компонентов (К) системы равно числу компонентов минус число возможных химических реакций между ними.
H2+He+Ar: К=3
CaCO CaO CO |
|
3 |
К=3-1=2 2 |
Классификация систем по числу компонентов:
Однокомпонентные
Двухкомпонентные
Трехкомпонентные
Многокомпонентные
Число степеней свободы (С) – число параметров состояния системы, которые могут быть одновременно произвольно изменены в некоторых пределах без изменения числа и природы фаз в системе.
Классификация систем по степеней свободы:
Инвариантные (С=0)Моновариантные (С=1)Бивариантные (С=2)
Правило фаз Гиббса: число степеней свободы (С) равновесной термодинамической системы равно числу независимых компонентов системы К минус число фаз Ф плюс число внешних факторов, влияющих на равновесие.
С= К – Ф + 2
С= К – Ф + 1 для систем с участием конденсированной фазы
уравнение Клапейрона–Клаузиуса: |
dP |
|
Hф.п. |
|
dT |
Vф.п. Tф.п |
|||
|
|
Если |
Vфп = Vг, то Vг = RT/P |
dP |
|
p Hф.п. |
dT |
2 |
|||
|
|
|
R Tф.п |
ln |
p2 |
H (T2 T1 ) |
||
p |
||||
|
R T T |
|||
|
1 |
1 |
2 |
|
Диаграммы однокомпонентных системы
С=3 – Ф
Фазовая диаграмма (диаграмма состояния) - графическое изображение зависимости Р от Т (Р от состава или Т от состава).
Принцип непрерывности: при непрерывном изменении параметров состояния все свойства отдельных фаз изменяются также непрерывно; свойства системы в целом изменяются непрерывно до тех пор, пока не изменится число или природа фаз в системе, что приводит к скачкообразному изменению свойств системы.
Принцип соответствия: на диаграмме состояния каждой фазе соответствует своя часть плоскости, которая называется полем фазы.
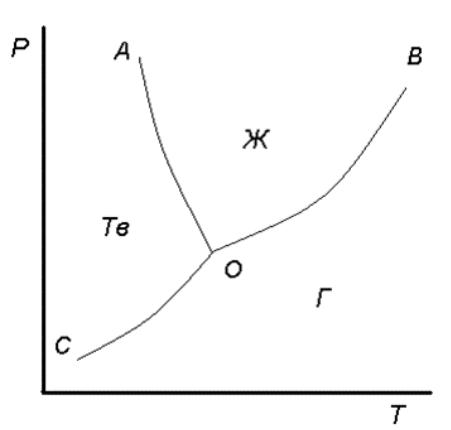
Фазовая диаграмма воды
С = 2 |
ОB – зависимость давления насыщенного |
|
пара воды от температуры |
||
|
||
|
ОС – зависимость давления насыщенного |
|
|
пара надо льдом от температуры |
|
С = 2 |
ОA – зависимость температуры плавления |
|
льда от давления |
||
|
||
С = 2 |
С = 1 |
|
|
тройная точка О: Р = 6.1 кПа, Т = 273.16 К |
|
|
С = 0 |
Равновесие Ж Г: Hфп 0 , Vфп 0, dP/dT > 0, наклон вправо Равновесие Т Ж : Hфп 0 , Vфп 0, dP/dT 0, наклон влево
Растворы
Раствор – гомогенная система, состоящая из двух или более компонентов, состав которой может непрерывно изменяться в некоторых пределах без скачкообразного изменения её свойств.
Растворитель – компонент, присутствующий в растворе в преобладающем количестве либо компонент, кристаллизующийся первым при охлаждении раствора.
Насыщенный раствор – раствор, содержащий при данных условиях максимальное количество растворенного вещества и находящийся в равновесии с избытком растворенным веществом.
Идеальные растворы в конденсированных фазах образуются компонентами, близкими по химической природе, у которых взаимодействие между всеми молекулами одинаково, образуются без теплового эффекта, но с уменьшением свободной энергии Гиббса. Близки к идеальным бесконечно разбавленные растворы, в которых можно пренебречь взаимодействием частиц растворителя и растворенного вещества между собой.
Коллигативные свойства растворов неэлектролитов
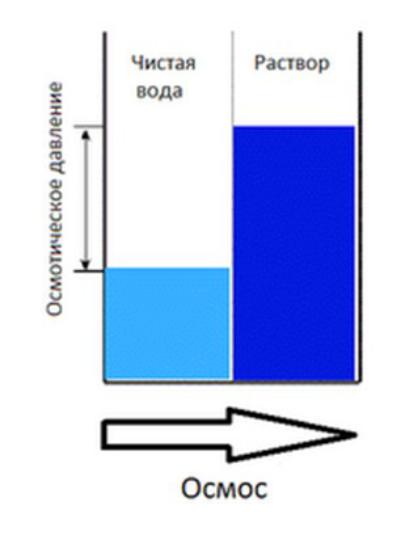
1. Осмотическое давление
Осмос – явление самопроизвольного перехода молекул растворителя через мембрану из растворителя в раствор или из более концентрированного раствора в менее концентрированный.
Осмотическое давление – давление, которое нужно приложить к раствору, чтобы понизить его уровень до уровня растворителя.
Закон Вант-Гоффа: осмотическое давление пропорционально концентрации молярной концентрации
= с·RT
2. Понижение давления пара растворителя над раствором
Закон Рауля: парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причем коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
pi pi0 Xi
Относительное понижение давления пара растворителя над раствором равно мольной доле растворенного вещества и не зависит от природы растворенного
вещества. |
p0 |
p |
|
|
Xв ва |
||
|
p0 |
|
|
|
|
|
P0 – давление насыщенного пара растворителя над чистым
растворителем
и P – давление насыщенного пара растворителя над раствором X – мольная доля
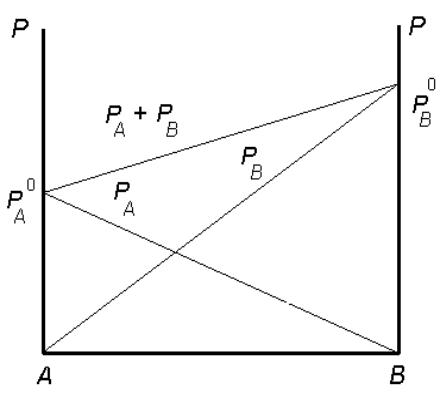
Если растворенное вещество летучее:
Р = ХАРА0 + ХВРВ0
ХА + XВ = 1
Р = РА0 + ХВ (РВ0 – РА0 )
Зависимость общего и парциальных давлений компонентов от состава идеального раствора
