
- •Химическая термодинамика количественно определяет тепловые эффекты различных процессов, выясняет принципиальную возможность самопроизвольного течения
- •Параметры состояния – физические величины, характеризующие состояние термодинамической системы .
- •Функции состояния - параметры состояния, которые не поддаются непосредственному измерению (внутренняя энергия, энтальпия,
- •Классификация процессов
- •Внутренняя энергия (U) сумма всех видов энергии кроме кинетической и потенциальной энергии системы
- •Первое начало термодинамики
- •Тепловой эффект (теплота) химической реакции – количество теплоты, выделившейся либо поглотившейся в ходе
- •Закон Гесса:
- •Алгебраическое сложение термохимических уравнений
- •Расчет по стандартным теплотам
- •Пример:
- •Расчет по стандартным теплотам сгорания
- •Пример:
Химическая термодинамика количественно определяет тепловые эффекты различных процессов, выясняет принципиальную возможность самопроизвольного течения химических реакций и условия, при которых химические реакции могут находиться в состоянии равновесия.
Система – тело или группа тел, находящихся во взаимодействии и отделенных от окружающей среды реальной или воображаемой границей.
Окружающая среда – это все, что находится в прямом или косвенном контакте с системой. Принято считать, что окружающая среда имеет такой большой размер, что отдача или приобретение ею теплоты не изменяет ее температуру.
Фаза – это часть системы, отделенная от других частей системы поверхностью раздела фаз и характеризующаяся одинаковыми физико-химическими свойствами во всех ее точках.
|
Система |
гомогенная (однородная) |
гетерогенная (неоднородная) |
состоит из одной фазы |
состоит из нескольких фаз |
•воздух
•кристалл соли
По характеру взаимодействия с окружающей средой:
Открытая |
Закрытая |
Изолированная |
Обменивается |
Не может |
Не имеет обмена |
энергией и |
обмениваться |
веществом и энергией. |
веществом с |
веществом, но |
Внутренняя энергия |
окружающей |
может энергией и |
системы остается |
средой. |
работой. |
постоянной. |

Параметры состояния – физические величины, характеризующие состояние термодинамической системы .
Экстенсивные - значения зависят от массы (объем, масса, внутренняя энергия, теплоемкость и др.). Обладают свойством аддитивности.
Интенсивные не зависят от массы (температура, давление, плотность, концентрация и др.). Свойством аддитивности не обладают, они определяются природой системы.
Независимые параметры состояния (основные) - параметры, которые поддаются непосредственному измерению:
• |
масса |
• |
состав |
|
• |
объем |
|||
• |
теплоемкость |
|||
• |
давление |
|||
|
|
Функции состояния - параметры состояния, которые не поддаются непосредственному измерению (внутренняя энергия, энтальпия, энтропия, термодинамические потенциалы).
! Значения функций состояния не зависит от пути перехода, а определяется лишь начальным и конечным состоянием системы.
Термодинамический процесс - изменение термодинамического состояния системы (изменения хотя бы одного параметра состояния).
изотермические – T=const;
изобарные – P=const;
изохорные – V=const;
адиабатные – протекают без теплообмена с окружающей средой.
Классификация процессов
По самопроизвольности:
Самопроизвольный протекает без затрат энергии извне.
Несамопроизвольный требует затрат энергии извне.
По обратимости
Обратимый - процесс, при котором система может вернуться в первоначальное состояние без каких-либо изменений как в самой системе, так и во внешней среде.
Необратимый - при протекании процесса в прямом и обратном направлении в системе или окружающей среде происходят какие-либо изменения.
Внутренняя энергия (U) сумма всех видов энергии кроме кинетической и потенциальной энергии системы как целого.
ΔU=U2-U1; ΔU=0 в изолированных системах
Энтальпия (H) – теплосодержание системы H=U+pV
Теплота (Q) (тепловой эффект процесса) – форма передачи энергии, реализуемая путем изменения кинетической энергии теплового (хаотического) движения частиц (атомов, молекул).
Работа (А) – форма обмена энергией с окружающей средой, реализуется путем упорядоченного движения молекул под действием определенной силы.

Первое начало термодинамики
Энергия не исчезает и не возникает из ничего, переход ее из одного вида в другой происходит в строго эквивалентных количествах.
Полная энергия изолированной системы постоянна.
Невозможно создать вечный двигатель (perpetuum mobile) первого рода, т.е. такую периодически действующую машину, которая производила бы работу без затрат энергии извне.
Тепло, сообщенное системе в каком-либо процессе, расходуется на приращение внутренней энергии системы и совершение работы.
Q – теплота процесса Q = U + А A – работа процесса
U – изменение внутренней энергии системы
-Q – теплота выделяется; +Q – теплота поглощается

Изохорный процесс (V = const; ΔV =
0):
Q U A |
Q U A |
A p V 0 |
A p V 0 |
QV U |
QV U |
|
QV CV (T2 T1 ) |
Изобарный процесс (Р =
const): |
T1 ) |
|
A p V R(T2 |
Qp U p V |
|
|
|
|
|
|
Qp H |
|
|
QP CP(T2 T1 ) |
Q U A
A p V 0
QV U
cV – теплоемкость при постоянном объеме
H U pV
cP – теплоемкость при постоянном давлении
CP – CV=R R=8,31 Дж/(моль·К)
Изотермический процесс (Т = const; ΔU = 0):
A RT ln V2 |
RT ln |
p1 |
QT A |
|
|
||||
V |
|
p |
2 |
|
1 |
|
|
|
|

Тепловой эффект (теплота) химической реакции – количество теплоты, выделившейся либо поглотившейся в ходе реакции.
Экзотермические реакции протекают с выделением теплоты ΔH<0, Q>0
Эндотермические реакции протекают с поглощением теплоты ΔH>0, Q<0
Q= – ΔH
H
H
2( |
г) |
1 |
2 |
O |
2(г) |
H |
O |
(ж) |
H 285,9 кДж |
1 |
|
2 |
|
|
|||||
2( |
г) |
2 |
O |
2(г) |
H |
O |
(г) |
H 241,9 кДж |
|
|
|
2 |
|
|
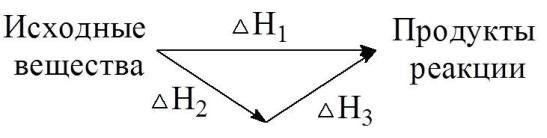
Закон Гесса:
Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
H1 H2 H3
Тепловой эффект (энтальпия)реакции r H 0298
