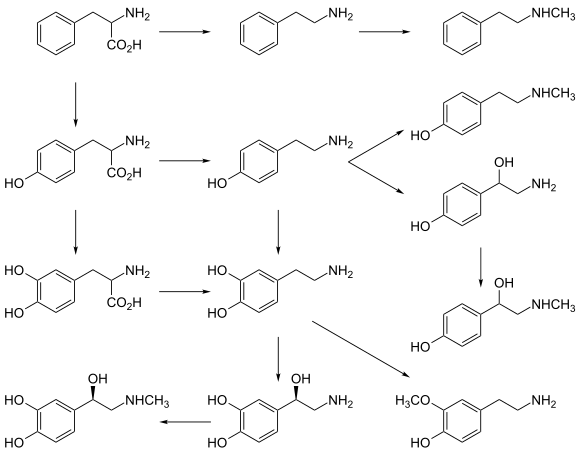
Другие тракты
Тубероинфундибулярный тракт образован аксонами нейронов, расположенных в аркуатном ядре гипоталамуса. Отростки таких нейронов достигают наружного слоя срединного возвышения. Этот тракт осуществляет контроль секреции пролактина. Дофамин тормозит его секрецию и поэтому содержание пролактина в плазме крови служит косвенным показателем функции дофаминергической системы мозга, что часто используют для оценки влияния на нее психофармакологических средств. Инцертогипоталамический тракт начинается от zona incerta и оканчивается в дорсальном и переднем отделах медиального таламуса, а также в перивентрикулярной области. Он принимает участие в нейроэндокринной регуляции. Источником проекций диенцефалоспинального тракта являются нейроны заднего гипоталамуса, отростки которых достигают задних рогов спинного мозга. Ретинальный тракт расположен в пределах сетчатки глаза. Особенности этого тракта делают его среди других дофаминергических трактов достаточно автономным.
Приведенная система разделения дофаминергических образований мозга на отдельные подсистемы не является абсолютной, так как проекции дофаминергических нейронов разных трактов перекрываются. Кроме того, в мозге отмечается и диффузное распределение дофаминергических элементов (отдельных клеток с отростками). Дофаминергические системы мозга созревают преимущественно в постнатальном периоде. Дофаминовые терминали образуют синапсы преимущественно на шипиках и стволах дендритов - это аксошипиковые и аксодендритные синапсы (их более 90 %). Лишь единичные синапсы (менее 10 %) расположены на телах нейронов (аксосоматические) и на аксонах (аксо-аксональные).
Видео: Дофаминовые пути
Дофаминовые рецепторы (РцДА)
Основными типами дофаминовых рецепторов являются Д1- и Д2-ре-цепторы. Недавно были открыты также рецепторы ДЗ, Д4 и Д5. Они все находятся главным образом на постсинаптической мембране. Но в дофаминергической системе существуют также ауторецепторы, расположенные на теле нейронов, аксонах, дендритах и терминалях, которые реагируют на собственный дофамин, регулируя его синтез и выделение. Их стимуляция приводит к снижению активности дофаминовых нейронов. Большая часть охарактеризованных дофаминовых рецепторов относится к Д2-рецепторам. О функции Д1-рецепторов известно меньше. Их от Д2-рецепторов отличает способность стимулировать активность фермента аденилатциклазы, которая в свою очередь участвует в синтезе второго мессенджера - цАМФ. Д1- и Д2-рецепторы существуют в двух формах - высоко- и низкоаффинной, что определяется по их способности к связыванию агонистов и антагонистов. Было показано, что Д2-рецепторы сродство к бутирофенонам, в то время как Д1-рецепторы такой способностью не обладают. Д2-рецепторы преобладают в стриатуме - хвостатом ядре и скорлупе, но имеются также в поясной извилине и коре островка. В стриатуме Д2 обнаружены не только на дофаминергических, но и на холинергических нейронах. Это объясняет сопряженное выделение ацетилхолина при введении агонистов дофамина. Картирование Д1-рецепторов дало менее убедительные результаты, однако было установлено, что они преобладают в коре больших полушарий, особенно в области префронтальной коры, где имеются и Д2-рецепторы. Д1-рецепторы есть и в стриатуме. Рецепторы ДЗ, Д4, Д5 были открыты относительно недавно. Структурные особенности и фармакологические свойства рецепторов ДЗ близки к таковым рецепторов Д2. Рецептор Д4 также имеет сходство с Д2 и ДЗ, а рецептор Д5 - с Д1. Различные психофармакологические препараты, будучи агонистами или антагонистами, относительно избирательно влияют на Д1- и Д2-рецепторы. Так, фенотиазины блокируют Д1- и Д2-рецепторы; галоперидол и пимозид являются более сильными блокаторами этих рецепторов; сильным антагонистом считается также сульпирид. В противоположность им флупентиксол высокоаффинен к Д1-рецепторам. Большое значение для понимания механизмов действия нейролептиков на уровне дофаминовых рецепторов придают их молекулярному строению. Оказалось, что молекулы дофамина и фенотиазина, по данным рентгеноструктурного анализа, обладают определенным структурным сходством. Есть также сходство в молекулах дофамина и амфетамина (агонист дофамина). Поэтому нейролептики способны устранять психотомиметические эффекты последнего. Длительное введение нейролептиков приводит к повышению связывания дофаминовых рецепторов и усилению поведенческих реакций на агонисты дофамина. Это явление трактуется как гиперчувствительность дофаминовых рецепторов. С ним связывают развитие побочных явлений при лечении нейролептиками, в частности с гиперчувствительностью рецепторов в стриатуме - развитие экстрапирамидных расстройств. Но открытие атипичных нейролептиков внесло некоторые коррективы в ранее существовавшие представления. Оказалось, что такой атипичный нейролептик, как сульпирид, являясь высокоспецифичным по отношению к Д2-рецепторам (в отличие от Хлорпромазина, галоперидола и др.), действуя на клетки вентральной области покрышки, иннервирующие лимбическую кору и кору больших полушарий, не влияет на нейроны черной субстанции, проецирующиеся на полосатое тело. Этим объясняется редкость возникновения лекарственного паркинсонизма при лечении сульпиридом. Такой атипичный нейролептик, как клозапин (лепонекс), связывает не только Д2-, но в большей степени Д1-рецепторы и рецепторы других нейрохимических систем (серотониновые, ацетилхолиновые и др.).
Дофамин - величайший обман мозга или как эмоционально не выгорать
Клетки
нашего мозга (нейроны) передают сигналы
друг другу с помощью особых веществ,
которые называются нейромедиаторами.
Своеобразный язык клеток. Нейромедиаторов
в мозге несколько, сегодня мы будем
говорить о дофамине (допамине).
Для
простоты восприятия мы разберем его в
два подхода.
1.
Не жать на педальку. Как можно сжечь
свои дофаминовые рецепторы. Как с вами
играют. Зависимости и нейромаркетинг.
2.
Что делать для восстановления и
поддержания здоровой дофаминовой
системы.
Основные
функции дофаминовой системы:
1.
Заставляет нас достигать целей, обещая
при этом золотые горы (система
поощрения)
2. Помогает переключатся
с одной задачи на другую.
3.
Выделяется при мыслях о награде.
4.
Падает при мыслях о невозможности
достичь награду
5. Помогает вам
фокусироваться на том, что для вас
важно.
6. Сразу скажу про
обман:
дофамин
дает вам лишь обещание счастья, но не
само счастье!
Еще
раз: большинство людей путают обещание
счатьстья и счастье, но это совершенно
разные вещи! Нельзя их путать!
Итак,
1.
Система поощрения.
Дофамин является одним из факторов
внутреннего подкрепления и служит
важной частью «системы поощрения»
мозга, поскольку вызывает чувство
удовольствия (или удовлетворения), чем
влияет на процессы мотивации и
обучения.
Когда у нас возникает
потребность, то выделяется дофамин,
который заставляет нас шевелится и
предринимать действия, чтобы достигнуть
цель. В 2001 году стэнфордский нейробиолог
Брайан Кнутсон опубликовал убедительное
исследование, в котором доказал, что
дофамин отвечает за предвкушение, а не
за переживание награды.
Дофамин
естественным образом вырабатывается
в больших количествах во время позитивного,
по субъективному представлению человека,
опыта — к примеру, секса, приёма вкусной
пищи, приятных телесных ощущений,
достижения поставленных задач и др.
Нейробиологические эксперименты
показали, что даже воспоминания о
позитивном поощрении могут увеличить
уровень дофамина, поэтому данный
нейромедиатор используется мозгом для
оценки и мотивации, закрепляя важные
для выживания и продолжения рода
действия.
Ключевым звеном мозговой
системы вознаграждения является сеть
мезолимбических дофаминовых нейронов
— нервных клеток, расположенных в
вентральной области покрышки (ВОП-VTA) у
основания мозга и посылающих проекции
в различные отделы передней части мозга,
главным образом в прилежащее ядро
(nucleus accumbens).
Нейроны ВОП высвобождают
из терминалей аксонов нейротрансмиттер
дофамин, связывающийся с соответствующими
рецепторами нейронов прилежащего ядра.
Дофаминовый нервный путь из ВОП в
прилежащее ядро играет важную роль в
развитии наркотического привыкания:
животные с повреждением этих мозговых
структур полностью утрачивают интерес
к наркотикам.

 2.
Активация дофаминергической передачи
необходима при процессах переключения
внимания человека с одного этапа
когнитивной деятельности на другой.
Таким
образом, недостаточность дофаминергической
передачи приводит к повышенной инертности
больного, которая клинически проявляется
амедленностью когнитивных процессов
(брадифрения) и персеверациями (мусоленьем
одного и того же).
3.
Почему нам приятно от мыслей о предстоящем
удовольствии?
Почему мы можем часами смаковать
предстоящее наслаждение? Последние
исследования показывают, что выработка
дофамина начинается ещё в процессе
ожидания удовольствия. Это очень важно.
Размышления уже спровоцируют выброс
дофамина и желание еще больше
возрастет.
Как
сжечь рецепторы. Сжигает все, что
стимулирует выброс дофамина, но не
удовлетворяет потребности (ресурсы
здоровья).
1.
Наркотики (никотин, алкоголь)
2.
Зависимости (сладкое, порно, лотереи,
казино и др.)
3. Зависимое поведение,
агрессия (насилие) и др.
1.
Наркотики необратимо (труднообратимо)
меняют дофаминовые нейроны.
Как и любое удовольствие, которое сильное
и частое.
В частности, многие
наркотики увеличивают выработку и
высвобождение дофамина в мозге в 5—10
раз, что позволяет людям, которые их
употребляют, получать чувство удовольствия
искусственным образом.
Так, амфетамин напрямую стимулирует
выброс дофамина, воздействуя на механизм
его транспортировки. Другие наркотики,
например, кокаин и некоторые другие
психостимуляторы, блокируют естественные
механизмы обратного захвата дофамина,
увеличивая его концентрацию в синаптическом
пространстве. Морфий и никотин имитируют
действие натуральных нейромедиаторов,
а алкоголь блокирует действие антагонистов
дофамина.
Если пациент продолжает
перестимулировать свою «систему
поощрения», постепенно мозг адаптируется
к искусственно повышаемому уровню
дофамина, производя меньше гормона и
снижая количество рецепторов в «системе
поощрения», один из факторов побуждающих
наркомана увеличивать дозу для получения
прежнего эффекта. Дальнейшее развитие
химической толерантности может постепенно
привести к метаболическим нарушениям
в головном мозге, а в долговременной
перспективе потенциально нанести
серьёзный ущерб здоровью мозга.
Дальнейшие
исследования показали, что дофамин в
мезолимбической системе у животных и
людей повышается от вкусной еды, приятных
телесных ощущений, секса, и от
ассоциированных с ними мыслей.
Соответственно, дофамин там резко падает
от голода, холода, боли, неприятных
телесных ощущений и ассоциированных с
этим мыслей.
То есть, повышение
дофамина в мезолимбике маркирует
полезные для выживания и размножения
действия, а падение дофамина - маркирует
вредные и опасные действия. Повышение
дофамина
в мезолимбике вызывает
у человека чувство удовольствия, а
понижение - чувство неудовольствия,
что потом записывается в память,
ассоциируется нейронными связями с
данным действием, и помогает людям и
животным определять надо ли снова делать
данное действие в будущем, или надо его
избегать.
Кроме того,
активизация/деактивизация некоторых
отделов "системы поощрения" (в
частности "вентральная область
покрышки") влияет на префронтальную
кору головного мозга (мезокортиальный
путь), отвечающую за движение и принятие
решений, и таким образом влияет на то,
будет ли человек выполнять задуманное
ранее действие или нет.
Согласно
очень популярной в нейрофизиологии
"теории Хебба", если активизация
нейронов достаточно сильная, то между
нейронами которые активизируются
одновременно могут даже возникнуть
новые межнейронные связи, а существующие
межнейронные связи могут разрушится
если уже связанные нейроны не активизируются
одновременно по каким-то причинам.[65]
То
есть, мысли также вляют на структуру
межклеточных связей между нейронами
(синапсы), а потом это изменение связей
изменяет поток нейромедиаторов через
эти нейроны.
Таким образом, мысль
влияет на архитектуру нейронных связей
и на выработку нейромедиаторов в мозгу,
и наоборот - нейромедиаторы и уже
существующая архитектура нейронов
влияют на последующие мысли человека.
В
природе такие автоматизированные
"ассоциативные связи" обычно
полезны, и даже необходимы для принятия
решений, ведь в дикой природе у животных
нет наркотиков, а натуральная “сиcтема
поощрения” в процессе эволюции создала
достаточно сдержек и противовесов чтобы
животное не навредило само
себе.
Например,
при
переедании у животного возникает боль
в желудке, понижающая дофамин;
после
оргазма вырабатывается глутамат который
резко снижает выработку дофамина после
секса, чтобы животное отдохнуло;
а
если животное долго будет думать о
чём-то непродуктивном, то голод, холод
и хищники ему быстро напомнят о
реальности.
Когда
человек принимает решение делать или
нет какое-либо действие, то обычно он
сначала ищет в памяти похожие
обстоятельства. Если оказывается, что
в прошлом у него уже была точно такая
проблема, он помнит как он её решил,
помнит что это решение доставило потом
удовольствие, и за прошедшее время не
возникло новых нейронных связей которые
бы отмакрировали старое решение как
неверное, - то человек часто не тратит
много времени на раздумья, а быстро
принимает записанное ранее решение или
быстро повторяет прежнюю логику
решения.
Есть также много
исследований, доказывающих что дофамин
необходим для запоминания и забывания.
Если какое-либо событие было для человека
очень приятно или очень неприятно, то
он обращает на него особое внимание,
т.е. дофамин усиливает связанные с этим
событием различные нейромедиаторы, и
это событие хорошо запоминается, а то
что было безразлично (дофамин остался
на обычном уровне) - быстро забывается.
Таким
образом,
дофамин
- это нейромедиатор в мозгу, который
выполняем две важные функции: служит
нейромедиатором поощрения и служит в
системе оценки и мотивации.
Дофамин
также необходим для запоминания, принятия
решений и обучения.
Например,
когда здоровым лабораторным мышам
искусственно заблокировали дофамин,
то они сидели на одном месте часами,
игнорируя еду, секс и развлечения, и
чуть было не погибли от истощения.
За
небольшими исключениями, данная система
контролирует не столько награды, сколько
наказания, путем перекрывания дофамина.
В таких случаях уровень дофамина падает,
заставляя нас предпринимать активные
действия. В итоге система поощрений
ненадолго возвращает дофамин, и нам
становится хорошо. Этот же механизм
работает, например, при победе на
спортивном соревновании, похвале или
осуждению других людей, и т.д. Падение
дофамина подгоняет нас к достижению
цели, что может быть достигнуто ценой
перенапряжения и стресса.
Так
что же происходит при искусственном
повышении уровня дофамина?
Разумеется
сбой «системы поощрения». Мозг больше
не может правильно решать что хорошо и
что плохо. Ощущения доставляют больше
удовольствия чем обычно, цвета становятся
красивыми и яркими, голоса громкими и
насыщенными тембром, любые ассоциации
кажутся возможными и достоверными.
Почти
любая первая пришедшая мысль кажется
правильной и интересной. Мозгу становиться
тяжелее переключиться на впечатления
приходящие из реального мира, ведь
внутри вдруг все стало таким интересным
и важным. При приеме легких доз наркотиков
мозг еще как-то может себя контролировать,
но с увеличением дозы,
дофамин поднимается выше критических
уровней
и педаль тормоза мыслей (глутамат) уже
почти не работает —
наступает острый психоз.
Человек
себя больше вообще не контролирует —
в буквальном смысле. После
окончания действия наркотика происходит
резкое падение уровня нейромедиаторов,
наступает депрессия и расскаяние, отчего
уровень нейромедиаторов падает еще
ниже нормы.
Наркоман от этого испытывает
неудовлетворенность, и через некоторое
время ему все большую радость доставляют
воспоминания о «кайфе» и он снова
потянется за наркотиком…
Учёные
показали, что на мозговую систему
вознаграждения наркотические вещества
оказывают более сильное и глубокое
стимулирующее действие, нежели какие-либо
естественные факторы вознаграждения.
Если
наркоман вовремя не остановит этот
цикл, то в реальной жизни начнутся
проблемы (потеря работы, друзей, семьи).
От тяжелых мыслей о потускневшей
реальности уровень дофамина будет
снижаться еще больше, и еще больше
захочется уйти в нереальный мир. Все
остальное постепенно начнет терять
значение. Избалованный дофамином мозг
может временно пересмотреть уровень
«нормы» для потока дофамина в сторону
увеличения, и тогда природные удовольствия
(еда, секс, общение с окружающими) уже
не будут рассматриваться как должное
вознаграждение. С
обычными природными удовольствиями
начнут ассоциироваться скорее неприятные
воспоминания (потеря социального
статуса, отторжение обществом, импотенция,
потеря вкуса пищи, и т.д.).
А
в дальнейшем при регулярном употреблении
во столько же раз снизится чувствительность
дофаминовых рецепторов. Чем сильнее и
регулярнее воздействие, тем больше
последствий. Снижение чувствительности
происходит через уменьшение плотности
рецепторов на единицу площади мембраны
клетки, на которой они располагаются).
Наверное,
все представляют себе человека под
галоперидолом? Вот это ожидает каждого,
кто убьёт свои дофаминовые рецепторы.
Их, кстати, в мозге не так и много по
сравнению с другими, всего примерно 400
тысяч (чтобы понимать масштаб: у нас в
мозге примерно 100 млрд нервных клеток).
Восстанавливаются они долго и больно,
некоторые исследования говорят, что до
3-4 лет, причём разные виды рецепторов с
разной скоростью. И, что самое плохое,
именно рецептор D2 восстанавливается
хуже всех. Ну
а хроническое издевательство над
дофаминовыми рецепторами приводит к
экспрессии гена, ответственного за их
синтез и дальше уже придётся жить вообще
без них.
Агрессия.
Допамин
выделяется и во время агрессии.
В
одной клетке держали самца и самку. По
соседству с ними были пять посторонних
мышей. После этого самку убирали из
клетки, а к самцу подсаживали бывших
соседей.
Самец довольно агрессивно
на это реагировал: кусал и иным образом
нападал на посторонних. Позже в клетку
была добавлена кнопка, на которую мышь
должна была нажать носом, если хотела,
чтобы “лишние” были удалены. Быстро
освоившись, мышь постоянно нажимала на
кнопку. После этого тому же самцу была
сделана инъекция препарата, который
подавил чувствительность допаминовых
рецепторов - и он практически перестал
нажимать на кнопку. Таким
образом, авторы эксперимента пришли к
выводу, что во время агрессии в организме
мыши вырабатывается допамин.
Однако
тут есть и более сложная зависимость:
Оказалось,
что добровольцы с низким уровнем дофамина
были гораздо менее настойчивы в попытке
выиграть деньги и в то же время активнее
демонстрировали агрессивное
поведение.
Между
тем до сих пор было принято считать, что
стимулируют агрессию только высокие
уровни дофамина.
Как
система подкрепления заставляет нас
действовать? Когда
мозг замечает возможность награды, он
выделяет нейромедиатор дофамин.
Дофамин
приказывает остальному мозгу
сосредоточиться на этой награде и во
что бы то ни стало получить ее в наши
жадные ручонки.
Прилив
дофамина сам по себе не вызывает счастья
— скорее просто возбуждает. Мы резвы,
бодры и увлечены. Мы чуем возможность
удовольствия и готовы усердно трудиться,
чтобы его достичь.
Дофамин
отвечает за действие, а не за
счастье.
Обещание
награды требовалось, чтобы не проворонить
выигрыш. Когда возбуждалась система
подкрепления, они переживали предвкушение,
а не удовольствие.
С притоком дофамина
этот новый объект желания кажется
критически необходимым, чтобы выжить.
Когда дофамин завладевает нашим
вниманием, мозг приказывает нам достать
объект или повторять то, что нас
привлекло.
Эволюции
плевать на счастье, но она обещает его,
чтобы мы боролись за жизнь.
Поэтому, ожидание счастья — а не
непосредственное его переживание —
мозг использует, чтобы мы продолжали
охотиться, собирать, работать и
свататься.
Согласно новой теории,
обсуждавшейся на недавно прошедшем в
Чикаго съезде Нейрологического общества,
допамин связан не столько с удовольствием,
сколько с постановкой задач, необходимых
для выживания, и их выполнением. Допамин
также играет важную роль в регистрации
мозгом изменений и особенностей
окружающей среды.
«Невозможно обращать внимание на все
подряд, — продолжает доктор Волков, —
но важно замечать все новое и необычное.
Вы можете не заметить летающую по комнате
муху, но если, скажем, муха вдруг будет
светиться в темноте, допамин даст
сигнал».
Кроме этого, допаминовый
детектор элементарных признаков
фокусирует внимание на объектах,
обладающих для вас повышенной ценностью,
как тех, что вы любите, или тех, которые
вызывают у вас страх.
Например, если вы любите шоколад, скорее
всего допаминовые нейроны сработают
при виде лежащего на прилавке маленького
боба какао. А если вы боитесь тараканов,
те же самые нейроны подадут еще более
сильный сигнал, если у «боба» обнаружится
шесть лапок.
Разумеется, теперь
мы живем в совершенно ином мире. Взять,
к примеру, всплеск
дофамина от вида, запаха или вкуса жирной
или сладкой пищи.
Выделение дофамина гарантирует, что мы
захотим объесться до отвала. Замечательный
инстинкт, если вы живете в мире, где еды
мало. Однако в нашей среде еда не просто
широкодоступна, но и готовится так,
чтобы максимизировать дофаминовый
ответ, поэтому каждый такой всплеск —
путь к ожирению, а не к долголетию.
Или
задумайтесь о
воздействии сексуальных образов на
нашу систему подкрепления.
На протяжении почти всей человеческой
истории обнаженные люди принимали
соблазнительные позы только перед
реальными партнерами.
Конечно, слабое
желание действовать в такой ситуации
было бы неразумным, если вы хотели
оставить в генофонде свою ДНК. Но спустя
несколько сотен тысяч лет мы оказались
в мире, где интернет-порно доступно
всегда, не говоря уже о вездесущих
сексуальных образах в рекламе и индустрии
развлечений. В
порыве преследования каждой из таких
сексуальных «возможностей» люди зависают
на порносайтах и становятся жертвами
рекламных кампаний, которые используют
секс,
чтобы продать все — от дезодоранта до
дизайнерских джинсов. Поэтому порно
тоже сжигает ваши дофаминовые
рецепторы.
Ключевое действие,
которое мы совершаем в Интернете, —
идеальная метафора обещания награды:
мы ищем. И ищем. И снова ищем, кликая
мышкой, как… как крыса в клетке, надеясь
на следующее «попадание», в ожидании
ускользающей награды, которая наконец-таки
даст нам ощущение насыщения. Возможно,
сотовые, серфинг в Интернете и социальные
сети случайно эксплуатируют нашу систему
подкрепления, но разработчики компьютерных
и видеоигр намеренно манипулируют ей,
чтобы подсадить игроков.
Обещание,
что переход на следующий уровень или
великая победа может произойти в любой
момент,
— вот что делает игру столь притягательной.
И поэтому от нее так трудно оторваться.
В
одном исследовании обнаружилось, что
видеоигра вызывает всплеск дофамина,
сопоставимый с использованием амфетамина:
дофаминовая лихорадка сопутствует как
игровой, так и наркотической зависимостям.
Вы не можете предсказать, когда получите
баллы или перейдете на другой уровень,
поэтому ваши дофаминергические нейроны
продолжают выстреливать, а вы прилипаете
к стулу. Кто- то сочтет это замечательным
развлечением, а кто-то — аморальной
эксплуатацией игроков.
Мы
стремимся к удовольствиям, и зачастую
— ценой собственного благополучия.
Когда дофамин направляет наш мозг на
поиск награды, мы становимся рисковыми,
импульсивными — безбашенными
личностями.
Но что особенно важно,
даже если мы не получаем награды, ее
обещания — и страха ее потерять —
довольно, чтобы удержать нас на крючке.
Если вы лабораторная крыса, вы будете
жать на рычаг, пока не упадете без сил
или не умрете с голоду. Если вы человек,
в лучшем случае у вас опустеет кошелек
и потяжелеет желудок. В
худшем случае вы можете обнаружить, что
увлекли себя в водоворот зависимостей
и навязчивых действий.
Когда
при обещании награды выделяется дофамин,
он делает вас более восприимчивыми к
любым искушениям.
Например,
полюбовавшись на эротические картинки,
мужчины более склонны к финансовым
рискам, а фантазии о выигрыше в лотерею
приводят к перееданию — обе грезы о
недостижимых наградах могут вам
навредить. Высокий уровень дофамина
увеличивает привлекательность сиюминутных
наслаждений, и вы уже не так озабочены
отдаленными последствиями.
2.
Активация дофаминергической передачи
необходима при процессах переключения
внимания человека с одного этапа
когнитивной деятельности на другой.
Таким
образом, недостаточность дофаминергической
передачи приводит к повышенной инертности
больного, которая клинически проявляется
амедленностью когнитивных процессов
(брадифрения) и персеверациями (мусоленьем
одного и того же).
3.
Почему нам приятно от мыслей о предстоящем
удовольствии?
Почему мы можем часами смаковать
предстоящее наслаждение? Последние
исследования показывают, что выработка
дофамина начинается ещё в процессе
ожидания удовольствия. Это очень важно.
Размышления уже спровоцируют выброс
дофамина и желание еще больше
возрастет.
Как
сжечь рецепторы. Сжигает все, что
стимулирует выброс дофамина, но не
удовлетворяет потребности (ресурсы
здоровья).
1.
Наркотики (никотин, алкоголь)
2.
Зависимости (сладкое, порно, лотереи,
казино и др.)
3. Зависимое поведение,
агрессия (насилие) и др.
1.
Наркотики необратимо (труднообратимо)
меняют дофаминовые нейроны.
Как и любое удовольствие, которое сильное
и частое.
В частности, многие
наркотики увеличивают выработку и
высвобождение дофамина в мозге в 5—10
раз, что позволяет людям, которые их
употребляют, получать чувство удовольствия
искусственным образом.
Так, амфетамин напрямую стимулирует
выброс дофамина, воздействуя на механизм
его транспортировки. Другие наркотики,
например, кокаин и некоторые другие
психостимуляторы, блокируют естественные
механизмы обратного захвата дофамина,
увеличивая его концентрацию в синаптическом
пространстве. Морфий и никотин имитируют
действие натуральных нейромедиаторов,
а алкоголь блокирует действие антагонистов
дофамина.
Если пациент продолжает
перестимулировать свою «систему
поощрения», постепенно мозг адаптируется
к искусственно повышаемому уровню
дофамина, производя меньше гормона и
снижая количество рецепторов в «системе
поощрения», один из факторов побуждающих
наркомана увеличивать дозу для получения
прежнего эффекта. Дальнейшее развитие
химической толерантности может постепенно
привести к метаболическим нарушениям
в головном мозге, а в долговременной
перспективе потенциально нанести
серьёзный ущерб здоровью мозга.
Дальнейшие
исследования показали, что дофамин в
мезолимбической системе у животных и
людей повышается от вкусной еды, приятных
телесных ощущений, секса, и от
ассоциированных с ними мыслей.
Соответственно, дофамин там резко падает
от голода, холода, боли, неприятных
телесных ощущений и ассоциированных с
этим мыслей.
То есть, повышение
дофамина в мезолимбике маркирует
полезные для выживания и размножения
действия, а падение дофамина - маркирует
вредные и опасные действия. Повышение
дофамина
в мезолимбике вызывает
у человека чувство удовольствия, а
понижение - чувство неудовольствия,
что потом записывается в память,
ассоциируется нейронными связями с
данным действием, и помогает людям и
животным определять надо ли снова делать
данное действие в будущем, или надо его
избегать.
Кроме того,
активизация/деактивизация некоторых
отделов "системы поощрения" (в
частности "вентральная область
покрышки") влияет на префронтальную
кору головного мозга (мезокортиальный
путь), отвечающую за движение и принятие
решений, и таким образом влияет на то,
будет ли человек выполнять задуманное
ранее действие или нет.
Согласно
очень популярной в нейрофизиологии
"теории Хебба", если активизация
нейронов достаточно сильная, то между
нейронами которые активизируются
одновременно могут даже возникнуть
новые межнейронные связи, а существующие
межнейронные связи могут разрушится
если уже связанные нейроны не активизируются
одновременно по каким-то причинам.[65]
То
есть, мысли также вляют на структуру
межклеточных связей между нейронами
(синапсы), а потом это изменение связей
изменяет поток нейромедиаторов через
эти нейроны.
Таким образом, мысль
влияет на архитектуру нейронных связей
и на выработку нейромедиаторов в мозгу,
и наоборот - нейромедиаторы и уже
существующая архитектура нейронов
влияют на последующие мысли человека.
В
природе такие автоматизированные
"ассоциативные связи" обычно
полезны, и даже необходимы для принятия
решений, ведь в дикой природе у животных
нет наркотиков, а натуральная “сиcтема
поощрения” в процессе эволюции создала
достаточно сдержек и противовесов чтобы
животное не навредило само
себе.
Например,
при
переедании у животного возникает боль
в желудке, понижающая дофамин;
после
оргазма вырабатывается глутамат который
резко снижает выработку дофамина после
секса, чтобы животное отдохнуло;
а
если животное долго будет думать о
чём-то непродуктивном, то голод, холод
и хищники ему быстро напомнят о
реальности.
Когда
человек принимает решение делать или
нет какое-либо действие, то обычно он
сначала ищет в памяти похожие
обстоятельства. Если оказывается, что
в прошлом у него уже была точно такая
проблема, он помнит как он её решил,
помнит что это решение доставило потом
удовольствие, и за прошедшее время не
возникло новых нейронных связей которые
бы отмакрировали старое решение как
неверное, - то человек часто не тратит
много времени на раздумья, а быстро
принимает записанное ранее решение или
быстро повторяет прежнюю логику
решения.
Есть также много
исследований, доказывающих что дофамин
необходим для запоминания и забывания.
Если какое-либо событие было для человека
очень приятно или очень неприятно, то
он обращает на него особое внимание,
т.е. дофамин усиливает связанные с этим
событием различные нейромедиаторы, и
это событие хорошо запоминается, а то
что было безразлично (дофамин остался
на обычном уровне) - быстро забывается.
Таким
образом,
дофамин
- это нейромедиатор в мозгу, который
выполняем две важные функции: служит
нейромедиатором поощрения и служит в
системе оценки и мотивации.
Дофамин
также необходим для запоминания, принятия
решений и обучения.
Например,
когда здоровым лабораторным мышам
искусственно заблокировали дофамин,
то они сидели на одном месте часами,
игнорируя еду, секс и развлечения, и
чуть было не погибли от истощения.
За
небольшими исключениями, данная система
контролирует не столько награды, сколько
наказания, путем перекрывания дофамина.
В таких случаях уровень дофамина падает,
заставляя нас предпринимать активные
действия. В итоге система поощрений
ненадолго возвращает дофамин, и нам
становится хорошо. Этот же механизм
работает, например, при победе на
спортивном соревновании, похвале или
осуждению других людей, и т.д. Падение
дофамина подгоняет нас к достижению
цели, что может быть достигнуто ценой
перенапряжения и стресса.
Так
что же происходит при искусственном
повышении уровня дофамина?
Разумеется
сбой «системы поощрения». Мозг больше
не может правильно решать что хорошо и
что плохо. Ощущения доставляют больше
удовольствия чем обычно, цвета становятся
красивыми и яркими, голоса громкими и
насыщенными тембром, любые ассоциации
кажутся возможными и достоверными.
Почти
любая первая пришедшая мысль кажется
правильной и интересной. Мозгу становиться
тяжелее переключиться на впечатления
приходящие из реального мира, ведь
внутри вдруг все стало таким интересным
и важным. При приеме легких доз наркотиков
мозг еще как-то может себя контролировать,
но с увеличением дозы,
дофамин поднимается выше критических
уровней
и педаль тормоза мыслей (глутамат) уже
почти не работает —
наступает острый психоз.
Человек
себя больше вообще не контролирует —
в буквальном смысле. После
окончания действия наркотика происходит
резкое падение уровня нейромедиаторов,
наступает депрессия и расскаяние, отчего
уровень нейромедиаторов падает еще
ниже нормы.
Наркоман от этого испытывает
неудовлетворенность, и через некоторое
время ему все большую радость доставляют
воспоминания о «кайфе» и он снова
потянется за наркотиком…
Учёные
показали, что на мозговую систему
вознаграждения наркотические вещества
оказывают более сильное и глубокое
стимулирующее действие, нежели какие-либо
естественные факторы вознаграждения.
Если
наркоман вовремя не остановит этот
цикл, то в реальной жизни начнутся
проблемы (потеря работы, друзей, семьи).
От тяжелых мыслей о потускневшей
реальности уровень дофамина будет
снижаться еще больше, и еще больше
захочется уйти в нереальный мир. Все
остальное постепенно начнет терять
значение. Избалованный дофамином мозг
может временно пересмотреть уровень
«нормы» для потока дофамина в сторону
увеличения, и тогда природные удовольствия
(еда, секс, общение с окружающими) уже
не будут рассматриваться как должное
вознаграждение. С
обычными природными удовольствиями
начнут ассоциироваться скорее неприятные
воспоминания (потеря социального
статуса, отторжение обществом, импотенция,
потеря вкуса пищи, и т.д.).
А
в дальнейшем при регулярном употреблении
во столько же раз снизится чувствительность
дофаминовых рецепторов. Чем сильнее и
регулярнее воздействие, тем больше
последствий. Снижение чувствительности
происходит через уменьшение плотности
рецепторов на единицу площади мембраны
клетки, на которой они располагаются).
Наверное,
все представляют себе человека под
галоперидолом? Вот это ожидает каждого,
кто убьёт свои дофаминовые рецепторы.
Их, кстати, в мозге не так и много по
сравнению с другими, всего примерно 400
тысяч (чтобы понимать масштаб: у нас в
мозге примерно 100 млрд нервных клеток).
Восстанавливаются они долго и больно,
некоторые исследования говорят, что до
3-4 лет, причём разные виды рецепторов с
разной скоростью. И, что самое плохое,
именно рецептор D2 восстанавливается
хуже всех. Ну
а хроническое издевательство над
дофаминовыми рецепторами приводит к
экспрессии гена, ответственного за их
синтез и дальше уже придётся жить вообще
без них.
Агрессия.
Допамин
выделяется и во время агрессии.
В
одной клетке держали самца и самку. По
соседству с ними были пять посторонних
мышей. После этого самку убирали из
клетки, а к самцу подсаживали бывших
соседей.
Самец довольно агрессивно
на это реагировал: кусал и иным образом
нападал на посторонних. Позже в клетку
была добавлена кнопка, на которую мышь
должна была нажать носом, если хотела,
чтобы “лишние” были удалены. Быстро
освоившись, мышь постоянно нажимала на
кнопку. После этого тому же самцу была
сделана инъекция препарата, который
подавил чувствительность допаминовых
рецепторов - и он практически перестал
нажимать на кнопку. Таким
образом, авторы эксперимента пришли к
выводу, что во время агрессии в организме
мыши вырабатывается допамин.
Однако
тут есть и более сложная зависимость:
Оказалось,
что добровольцы с низким уровнем дофамина
были гораздо менее настойчивы в попытке
выиграть деньги и в то же время активнее
демонстрировали агрессивное
поведение.
Между
тем до сих пор было принято считать, что
стимулируют агрессию только высокие
уровни дофамина.
Как
система подкрепления заставляет нас
действовать? Когда
мозг замечает возможность награды, он
выделяет нейромедиатор дофамин.
Дофамин
приказывает остальному мозгу
сосредоточиться на этой награде и во
что бы то ни стало получить ее в наши
жадные ручонки.
Прилив
дофамина сам по себе не вызывает счастья
— скорее просто возбуждает. Мы резвы,
бодры и увлечены. Мы чуем возможность
удовольствия и готовы усердно трудиться,
чтобы его достичь.
Дофамин
отвечает за действие, а не за
счастье.
Обещание
награды требовалось, чтобы не проворонить
выигрыш. Когда возбуждалась система
подкрепления, они переживали предвкушение,
а не удовольствие.
С притоком дофамина
этот новый объект желания кажется
критически необходимым, чтобы выжить.
Когда дофамин завладевает нашим
вниманием, мозг приказывает нам достать
объект или повторять то, что нас
привлекло.
Эволюции
плевать на счастье, но она обещает его,
чтобы мы боролись за жизнь.
Поэтому, ожидание счастья — а не
непосредственное его переживание —
мозг использует, чтобы мы продолжали
охотиться, собирать, работать и
свататься.
Согласно новой теории,
обсуждавшейся на недавно прошедшем в
Чикаго съезде Нейрологического общества,
допамин связан не столько с удовольствием,
сколько с постановкой задач, необходимых
для выживания, и их выполнением. Допамин
также играет важную роль в регистрации
мозгом изменений и особенностей
окружающей среды.
«Невозможно обращать внимание на все
подряд, — продолжает доктор Волков, —
но важно замечать все новое и необычное.
Вы можете не заметить летающую по комнате
муху, но если, скажем, муха вдруг будет
светиться в темноте, допамин даст
сигнал».
Кроме этого, допаминовый
детектор элементарных признаков
фокусирует внимание на объектах,
обладающих для вас повышенной ценностью,
как тех, что вы любите, или тех, которые
вызывают у вас страх.
Например, если вы любите шоколад, скорее
всего допаминовые нейроны сработают
при виде лежащего на прилавке маленького
боба какао. А если вы боитесь тараканов,
те же самые нейроны подадут еще более
сильный сигнал, если у «боба» обнаружится
шесть лапок.
Разумеется, теперь
мы живем в совершенно ином мире. Взять,
к примеру, всплеск
дофамина от вида, запаха или вкуса жирной
или сладкой пищи.
Выделение дофамина гарантирует, что мы
захотим объесться до отвала. Замечательный
инстинкт, если вы живете в мире, где еды
мало. Однако в нашей среде еда не просто
широкодоступна, но и готовится так,
чтобы максимизировать дофаминовый
ответ, поэтому каждый такой всплеск —
путь к ожирению, а не к долголетию.
Или
задумайтесь о
воздействии сексуальных образов на
нашу систему подкрепления.
На протяжении почти всей человеческой
истории обнаженные люди принимали
соблазнительные позы только перед
реальными партнерами.
Конечно, слабое
желание действовать в такой ситуации
было бы неразумным, если вы хотели
оставить в генофонде свою ДНК. Но спустя
несколько сотен тысяч лет мы оказались
в мире, где интернет-порно доступно
всегда, не говоря уже о вездесущих
сексуальных образах в рекламе и индустрии
развлечений. В
порыве преследования каждой из таких
сексуальных «возможностей» люди зависают
на порносайтах и становятся жертвами
рекламных кампаний, которые используют
секс,
чтобы продать все — от дезодоранта до
дизайнерских джинсов. Поэтому порно
тоже сжигает ваши дофаминовые
рецепторы.
Ключевое действие,
которое мы совершаем в Интернете, —
идеальная метафора обещания награды:
мы ищем. И ищем. И снова ищем, кликая
мышкой, как… как крыса в клетке, надеясь
на следующее «попадание», в ожидании
ускользающей награды, которая наконец-таки
даст нам ощущение насыщения. Возможно,
сотовые, серфинг в Интернете и социальные
сети случайно эксплуатируют нашу систему
подкрепления, но разработчики компьютерных
и видеоигр намеренно манипулируют ей,
чтобы подсадить игроков.
Обещание,
что переход на следующий уровень или
великая победа может произойти в любой
момент,
— вот что делает игру столь притягательной.
И поэтому от нее так трудно оторваться.
В
одном исследовании обнаружилось, что
видеоигра вызывает всплеск дофамина,
сопоставимый с использованием амфетамина:
дофаминовая лихорадка сопутствует как
игровой, так и наркотической зависимостям.
Вы не можете предсказать, когда получите
баллы или перейдете на другой уровень,
поэтому ваши дофаминергические нейроны
продолжают выстреливать, а вы прилипаете
к стулу. Кто- то сочтет это замечательным
развлечением, а кто-то — аморальной
эксплуатацией игроков.
Мы
стремимся к удовольствиям, и зачастую
— ценой собственного благополучия.
Когда дофамин направляет наш мозг на
поиск награды, мы становимся рисковыми,
импульсивными — безбашенными
личностями.
Но что особенно важно,
даже если мы не получаем награды, ее
обещания — и страха ее потерять —
довольно, чтобы удержать нас на крючке.
Если вы лабораторная крыса, вы будете
жать на рычаг, пока не упадете без сил
или не умрете с голоду. Если вы человек,
в лучшем случае у вас опустеет кошелек
и потяжелеет желудок. В
худшем случае вы можете обнаружить, что
увлекли себя в водоворот зависимостей
и навязчивых действий.
Когда
при обещании награды выделяется дофамин,
он делает вас более восприимчивыми к
любым искушениям.
Например,
полюбовавшись на эротические картинки,
мужчины более склонны к финансовым
рискам, а фантазии о выигрыше в лотерею
приводят к перееданию — обе грезы о
недостижимых наградах могут вам
навредить. Высокий уровень дофамина
увеличивает привлекательность сиюминутных
наслаждений, и вы уже не так озабочены
отдаленными последствиями.
Дофаминергические системы Головной мозг Здесь сосредоточены основные каналы дофамина. Находясь в «поощрительном» канале, дофамин синтезируется в телах всех нервных клеток, расположенных в пределах вентральной области покрышки (ВОП), откуда он попадает в прилежащее ядро и префронтальную кору. За моторные функции дофамина отвечает отдельный канал, в котором присутствуют тела клеток черного вещества (синтезируясь внутри этих клеток, дофамин впоследствии проникает в полосатое тело. В головном мозге дофамин играет важную роль, контролируя моторику, он также отвечает за мотивацию, регулирует степень активности ЦНС, формирует когнитивную функцию и систему поощрений, а также отвечает за функции низшего порядка, такие, как выработка грудного молока у женщин, сексуальное удовлетворение и тошнота. Дофаминергических нейронов (то есть нейронов, основным нейромедиатором которых является дофамин) не так много (всего порядка 400 000 в головном мозге человека), 3) причем их клеточные тела сосредоточены в относительно небольших участках головного мозга, откуда их действие проецируется на многие другие участки мозга, откуда достигает «своих целей». Подобные комплексы дофаминергических клеток были впервые обнаружены в 1964 году Анникой Дальстрем и Кьелем Фуксом, которые придумали для каждой из них свое обозначение (в алфавитном порядке: «А» - «аминергиеческие» и т.д.). В рамках придуманной этими учеными системы, в областях A1 - A7 находится нейромедиатор норэпинефрин, тогда как участки A8 - A14 содержат дофамин. Ниже приведен перечень дофаминергических областей головного мозга, выделенных этими учеными: Черное вещество, небольшой участок среднего мозга, в котором развиваются подкорковые узлы. Нейроны дофамина содержатся, главным образом, в одной из зон данной области под названием «парс компакта» (группа клеток A8) и в прилежащих зонах (группа A9). У людей действие дофаминовых нейронов парс компакты черного вещества проецируется на верхнюю часть полосатого тела (т.н. нигростриатный путь), за счет чего осуществляется контроль моторики и освоение новых движений. Термин substantia nigra (черное вещество) произошел от латинского словосочетания, обозначающего «черное вещество», и связан с темной окраской дофаминергических нейронов. Это наиболее хрупкие нейроны, поэтому, когда большая их часть «умирает», у человека развивается синдром Паркинсона.4) Вентральная область покрышки (ВОП) – еще один участок среднего мозга. Действие большей части дофаминергических нейронов ВОП (группа клеток A10) проецируется на префронтальную кору (по мезокортикальному каналу, оставшиеся же воздействуют на прилежащее ядро (через мезолимбический канал). В совокупности, эти два канала называются каналами мезокортиколимбической проекции; дофаминергические проекции с ВОП также поступают в мозжечковую миндалину, поясную извилину, гиппокамп и в обонятельную луковицу. Мезокортиколимбические нейроны играют основополагающую роль в формировании поощрительного и других аспектов мотивации. Прилежащее ядро зачастую относят к «лимбической» части полосатого тела. На самом деле, прилежащее ядро представляет собой участок полосатого тела, отвечающий за контроль моторики, включая мотивацию и принятие решений. Таким образом, роль ВОП в мотивации и принятии решений структурально аналогична роли черного вещества в плане контроля моторики низшего порядка. У приматов (обезьян и людей) действие нейронов дофамина из определенных участков черного вещества и ВОП проецируется практически на все отделы коры головного мозга, при этом сильнее других раздражаются моторная и премоторная зоны.5) Задний отдел гипоталамуса. Сигналы этих дофаминергических клеток (группа A11) проецируются на спинной мозг, при этом их функции до конца не изучены. По некоторым данным, при патологии в данной области развивается синдром беспокойных ног, когда человек не может заснуть вследствие непреодолимой тяги постоянно двигать различными частями тела, особенно ногами. 6) Дугообразное ядро (группа клеток A12) и перевентрикулярное ядро (группа A14) гипоталамуса. Сигналы этих дофаминергических нейронов (тубероинфонлибулярного канала) проецируются на гипофиз, влияя, таким образом, на секрецию гормона пролактина. Дофамин является основным нейроэндокринным ингибитором выработки пролактина передней частью гипофиза. Дофамин, синтезированный нейронами дугообразного ядра, поступает в гипоталамо-гипофизарные кровеносные сосуды срединного возвышения, которые «питают» гипофиз. Лактотрофные клетки гипофиза, ответственные за выработку пролактина, в отсутствии дофамина, непрерывно синтезируют пролактин; дофамин же ингибирует выработку данного гормона. Таким образом, в контексте регуляции секреции пролактина, дофамин называют пролактин-ингибирующий фактор (ПИФ), пролактин-ингибирующий гормон (ПИГ) или пролактостатин. Неопределенная зона. Эти клетки (группа A13) проецируют свои сигналы на некоторые области гипоталамуса и частично контролируют деятельность гонадолиберина, гормона, стимулирующего развитие репродуктивной системы в период половой зрелости как у мужчин, так и у Еще одна группа гормонов, отвечающих за выработку дофамина, расположена внутри сетчатки глаза. Эти нейроны называются амакринными клетками, поскольку они лишены аксона. Под действием этих клеток дофамин попадает во внеклеточную среду (данный процесс протекает наиболее активно в светлое время суток, затихая ночью). Дофамин из сетчатки повышает активность колбочковых зрительных клеток сетчатки, одновременно ингибируя палочковидные клетки — в результате глаз начинает различать больше оттенков цветов и контрастов в условиях яркого света, зато при приглушенном свете цветочувствительность глаза, наоборот, снижается.7) За пределами нервной системы Дофамин не преодолевает гематоэнцефалический барьер, поэтому он синтезируется и функционирует в периферийных областях независимо от синтеза и деятельности в головном мозге. В крови циркулирует довольно приличное количество дофамина, однако его функции не до конца изучены. Дофамин присутствует и в плазме (в тех же концентрациях, что и эпинефрин), но у людей свыше 95% плазменного дофамина имеет форму сульфата дофамина, соединения, образованного при воздействии фермента сульфотрансферазы 1A3/1A4 на свободный дофамин. Основная масса дофамин-сульфата синтезируется в брыжеечных органах, окружающих различные части пищеварительной системы. По мнению ученых, дофамин-сульфат синтезируется по принципу детоксикации дофамина, поступающего в организм вместе с пищей или синтезированного в процессе пищеварения — после еды концентрация дофамина в плазме увеличивается более чем в 50 раз. Не обладая биологической функцией (будучи бесполезным), сульфат дофамина выводится из организма вместе с мочой. Относительно небольшое количество несвязанного дофамина в крови синтезируется при участии симпатической нервной системы, пищеварительной системы и, вероятно, других органов. Он воздействует на рецепторы дофамина в периферийных тканях, метаболизируется или принимает форму норэпинефрина (под действием фермента дофамин-бета-гидроксилазы, который «впрыскивается» в кровоток мозжечковой миндалиной). Некоторые рецепторы дофамина крепятся к стенкам артерий, где выполняют сосудорасширяющую функцию и блокируют выработку норэпинефрина. Подобного рода ответные реакции возникают на почве высвобождения дофамина из каротидного параганглия при пониженном уровне кислорода, однако ученые не уверены в том, выполняют ли эти рецепторы другие важные функции. Некоторые периферические системы, в которых циркулирует дофамин, помимо регуляции кровообращения, выполняют экзокринную или парактринную функцию. К ним относятся: Иммунная система. Дофамин воздействует на рецепторы иммунных клеток, особенно, лимфоцитов. Его действие распространяется на иммунные клетки селезенки, костного мозга и кровеносной системы. Более того, иммунные клетки способны самостоятельно синтезировать и выделять дофамин. Основной функцией дофамина в отношении к лимфоцитам является его способность частично деактивировать эти клетки. Функциональная значимость данного свойства до сих пор не установлена, но оно позволяет нервной и иммунной системам контактировать друг с другом, что играет важную роль при лечении некоторых аутоиммунных расстройств. 8) Почки. В клетках почек представлены самые различные рецепторы дофамина, который там же и синтезируется (клетками почечного канальца), откуда он поступает в канальцевую жидкость. Дофамин усиливает кровоснабжение почек, ускоряя клубочковую фильтрацию и способствуя активному вымыванию натрия из организма (вместе с мочой). Нарушение почечной функции дофамина зачастую обусловлено повышенным давлением или проблемами на генетическом уровне, на фоне которых экскреция натрия замедляется и у человека повышается кровяное давление. Поджелудочная железа. В данном случае дофамин выполняет комплексную функцию. Поджелудочная железа состоит из двух частей, экзокринной и эндокринной. В первой синтезируются ферменты и прочие вещества, которые впоследствии поступают в тонкий кишечник, где происходит переваривание пищи. Одним из таких веществ как раз является дофамин. Функция дофамина в тонком кишечнике до конца не установлена; как вариант, он защищает слизистую кишечника от повреждений и замедляет моторику ЖКТ (скорость продвижения пищи по кишечнику). 9) Эндокринная доля поджелудочной железы, также известная как островок Лангерганса, синтезирует ряд гормонов, включая инсулин, которые впоследствии поступают в кровь. По некоторым данным, в бета-клетках, которые синтезируют инсулин, представлены рецепторы дофамина, который, в свою очередь, препятствует выделению ими инсулина. Ученые до сих пор не разобрались, откуда же поступает дофамин —из кровеносной системы, из симпатической нервной системы, или же он синтезируется на определенных участках поджелудочной железы другими ее клетками. Действие дофамина на клеточном уровне Действие дофамина на клеточном уровне Подобно многим другим биологически активным веществам, дофамин прикрепляется к рецепторам на поверхности клеток, активируя эти рецепторы. У млекопитающих, ученые выделяют пять видов рецепторов дофамина (D1- D5). Все они выполняют функцию сопряженных с G-белком рецепторов, то есть их деятельность регулируется системой вторичных мессенджеров. Если не вдаваться в подробности, рецепторы дофамина у млекопитающих можно условно объединить в два семейства (D1-подобные и D2-подобные). Результатом деятельности D1-подобных рецепторов (D1 и D5) может стать как возбуждение (при открытии каналов натрия), так и ингибирование (при открытии каналов калия); D2-подобные рецепторы (D2, D3 и D4), как правило, в конечном счете ингибируют выбранный в качестве мишени нейрон. Именно поэтому некорректно рассматривать дофамин либо только как возбуждающее средство, либо только как ингибитор. Он воздействует на нейроны по-разному, в зависимости от того, какие рецепторы присутствуют на мембране каждого конкретного нейрона и от внутренней реакции того или иного нейрона на АМФ. В ЦНС больше всего D1-рецепторов (и далее в порядке убывания). Уровень внеклеточного дофамина зависит от двух факторов (механизмов): тонической и фазовой трансмиссии дофамина. Тоническая трансмиссия начинается при высвобождении небольших «порций» дофамина, независимо от деятельности нейронов, и регулируется посредством обратного захвата других нейронов и нейромедиаторов. Фазовая выработка дофамина является следствием деятельности клеток, содержащих дофамин. Данный процесс характеризуется нерегулярным ускорением синтеза отдельных «порций» (пиковый потенциал составляет 2–6 стремительных выброса один за другим). 10) Черное вещество, система дофамина и контроль моторики Черное вещество является одним из компонентов подкорковых ядер, группы взаимосвязанных структур в передней и средней части головного мозга, которые отвечают за моторику. Ученые до конца не разобрались в алгоритме этой функции, но описывают ее как «выбор реакции». Приверженцы этой теории убеждены в том, что, когда у человека или у животного есть выбор (несколько вариантов действий), как ему поступить в той или иной ситуации, активируются подкорковые ядра, которые и определяют выбор того или иного варианта. Таким образом, подкорковые ядра определяют наше ситуативное поведение (не влияя при этом на детали). Считается, что дофамин модулирует процесс выбора реакции (как минимум двумя способами). Во-первых, дофамин определяет «границы усилий»: чем активнее дофамин, тем меньше стимулов потребуется для выбора той или иной модели поведения. Следовательно, высокие концентрации дофамина значительно повышают двигательную активность и провоцируют «импульсивное» поведение; при низком уровне дофамина человек, наоборот, становится вялым и заторможенным. При болезни Паркинсона, на фоне которой дофаминовые запасы в черном веществе практически полностью иссякают, происходит оцепенение, а движения становятся редкими и замедленными, и, тем не менее, когда люди с данным синдромом подвергаются воздействию мощных внешних стимулов (например, когда им что-то угрожает), их реакции становятся своевременными, как у здоровых людей. И, наоборот, наркотики, которые усиливают действие дофамина (кокаин и амфетамин), вызывают гиперактивность, в частности, чрезмерное психомоторное возбуждение и стереотипные движения. Дофамин также является своего рода раздражителем для выработки рефлекса. Двигательный рефлекс сопровождается повышением активности дофамина, в результате чего меняется последовательность подкорковых ядер (таким образом, что в следующий раз в подобной ситуации нужная реакция произойдет быстрее). Данный процесс является разновидностью выработки оперантного условного рефлекса (обучение методом проб и ошибок), при этом дофамин играет роль «поощрительного» сигнала. Структура и физические свойства Подкорковые ядра отличаются довольно сложной структурой, поэтому роль дофамина в данном случае далеко неоднозначна. В пределах макроса действие дофамина проецируется лишь с парс компакты черного вещества на полосатое тело, однако он контактирует с различными нейронами, преобразуя их мишени (активируя одну их часть через D1-рецепторы и ингибируя другую часть с помощью D2-рецепторов. Значительное количество дофамина поступает в шейки дендритных шипиков, откуда оказывает синхронизирующее действие на специфические синапсы, берущие свое начало в коре больших полушарий головного мозга. Существует два отдельных канала, по которым проходят сигналы дофамина (синтезируясь в полосатом теле), а именно, прямой и косвенный каналы. Считается, что дофамин активируется при открытии прямого канала и блокировке косвенного. Многие теоретики полагают, что в основе формирования двигательного навыка в подкорковых ядрах лежит долговременное потенциирование полосатого тела, основным регулятором которого является дофамин—другими словами, это механизм, согласно которому дофамин способствует либо укреплению, либо ослаблению синоптических связей внутри полосатого тела.[23] Вентральная область покрышки и «поощрение» В вентральной области покрышки (ВОП) находится основная масса нейронов дофамина (если говорить о головном мозге человека). Их сигналы проецируются на многие зоны головного мозга, но наиболее активно это происходит в мезолимбическом канале, откуда действие нейронов распространяется на прилежащее ядро («центр удовольствия») и прочие лимбические структуры, а также в мезокортикальном канале («мишенями» которого являются префронтальная и островковая области префронтальной коры. «Поощрение» Дофаминовая система ВОП имеет непосредственное отношение к системе «поощрений» головного мозга. Выработка дофамина в таких его областях, как прилежащее ядро и префронтальная кора, является следствием «поощрений» в виде вкусной еды, секса и нейтральных стимулов, которые с ними ассоциируются.[24] Источником дофамина в данном случае является прежде всего ВОП, хотя черное вещество также играет определенную роль в этом процессе. Электрическая стимуляция ВОП или ее выпускных каналов, сама по себе, является потенциальной «наградой»: животные быстро учатся «переключать нужные рычаги» для активации синтеза дофамина и зачастую им это нравится и они не останавливаются, постепенно наращивая темп.[25] Различные лекарства (в частности, наркотические средства), после приема которых уровень дофамина в крови резко повышается, по сути, тоже являются своего рода «поощрением» и усиливают действие прочих «наград».[25] Несмотря на многочисленные данные о тесной взаимосвязи между дофамином и «поощрением» головного мозга, ученые никак не могут прийти к единому мнению насчет того, является ли действие дофамина (само по себе) «поощрением», или же дофамин лишь вносит определенный вклад в этот сложный процесс. Расхождение во мнениях обусловлено двумя наблюдениями: (1) Являясь «поощрением», дофамин в то же время раздражает ЦНС (благодаря чему человек не может усидеть на месте, совершая различные движения; (2) зачастую дофамин синтезируется под действием факторов, не имеющих ни малейшего отношения к поощрению (наиболее ярким примером является боль). Одной из наиболее популярных альтернатив теории поощрения является теория «стимул – реакция», сторонники которой убеждены, что основная функция дофамина заключается в усилении стимулов различной природы (как положительных, так и отрицательных). [26] По данным многочисленных исследований, дофамин является не самим «вознаграждением», а, скорее, его действие обусловлено «ошибочным прогнозом в отношении этого вознаграждения, то есть определяет степень неожиданности того или иного вознаграждения. Приверженцы данной гипотезы, в основу которой легли записи Вольфрама Шульца, уверены, что, если вознаграждение не было неожиданностью, то дофамин не активируется, тогда как в случае «сюрприза» уровень дофамина в крови ненадолго повышается, а при отсутствии ожидаемой награды его концентрация, наоборот, понижается (до отметки ниже изначальной). Гипотеза «ошибочного прогноза» вызвала неподдельный интерес со стороны нейробиологов, поскольку вычислительный метод обучения, известный как метод временных различий, подразумевает интенсивное использование сигнала, в котором закодирован ошибочный прогноз. Полное соответствие теории с имеющимися данными послужило поводом более тесного и плодотворного сотрудничества между нейробиологоми-теоретиками и практиками. [26] Результаты недавних исследований являются наглядным подтверждением тому, что даже если отдельные дофаминергические нейроны функционируют по принципу «поощрительных» нейронов, другие не реагируют на «сюрпризы», в частности, негативные.[27] В ходе данного исследования учеными было установлено, что «поощрительные» нейроны преобладают в вентромедиальной зоне парс компакты черного вещества и в вентральной области покрышки. Сигналы этих нейронов проецируются, главным образом, на вентральный стриатум, таким образом передавая ценную информацию о «вознаграждении».[27] Больше всего эмоциональных нейронов находится в дорсолатеральной зоне парс компакты черного вещества, откуда их сигналы проецируются на дорсальный стриатум, определяя, таким образом, выбор той или иной модели поведения. [27] Ученые предполагают, что различия между этими двумя типами дофаминергических нейронов обусловлены источниками их сигналов: сигналы «вознаграждений» синтезируются в базальных отделах переднего мозга, тогда как сигналы эмоциональных (реагирующих на неожиданность) нейронов – в латеральной уздечке эпиталамуса.[27] У приматов нейроны черного вещества и ВОП проецируют свои сигналы на префронтальную кору;[28] ученые до сих пор ломают голову над тем, каким же образом и почему дофамин иннервирует другие участки коры головного мозга приматов. На протяжении многих лет бытует мнение о том, что в условиях стресса (пусть даже незначительного) выработка дофамина в префронтальной коре мозга грызунов заметно ускоряется,[29] что говорит о сильном влиянии эмоциональных нейронов дофамина на эту зону. «Стремление» и «удовлетворение» (различия) В свое время Кент Берридж и другие исследователи бурно дискутировали между собой на тему разницы между «вознаграждением» (с точки зрения мотивации) и удовольствием (сквозь призму эмоциональной экспрессии). Выражаясь простым языком, они пытались отличить «стремление» от «удовлетворения». Стремление возникает при наличии определенных стимулов (например, еды), при воздействии которых животное старается вести себя таким образом, чтобы заслужить (получить) эту «награду». «Удовлетворение» - это ощущение счастья и наслаждения, например, во время еды. Результаты многих исследований свидетельствуют о том, что дофаминовая система является неотъемлемой частью системы головного мозга, отвечающего за стремление (но не за удовлетворение). Наркотики, усиливающие выработку и действие дофамина (главным образом, психо-стимуляторы, такие, как метамфетамин и кокаин), подобным образом, обостряют у человека стремление, но зато практически не влияют на удовольствие. И, наоборот, опиаты, такие, как героин и морфин, усиливают удовольствие, но при этом почти не влияют на стремление. Животные с неактивной системой ВОП-дофамина не будут стремиться найти пищу, даже когда голодны, и так и будут голодать до самой смерти (если не вмешается человек), однако если положить кусок пищи ем в рот, они с удовольствием съедят его, выражая удовлетворение всем своим видом. [24] Участие дофамина в формировании когнитивной функции Ученые активно изучают влияние дофамина на формирование высшей умственной деятельности на примере обезьян и грызунов. Все началось с одного исследования, проведенного Брозоски и его командой в 1979 году, в ходе которого ученые смогли наглядно продемонстрировать, что при истощении запасов катехоламинов в префронтальной коре мозга обезьян у них нарушалась пространственная память (точно так же, как при удалении самой префронтальной коры).[30] Недавно ученые установили, что, как дофамин, так и норэпинефрин, оказывают существенное влияние на функционирование ПФК, помогая скоординировать когнитивную функцию с возбуждением ЦНС.[31] Роль дофамина в формировании функции ПФК можно наглядно выразить посредством U-образной кривой зависимости, при этом, воздействуя на свои D1-рецепторы, дофамин в той или иной степени нарушает кратковременную память.[32]В префронтальной коре приматов, при раздражении D1-рецептора дофамина, селективно возбуждаются клетки «задержки» (которые также называют клетками «памяти»), тогда как при активации D2 рецепторов меняется степень возбуждения «рефлекторных клеток».[33] Фармакология Существует несколько коммерческих названий (торговых марок) дофамина («Интропин», «Дофастат», «Ревимин» и др.), под которыми он широко применяется как в виде перорального лекарственного препарата, так и в форме раствора для инъекций. Чаще всего дофамином лечат острые формы гипотонии, брадикардии (замедленного сердечного пульса), циркуляторного шока или остановки сердца, особенно у новорожденных детей. Действие дофамина зависит от его дозировки: он может стимулировать почечную экскрецию натрия, усиливать сердцебиение и повышать артериальное давление. В «сердечно-бета» дозировке (5-10 мкг/кг/мин), дофамин, воздействуя на симпатическую нервную систему, повышает частоту сокращений сердечной мышцы, тем самым увеличивая объем сердца и повышая артериальное давление. В «прессорной альфа-дозировке» (10 - 20 мкг/кг/мин) дофамин обладает сосудосуживающим действием, в результате чего еще больше повышается артериальное давление, при этом зачастую возникают неприятные и серьезные побочные эффекты в виде почечной недостаточности и сердечной аритмии.[35][36] В более ранних справочниках упоминается «почечная/дофаминергическая дозировка» дофамина (2 - 5 мкг/кг/мин), которая восстанавливает (и даже улучшает) функцию печени без каких-либо побочных эффектов, однако в ходе недавних исследований было установлено, что такие низкие дозировки, по сути, не являются эффективными (с точки зрения лечения болезней) и зачастую способны только навредить организму.[37] Токсичность LD50, или дозировка, которая является летальной в 50% случаев, для дофамина составляет: 59 мг/кг (для мышей; в виде внутривенных инъекций); 950 мг/кг (для мышей; в виде внутрибрюшинных инъекций); 163 мг/кг (для крыс; в виде внутрибрюшинных инъекций); 79 мг/кг (для собак; внутривенно).[38] L-ДОФА Леводопа – это вещество-предшественник дофамина, которое активно применяется (в различных формах) для лечения болезни Паркинсона и дистонии, чувствительной к агонистам дофамина. Как правило, данный препарат принимают совместно с ингибитором периферийного декарбоксилирования (ДДК, дофа - декарбоксилазой), представленным на рынке под торговыми названиями «карбидопа» и «бензеразид». В некоторых случаях леводопу комбинируют с ингибиторами альтернативных метаболических каналов допамина (катехол-O-метил-трансферазы); в виде препаратов энтакапона и толкапона). Психостимуляторы Кокаин и амфетамины повышают активность нейронов дофамина; и, тем не менее, их механизмы сильно отличаются. Кокаин является блокатором переносчика дофамина и переносчика норэпинефрина. Он является неконкурентным ингибитором повторного обратного захвата дофамина (в результате чего повышается уровень дофамина в синоптической щели). Подобно кокаину, аналоговые амфетамины усиливают приток дофамина в синоптическую щель, однако принцип их действия куда более сложный, чем принцип действия кокаина. [39] Амфетамин попадает в пресинаптические нейроны через нейронную мембрану или ДАТ , после чего (будучи внутри) он прикрепляется к рецептору TAAR1 или проникает в синоптические пузырьки через ВМАП-2 . При попадании амфетамина в синоптические пузырьки с помощью VMAT2, в цитозоль выбрасывается дофамин. Прикрепляясь к TAAR1, амфетамин снижает скорость возбуждения рецептора дофамина (через каналы калия) и активирует протеин-киназу-А (ПКА) и протеин-киназу-C (ПКС), в результате чего ДАТ фосфорилируется. Когда фосфорилятором ДАТ является ПКА, ДАТ поступает обратно в пресиноптический нейрон (поглощается им), прекращая дальнейшее перемещение. Если же в роли фосфорилятора выступает ПКС, то возможны два сценария «поведения» ДАТ (противоположный вышеописанному и ПКС сценарий). Как известно, амфетамин также усиливает приток кальция в клетки (вследствие активации рецептора TAAR1), что связано с фосфориляцией ДАТ (внутри канала киназы CAMK), на фоне которой происходит отток дофамина из клеток. Нейролептики Отдельные препараты, которые снижают активность дофамина, успешно применяются для лечения шизофрении и других психических расстройств. Эти антипсихотические лекарства, также известные как нейролептики или «сильные транквилизаторы», отличаются от «слабых транквилизаторов» (таких как валиум), которыми снимают повышенную тревожность и лечат бессонницу. Нейролептики подавляют практически любой вид активности, в частности, эффективно справляются с неадекватным поведением (бредовыми идеями) и повышенной психомоторной активностью (типичный признак психоза). С появлением первого универсального нейролептика хлорпромазина (торазина) в 50-е, многие шизофреники перешли на амбулаторный режим лечения (то есть их выписали из психдиспансеров). И все же, долгое время нейролептики были под подозрением ученых, и тому есть несколько причин. Во-первых, у многих людей на фоне приема нейролептиков развивается стойкое отвращение (например, к еде, алкоголю и т.д.), поскольку они притупляют мышление, делая человека заторможенным, и лишают его способности получать удовольствие. [40] Во-вторых, до сих пор не доказано, что их действие направлено конкретно на борьбу с психотическим поведением, а не на подавление любого рода активности. В-третьих, зачастую прием нейролептиков сопровождается серьезными побочными эффектами, включая прибавку в весе, сахарный диабет, усталость, половую дисфункцию, гормональные нарушения и позднюю дискинезию (вид двигательного расстройства). Некоторые побочные эффекты не исчезают даже после отмены препарата (а в ряде случаев «мучают» человека всю оставшуюся жизнь). Самые первые нейролептики (разработанные специально для лечения психоза) сильно влияли на многие функции дофамина. Такие препараты называют «типичными нейролептиками». Из-за тяжелейших побочных эффектов этих препаратов, ученые занялись разработкой нейролептиков нового поколения, которые назвали «атипичные нейролептики» или «антипсихотики нового поколения»; эти препараты воздействуют лишь на определенные рецепторы дофамина, имеющие прямое отношение к развитию психоза, тем самым снимая психотические симптомы, но при этом не вызывают таких серьезных побочных эффектов. И, тем не менее, нейролептики нового поколения стали предметом бурной дискуссии, поскольку многие ученые и врачи сомневаются, что эти препараты действительно улучшают состояние больных (некоторые считают, что они обладают слабовыраженным действием). Различные заболевания и расстройства Дофаминовая система играет ключевую роль в развитии определенных заболеваний и нарушений, включая болезнь Паркинсона, синдром дефицита внимания с гиперактивностью, шизофрению и наркозависимость. Болезнь Паркинсона Болезнь Паркинсона – это расстройство, на фоне которого у человека развивается ригидность (он становится малоподвижным, зачастую пребывая в оцепенении), замедляются движения и начинают непроизвольно дрожать конечности. На поздних стадиях, данное заболевание зачастую перетекает в слабоумие, и в конечном счете, приводит к летальному исходу. Основные симптомы болезни Паркинсона возникают на почве значительного истощения запасов дофамин-синтезирующих клеток в черном веществе. Эти клетки самые хрупкие и разрушаются быстрее остальных, чему способствуют различные травмы головного мозга, включая энцефалит (о котором рассказывается в книге и одноименном фильме «Пробуждение»), контузии и сотрясение мозга у спортсменов и отдельные формы отравления (например, МФТГ ), которые сопровождаются сильным снижением уровня клеток, синтезирующих дофамин, в результате чего у человека развивается синдром Паркинсона, который практически полностью идентичен болезни Паркинсона. И все же, в большинстве случаев, болезнь Паркинсона имеет «идиопатическую» подоплеку (то есть, причина гибели клеток не установлена). Чаще всего для лечения болезни Паркинсона применяют L-ДОФА, метаболический предшественник дофамина. Данный метод лечения не позволяет восполнить истощенные запасы клеток, однако заставляет оставшиеся клетки активнее синтезировать дофамин, тем самым частично компенсируя потери. На поздних стадиях заболевания данный вид лечения теряет свою эффективность, поскольку клеток уже настолько мало, что они не могут синтезировать достаточное количество дофамина (независимо от принятой дозы L-ДОФА). С наступлением поздней стадии болезни Паркинсона, механизмы, регулирующие метаболизм дофаминовых клеток, нарушаются, становясь хаотичными, в результате чего у человека развивается синдром дисрегуляции дофамина, когда состояние больного постоянно колеблется (гиперактивность сменяется параличом и наоборот).[41] Синдром дефицита внимания с гиперактивностью
При изменении скорости нейротрансмиссии дофамина, у человека развивается синдром дефицита внимания с гиперактивностью (СДВГ), заболевание, которое сопровождается невозможностью сконцентрироваться на чем-то, невнимательностью и/или импульсивностью. Между рецепторами дофамина, его переносчиками и СДВГ существует некая взаимосвязь на генетическом уровне [42]. Наиболее отчетливо данная связь проявляется при приеме лекарств, направленных на лечение СДВГ. Наиболее эффективными препаратами в данном случае являются психостимуляторы, такие как метилфенидат («Риталин», «Концерта») и амфетамин (поскольку эти средства повышают уровень дофамина и норэпинефрина в головном мозге). [43] Наркозависимость При формировании наркотической зависимости (от того или иного препарата или наркотика) в прилежащем ядре меняется генная экспрессия, что, в свою очередь, сказывается на нейротрансмиссии дофамина.[44][45] Самыми важными транскрипционными факторами, отвечающими за эти изменения, являются ΔFosB, циклический аденозин-монофосфат (цAMФ), цАМФ-ответный элемент активирующего белка (CREB) и ядерный фактор «каппа-би» (NFκB).[45] Наиболее значимым фактором является ΔFosB, поскольку именно его «запасы» (большие) в прилежащем ядре необходимы для проявления большинства адаптивных реакций головного мозга при наркозависимости;[45] Данный фактор отвечает за формирование зависимости от многих наркотиков, включая каннабиоиды, кокаин, никотин, фенилциклидин и аналоговые амфетамины.[44][45] Транскрипционный фактор ΔJunD является прямым антагонистом ΔFosB.[45] При повышении уровня ΔJunD в прилежащем ядре, адаптивные аддиктивные реакции головного мозга (которые наблюдается при хронической наркомании) частично или полностью исчезают (фактор ΔFosB их блокирует).[45] Более того, ΔFosB регулирует поведенческие реакции на естественные «вознаграждения» головного мозга (вкусную и приятно пахнущую еду, секс и физические упражнения).[44][45] Поскольку естественные «вознаграждения», подобно наркотикам, индуцируют фактор ΔFosB, при регулярном получении таких «наград», человек привыкает к ним и ему их требуется все больше и больше (для удовлетворения своих потребностей).[44][45] Ингибиторы ΔFosB (препараты-блокаторы данного фактора) с успехом применяют для лечения наркозависимости и сопутствующих расстройств. [46] Боль Ученые доказали, что дофамин участвует в процессах, связанных с болевыми ощущениями, на различных уровнях ЦНС, включая спинной мозг, околоводопроводное серое вещество головного мозга (ОПСВ), зрительный бугор, подкорковые ядра и переднюю поясную кору. Следовательно, когда уровень дофамина снижается, проявляются болевые ощущения (такое часто происходит на фоне болезни Паркинсона). Аномалии дофаминергической трансмиссии характерны для таких дискомфортных заболеваний, как неврогенный глоссит (синдром жжения рта), [47] фибромиалгия и синдром беспокойных ног. В целом, обезболивающее действие дофамина обусловлено активацией D2-рецептора; исключением является зона ОПСВ, где при активации болевые ощущения затухают при активации D1 – рецептора, что, видимо, связано с возбуждением нейронов, которые участвуют в «нисходящем ингибировании». [48] Более того, при активации D1-рецептора в островковой области коры больших полушарий головного мозга последующие болевые ощущения становятся менее выраженными. Тошнота Тошнота и рвота во многом связаны с процессами, протекающими в стволовой части головного мозга, известной как хеморецепторная триггерная зона. В ней сосредоточена большая группа D2-рецепторов. Следовательно, препараты-активаторы этих рецепторов вызывают сильную тошноту. Сюда относятся препараты, которыми лечат болезнь Паркинсона, а также другие агонисты дофамина, такие, как апоморфин. Антагонисты D2-рецепторов (например, метоклопрамид) зачастую эффективно снимают тошноту. Психоз Чересчур активная дофаминергическая трансмиссия является признаком психоза и шизофрении.[49] И, тем не менее, данные клинических исследований, авторы которых связывают шизофрению с нарушением метаболизма дофамина в головном мозге, сильно варьируются (от противоречивых до негативных), поскольку концентрация ГВК в спинномозговой жидкости оказалась одинаковой как у шизофреников, так и у здоровых людей из контрольной группы.[50] У шизофреников наблюдается повышенная дофаминергическая активность, в частности, в мезолимбическом канале. И все же, зачастую это сопровождается снижением активности дофамина в другом (мезокортикальном) канале. Принято считать, что оба канала отвечают за различные симптомы шизофрении. Нейролептики, в большинстве своем, действуют по принципу антагонизма по отношению к дофамину, ингибируя его на уровне рецепторов и тем самым блокируя нейрохимическое действие пропорционально дозировке. Большинство нейролептиков старого поколения, так называемых «типичных антипсихотиков», воздействуют на D2-рецепторы,[51] тогда как действие «атипичных нейролептиков» также направлено на другие рецепторы (D1, D3 и D4), хотя они обладают меньшей аффинностью по отношению к рецепторам дофамина как таковым.[52] Открытие, связанное со способностью наркотиков вроде амфетаминов, метамфетамина и кокаина более чем в 10 раз повышать уровень дофамина, тем самым вызывая временный психоз[53], является еще одним тому доказательством.[54] И, тем не менее, многие наркотики, не имеющие никакого отношения к дофамину, также способны вызывать как острый, так и хронический психоз.[55] Антагонисты NMDA-рецепторов (кетамин и ФЦП) активно изучаются в попытках воссоздать позитивные и негативные симптомы шизофрении.[56][57] Дофаминергическая дисрегуляция также наблюдается при депрессивных расстройствах. [58] В прошлом ученые активно изучали взаимосвязь между уровнем дофамина в крови людей, страдающих депрессией, и самой депрессией. В ходе многочисленных исследований ученые пришли к выводу, что у депрессивных людей уровень тирозина (вещества-предшественника дофамина) в плазме, вентрикулярной и люмбарной спинной жидкости ниже, чем у здоровых людей (контрольной группы).[59][60] Авторы одного из таких экспериментов измерили уровень гомо-ванилиновой кислоты (основного метаболита дофамина в спинномозговой жидкости) у людей, страдающих депрессией.[61] Зачастую ученые пользуются методом полимеразной цепной реакции с обратной транскриптазой (ОT-ПЦР), позволяющим определить генную экспрессию в определенных рецепторах дофамина в мозжечковой миндалине; этот показатель, как правило, бывает повышен у людей, страдающих депрессией, по отношению к здоровым людям. [62] Принцип действия популярных антидепрессантов также основан на преобразовании дофаминергических каналов. По словам ученых, многие антидепрессанты вызывают повышение внеклеточной концентрации дофамина в префронтальной коре головного мозга крыс,[63] однако действие этих лекарств на полосатое тело и прилежащее ядро сильно варьируется.[64][65] Это можно сравнить с электрошоковой терапией (ЭШТ), на фоне которой уровень дофамина в полосатом теле головного мозга крыс повышается в сотни раз. [66] В ходе более поздних экспериментов с грызунами, ученые заметили, что депрессивные модели поведения связаны со сбоями в работе дофаминергической системы.[67] У грызунов, подверженных слабо выраженному хроническому стрессу, менее развита реакция избегания (опасности) и они показывают худшие результаты при выполнении теста принудительного плавания, который связан с активацией дофаминергического мезолимбического канала.[67] Кроме того, депрессивное поведение у грызунов зачастую является следствием непризнания в «социуме» и может меняться в лучшую сторону при активации дофаминергических каналов.[68] Более того, науке известны случаи расщепления дофамина в хвостатом и прилежащем ядрах на фоне приобретенной беспомощности у животных. Первые симптомы снимаются агонистами дофамина и антидепрессантами, при условии, что животное еще не стало беспомощным. [69] Прикладная биология и эволюция Микроорганизмы Ученые не обнаружили дофамин в археях, однако его способны синтезировать некоторые другие бактерии и инфузории из рода тетрахимена. [70] Что особенно важно, в некоторых бактериях содержатся гомологи всех ферментов, которые используются животными для синтеза дофамина. Ученые предполагают, что животные синтезируют дофамин, прибегая к помощи бактерий, путем горизонтального переноса генов (это произошло на довольно поздней ступени эволюции, и, вероятно, было обусловлено симбиозом бактерий с эукариотическими клетками, образующими митохондрию.[71] Животные Почти все многоклеточные животные используют дофамин для «общения» клеток между собой. Науке известен лишь один случай обнаружения дофамина в губчатых (губках), причем его функция не установлена;[72] И, тем не менее, ученые нашли дофамин в нервной системе множества видов с радиальной симметрией, включая книдарии (медузы, гидра, кораллы и т.д).[73] Все это указывает на то, что дофамин с незапамятных времен (более 500 миллионов лет назад, еще в кембрийский период палеозойской эры ) выполнял функцию нейромедиатора нервной системы живых организмов, в частности, позвоночных, иглокожих, членистоногих, моллюсков и некоторых видов червей.[74][75] У всех животных дофамин влияет на моторику.[76] У хорошо изученных червей-нематод Caenorhabditis elegans, дофамин замедляет локомоцию и способствует более активному поиску пищи. У планарий дофамин вызывает «винтообразные» движения; пиявок он лишает способности плавать, заставляя ползти; и т.д. У многих позвоночных животных дофамин активирует «функции» переключения моделей поведения и выбора реакции (как и у млекопитающих). [76] Кроме того, дофамин является неотъемлемой частью системы «вознаграждений» головного мозга (у всех животных, за исключением класса членистоногих), а в ходе недавних исследований было установлено, что дофамин (как минимум) является медиатором «вознаграждений» у плодовой мушки.[77][78] Нематод, планарий, моллюсков, чернобрюхую дрозофилу и позвоночных можно «приучить» к выработке дофамина.[76] Долгое время считалось (и считается), что членистоногие являются исключением из данного правила, поскольку у представителей этого класса (насекомых, ракообразных и др.) дофамин вызывает обратный эффект, а медиатором системы «вознаграждений» у них является октопамин (нейромедиатор, который отсутствует у позвоночных, но по своей структуре и свойствам напоминает норэпинефрин). По некоторым данным, способность октопамина повышать аппетит обусловлена активацией группы дофаминергических нейронов, до которых раньше просто не могли «добраться».[77][78] Самостоятельная популяция клеток, синтезирующих дофамин, способствует усилению отвращения, вызываемого реакцией органов обоняния на запахи (то же самое происходит у млекопитающих).[79] Растения Многие растения (в частности, съедобные) в той или иной степени способны синтезировать дофамин. Больше всего дофамина содержится в бананах (в мякоти красных и желтых бананов концентрация дофамина составляет 40-50 миллионных долей массы самих плодов. В картошке, авокадо, брокколи и брюссельской капусте также может содержаться дофамин (1 миллионная доля и более); в апельсинах, помидорах, шпинате, бобах и др. – менее 1 миллионной. [80] В растениях дофамин синтезируется из аминокислоты тирозина (подобным образом, как и у животных). Дофамин метаболизируется несколькими способами (побочными продуктами данной реакции являются меланин и различные алкалоиды).[80] Функции растительных катехоламинов довольно мало изучены, однако учеными было доказано, что они играют определенную роль в формировании ответной реакции растений на внешние стрессовые факторы, такие как бактериальная инфекция, в ряде случаев играют роль своего рода «гормона роста» и вносят определенные изменения в метаболизм сахаров. [80] Дофамин, поступающий в организм вместе с пищей, не может воздействовать на головной мозг, будучи не в состоянии преодолеть гематоэнцефалический барьер. И, тем не менее, во многих растениях содержится L-ДОФА, метаболический прекурсор дофамина.[81] Больше всего его в листьях и стручках растений из рода Мукуна, особенно Мукуны жгучей (бархатных бобов), которая является лекарственным препаратом и ценным источником L-ДОФА.[82] Еще одно растение, богатое L-ДОФА, это Боб садовый, из которого получают конские бобы (также известные как «зеленые бобы»). И все же концентрация L-ДОФА в самих бобах гораздо ниже, чем стручковой кожуре и других частях растения. [83] В семенах кустарников Кассии и Баугинии также содержится значительное количество L-ДОФА.[81] Желтовато-зеленая морская водоросль Ульвария темная, которая является основным «компонентом» «цветения воды», очень богата дофамином (прибл. 4,4% массы сухого продукта). Ученые доказали, что дофамин в составе этой водоросли защищает ее от поедания морскими травоядными животными (змеями и изоподами).[84] Вещество-предшественник меланина Меланины – это группа темноокрашенных веществ, содержащихся во многих живых организмах. Ввиду физических свойств меланинов, эксперименты с ними проводят крайне редко (это очень сложно), поэтому отдельные аспекты их биохимии малоизучены и являются «загадкой» для ученых. По своему химическому составу они очень похожи на дофамин, причем существует определенный тип меланина, известный как «дофамин-меланин», который синтезируют путем окисления дофамина при участии фермента тирозиназы.[85] Меланин, отвечающий за темный оттенок кожи человека, другого типа: он синтезируется в канале, в котором в роли вещества-предшественника выступает L-ДОФА, а не дофамин. И, тем не менее, существует масса доказательств тому, что весь «нейро-меланин», придающий темную окраску черному веществу головного мозга, как минимум, частично состоит из «дофамин-меланина». [86] Меланин, полученный из дофамина, вероятно, присутствует и в других (минимум нескольких) биологических системах. Часть растительного дофамина является прекурсором «дофамина-меланина». [87] Считается, что сложные сегменты на крыльях бабочек, а также черно-белые полосы на личинках насекомых являются следствием скоплений «дофамин-меланина».[88] Механизмы биохимических реакций По своей структуре, дофамин относится к классам катехоламинов и фенэтиламинов. В рамках биологической системы, дофамин синтезируется в клетках головного мозга и надпочечников из L-ДОФА. В клетках мозга он объединяется с рецепторами, после чего в виде пузырьков высвобождается (синоптическая трансмиссия). После этого дофамин либо резорбирует в пре- синоптическом терминале (для вторичного использования), либо расщепляется под действием ферментов моноамин-оксидазы или КOMT до состояния различных метаболитов. Биосинтез Дофамин синтезируется далеко не во всех клетках, чаще всего, в нейронах и клетках мозгового вещества надпочечниковs. Ниже приведен метаболический путь дофамина: • L-фенилаланин → L-тирозин → L-ДОФА → дофамин Как мы видим, прямым «предшественником» дофамина является L-ДОФА, однако дофамин способен синтезироваться без участия своего прекурсора: из незаменимых аминокислот фенилаланина и тирозина. Эти аминокислоты содержатся практически во всей белковой пище (тирозин встречается чаще). Несмотря на то, что и сам дофамин содержится во многих продуктах, он не способен преодолевать гематоэнцефалический барьер, защищающий наш головной мозг. Лишь дофамин, который синтезируется внутри головного мозга, способен воздействовать на ЦНС. L-фенилаланин принимает форму L-тирозина (при участии фермента фенилаланин-гидроксилазы (ФАГ) и сопутствующих факторов - кислорода (O2) и тетра-гидро-биопротеина (ТГББ). В свою очередь, L-тирозин превращается в L-ДОФА (под действием фермента тирозин-гидроксилазы (ТГ) и сопутствующих факторов - тетра-гидро-биопротеина (ТГББ), O2 и двухвалентного железа (Fe2+). В итоге, при участии фермента декарбоксилазы ароматических L-аминокислот (ДАЛА; также известного как ДОФА-декарбоксилаза (ДДК) и сопутствующего фактора пиридоксаль-фосфата (ПЛФ), L-ДОФА принимает форму дофамина. Сам дофамин зачастую выполняет функцию прекурсора в процессе синтеза нейромедиаторов - норэпинефрина и эпинефрина. Под действием фермента дофамин-β-гидроксилазы (ДБГ) и сопутствующих факторов (O2 и L-аскорбиновой кислоты), дофамин принимает форму норэпинефрина, который, в свою очередь, превращается в эпинефрин (при участии фермента фенил-этаноламин-N-метил-трансферазы (ФНМТ) и сопутствующего фактора - S-аденозил-L-метионина (SAM)). Следует отметить, что некоторые сопутствующие факторы перед вступлением в реакцию сами должны синтезироваться. При отсутствии (или недостатке) любой из необходимых аминокислот или того или иного сопутствующего фактора, последующий биосинтез дофамина, норэпинефрина и эпинефрина нарушается. Хранение, секреция и обратный захват Внутри головного мозга, дофамин выполняет функцию нейромедиатора, принцип действия которого во многом идентичен механизмам других нейромедиаторов. Только что синтезированный дофамин переносится из цитозоли в синоптические пузырьки (в чем ему помогает везикулярный моноаминный переносчик - 2 (ВMAП-2). Дофамин продолжает накапливаться в этих пузырьках до того, пока они его не вытолкнут в синоптическую щель одним из двух следующих способов: как правило, везикулярный потенциал действия «заставляет» пузырьки избавляться от своего содержимого, которое прямиком «катапультируется» в синоптическую щель (этот процесс ученые называют экзоцитозом или внеклеточным процессом);[39] однако порой нейроны дофамина, будучи колокализированными с рецептором TAAR1, выбрасывают дофамин в синапс, подобно амфетамину в присутствии необходимого количества эндогенного фенетиламина.[39] Будучи в синапсе, дофамин прикрепляется к рецепторам дофамина, активируя их; эти рецепторы сосредоточены либо в пост-синоптических клетках-мишенях, либо на мембране самой пре-синоптической клетки, из которой высвобождается дофамин (например, короткие ауто-рецепторы D2 ). После того, как «сработал» потенциал действия, молекулы дофамина сразу отцепляются от своих рецепторов, после чего снова поглощаются пре-синоптической клеткой посредством обратного захвата, медиатором которого является либо высокоаффинный переносчик дофамина (ДАП), либо низкоаффинный моноаминный переносчик плазменной мембраны (ПМАП). Попадая в цитозоль, дофамин вновь внедряется в пузырьки (при участии ВМАП-2), что обеспечивает ему дальнейшее передвижение. Распад Дофамин распадается на неактивные метаболиты, в чем ему помогает комплекс ферментов: моноамин-оксидаза (MAO), альдегид-дегидро-геназа (АЛДГ) и катехол-O-метил-трансфераза (КOMT), действующих один за другим. Изо-формы МАО, MAO-A и MAO-B в данном случае одинаково эффективны. Метаболиты: • ДОФАЛ (3,4-дигидрокси-фенил-ацетат-альдегид) • ДОФУК (3,4-дигидрокси-фенил-уксусная кислота) • ДОФET (3,4-дигидрокси-фенил-этанол, также известный как гидрокси-тирозол) • MOФET (3-метокси-4-гидрокси-фенил-этанол, также известный как гомаваниллиловый спирт) • 3-MT (3-метокси-тирамин, частичный агонист рецептора TAAR1) • ГВК (гомо-ванилиновая кислота) Все эти метаболиты являются промежуточными продуктами реакции, за исключением MOФET и ГВК, которые отфильтровываются почками из кровеносной системы, после чего выводятся из организма вместе с мочой. Специфические метаболические реакции: • Дофамин → ДОФАЛ (медиатор – MAO) • ДОФАЛ → ДОФУК (медиатор – АДГГ) • ДОФАЛ → ДОФЕТ (медиатор – альдоза-редуктаза (вспомогательный путь выведения) • ДОФУК → ГВК (медиатор – КОМТ) • ДОФЕТ → MOФET (медиатор – КОМТ) • Дофамин → 3-MT (медиатор – КOMT) • 3-MT → ГВК (медиатор – MAO) В большинстве участков головного мозга, включая полосатое тело и подкорковые ядра, дофамин деактивируется методом обратного захвата со стороны переносчика дофамина (DAT), после чего дофамин распадается под действием МАО, превращаясь в ДОФУК. Однако, в префронтальной коре слишком мало белков DAT, а потому деактивация дофамина происходит за счет обратного захвата со стороны переносчика норэпинефрина (NET), по всей вероятности, по соседству с нейронами норэпинефрина, после чего дофамин расщепляется до состояния 3-MT (под действием КОМТ).[92] DAT является более быстрым и активным переносчиком, чем NET: у мышей уровень дофамина в крови постепенно снижается, при этом период полувыведения составляет 200 миллисекунды из хвостатого ядра (путь выведения - DAT) и 2 000 миллисекунды в ПФК.[93] Нерасщепленный дофамин принимает форму пузырьков (что необходимо для дальнейшего передвижения). Химические свойства С точки зрения химии, молекула дофамина состоит из структуры катехинов (бензольного кольца с двумя гидроксильными группами по бокам), к которой крепится одна группа аминов. Сам по себе, дофамин является самым простейшим из существующих катехоламинов (семейства, к которому также относятся нейромедиаторы норэпинефрин и эпинефрин). При наличии бензольного кольца с прикрепленными аминами образуется фенэтиламин (к данному семейству относятся многочисленные психостимуляторы). Подобно большинству аминов, дофамин имеет органическое основание. При нейтральном или кислотном pH, к дофамину, как правило, присоединяются протоны. Протонированный дофамин отлично растворяется в воде и имеет довольно плотную структуру, хотя под действием кислорода или других оксидантов окисляется. При щелочном pH дофамин теряет протоны. В щелочной форме дофамин хуже растворяется в воде, обладает высокой реактивностью и легко окисляется. Будучи pH-зависимым, химический и лекарственный дофамин имеет форму гидрохлорида дофамина, то есть, выпускается в виде хлористоводородной соли, которая образуется при соединении дофамина с соляной кислотой. Сухой гидрохлорид дофамина представляет собой бесцветный порошок с мелкими гранулами. После растворения в дистиллированной воде получается умеренно кислотный и плотный раствор. Однако дофамин не сочетается с щелочными электролитами, такими, как бикарбонатный буферный раствор, поскольку в этой комбинации он (дофамин) теряет свои свойства (деактивируется). Окисление Попадая в организм, дофамин, как правило, распадается в процессе окисления (в роли катализатора выступает фермент моноамин-оксидазы. И, тем не менее, дофамин обладает способностью к самоокислению, то есть, напрямую вступает в реакцию с кислородом, в результате чего образуются хиноны и различные свободные радикалы (побочные продукты реакции).[94] В присутствии двухвалентного железа и прочих факторов, самоокисление происходит быстрее. Способность дофамина к самоокислению с последующим синтезом хинонов и свободных радикалов делает его мощным клеточным токсином, более того, ученые доказали, что данный механизм действия дофамина вызывает потерю чувствительности клеток (как при болезни Паркинсона и некоторых других заболеваниях). [95] Поли-дофамин В ходе эксперимента с адгезивными белками моллюсков (2007 г.), ученые обнаружили, что многие материалы, если их поместить в слабо-щелочной раствор дофамина, покрываются слоем полимеризованного дофамина, который зачастую называют поли-дофамином.[96][97] Полимеризованный дофамин вступает в спонтанную реакцию окисления, и, по сути, является разновидностью меланина.[98] Синтез обычно подразумевает реакцию дофамина с трометамолом (в качестве щелочи) в воде. Структура поли-дофамина крайне мало изучена. [97] Поли-дофаминовое покрытие образуется на поверхности объектов различного размера, начиная от нано-частиц до больших поверхностей. Ученые активно изучают свойства и потенциальные сферы применения такого покрытия, и убеждены, что в скором времени его можно будет использовать для защиты предметов и веществ от разрушения под действием света или для производства оболочки (капсул) лекарств. Если говорить о более изощренным применении, то поли-дофамин можно будет использовать в качестве субстрата для биосенсоров и других биологически активных макро-молекул.[98] История Дофамин был впервые синтезирован в 1910 году Джорждем Баргером и Джеймсом Эвенсом в стенах лаборатории Wellcome в Лондоне (Англия),[99] в 1957 году Кэтлин Монтагу впервые обнаружила дофамин в головном мозге человека. Свое название дофамин получил, будучи моноамином, прекурсором которого (в ходе синтеза Баргера-Эвенса) стал 3,4-дигидро-фенилаланин (леводофамин или L-ДОФА). Нейромедиативная функция дофамина была открыта в 1958 году Арвидом Карлсоном и Нильсом-Эйком Хилларпом в химико-фармакологической лаборатории Национального Института Сердца в Швеции.[100] В 2000 году Карлссон получил Ноблевскую Премию за заслуги в области физиологии и медицины, доказав, что дофамин является не просто предшественником норэпинефрина (норадреналина) и эпинефрина (адреналина), но и нейромедиатором Источник: Дофамин © Lifebio.wiki
Dopamine
Dopamine |
|
||
Skeletal formula of dopamine |
|
||
Clinical data |
|
||
Other names |
|
|
|
Physiological data |
|
||
Source tissues |
Substantia nigra; ventral tegmental area; many others |
|
|
Target tissues |
System-wide |
|
|
Receptors |
D1, D2, D3, D4, D5, TAAR1[1] |
|
|
Agonists |
Direct: apomorphine, bromocriptine Indirect: cocaine, amphetamine |
|
|
Antagonists |
Neuroleptics, metoclopramide, domperidone |
|
|
Precursor |
Phenylalanine, tyrosine, and L-DOPA |
|
|
Biosynthesis |
DOPA decarboxylase |
|
|
Metabolism |
MAO, COMT[1] |
|
|
Identifiers |
|
||
|
|
||
IUPAC name |
|||
CAS Number |
|
||
PubChem CID |
|
||
IUPHAR/BPS |
|
||
DrugBank |
|
||
ChemSpider |
|
||
UNII |
|
||
KEGG |
|
||
CompTox Dashboard (EPA) |
|
||
ECHA InfoCard |
100.000.101 |
||
Chemical and physical data |
|||
Formula |
C8H11NO2 |
||
Molar mass |
153.181 g·mol−1 |
||
3D model (JSmol) |
|
||
|
|||
SMILES |
|
InChI |
Dopamine (DA, a contraction of 3,4-dihydroxyphenethylamine) is a neurotransmitter that plays several important roles in the brain and body. It is an organic chemical of the catecholamine and phenethylamine families. Dopamine constitutes about 80% of the catecholamine content in the brain. It is an amine synthesized by removing a carboxyl group from a molecule of its precursor chemical, L-DOPA, which is synthesized in the brain and kidneys. Dopamine is also synthesized in plants and most animals. In the brain, dopamine functions as a neurotransmitter—a chemical released by neurons (nerve cells) to send signals to other nerve cells. Neurotransmitters are synthesized in specific regions of the brain, but affect many regions systemically. The brain includes several distinct dopamine pathways, one of which plays a major role in the motivational component of reward-motivated behavior. The anticipation of most types of rewards increases the level of dopamine in the brain,[3] and many addictive drugs increase dopamine release or block its reuptake into neurons following release. Other brain dopamine pathways are involved in motor control and in controlling the release of various hormones. These pathways and cell groups form a dopamine system which is neuromodulatory.[citation needed]
In popular culture and media, dopamine is usually seen as the main chemical of pleasure, but the current opinion in pharmacology is that dopamine instead confers motivational salience;[4][5][6] in other words, dopamine signals the perceived motivational prominence (i.e., the desirability or aversiveness) of an outcome, which in turn propels the organism's behavior toward or away from achieving that outcome.[6][7]
Outside the central nervous system, dopamine functions primarily as a local paracrine messenger. In blood vessels, it inhibits norepinephrine release and acts as a vasodilator (at normal concentrations); in the kidneys, it increases sodium excretion and urine output; in the pancreas, it reduces insulin production; in the digestive system, it reduces gastrointestinal motility and protects intestinal mucosa; and in the immune system, it reduces the activity of lymphocytes. With the exception of the blood vessels, dopamine in each of these peripheral systems is synthesized locally and exerts its effects near the cells that release it.
Several important diseases of the nervous system are associated with dysfunctions of the dopamine system, and some of the key medications used to treat them work by altering the effects of dopamine. Parkinson's disease, a degenerative condition causing tremor and motor impairment, is caused by a loss of dopamine-secreting neurons in an area of the midbrain called the substantia nigra. Its metabolic precursor L-DOPA can be manufactured; Levodopa, a pure form of L-DOPA, is the most widely used treatment for Parkinson's. There is evidence that schizophrenia involves altered levels of dopamine activity, and most antipsychotic drugs used to treat this are dopamine antagonists which reduce dopamine activity.[8] Similar dopamine antagonist drugs are also some of the most effective anti-nausea agents. Restless legs syndrome and attention deficit hyperactivity disorder (ADHD) are associated with decreased dopamine activity.[9] Dopaminergic stimulants can be addictive in high doses, but some are used at lower doses to treat ADHD. Dopamine itself is available as a manufactured medication for intravenous injection: although it cannot reach the brain from the bloodstream, its peripheral effects make it useful in the treatment of heart failure or shock, especially in newborn babies.

Structure
A dopamine molecule consists of a catechol structure (a benzene ring with two hydroxyl side groups) with one amine group attached via an ethyl chain.[10] As such, dopamine is the simplest possible catecholamine, a family that also includes the neurotransmitters norepinephrine and epinephrine.[11] The presence of a benzene ring with this amine attachment makes it a substituted phenethylamine, a family that includes numerous psychoactive drugs.[12]
Like most amines, dopamine is an organic base.[13] As a base, it is generally protonated in acidic environments (in an acid-base reaction).[13] The protonated form is highly water-soluble and relatively stable, but can become oxidized if exposed to oxygen or other oxidants.[13] In basic environments, dopamine is not protonated.[13] In this free base form, it is less water-soluble and also more highly reactive.[13] Because of the increased stability and water-solubility of the protonated form, dopamine is supplied for chemical or pharmaceutical use as dopamine hydrochloride—that is, the hydrochloride salt that is created when dopamine is combined with hydrochloric acid.[13] In dry form, dopamine hydrochloride is a fine powder which is white to yellow in color.[14]

Dopamine structure
Phenethylamine structure
Catechol structure
Biochemistry
Biosynthetic pathways for catecholamines and trace amines in the human brain[15][16][17]
L-Phenylalanine L-Tyrosine L-DOPA Epinephrine Phenethylamine p-Tyramine Dopamine Norepinephrine N-Methylphenethylamine N-Methyltyramine p-Octopamine Synephrine 3-Methoxytyramine AADC AADC AADC primary pathway PNMT PNMT PNMT PNMT AAAH AAAH brain CYP2D6 minor pathway COMT DBH DBH
In humans, catecholamines and phenethylaminergic trace amines are derived from the amino acid phenylalanine. It is well established that dopamine is produced from L-tyrosine via L-DOPA; however, recent evidence has shown that CYP2D6 is expressed in the human brain and catalyzes the biosynthesis of dopamine from L-tyrosine via p-tyramine.[17] |
Synthesis
Dopamine is synthesized in a restricted set of cell types, mainly neurons and cells in the medulla of the adrenal glands.[18] The primary and minor metabolic pathways respectively are:
Primary: L-Phenylalanine → L-Tyrosine → L-DOPA → Dopamine[15][16]
Minor: L-Phenylalanine → L-Tyrosine → p-Tyramine → Dopamine[15][16][17]
Minor: L-Phenylalanine → m-Tyrosine → m-Tyramine → Dopamine[17][19][20]
The direct precursor of dopamine, L-DOPA, can be synthesized indirectly from the essential amino acid phenylalanine or directly from the non-essential amino acid tyrosine.[21] These amino acids are found in nearly every protein and so are readily available in food, with tyrosine being the most common. Although dopamine is also found in many types of food, it is incapable of crossing the blood–brain barrier that surrounds and protects the brain.[22] It must therefore be synthesized inside the brain to perform its neuronal activity.[22]
L-Phenylalanine is converted into L-tyrosine by the enzyme phenylalanine hydroxylase, with molecular oxygen (O2) and tetrahydrobiopterin as cofactors. L-Tyrosine is converted into L-DOPA by the enzyme tyrosine hydroxylase, with tetrahydrobiopterin, O2, and iron (Fe2+) as cofactors.[21] L-DOPA is converted into dopamine by the enzyme aromatic L-amino acid decarboxylase (also known as DOPA decarboxylase), with pyridoxal phosphate as the cofactor.[21]
Dopamine itself is used as precursor in the synthesis of the neurotransmitters norepinephrine and epinephrine.[21] Dopamine is converted into norepinephrine by the enzyme dopamine β-hydroxylase, with O2 and L-ascorbic acid as cofactors.[21] Norepinephrine is converted into epinephrine by the enzyme phenylethanolamine N-methyltransferase with S-adenosyl-L-methionine as the cofactor.[21]
Some of the cofactors also require their own synthesis.[21] Deficiency in any required amino acid or cofactor can impair the synthesis of dopamine, norepinephrine, and epinephrine.[21]
Degradation
Dopamine is broken down into inactive metabolites by a set of enzymes—monoamine oxidase (MAO), catechol-O-methyl transferase (COMT), and aldehyde dehydrogenase (ALDH), acting in sequence.[23] Both isoforms of monoamine oxidase, MAO-A and MAO-B, effectively metabolize dopamine.[21] Different breakdown pathways exist but the main end-product is homovanillic acid (HVA), which has no known biological activity.[23] From the bloodstream, homovanillic acid is filtered out by the kidneys and then excreted in the urine.[23] The two primary metabolic routes that convert dopamine into HVA are:
Dopamine → DOPAL → DOPAC → HVA – catalyzed by MAO, ALDH, and COMT respectively
Dopamine → 3-Methoxytyramine → HVA – catalyzed by COMT and MAO+ALDH respectively
In clinical research on schizophrenia, measurements of homovanillic acid in plasma have been used to estimate levels of dopamine activity in the brain. A difficulty in this approach however, is separating the high level of plasma homovanillic acid contributed by the metabolism of norepinephrine.[24][25]
Although dopamine is normally broken down by an oxidoreductase enzyme, it is also susceptible to oxidation by direct reaction with oxygen, yielding quinones plus various free radicals as products.[26] The rate of oxidation can be increased by the presence of ferric iron or other factors. Quinones and free radicals produced by autoxidation of dopamine can poison cells, and there is evidence that this mechanism may contribute to the cell loss that occurs in Parkinson's disease and other conditions.[27]
Functions
Cellular effects
Main articles: Dopamine receptor and TAAR1
Primary targets of dopamine in the human brain[1][28] |
||||
Family |
Receptor |
Gene |
Type |
Mechanism |
D1-like |
D1 |
DRD1 |
Gs-coupled. |
Increase intracellular levels of cAMP by activating adenylate cyclase. |
D5 |
DRD5 |
|||
D2-like |
D2 |
DRD2 |
Gi-coupled. |
Decrease intracellular levels of cAMP by inhibiting adenylate cyclase. |
D3 |
DRD3 |
|||
D4 |
DRD4 |
|||
TAAR |
TAAR1 |
TAAR1 |
Gs-coupled. Gq-coupled. |
Increase intracellular levels of cAMP and intracellular calcium concentration. |
Dopamine exerts its effects by binding to and activating cell surface receptors.[18] In humans, dopamine has a high binding affinity at dopamine receptors and human trace amine-associated receptor 1 (hTAAR1).[1][28] In mammals, five subtypes of dopamine receptors have been identified, labeled from D1 to D5.[18] All of them function as metabotropic, G protein-coupled receptors, meaning that they exert their effects via a complex second messenger system.[29] These receptors can be divided into two families, known as D1-like and D2-like.[18] For receptors located on neurons in the nervous system, the ultimate effect of D1-like activation (D1 and D5) can be excitation (via opening of sodium channels) or inhibition (via opening of potassium channels); the ultimate effect of D2-like activation (D2, D3, and D4) is usually inhibition of the target neuron.[29] Consequently, it is incorrect to describe dopamine itself as either excitatory or inhibitory: its effect on a target neuron depends on which types of receptors are present on the membrane of that neuron and on the internal responses of that neuron to the second messenger cAMP.[29] D1 receptors are the most numerous dopamine receptors in the human nervous system; D2 receptors are next; D3, D4, and D5 receptors are present at significantly lower levels.[29]
Storage, release, and reuptake

Dopamine processing in a synapse. After release dopamine can either be taken up again by the presynaptic terminal, or broken down by enzymes. TH: tyrosine hydroxylase DOPA: L-DOPA DAT: dopamine transporter DDC: DOPA decarboxylase VMAT: vesicular monoamine transporter 2 MAO: Monoamine oxidase COMT: Catechol-O-methyl transferase HVA: Homovanillic acid
Inside the brain, dopamine functions as a neurotransmitter and neuromodulator, and is controlled by a set of mechanisms common to all monoamine neurotransmitters.[18] After synthesis, dopamine is transported from the cytosol into synaptic vesicles by a solute carrier—a vesicular monoamine transporter, VMAT2.[30] Dopamine is stored in these vesicles until it is ejected into the synaptic cleft. In most cases, the release of dopamine occurs through a process called exocytosis which is caused by action potentials, but it can also be caused by the activity of an intracellular trace amine-associated receptor, TAAR1.[28] TAAR1 is a high-affinity receptor for dopamine, trace amines, and certain substituted amphetamines that is located along membranes in the intracellular milieu of the presynaptic cell;[28] activation of the receptor can regulate dopamine signaling by inducing dopamine reuptake inhibition and efflux as well as by inhibiting neuronal firing through a diverse set of mechanisms.[28][31]
Once in the synapse, dopamine binds to and activates dopamine receptors.[32] These can be postsynaptic dopamine receptors, which are located on dendrites (the postsynaptic neuron), or presynaptic autoreceptors (e.g., the D2sh and presynaptic D3 receptors), which are located on the membrane of an axon terminal (the presynaptic neuron).[18][32] After the postsynaptic neuron elicits an action potential, dopamine molecules quickly become unbound from their receptors. They are then absorbed back into the presynaptic cell, via reuptake mediated either by the dopamine transporter or by the plasma membrane monoamine transporter.[33] Once back in the cytosol, dopamine can either be broken down by a monoamine oxidase or repackaged into vesicles by VMAT2, making it available for future release.[30]
In the brain the level of extracellular dopamine is modulated by two mechanisms: phasic and tonic transmission.[34] Phasic dopamine release, like most neurotransmitter release in the nervous system, is driven directly by action potentials in the dopamine-containing cells.[34] Tonic dopamine transmission occurs when small amounts of dopamine are released without being preceded by presynaptic action potentials.[34] Tonic transmission is regulated by a variety of factors, including the activity of other neurons and neurotransmitter reuptake.[34]
Nervous system
Main articles: Dopaminergic cell groups and Dopaminergic pathways
See also: Hypothalamic–pituitary–prolactin axis

Major dopamine pathways. As part of the reward pathway, dopamine is manufactured in nerve cell bodies located within the ventral tegmental area (VTA) and is released in the nucleus accumbens and the prefrontal cortex. The motor functions of dopamine are linked to a separate pathway, with cell bodies in the substantia nigra that manufacture and release dopamine into the dorsal striatum.
Inside the brain, dopamine plays important roles in executive functions, motor control, motivation, arousal, reinforcement, and reward, as well as lower-level functions including lactation, sexual gratification, and nausea. The dopaminergic cell groups and pathways make up the dopamine system which is neuromodulatory.
Dopaminergic neurons (dopamine-producing nerve cells) are comparatively few in number—a total of around 400,000 in the human brain[35]—and their cell bodies are confined in groups to a few relatively small brain areas.[36] However their axons project to many other brain areas, and they exert powerful effects on their targets.[36] These dopaminergic cell groups were first mapped in 1964 by Annica Dahlström and Kjell Fuxe, who assigned them labels starting with the letter "A" (for "aminergic").[37] In their scheme, areas A1 through A7 contain the neurotransmitter norepinephrine, whereas A8 through A14 contain dopamine. The dopaminergic areas they identified are the substantia nigra (groups 8 and 9); the ventral tegmental area (group 10); the posterior hypothalamus (group 11); the arcuate nucleus (group 12); the zona incerta (group 13) and the periventricular nucleus (group 14).[37]
The substantia nigra is a small midbrain area that forms a component of the basal ganglia. This has two parts—an input area called the pars compacta and an output area the pars reticulata. The dopaminergic neurons are found mainly in the pars compacta (cell group A8) and nearby (group A9).[36] In humans, the projection of dopaminergic neurons from the substantia nigra pars compacta to the dorsal striatum, termed the nigrostriatal pathway, plays a significant role in the control of motor function and in learning new motor skills.[38] These neurons are especially vulnerable to damage, and when a large number of them die, the result is a parkinsonian syndrome.[39]
The ventral tegmental area (VTA) is another midbrain area. The most prominent group of VTA dopaminergic neurons projects to the prefrontal cortex via the mesocortical pathway and another smaller group projects to the nucleus accumbens via the mesolimbic pathway. Together, these two pathways are collectively termed the mesocorticolimbic projection.[36][38] The VTA also sends dopaminergic projections to the amygdala, cingulate gyrus, hippocampus, and olfactory bulb.[36][38] Mesocorticolimbic neurons play a central role in reward and other aspects of motivation.[38] Accumulating literature shows that dopamine also plays a crucial role in aversive learning through its effects on a number of brain regions.[40][41][42]
The posterior hypothalamus has dopamine neurons that project to the spinal cord, but their function is not well established.[43] There is some evidence that pathology in this area plays a role in restless legs syndrome, a condition in which people have difficulty sleeping due to an overwhelming compulsion to constantly move parts of the body, especially the legs.[43]
The arcuate nucleus and the periventricular nucleus of the hypothalamus have dopamine neurons that form an important projection—the tuberoinfundibular pathway which goes to the pituitary gland, where it influences the secretion of the hormone prolactin.[44] Dopamine is the primary neuroendocrine inhibitor of the secretion of prolactin from the anterior pituitary gland.[44] Dopamine produced by neurons in the arcuate nucleus is secreted into the hypophyseal portal system of the median eminence, which supplies the pituitary gland.[44] The prolactin cells that produce prolactin, in the absence of dopamine, secrete prolactin continuously; dopamine inhibits this secretion.[44] In the context of regulating prolactin secretion, dopamine is occasionally called prolactin-inhibiting factor, prolactin-inhibiting hormone, or prolactostatin.[44]
The zona incerta, grouped between the arcuate and periventricular nuclei, projects to several areas of the hypothalamus, and participates in the control of gonadotropin-releasing hormone, which is necessary to activate the development of the male and female reproductive systems, following puberty.[44]
An additional group of dopamine-secreting neurons is found in the retina of the eye.[45] These neurons are amacrine cells, meaning that they have no axons.[45] They release dopamine into the extracellular medium, and are specifically active during daylight hours, becoming silent at night.[45] This retinal dopamine acts to enhance the activity of cone cells in the retina while suppressing rod cells—the result is to increase sensitivity to color and contrast during bright light conditions, at the cost of reduced sensitivity when the light is dim.[45]
Basal ganglia

Main circuits of the basal ganglia. The dopaminergic pathway from the substantia nigra pars compacta to the striatum is shown in light blue.
The largest and most important sources of dopamine in the vertebrate brain are the substantia nigra and ventral tegmental area.[36] These structures are closely related to each other and functionally similar in many respects.[36] Both are components of the mid brain.[36] The largest component of the basal ganglia is the striatum.[46] The substantia nigra sends a dopaminergic projection to the dorsal striatum, while the ventral tegmental area sends a similar type of dopaminergic projection to the ventral striatum.[36]
Progress in understanding the functions of the basal ganglia has been slow.[46] The most popular hypotheses, broadly stated, propose that the basal ganglia play a central role in action selection.[47] The action selection theory in its simplest form proposes that when a person or animal is in a situation where several behaviors are possible, activity in the basal ganglia determines which of them is executed, by releasing that response from inhibition while continuing to inhibit other motor systems that if activated would generate competing behaviors.[48] Thus the basal ganglia, in this concept, are responsible for initiating behaviors, but not for determining the details of how they are carried out. In other words, they essentially form a decision-making system.[48]
The basal ganglia can be divided into several sectors, and each is involved in controlling particular types of actions.[49] The ventral sector of the basal ganglia (containing the ventral striatum and ventral tegmental area) operates at the highest level of the hierarchy, selecting actions at the whole-organism level.[48] The dorsal sectors (containing the dorsal striatum and substantia nigra) operate at lower levels, selecting the specific muscles and movements that are used to implement a given behavior pattern.[49]
Dopamine contributes to the action selection process in at least two important ways. First, it sets the "threshold" for initiating actions.[47] The higher the level of dopamine activity, the lower the impetus required to evoke a given behavior.[47] As a consequence, high levels of dopamine lead to high levels of motor activity and impulsive behavior; low levels of dopamine lead to torpor and slowed reactions.[47] Parkinson's disease, in which dopamine levels in the substantia nigra circuit are greatly reduced, is characterized by stiffness and difficulty initiating movement—however, when people with the disease are confronted with strong stimuli such as a serious threat, their reactions can be as vigorous as those of a healthy person.[50] In the opposite direction, drugs that increase dopamine release, such as cocaine or amphetamine, can produce heightened levels of activity, including, at the extreme, psychomotor agitation and stereotyped movements.[51]
The second important effect of dopamine is as a "teaching" signal.[47] When an action is followed by an increase in dopamine activity, the basal ganglia circuit is altered in a way that makes the same response easier to evoke when similar situations arise in the future.[47] This is a form of operant conditioning, in which dopamine plays the role of a reward signal.[48]
Reward

Illustration of dopaminergic reward structures
In the language used to discuss the reward system, reward is the attractive and motivational property of a stimulus that induces appetitive behavior (also known as approach behavior) and consummatory behavior.[52] A rewarding stimulus is one that can induce the organism to approach it and choose to consume it.[52] Pleasure, learning (e.g., classical and operant conditioning), and approach behavior are the three main functions of reward.[52] As an aspect of reward, pleasure provides a definition of reward;[52] however, while all pleasurable stimuli are rewarding, not all rewarding stimuli are pleasurable (e.g., extrinsic rewards like money).[52][53] The motivational or desirable aspect of rewarding stimuli is reflected by the approach behavior that they induce, whereas the pleasure from intrinsic rewards results from consuming them after acquiring them.[52] A neuropsychological model which distinguishes these two components of an intrinsically rewarding stimulus is the incentive salience model, where "wanting" or desire (less commonly, "seeking"[54]) corresponds to appetitive or approach behavior while "liking" or pleasure corresponds to consummatory behavior.[52][4][55] In human drug addicts, "wanting" becomes dissociated with "liking" as the desire to use an addictive drug increases, while the pleasure obtained from consuming it decreases due to drug tolerance.[4]
Within the brain, dopamine functions partly as a global reward signal. An initial dopamine response to a rewarding stimulus encodes information about the salience, value, and context of a reward.[52] In the context of reward-related learning, dopamine also functions as a reward prediction error signal, that is, the degree to which the value of a reward is unexpected.[52] According to this hypothesis proposed by Montague, Dayan, and Sejnowski,[56] rewards that are expected do not produce a second phasic dopamine response in certain dopaminergic cells, but rewards that are unexpected, or greater than expected, produce a short-lasting increase in synaptic dopamine, whereas the omission of an expected reward actually causes dopamine release to drop below its background level.[52] The "prediction error" hypothesis has drawn particular interest from computational neuroscientists, because an influential computational-learning method known as temporal difference learning makes heavy use of a signal that encodes prediction error.[52] This confluence of theory and data has led to a fertile interaction between neuroscientists and computer scientists interested in machine learning.[52]
Evidence from microelectrode recordings from the brains of animals shows that dopamine neurons in the ventral tegmental area (VTA) and substantia nigra are strongly activated by a wide variety of rewarding events.[52] These reward-responsive dopamine neurons in the VTA and substantia nigra are crucial for reward-related cognition and serve as the central component of the reward system.[4][57][58] The function of dopamine varies in each axonal projection from the VTA and substantia nigra;[4] for example, the VTA–nucleus accumbens shell projection assigns incentive salience ("want") to rewarding stimuli and its associated cues, the VTA–prefrontal cortex projection updates the value of different goals in accordance with their incentive salience, the VTA–amygdala and VTA–hippocampus projections mediate the consolidation of reward-related memories, and both the VTA–nucleus accumbens core and substantia nigra–dorsal striatum pathways are involved in learning motor responses that facilitate the acquisition of rewarding stimuli.[4][59] Some activity within the VTA dopaminergic projections appears to be associated with reward prediction as well.[4][59]
Pleasure
While dopamine has a central role in causing "wanting," associated with the appetitive or approach behavioral responses to rewarding stimuli, detailed studies have shown that dopamine cannot simply be equated with hedonic "liking" or pleasure, as reflected in the consummatory behavioral response.[53] Dopamine neurotransmission is involved in some but not all aspects of pleasure-related cognition, since pleasure centers have been identified both within the dopamine system (i.e., nucleus accumbens shell) and outside the dopamine system (i.e., ventral pallidum and parabrachial nucleus).[53][55][60] For example, direct electrical stimulation of dopamine pathways, using electrodes implanted in the brain, is experienced as pleasurable, and many types of animals are willing to work to obtain it.[61] Antipsychotic drugs reduce dopamine levels and tend to cause anhedonia, a diminished ability to experience pleasure.[62] Many types of pleasurable experiences—such as sex, eating, and playing video games—increase dopamine release.[63] All addictive drugs directly or indirectly affect dopamine neurotransmission in the nucleus accumbens;[4][61] these drugs increase drug "wanting", leading to compulsive drug use, when repeatedly taken in high doses, presumably through the sensitization of incentive-salience.[55] Drugs that increase synaptic dopamine concentrations include psychostimulants such as methamphetamine and cocaine. These produce increases in "wanting" behaviors, but do not greatly alter expressions of pleasure or change levels of satiation.[55][61] However, opiate drugs such as heroin and morphine produce increases in expressions of "liking" and "wanting" behaviors.[55] Moreover, animals in which the ventral tegmental dopamine system has been rendered inactive do not seek food, and will starve to death if left to themselves, but if food is placed in their mouths they will consume it and show expressions indicative of pleasure.[64]
A clinical study from January 2019 that assessed the effect of a dopamine precursor (levodopa), dopamine antagonist (risperidone), and a placebo on reward responses to music – including the degree of pleasure experienced during musical chills, as measured by changes in electrodermal activity as well as subjective ratings – found that the manipulation of dopamine neurotransmission bidirectionally regulates pleasure cognition (specifically, the hedonic impact of music) in human subjects.[65][66] This research demonstrated that increased dopamine neurotransmission acts as a sine qua non condition for pleasurable hedonic reactions to music in humans.[65][66]
Outside the nervous system
Dopamine does not cross the blood–brain barrier, so its synthesis and functions in peripheral areas are to a large degree independent of its synthesis and functions in the brain.[22] A substantial amount of dopamine circulates in the bloodstream, but its functions there are not entirely clear.[23] Dopamine is found in blood plasma at levels comparable to those of epinephrine, but in humans, over 95% of the dopamine in the plasma is in the form of dopamine sulfate, a conjugate produced by the enzyme sulfotransferase 1A3/1A4 acting on free dopamine.[23] The bulk of this dopamine sulfate is produced in the mesentery that surrounds parts of the digestive system.[23] The production of dopamine sulfate is thought to be a mechanism for detoxifying dopamine that is ingested as food or produced by the digestive process—levels in the plasma typically rise more than fifty-fold after a meal.[23] Dopamine sulfate has no known biological functions and is excreted in urine.[23]
The relatively small quantity of unconjugated dopamine in the bloodstream may be produced by the sympathetic nervous system, the digestive system, or possibly other organs.[23] It may act on dopamine receptors in peripheral tissues, or be metabolized, or be converted to norepinephrine by the enzyme dopamine beta hydroxylase, which is released into the bloodstream by the adrenal medulla.[23] Some dopamine receptors are located in the walls of arteries, where they act as a vasodilator and an inhibitor of norepinephrine release.[67] These responses might be activated by dopamine released from the carotid body under conditions of low oxygen, but whether arterial dopamine receptors perform other biologically useful functions is not known.[67]
Beyond its role in modulating blood flow, there are several peripheral systems in which dopamine circulates within a limited area and performs an exocrine or paracrine function.[23] The peripheral systems in which dopamine plays an important role include the immune system, the kidneys and the pancreas.
Immune system
In the immune system dopamine acts upon receptors present on immune cells, especially lymphocytes.[68] Dopamine can also affect immune cells in the spleen, bone marrow, and circulatory system.[69] In addition, dopamine can be synthesized and released by immune cells themselves.[68] The main effect of dopamine on lymphocytes is to reduce their activation level. The functional significance of this system is unclear, but it affords a possible route for interactions between the nervous system and immune system, and may be relevant to some autoimmune disorders.[69]
Kidneys
The renal dopaminergic system is located in the cells of the nephron in the kidney, where all subtypes of dopamine receptors are present.[70] Dopamine is also synthesized there, by tubule cells, and discharged into the tubular fluid. Its actions include increasing the blood supply to the kidneys, increasing the glomerular filtration rate, and increasing the excretion of sodium in the urine. Hence, defects in renal dopamine function can lead to reduced sodium excretion and consequently result in the development of high blood pressure. There is strong evidence that faults in the production of dopamine or in the receptors can result in a number of pathologies including oxidative stress, edema, and either genetic or essential hypertension. Oxidative stress can itself cause hypertension.[71] Defects in the system can also be caused by genetic factors or high blood pressure.[72]
Pancreas
In the pancreas the role of dopamine is somewhat complex. The pancreas consists of two parts, an exocrine and an endocrine component. The exocrine part synthesizes and secretes digestive enzymes and other substances, including dopamine, into the small intestine.[73] The function of this secreted dopamine after it enters the small intestine is not clearly established—the possibilities include protecting the intestinal mucosa from damage and reducing gastrointestinal motility (the rate at which content moves through the digestive system).[73]
The pancreatic islets make up the endocrine part of the pancreas, and synthesize and secrete hormones including insulin into the bloodstream.[73] There is evidence that the beta cells in the islets that synthesize insulin contain dopamine receptors, and that dopamine acts to reduce the amount of insulin they release.[73] The source of their dopamine input is not clearly established—it may come from dopamine that circulates in the bloodstream and derives from the sympathetic nervous system, or it may be synthesized locally by other types of pancreatic cells.[73]
Medical uses
Main article: Dopamine (medication)

Dopamine HCl preparation, single dose vial for intravenous administration
Dopamine as a manufactured medication is sold under the trade names Intropin, Dopastat, and Revimine, among others. It is on the World Health Organization's List of Essential Medicines.[74] It is most commonly used as a stimulant drug in the treatment of severe low blood pressure, slow heart rate, and cardiac arrest. It is especially important in treating these in newborn infants.[75] It is given intravenously. Since the half-life of dopamine in plasma is very short—approximately one minute in adults, two minutes in newborn infants and up to five minutes in preterm infants—it is usually given in a continuous intravenous drip rather than a single injection.[76]
Its effects, depending on dosage, include an increase in sodium excretion by the kidneys, an increase in urine output, an increase in heart rate, and an increase in blood pressure.[76] At low doses it acts through the sympathetic nervous system to increase heart muscle contraction force and heart rate, thereby increasing cardiac output and blood pressure.[77] Higher doses also cause vasoconstriction that further increases blood pressure.[77][78] Older literature also describes very low doses thought to improve kidney function without other consequences, but recent reviews have concluded that doses at such low levels are not effective and may sometimes be harmful.[79] While some effects result from stimulation of dopamine receptors, the prominent cardiovascular effects result from dopamine acting at α1, β1, and β2 adrenergic receptors.[80][81]
Side effects of dopamine include negative effects on kidney function and irregular heartbeats.[77] The LD50, or lethal dose which is expected to prove fatal in 50% of the population, has been found to be: 59 mg/kg (mouse; administered intravenously); 95 mg/kg (mouse; administered intraperitoneally); 163 mg/kg (rat; administered intraperitoneally); 79 mg/kg (dog; administered intravenously).[82]
A fluorinated form of L-DOPA known as fluorodopa is available for use in positron emission tomography to assess the function of the nigrostriatal pathway.[83]
Disease, disorders, and pharmacology
See also: List of dopaminergic drugs
The dopamine system plays a central role in several significant medical conditions, including Parkinson's disease, attention deficit hyperactivity disorder, Tourette syndrome, schizophrenia, bipolar disorder, and addiction. Aside from dopamine itself, there are many other important drugs that act on dopamine systems in various parts of the brain or body. Some are used for medical or recreational purposes, but neurochemists have also developed a variety of research drugs, some of which bind with high affinity to specific types of dopamine receptors and either agonize or antagonize their effects, and many that affect other aspects of dopamine physiology,[84] including dopamine transporter inhibitors, VMAT inhibitors, and enzyme inhibitors.
Aging brain
Main article: Aging brain
A number of studies have reported an age-related decline in dopamine synthesis and dopamine receptor density (i.e., the number of receptors) in the brain.[85] This decline has been shown to occur in the striatum and extrastriatal regions.[86] Decreases in the D1, D2, and D3 receptors are well documented.[87][88][89] The reduction of dopamine with aging is thought to be responsible for many neurological symptoms that increase in frequency with age, such as decreased arm swing and increased rigidity.[90] Changes in dopamine levels may also cause age-related changes in cognitive flexibility.[90]
Other neurotransmitters, such as serotonin and glutamate also show a decline in output with aging.[89][91]
Multiple sclerosis
Studies reported that dopamine imbalance influences the fatigue in multiple sclerosis.[92] In patients with multiple sclerosis, dopamine inhibits production of IL-17 and IFN-γ by peripheral blood mononuclear cells.[93]
Parkinson's disease
Parkinson's disease is an age-related disorder characterized by movement disorders such as stiffness of the body, slowing of movement, and trembling of limbs when they are not in use.[50] In advanced stages it progresses to dementia and eventually death.[50] The main symptoms are caused by the loss of dopamine-secreting cells in the substantia nigra.[94] These dopamine cells are especially vulnerable to damage, and a variety of insults, including encephalitis (as depicted in the book and movie "Awakenings"), repeated sports-related concussions, and some forms of chemical poisoning such as MPTP, can lead to substantial cell loss, producing a parkinsonian syndrome that is similar in its main features to Parkinson's disease.[95] Most cases of Parkinson's disease, however, are idiopathic, meaning that the cause of cell death cannot be identified.[95]
The most widely used treatment for parkinsonism is administration of L-DOPA, the metabolic precursor for dopamine.[22] L-DOPA is converted to dopamine in the brain and various parts of the body by the enzyme DOPA decarboxylase.[21] L-DOPA is used rather than dopamine itself because, unlike dopamine, it is capable of crossing the blood-brain barrier.[22] It is often co-administered with an enzyme inhibitor of peripheral decarboxylation such as carbidopa or benserazide, to reduce the amount converted to dopamine in the periphery and thereby increase the amount of L-DOPA that enters the brain.[22] When L-DOPA is administered regularly over a long time period, a variety of unpleasant side effects such as dyskinesia often begin to appear; even so, it is considered the best available long-term treatment option for most cases of Parkinson's disease.[22]
L-DOPA treatment cannot restore the dopamine cells that have been lost, but it causes the remaining cells to produce more dopamine, thereby compensating for the loss to at least some degree.[22] In advanced stages the treatment begins to fail because the cell loss is so severe that the remaining ones cannot produce enough dopamine regardless of L-DOPA levels.[22] Other drugs that enhance dopamine function, such as bromocriptine and pergolide, are also sometimes used to treat Parkinsonism, but in most cases L-DOPA appears to give the best trade-off between positive effects and negative side-effects.[22]
Dopaminergic medications that are used to treat Parkinson's disease are sometimes associated with the development of a dopamine dysregulation syndrome, which involves the overuse of dopaminergic medication and medication-induced compulsive engagement in natural rewards like gambling and sexual activity.[96][97] The latter behaviors are similar to those observed in individuals with a behavioral addiction.[96]
Drug addiction and psychostimulants
Main article: Addiction

Cocaine increases dopamine levels by blocking dopamine transporters (DAT), which transport dopamine back into a synaptic terminal after it has been emitted.
Cocaine, substituted amphetamines (including methamphetamine), Adderall, methylphenidate (marketed as Ritalin or Concerta), and other psychostimulants exert their effects primarily or partly by increasing dopamine levels in the brain by a variety of mechanisms.[98] Cocaine and methylphenidate are dopamine transporter blockers or reuptake inhibitors;[99] they non-competitively inhibit dopamine reuptake, resulting in increased dopamine concentrations in the synaptic cleft.[100][101]: 54–58 Like cocaine, substituted amphetamines and amphetamine also increase the concentration of dopamine in the synaptic cleft, but by different mechanisms.[31][101]: 147–150
The effects of psychostimulants include increases in heart rate, body temperature, and sweating; improvements in alertness, attention, and endurance; increases in pleasure produced by rewarding events; but at higher doses agitation, anxiety, or even loss of contact with reality.[98] Drugs in this group can have a high addiction potential, due to their activating effects on the dopamine-mediated reward system in the brain.[98] However some can also be useful, at lower doses, for treating attention deficit hyperactivity disorder (ADHD) and narcolepsy.[102][103] An important differentiating factor is the onset and duration of action.[98] Cocaine can take effect in seconds if it is injected or inhaled in free base form; the effects last from 5 to 90 minutes.[104] This rapid and brief action makes its effects easily perceived and consequently gives it high addiction potential.[98] Methylphenidate taken in pill form, in contrast, can take two hours to reach peak levels in the bloodstream,[102] and depending on formulation the effects can last for up to 12 hours.[105] These longer acting formulations have the benefit of reducing the potential for abuse, and improving adherence for treatment by using more convenient dosage regimens.[106]

Methamphetamine hydrochloride also known as crystal meth
A variety of addictive drugs produce an increase in reward-related dopamine activity.[98] Stimulants such as nicotine, cocaine and methamphetamine promote increased levels of dopamine which appear to be the primary factor in causing addiction. For other addictive drugs such as the opioid heroin, the increased levels of dopamine in the reward system may play only a minor role in addiction.[107] When people addicted to stimulants go through withdrawal, they do not experience the physical suffering associated with alcohol withdrawal or withdrawal from opiates; instead they experience craving, an intense desire for the drug characterized by irritability, restlessness, and other arousal symptoms,[108] brought about by psychological dependence.
The dopamine system plays a crucial role in several aspects of addiction. At the earliest stage, genetic differences that alter the expression of dopamine receptors in the brain can predict whether a person will find stimulants appealing or aversive.[109] Consumption of stimulants produces increases in brain dopamine levels that last from minutes to hours.[98] Finally, the chronic elevation in dopamine that comes with repetitive high-dose stimulant consumption triggers a wide-ranging set of structural changes in the brain that are responsible for the behavioral abnormalities which characterize an addiction.[110] Treatment of stimulant addiction is very difficult, because even if consumption ceases, the craving that comes with psychological withdrawal does not.[108] Even when the craving seems to be extinct, it may re-emerge when faced with stimuli that are associated with the drug, such as friends, locations and situations.[108] Association networks in the brain are greatly interlinked.[111]
Psychosis and antipsychotic drugs
Main article: Psychosis
Psychiatrists in the early 1950s discovered that a class of drugs known as typical antipsychotics (also known as major tranquilizers), were often effective at reducing the psychotic symptoms of schizophrenia.[112] The introduction of the first widely used antipsychotic, chlorpromazine (Thorazine), in the 1950s, led to the release of many patients with schizophrenia from institutions in the years that followed.[112] By the 1970s researchers understood that these typical antipsychotics worked as antagonists on the D2 receptors.[112][113] This realization led to the so-called dopamine hypothesis of schizophrenia, which postulates that schizophrenia is largely caused by hyperactivity of brain dopamine systems.[114] The dopamine hypothesis drew additional support from the observation that psychotic symptoms were often intensified by dopamine-enhancing stimulants such as methamphetamine, and that these drugs could also produce psychosis in healthy people if taken in large enough doses.[114] In the following decades other atypical antipsychotics that had fewer serious side effects were developed.[112] Many of these newer drugs do not act directly on dopamine receptors, but instead produce alterations in dopamine activity indirectly.[115] These drugs were also used to treat other psychoses.[112] Antipsychotic drugs have a broadly suppressive effect on most types of active behavior, and particularly reduce the delusional and agitated behavior characteristic of overt psychosis.[113]
Later observations, however, have caused the dopamine hypothesis to lose popularity, at least in its simple original form.[114] For one thing, patients with schizophrenia do not typically show measurably increased levels of brain dopamine activity.[114] Even so, many psychiatrists and neuroscientists continue to believe that schizophrenia involves some sort of dopamine system dysfunction.[112] As the "dopamine hypothesis" has evolved over time, however, the sorts of dysfunctions it postulates have tended to become increasingly subtle and complex.[112]
Psychopharmacologist Stephen M. Stahl suggested in a review of 2018 that in many cases of psychosis, including schizophrenia, three interconnected networks based on dopamine, serotonin, and glutamate – each on its own or in various combinations – contributed to an overexcitation of dopamine D2 receptors in the ventral striatum.[116]
Attention deficit hyperactivity disorder
Altered dopamine neurotransmission is implicated in attention deficit hyperactivity disorder (ADHD), a condition associated with impaired cognitive control, in turn leading to problems with regulating attention (attentional control), inhibiting behaviors (inhibitory control), and forgetting things or missing details (working memory), among other problems.[117] There are genetic links between dopamine receptors, the dopamine transporter, and ADHD, in addition to links to other neurotransmitter receptors and transporters.[118] The most important relationship between dopamine and ADHD involves the drugs that are used to treat ADHD.[119] Some of the most effective therapeutic agents for ADHD are psychostimulants such as methylphenidate (Ritalin, Concerta) and amphetamine (Evekeo, Adderall, Dexedrine), drugs that increase both dopamine and norepinephrine levels in the brain.[119] The clinical effects of these psychostimulants in treating ADHD are mediated through the indirect activation of dopamine and norepinephrine receptors, specifically dopamine receptor D1 and adrenoceptor α2, in the prefrontal cortex.[117][120][121]
Pain
Dopamine plays a role in pain processing in multiple levels of the central nervous system including the spinal cord, periaqueductal gray, thalamus, basal ganglia, and cingulate cortex.[122] Decreased levels of dopamine have been associated with painful symptoms that frequently occur in Parkinson's disease.[122] Abnormalities in dopaminergic neurotransmission also occur in several painful clinical conditions, including burning mouth syndrome, fibromyalgia, and restless legs syndrome.[122]
Nausea
Nausea and vomiting are largely determined by activity in the area postrema in the medulla of the brainstem, in a region known as the chemoreceptor trigger zone.[123] This area contains a large population of type D2 dopamine receptors.[123] Consequently, drugs that activate D2 receptors have a high potential to cause nausea.[123] This group includes some medications that are administered for Parkinson's disease, as well as other dopamine agonists such as apomorphine.[124] In some cases, D2-receptor antagonists such as metoclopramide are useful as anti-nausea drugs.[123]
Comparative biology and evolution
Microorganisms
There are no reports of dopamine in archaea, but it has been detected in some types of bacteria and in the protozoan called Tetrahymena.[125] Perhaps more importantly, there are types of bacteria that contain homologs of all the enzymes that animals use to synthesize dopamine.[126] It has been proposed that animals derived their dopamine-synthesizing machinery from bacteria, via horizontal gene transfer that may have occurred relatively late in evolutionary time, perhaps as a result of the symbiotic incorporation of bacteria into eukaryotic cells that gave rise to mitochondria.[126]
Animals
Dopamine is used as a neurotransmitter in most multicellular animals.[127] In sponges there is only a single report of the presence of dopamine, with no indication of its function;[128] however, dopamine has been reported in the nervous systems of many other radially symmetric species, including the cnidarian jellyfish, hydra and some corals.[129] This dates the emergence of dopamine as a neurotransmitter back to the earliest appearance of the nervous system, over 500 million years ago in the Cambrian Period. Dopamine functions as a neurotransmitter in vertebrates, echinoderms, arthropods, molluscs, and several types of worm.[130][131]
In every type of animal that has been examined, dopamine has been seen to modify motor behavior.[127] In the model organism, nematode Caenorhabditis elegans, it reduces locomotion and increases food-exploratory movements; in flatworms it produces "screw-like" movements; in leeches it inhibits swimming and promotes crawling. Across a wide range of vertebrates, dopamine has an "activating" effect on behavior-switching and response selection, comparable to its effect in mammals.[127][132]
Dopamine has also consistently been shown to play a role in reward learning, in all animal groups.[127] As in all vertebrates – invertebrates such as roundworms, flatworms, molluscs and common fruit flies can all be trained to repeat an action if it is consistently followed by an increase in dopamine levels.[127] In fruit flies, distinct elements for reward learning suggest a modular structure to the insect reward processing system that broadly parallels that the mammalian one.[133] For example, dopamine regulates short- and long-term learning in monkeys;[134] in fruit flies, different groups of dopamine neurons mediate reward signals for short- and long-term memories.[135]
It had long been believed that arthropods were an exception to this with dopamine being seen as having an adverse effect. Reward was seen to be mediated instead by octopamine, a neurotransmitter closely related to norepinephrine.[136] More recent studies, however, have shown that dopamine does play a part in reward learning in fruit flies. It has also been found that the rewarding effect of octopamine is due to its activating a set of dopaminergic neurons not previously accessed in the research.[136]
Plants

Dopamine can be found in the peel and fruit pulp of bananas.
Many plants, including a variety of food plants, synthesize dopamine to varying degrees.[137] The highest concentrations have been observed in bananas—the fruit pulp of red and yellow bananas contains dopamine at levels of 40 to 50 parts per million by weight.[137] Potatoes, avocados, broccoli, and Brussels sprouts may also contain dopamine at levels of 1 part per million or more; oranges, tomatoes, spinach, beans, and other plants contain measurable concentrations less than 1 part per million.[137] The dopamine in plants is synthesized from the amino acid tyrosine, by biochemical mechanisms similar to those that animals use.[137] It can be metabolized in a variety of ways, producing melanin and a variety of alkaloids as byproducts.[137] The functions of plant catecholamines have not been clearly established, but there is evidence that they play a role in the response to stressors such as bacterial infection, act as growth-promoting factors in some situations, and modify the way that sugars are metabolized. The receptors that mediate these actions have not yet been identified, nor have the intracellular mechanisms that they activate.[137]
Dopamine consumed in food cannot act on the brain, because it cannot cross the blood–brain barrier.[22] However, there are also a variety of plants that contain L-DOPA, the metabolic precursor of dopamine.[138] The highest concentrations are found in the leaves and bean pods of plants of the genus Mucuna, especially in Mucuna pruriens (velvet beans), which have been used as a source for L-DOPA as a drug.[139] Another plant containing substantial amounts of L-DOPA is Vicia faba, the plant that produces fava beans (also known as "broad beans"). The level of L-DOPA in the beans, however, is much lower than in the pod shells and other parts of the plant.[140] The seeds of Cassia and Bauhinia trees also contain substantial amounts of L-DOPA.[138]
In a species of marine green algae Ulvaria obscura, a major component of some algal blooms, dopamine is present in very high concentrations, estimated at 4.4% of dry weight. There is evidence that this dopamine functions as an anti-herbivore defense, reducing consumption by snails and isopods.[141]
As a precursor for melanin
Melanins are a family of dark-pigmented substances found in a wide range of organisms.[142] Chemically they are closely related to dopamine, and there is a type of melanin, known as dopamine-melanin, that can be synthesized by oxidation of dopamine via the enzyme tyrosinase.[142] The melanin that darkens human skin is not of this type: it is synthesized by a pathway that uses L-DOPA as a precursor but not dopamine.[142] However, there is substantial evidence that the neuromelanin that gives a dark color to the brain's substantia nigra is at least in part dopamine-melanin.[143]
Dopamine-derived melanin probably appears in at least some other biological systems as well. Some of the dopamine in plants is likely to be used as a precursor for dopamine-melanin.[144] The complex patterns that appear on butterfly wings, as well as black-and-white stripes on the bodies of insect larvae, are also thought to be caused by spatially structured accumulations of dopamine-melanin.[145]
History and development
Main article: History of catecholamine research
Dopamine was first synthesized in 1910 by George Barger and James Ewens at Wellcome Laboratories in London, England[146] and first identified in the human brain by Katharine Montagu in 1957. It was named dopamine because it is a monoamine whose precursor in the Barger-Ewens synthesis is 3,4-dihydroxyphenylalanine (levodopa or L-DOPA). Dopamine's function as a neurotransmitter was first recognized in 1958 by Arvid Carlsson and Nils-Åke Hillarp at the Laboratory for Chemical Pharmacology of the National Heart Institute of Sweden.[147] Carlsson was awarded the 2000 Nobel Prize in Physiology or Medicine for showing that dopamine is not only a precursor of norepinephrine (noradrenaline) and epinephrine (adrenaline), but is also itself a neurotransmitter.[148]
Polydopamine
Research motivated by adhesive polyphenolic proteins in mussels led to the discovery in 2007 that a wide variety of materials, if placed in a solution of dopamine at slightly basic pH, will become coated with a layer of polymerized dopamine, often referred to as polydopamine.[149][150] This polymerized dopamine forms by a spontaneous oxidation reaction, and is formally a type of melanin.[151] Synthesis usually involves reaction of dopamine hydrochloride with Tris as a base in water. The structure of polydopamine is unknown.[150]
Polydopamine coatings can form on objects ranging in size from nanoparticles to large surfaces.[151] Polydopamine layers have chemical properties that have the potential to be extremely useful, and numerous studies have examined their possible applications.[151] At the simplest level, they can be used for protection against damage by light, or to form capsules for drug delivery.[151] At a more sophisticated level, their adhesive properties may make them useful as substrates for biosensors or other biologically active macromolecules.[151]
TAAR1
From Wikipedia, the free encyclopedia
(Redirected from Human trace amine-associated receptor 1)
Jump to navigationJump to search
TAAR1 |
|||||||
|
|||||||
Identifiers |
|||||||
Aliases |
TAAR1, TA1, TAR1, TRAR1, trace amine associated receptor 1, Trace amine receptor |
||||||
External IDs |
OMIM: 609333 MGI: 2148258 HomoloGene: 24938 GeneCards: TAAR1 |
||||||
|
|||||||
|
|||||||
|
|||||||
Orthologs |
|||||||
Species |
Human |
Mouse |
|
||||
Entrez |
|
|
|
||||
Ensembl |
|
|
|
||||
UniProt |
|
|
|
||||
RefSeq (mRNA) |
|
|
|
||||
RefSeq (protein) |
|
|
|
||||
Location (UCSC) |
Chr 6: 132.64 – 132.66 Mb |
n/a |
|
||||
PubMed search |
[2] |
[3] |
|
||||
Wikidata |
|||||||
|
|||||||
Trace amine-associated receptor 1 (TAAR1) is a trace amine-associated receptor (TAAR) protein that in humans is encoded by the TAAR1 gene.[4] TAAR1 is an intracellular amine-activated Gs-coupled and Gq-coupled G protein-coupled receptor (GPCR) that is primarily expressed in several peripheral organs and cells (e.g., the stomach, small intestine, duodenum, and white blood cells), astrocytes, and in the intracellular milieu within the presynaptic plasma membrane (i.e., axon terminal) of monoamine neurons in the central nervous system (CNS).[5][6][7][8] TAAR1 was discovered in 2001 by two independent groups of investigators, Borowski et al. and Bunzow et al.[9][10] TAAR1 is one of six functional human trace amine-associated receptors, which are so named for their ability to bind endogenous amines that occur in tissues at trace concentrations.[11][12] TAAR1 plays a significant role in regulating neurotransmission in dopamine, norepinephrine, and serotonin neurons in the CNS;[6][11] it also affects immune system and neuroimmune system function through different mechanisms.[13][14][15][16]
TAAR1 is a high-affinity receptor for amphetamine, methamphetamine, dopamine, and trace amines which mediates some of their cellular effects in monoamine neurons within the central nervous system.[6][11]
The primary endogenous ligands of the human TAAR1 (hTAAR1) receptor, by rank order of potency, are: tyramine > β-phenethylamine > dopamine = octopamine.[5]
Contents
1Discovery
2Structure
3Gene
4Tissue distribution
4.1Location within neurons
4.2Receptor oligomers
5Ligands
5.1Agonists
5.1.1Trace amines
5.1.2Thyronamines
5.1.3Synthetic
5.2Partial agonists
5.3Inverse agonists
5.4Neutral antagonists
6Function
6.1Monoaminergic systems
6.2Immune system
7Clinical significance
7.1Research
8Notes
9References
10External links
Discovery[edit]
TAAR1 was discovered independently by Borowski et al. and Bunzow et al. in 2001. To find the genetic variants responsible for TAAR1 synthesis, they used mixtures of oligonucleotides with sequences related to G protein-coupled receptors (GPCRs) of serotonin and dopamine to discover novel DNA sequences in rat genomic DNA and cDNA, which they then amplified and cloned. The resulting sequence was not found in any database and coded for TAAR1.[9][10] Later, the functional role of TAAR1 and other receptors from this family was studied by Raul Gainetdinov and his colleagues.[17]
Structure[edit]
TAAR1 shares structural similarities with the class A rhodopsin GPCR subfamily.[10] It has 7 transmembrane domains with short N and C terminal extensions.[18] TAAR1 is 62–96% identical with TAARs2-15, which suggests that the TAAR subfamily has recently evolved; while at the same time, the low degree of similarity between TAAR1 orthologues suggests that they are rapidly evolving.[9] TAAR1 shares a predictive peptide motif with all other TAARs. This motif overlaps with transmembrane domain VII, and its identity is NSXXNPXX[Y,H]XXX[Y,F]XWF. TAAR1 and its homologues have ligand pocket vectors that utilize sets of 35 amino acids known to be involved directly in receptor-ligand interaction.[12]
Gene[edit]
All human TAAR genes are located on a single chromosome spanning 109 kb of human chromosome 6q23.1, 192 kb of mouse chromosome 10A4, and 216 kb of rat chromosome 1p12. Each TAAR is derived from a single exon, except for TAAR2, which is coded by two exons.[12] The human TAAR1 gene is thought to be an intronless gene.[19]
Tissue distribution[edit]

This diagram illustrates how TAAR1 activation induces incretin-like effects through the release of gastrointestinal hormones and influences food intake, blood glucose levels, and insulin release.[8] TAAR1 expression in the periphery is indicated with "x".[8]
To date, TAAR1 has been identified and cloned in five different mammal genomes: human, mouse, rat, monkey, and chimpanzee. In rats, mRNA for TAAR1 is found at low to moderate levels in peripheral tissues like the stomach, kidney, intestines[20] and lungs, and at low levels in the brain.[9] Rhesus monkey Taar1 and human TAAR1 share high sequence similarity, and TAAR1 mRNA is highly expressed in the same important monoaminergic regions of both species. These regions include the dorsal and ventral caudate nucleus, putamen, substantia nigra, nucleus accumbens, ventral tegmental area, locus coeruleus, amygdala, and raphe nucleus.[5][21] hTAAR1 has also been identified in human astrocytes.[5][13]
Outside of the human central nervous system, hTAAR1 also occurs as an intracellular receptor and is primarily expressed in the stomach, intestines,[20] duodenum,[20] pancreatic β-cells, and white blood cells.[8][20] In the duodenum, TAAR1 activation increases glucagon-like peptide-1 (GLP-1) and peptide YY (PYY) release;[8] in the stomach, hTAAR1 activation has been observed to increase somatostatin (growth hormone-inhibiting hormone) secretion from delta cells.[8]
hTAAR1 is the only human trace amine-associated receptor subtype that is not expressed within the human olfactory epithelium.[22]
Location within neurons[edit]
TAAR1 is an intracellular receptor expressed within the presynaptic terminal of monoamine neurons in humans and other animals.[6][11][23] In model cell systems, hTAAR1 has extremely poor membrane expression.[23] A method to induce hTAAR1 membrane expression has been used to study its pharmacology via a bioluminescence resonance energy transfer cAMP assay.[23]
Because TAAR1 is an intracellular receptor in monoamine neurons, exogenous TAAR1 ligands must enter the presynaptic neuron through a membrane transport protein[note 1] or be able to diffuse across the presynaptic membrane in order to reach the receptor and produce reuptake inhibition and neurotransmitter efflux.[11] Consequently, the efficacy of a particular TAAR1 ligand in producing these effects in different monoamine neurons is a function of both its binding affinity at TAAR1 and its capacity to move across the presynaptic membrane at each type of neuron.[11] The variability between a TAAR1 ligand's substrate affinity at the various monoamine transporters accounts for much of the difference in its capacity to produce neurotransmitter release and reuptake inhibition in different types of monoamine neurons.[11] E.g., a TAAR1 ligand which can easily pass through the norepinephrine transporter, but not the serotonin transporter, will produce – all else equal – markedly greater TAAR1-induced effects in norepinephrine neurons as compared to serotonin neurons.
Receptor oligomers[edit]
TAAR1 forms GPCR oligomers with monoamine autoreceptors in neurons in vivo.[24][25] These and other reported TAAR1 hetero-oligomers include:
TAAR1–D2sh[note 2][24]
TAAR1–α2A[25]
TAAR1–TAAR2[8]
Ligands[edit]
Trace amine-associated receptor 1 |
|
Transduction mechanisms |
Gs, Gq, GIRKs, β-arrestin 2 |
Primary endogenous agonists |
tyramine, β-phenylethylamine, octopamine, dopamine |
Agonists |
Endogenous: trace amines Exogenous: RO5166017, amphetamine, methamphetamine, others |
Neutral antagonists |
None characterized |
Inverse agonists |
EPPTB |
Positive allosteric modulators |
N/A |
Negative allosteric modulators |
N/A |
External resources |
|
IUPHAR/BPS |
364 |
DrugBank |
Q96RJ0 |
HMDB |
HMDBP10805 |
Agonists[edit]
Trace amines[edit]
For a more comprehensive list, see Trace amine § List of trace amines.
Trace amines are endogenous amines which act as agonists at TAAR1 and are present in extracellular concentrations of 0.1–10 nM in the brain, constituting less than 1% of total biogenic amines in the mammalian nervous system.[27] Some of the human trace amines include tryptamine, phenethylamine (PEA), N-methylphenethylamine, p-tyramine, m-tyramine, N-methyltyramine, p-octopamine, m-octopamine, and synephrine. These share structural similarities with the three common monoamines: serotonin, dopamine, and norepinephrine. Each ligand has a different potency, measured as increased cyclic AMP (cAMP) concentration after the binding event.
The rank order of potency for the primary endogenous ligands at hTAAR1 is: tyramine > β-phenethylamine > dopamine = octopamine.[5]
Thyronamines[edit]
Thyronamines are molecular derivatives of the thyroid hormone and are very important for endocrine system function. 3-Iodothyronamine (T1AM) is the most potent TAAR1 agonist yet discovered, although it lacks monoamine transporter affinity and therefore has little effect in monoamine neurons of the central nervous system. Activation of TAAR1 by T1AM results in the production of large amounts of cAMP. This effect is coupled with decreased body temperature and cardiac output.
Synthetic[edit]
Amphetamine and its substituted derivatives methamphetamine and MDMA are all potent hTAAR1 agonists.[6][8] Upon association with TAAR1, they elicit increases in cAMP production similar to those of PEA and p-tyramine.[8] These compounds are structurally similar to PEA and p-tyramine.[10][28]
Benzofurans: 5-APB, 5-APDB, 6-APB, 6-APDB, 4-APB, 7-APB, 5-EAPB, and 5-MAPDB, as well as the benzodifuran 2C-B-FLY, are hTAAR1 agonists that have an MDMA-like pharmacodynamic profile.[29]
The methylphenethylamines are agonists of hTAAR1; these include α-methylphenethylamine (amphetamine), β-methylphenethylamine, N-methylphenethylamine (a trace amine), 2-methylphenethylamine, 3-methylphenethylamine, and 4-methylphenethylamine.[30]
In rats, lysergic acid diethylamide (LSD) is an agonist of rTAAR1,[10] but in humans it lacks any affinity for hTAAR1.[30]
Certain 2-aminooxazoline compounds (RO5166017, RO5256390, RO5203648, and RO5263397) are orally bioavailable, highly potent, and selective agonists of TAAR1 in laboratory animals.[31]
RO5166017 or (S)-4-[(ethylphenylamino)methyl]-4,5-dihydrooxazol-2-ylamine is a selective TAAR1 agonist without significant activity at other targets.[32]
RO5203648 and RO5263397 are highly selective TAAR1 partial agonists.[24] RO5203648 demonstrated clear antidepressant and anti-psychotic activity, additionally it attenuated drug self-administration and exhibited wakefulness promoting and cognition enhancing properties in murine and simian models.[33]
Ulotaront, investigational antipsychotic.
Partial agonists[edit]
Ralmitaront, investigational antipsychotic.
Inverse agonists[edit]
EPPTB or N-(3-ethoxyphenyl)-4-(pyrrolidin-1-yl)-3-trifluoromethylbenzamide is a selective hTAAR1 inverse agonist.[5][34]
Neutral antagonists[edit]
As of early 2018, no neutral antagonists for hTAAR1 have been characterized.[5]
Function[edit]
Phenethylamine and amphetamine in a TAAR1-localized dopamine neuron
via AADC
Amphetamine enters the presynaptic neuron across the neuronal membrane or through DAT.[11] Once inside, it binds to TAAR1 or enters synaptic vesicles through VMAT2.[11][35] When amphetamine enters synaptic vesicles through VMAT2, it collapses the vesicular pH gradient, which in turn causes dopamine to be released into the cytosol (light tan-colored area) through VMAT2.[35][36] When amphetamine binds to TAAR1, it reduces the firing rate of the dopamine neuron via potassium channels and activates protein kinase A (PKA) and protein kinase C (PKC), which subsequently phosphorylates DAT.[11][37][38] PKA-phosphorylation causes DAT to withdraw into the presynaptic neuron (internalize) and cease transport.[11] PKC-phosphorylated DAT may either operate in reverse or, like PKA-phosphorylated DAT, internalize and cease transport.[11] Amphetamine is also known to increase intracellular calcium, an effect which is associated with DAT phosphorylation through a CAMKIIα-dependent pathway, in turn producing dopamine efflux.[39][40] |
Monoaminergic systems[edit]
Before the discovery of TAAR1, trace amines were believed to serve very limited functions. They were thought to induce noradrenaline release from sympathetic nerve endings and compete for catecholamine or serotonin binding sites on cognate receptors, transporters, and storage sites.[27] Today, they are believed to play a much more dynamic role by regulating monoaminergic systems in the brain.
One of the downstream effects of active TAAR1 is to increase cAMP in the presynaptic cell via Gαs G-protein activation of adenylyl cyclase.[9][10][12] This alone can have a multitude of cellular consequences. A main function of the cAMP may be to up-regulate the expression of trace amines in the cell cytoplasm.[28] These amines would then activate intracellular TAAR1. Monoamine autoreceptors (e.g., D2 short, presynaptic α2, and presynaptic 5-HT1A) have the opposite effect of TAAR1, and together these receptors provide a regulatory system for monoamines.[11] Notably, amphetamine and trace amines possess high binding affinities for TAAR1, but not for monoamine autoreceptors.[11][6] The effect of TAAR1 agonists on monoamine transporters in the brain appears to be site-specific.[11] Imaging studies indicate that monoamine reuptake inhibition by amphetamine and trace amines is dependent upon the presence of TAAR1 co-localization in the associated monoamine neurons.[11] As of 2010, co-localization of TAAR1 and the dopamine transporter (DAT) has been visualized in rhesus monkeys, but co-localization of TAAR1 with the norepinephrine transporter (NET) and the serotonin transporter (SERT) has only been evidenced by messenger RNA (mRNA) expression.[11]
In neurons with co-localized TAAR1, TAAR1 agonists increase the concentrations of the associated monoamines in the synaptic cleft, thereby increasing post-synaptic receptor binding.[11] Through direct activation of G protein-coupled inwardly-rectifying potassium channels (GIRKs), TAAR1 can reduce the firing rate of dopamine neurons, in turn preventing a hyper-dopaminergic state.[32][37][38] Amphetamine and trace amines can enter the presynaptic neuron either through DAT or by diffusing across the neuronal membrane directly.[11] As a consequence of DAT uptake, amphetamine and trace amines produce competitive reuptake inhibition at the transporter.[11] Upon entering the presynaptic neuron, these compounds activate TAAR1 which, through protein kinase A (PKA) and protein kinase C (PKC) signaling, causes DAT phosphorylation. Phosphorylation by either protein kinase can result in DAT internalization (non-competitive reuptake inhibition), but PKC-mediated phosphorylation alone induces reverse transporter function (dopamine efflux).[11][41]
Immune system[edit]
See also: Neuroimmune system
Expression of TAAR1 on lymphocytes is associated with activation of lymphocyte immuno-characteristics.[15] In the immune system, TAAR1 transmits signals through active PKA and PKC phosphorylation cascades.[15] In a 2012 study, Panas et al. observed that methamphetamine had these effects, suggesting that, in addition to brain monoamine regulation, amphetamine-related compounds may have an effect on the immune system.[15] A recent paper showed that, along with TAAR1, TAAR2 is required for full activity of trace amines in PMN cells.[16]
Phytohaemagglutinin upregulates hTAAR1 mRNA in circulating leukocytes;[5] in these cells, TAAR1 activation mediates leukocyte chemotaxis toward TAAR1 agonists.[5] TAAR1 agonists (specifically, trace amines) have also been shown to induce interleukin 4 secretion in T-cells and immunoglobulin E (IgE) secretion in B cells.[5]
Astrocyte-localized TAAR1 regulates EAAT2 levels and function in these cells;[13] this has been implicated in methamphetamine-induced pathologies of the neuroimmune system.[13]
Clinical significance[edit]
Low phenethylamine (PEA) concentration in the brain is associated with major depressive disorder,[9][27][42] and high concentrations are associated with schizophrenia.[42][43] Low PEA levels and under-activation of TAAR1 also appears to be associated with ADHD.[42][43][44] It is hypothesized that insufficient PEA levels result in TAAR1 inactivation and overzealous monoamine uptake by transporters, possibly resulting in depression.[9][27] Some antidepressants function by inhibiting monoamine oxidase (MAO), which increases the concentration of trace amines, which is speculated to increase TAAR1 activation in presynaptic cells.[9][12] Decreased PEA metabolism has been linked to schizophrenia, a logical finding considering excess PEA would result in over-activation of TAAR1 and prevention of monoamine transporter function. Mutations in region q23.1 of human chromosome 6 – the same chromosome that codes for TAAR1 – have been linked to schizophrenia.[12]
Medical reviews from February 2015 and 2016 noted that TAAR1-selective ligands have significant therapeutic potential for treating psychostimulant addictions (e.g., cocaine, amphetamine, methamphetamine, etc.).[6][7] Despite, wide distribution outside of CNS and PNS TAAR1 does not affect hematological functions and the regulation of thyroid hormones across different stages of ageing. Such data represent that future TAAR1-based therapies should exert little hematological effect and thus will likely have a good safety profile.[45]
Research[edit]
A large candidate gene association study published in September 2011 found significant differences in TAAR1 allele frequencies between a cohort of fibromyalgia patients and a chronic pain-free control group, suggesting this gene may play an important role in the pathophysiology of the condition; this possibly presents a target for therapeutic intervention.[46]
In preclinical research on rats, TAAR1 activation in pancreatic cells promotes insulin, peptide YY, and GLP-1 secretion;[47][non-primary source needed] therefore, TAAR1 is potentially a biological target for the treatment of obesity and diabetes.[47][non-primary source needed]
Notes