
6 семестр / Физическая химия 1-ая аттестация 6 семестр
.docxПостулаты т/д
1) Любая изолированная т/д система с течением времени приходит в равновесное состояние и самопроизвольно не может из него выйти – этот процесс называется ре-лаксацией; Условие равновесия – т.е. равновесие, которое протекает при определ. условиях;
2) Либо же нулевой за-н т/д: Если т/д система А находится в тепловом равновесии с т/д системой В, а та в свою очередь находится в тепловом равновесии с т/д системой С, то система А и С также находятся в равновесии:
3) При заданных внешних переменных энергия равновесной системы явл. монотонной фу-цией её температуры.
a-внутр. переменная; b-внеш. переменная; U=f(T)-монотонная; a=f(b,T) или F (a, b, T)=0 – ур. состояния).
Термодинамический метод: Т/д-наука, изучающая взаимные переходы теплоты и работы в равновесных системах и при переходе к равновесию. Хим. т/д – раздел физ. химии, в котором т/д методы применяются для анализа хим. и физ-хим. явлений: хим. ре-ций, фазовых переходов и процессов в ра-рах. Система: Объект изучения т/д-т/д система-материальный объект, выделенный из внешней среды с помощью реально сущ. или воображаемой граничной поверхности и способный обмениваться с др. телами энергией и (или) ве-вом. Любая т/д система явл. моделью реального объекта, поэтому ее соответствие реальности зависит от приближений, которые выбраны в рамках исп. модели. Системы бывают: *открытые, в которых сущ. обмен энергией и ве-вом с окр. средой; *закрытые, в кот. сущ. обмен энергией с окружением, но нет обмена с ве-вом; *изолированные, в которых нет обмена ни с чем.
Теплота, работа, т/д параметры состояния. Интен- и экстенсивные переменные
Работа(А)– способ энергообмена системы с окр. средой при условии, что в движении частиц можно выбрать направление. Работа это способ упорядоченного энергообмена с окр. средой. Теплота(Q)–это способ неупорядоченного энергообмена системы с окр. средой. Чтобы произошёл теплообмен необходимо провзаимодействовать частицам. Теплота, как и работа не зависит от пути процесса, а определ. только начальным и конечным состояниями системы. Состояние любой т/д системы может быть охарактериз. количественно с помощью т/д переменных. Все они взаимосвяз, и для удобства построения математ. аппарата их делят на независимые переменные и т/д фу-ции. Переменные, которые фиксированы условиями существования системы, и не могут изменяться в пределах рассматриваемой задачи–т/д параметрами. Различают переменные: *внешние, кот. определ. св-вами и координатами тел в окр. среде и зависят от контактов системы с окружением, например, m или n; *внутренние, кот. зависят только от св-в самой системы; *экстенсивные, которые прямо пропорциональны массе системы или числу частиц, например, V, U, S, C; *интенсивные, которые не зависят от массы системы или числа частиц, например, T, p. Отношение любых двух экстенсивных переменных является интенсивным параметром, например, парциальный мольный объем V или мольная доля x. Различ. следующие состояния т/д систем: *равновесное, когда все характеристики системы постоянны и в ней нет потоков вещества или энергии. При этом выделяют: – устойчивое (стабильное) состояние, при котором всякое бесконечно малое воздействие вызывает только бесконечно малое изменение состояния, а при устранении этого воздействия система возвращается в исх. состояние; – метастабильное состояние, которое отличается от устойчивого тем, что некоторые конечные воздейст. вызывают конечные изменения состояния, которые не исчезают при устранении этих воздействий; *неравновесное (лабильное) сост. при котором всякое бесконечно малое воздейств. вызывает конеч. измен. состояния системы; *стационарное, когда независимые переменные постоянны во времени, но в системе имеются потоки.
Фу-ции
состояния и фу-ции процесса
*Фу-ции
процесса (перехода) значение
зависит
от
пути,
по
кот.
происходит
изменение
системы
(основные фу-ции: теплота, работа) *Фу-ции
состояния: зависят
только от состояния системы и
не
зависят
от
пути,
по
которому
это
состояние
получено. Характериз. данное состояние
системы (U,S,T,V,р)-опр.
состояние и не зависит от пути, по
которому это состояние было получено.
Приз-наки:
f(x;y;z)
1.
df=(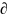 f/
x)dx
+ (
f/
y)dy
+ (
f/
z)dz
(бесконечно малое изменение ф-ии f
является полным дифференциалом); 2.
f/
x)dx
+ (
f/
y)dy
+ (
f/
z)dz
(бесконечно малое изменение ф-ии f
является полным дифференциалом); 2.
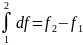 (изменение
функции
при
переходе
из
состояния
1
в
состояние
2
определяется
только
этими
состояниями);
3.
(изменение
функции
при
переходе
из
состояния
1
в
состояние
2
определяется
только
этими
состояниями);
3.
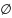 df=0
(в результате любого цикл. процесса
фу-ция сост. не меняется). Примеры
фу-ций
состояния:
U,H,
энергия
Гельмгольца
F,G,S. Термодинам. переменные-V,p,T– также
фу-ции
состояния,
т.к. они однозначно
характериз.
состояние
системы.
Примеры
фу-ций
перехода:
теплота
Q
и
работа
W.
df=0
(в результате любого цикл. процесса
фу-ция сост. не меняется). Примеры
фу-ций
состояния:
U,H,
энергия
Гельмгольца
F,G,S. Термодинам. переменные-V,p,T– также
фу-ции
состояния,
т.к. они однозначно
характериз.
состояние
системы.
Примеры
фу-ций
перехода:
теплота
Q
и
работа
W.
Равновесное состояние и квазистатистические процессы. Обратимые и необратимые процессы (примеры) Если состояние системы изменяется, то говорят, что в системе происходит т/д процесс. Процесс в т/д-это последовательность состояний системы, ведущих от одного начального набора т/д переменных к др.-конечному. Различают процессы: *самопроизвольные, для осуществления которых не надо затрачивать энергию; *несамопроизвольные, происходящие только при затрате энергии; *обратимые, когда переход системы из одного состояния в другое и обратно может происходить через последовательность одних и тех же состояний, и после возвращения в исх. состояние в окр. среде не остается макроскопических изменений; *квазистатические (равновесные), кот. происходят под действием бесконечно малой разности обобщенных сил; *необратимые (неравновесные), когда в результате процесса невозможно возвратить и систему, и ее окружение к первоначальному состоянию. В ходе процесса некоторые т/д переменные могут быть зафиксированы. В частности, различают изотермический (T=const), изохорный (V=const), изобарный (p =const) и адиабатический (Q=0, δQ=0) процессы.
У равнение
состояния идеальных и реальных газов
равнение
состояния идеальных и реальных газов
Фу-ции
состояния не явл. независимыми, они
связаны между собой ур-нями, назыв. ур.
состояния. Например, ур. вида f(p,
V,
T)=0
есть ур. состояния индивидуального
ве-ва: в отсутствие внешних электрических
и магнитных полей V,
T
и внешнее p
const
для всех частей системы. Поэтому состояние
системы может быть определено без
необходимости точного определения все
возможных переменных. Например, в случае
смеси идеальных газов достаточно указать
число молей (n)
каждого аза, общее давление смеси и ее
Т; тогда V
системы может быть вычислен из ур.
состояния идеальных газов: pV=( )RT-ур.
Менделеева-Клапейрона; парциальное
давление (
)RT-ур.
Менделеева-Клапейрона; парциальное
давление ( )
каждого газа в смеси может быть легко
рассчитано из аналогичного ур.:
V=
)
каждого газа в смеси может быть легко
рассчитано из аналогичного ур.:
V=
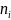 RT.
RT.
Р еальные
газы
лишь
приближенно
описываются
ур-ем
состояния
идеального газа. При высоких р и низких
Т (особенно когда газ близок к
конденсации)
отклонения
от
идеального
поведения
становятся
значительными.
Удобной
мерой
неидеальности
явл.
фактор
сжимаемости
Z=pVm/RT,
поскольку
для
идеального
газа Z=1 при любых условиях.
На
рис.
представлены
факторы
сжимаемости
некоторых
реальных
газов
как
фу-ции
р
при
298
К
(прямая
линия соответ.
идеальному
газу).
Из
рисунка
видно,
что
при
высоких
давлениях
для
всех
газов
Z>1,
т.е.
их
труднее
сжать,
чем
идеальный
газ,
т.к.
в этой области преобладают силы
межмолекулярного
отталкивания.
При
низких
р
для
некоторых
газов
Z
< 1,
что
объясняется
преобладанием
межмолекулярного
притяжения.
При
p
еальные
газы
лишь
приближенно
описываются
ур-ем
состояния
идеального газа. При высоких р и низких
Т (особенно когда газ близок к
конденсации)
отклонения
от
идеального
поведения
становятся
значительными.
Удобной
мерой
неидеальности
явл.
фактор
сжимаемости
Z=pVm/RT,
поскольку
для
идеального
газа Z=1 при любых условиях.
На
рис.
представлены
факторы
сжимаемости
некоторых
реальных
газов
как
фу-ции
р
при
298
К
(прямая
линия соответ.
идеальному
газу).
Из
рисунка
видно,
что
при
высоких
давлениях
для
всех
газов
Z>1,
т.е.
их
труднее
сжать,
чем
идеальный
газ,
т.к.
в этой области преобладают силы
межмолекулярного
отталкивания.
При
низких
р
для
некоторых
газов
Z
< 1,
что
объясняется
преобладанием
межмолекулярного
притяжения.
При
p 0
эффект
межмолекулярного
взаимодействия
исчезает,
потому что длина свобод-
ного
пробега
молекул
становится
много
больше
расстояния
между
частицами,
и
для
всех
газов
Z
1,
т.е.
в
этих
условиях
все
газы
ведут
себя
почти
идеально.
0
эффект
межмолекулярного
взаимодействия
исчезает,
потому что длина свобод-
ного
пробега
молекул
становится
много
больше
расстояния
между
частицами,
и
для
всех
газов
Z
1,
т.е.
в
этих
условиях
все
газы
ведут
себя
почти
идеально.
Уравнение
Ван-дер-Ваальса и его анализ:
Наиболее
известным
уравнением,
описывающим
одновременно
свойства
и
газа,
и
жидкости,
является
уравнение
Ван-дер-Ваальса: p
= (RT/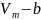 )
– (a/
)
– (a/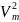 )
или
)
или
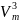 -(b
+ RT/p)
+ (a/p)
-(b
+ RT/p)
+ (a/p)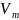 -
ab/p
= 0,
где взаимод. молекул силами a-межмолек.
притяжения, b-наличие
у молекул собственного объема.
-
ab/p
= 0,
где взаимод. молекул силами a-межмолек.
притяжения, b-наличие
у молекул собственного объема.
На рис. изображены изотермы газа или ж по ур. В-д-В. При высоких Т (изотерма Т3) они мал отличаются (в особенности в области больших V) от гипербол. При понижении Т (изотерма Т2) заметно искривление, которое при некоторой Т (Тcr) приводит к перегибу изотермы в точке К. Эта точка соотв. Критическому состоянию ве-ва. Для всех Т ниже Тcr, на изотермах сущ. изгиб, который выражен тем резче, чем ниже Т. На изотерме Т1 участок А1, А2, изображенный сплошной линией – изобарой, кот. означает переход ве-ва из ж в газообразное состояния. ГРАФИК САМИМ!
Т еорема
о соответственных состояниях. Уравнение
состояния в вириальной форме
Состояния
разных
ве-в,
имеющие
одинаковые
значения
при
веденных
переменных, назыв. соответственными.
Согласно
за-ну
соответственных
состояний,
если
для
рассматриваемых
газов
значения
двух
приведенных
переменных
одинаковы,
долж-ны
совпадать
и
значения
третьей
приведенной
переменной.
Т.О.,
ур.
состояния раз-личных ве-в, записанные
в приведенных
переменных,
должны
совпадать.
Это
утверждение
эквивалентно
постулату
о сущ. общего универсального приведенного
ур.
состояния:
F(pr,
Vr,
Tr)
=
0.
еорема
о соответственных состояниях. Уравнение
состояния в вириальной форме
Состояния
разных
ве-в,
имеющие
одинаковые
значения
при
веденных
переменных, назыв. соответственными.
Согласно
за-ну
соответственных
состояний,
если
для
рассматриваемых
газов
значения
двух
приведенных
переменных
одинаковы,
долж-ны
совпадать
и
значения
третьей
приведенной
переменной.
Т.О.,
ур.
состояния раз-личных ве-в, записанные
в приведенных
переменных,
должны
совпадать.
Это
утверждение
эквивалентно
постулату
о сущ. общего универсального приведенного
ур.
состояния:
F(pr,
Vr,
Tr)
=
0.
Т.к.
это ур. не содержит в явном виде
индивидуальных постоянных, оно должно
быть применимо к любому газу. За-н
соответственны состояний явл. общим
утверждением, не связанным с конкретным
видом ур. состояния. На практике за-н
соответственных состояний приближенно
выполняется для однотипных ве-в, что
позволяет, например, исп. для реальных
газов обобщенные диаграммы сжимаемости
(рис.). С
высокой
точностью
по-
ведение
любого
реального
газа
можно описать с помощью вириального
ур.
состояния
–
бесконечного
ряда
по
степеням
обратного
объема:
p=RT/
(1+B2/
+ B3/
+ …) или
давления: =RT/
(1+B2p
+ B3p2
+…), где
Bi,
Bi'
– i-ые вириальные коэффициенты,
которые зависят от приро-
ды
газа и от температуры. Первый вириальный
коэф. = 1.
Так
как в большинстве случаев B2/V
>> B3
/V 2
>> ..., при описании эксперимент. данных
ограничиваются вторым вириальным коэф.
При
низких
Т
B2
<
0,
с
ростом
Т
его значение проходит через 0, затем
становится положительным, достигает
максимума и далее очень медленно убывает.
При высоких Т B2
и
все
последующие
вириальные
коэф.
стремятся
к
0. Т, при которой B2
= 0, назыв. Т Бойля. При этой Т фактор
сжимаемости реального
газа
близок к 1 при любых р. Термическое
ур. состояния
можно
определить
экспериментально,
изучая
зависимость
V
фазы от T
и p.
При этом получают величины,
назыв.
термическими
коэф.:
(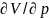 )T
=
-
)T
=
-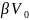 ,
,
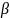 -изотермический
коэф. сжимаемости; (
-изотермический
коэф. сжимаемости; ( )р
=
)р
=
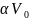 ,
,
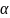 -изобарный
коэф. расширения.
Вычисление
работы для различных процессов в
идеальных газах
Работа
идеального газа в различных процессах
-изобарный
коэф. расширения.
Вычисление
работы для различных процессов в
идеальных газах
Работа
идеального газа в различных процессах
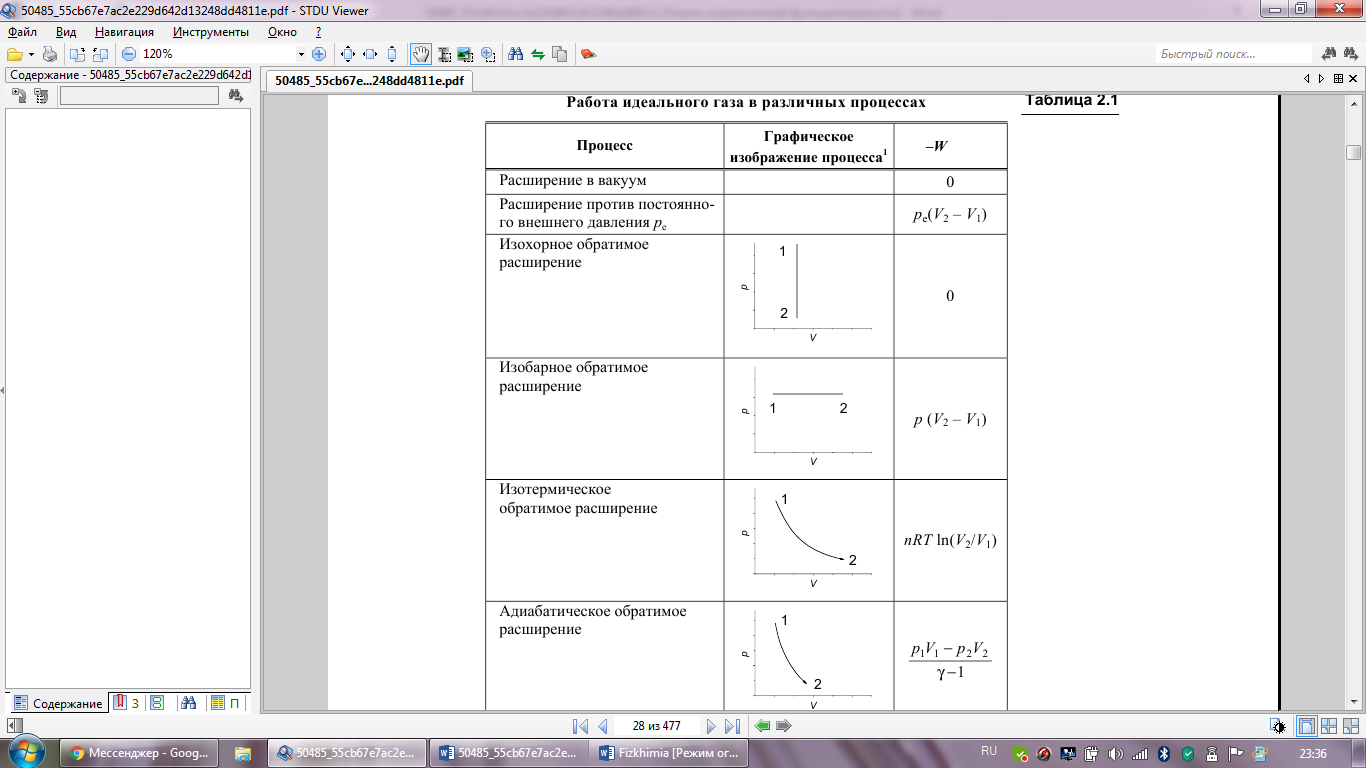
Первый за-н т/д, его формулировка и аналитическое выражение: Первый закон (первое начало) термодинамики-это фактически закон сохранения энергии. Он утверждает, что: cущ. аддитивная фу-ция состояния т/д системы, назыв. энергией (U). Энергия изолированной системы постоянна. В закрытой системе энергия может из- меняться за счет: а) совершения работы (W) над окр. средой (или среды над системой); б) обмена теплотой (Q) с окр. средой: dU = δQ + δW (дифференциальная форма); ∆U = Q + W (интегральная форма). Буква δ в уравнении отражает тот факт, что Q и W-фу-ции перехода и их бесконечно малое изменение не явл. полным дифференциалом. Первый закон справедлив для любых систем и процессов, но в случае открытых систем исп. его в форме ур. (диф. форма) нельзя, так как в процессах, сопровождающихся переносом ве-ва от системы к окружению или обратно, наблюдаемые изменения энергии не удается разделить на теплоту и работу. Причина-тот факт, что при внесении в систему некото-рого кол-ва ве-ва изменяется V системы, т.е. совершается работа расширения (сжатия), и при этом вместе с ве-вом поступает некоторое кол-во связанной с ним энтропии.
Иногда
для
открытых
систем
первый
закон
записывают
в
виде:
dU=δQ+δW+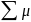 idni,
где
последняя сумма характеризует процесс
обмена ве-вом между
системой
и окружением. Эту сумму условно назыв.«хим.
работой», имея в виду работу переноса
ве-ва из окружения в систему.
Фу-ция
μ получила название «хим. потенциал»
idni,
где
последняя сумма характеризует процесс
обмена ве-вом между
системой
и окружением. Эту сумму условно назыв.«хим.
работой», имея в виду работу переноса
ве-ва из окружения в систему.
Фу-ция
μ получила название «хим. потенциал»
Взаимные
превращ. теплоты и работы для различ.
процессов в идеальных газах. В
лю-бых процессах для одноатомного
идеального газа определяется выражением:
 U=3/2
U=3/2
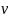 R
T=3/2(p2V2-p1V1)
.В
изобарном процессе работу идеального
газа можно рассчитывать по ф-ам:
A=p
V=m/M*R
T,
p=const.
В
изохорном процессе работа газа равна
0.
Внутренняя
энергия как фу-ция состояния
системы
Внутренняя
энергия явл. функцией состояния
системы-функция, изменение которой не
зависит от пути процесса, а зависит
только от конечного и начального
состояния системы. Внутренняя энергия
оказывается функцией состояния вещества,
и сама является параметром состояния. Удельная
внутренняя энергия однородного тела
может быть определена любой парой
независимых параметров состояния:
U=f(T,
V);
U=f
(T,
p);
U=f
(p,
V).
Определение
внутренней энергии в т/д и молекулярной
теории
В
МТ:
Внутренняя энергия – это энергия
теплового движения микрочастиц системы
(молекул, атомов, электронов, ядер и т.
д.) и энергии взаимодействия этих
частиц.
В
т/д:
Внутренняя энергия тела слагается из
кинетической энергии поступательного
движения молекул, кинетической и
потенциальной энергий колебательного
движения атомов в молекулах, потенциальной
энергии взаимодействия между молекулами
и внутримолекулярной энергии (т.е.
энергии электронных оболочек атомов и
внутри ядерной). Кинетическая энергия
тела как целого и его потенциальная
энергия во внешнем силовом поле во
внутреннюю энергию не входят.
В
термодинамические формулы входит не
сама энергия, а ее изменение, поэтому
внутреннюю энергию можно определять с
точностью до аддитивной постоянной.
Внутренняя
энергия системы тел состоит из внутренней
энергии каждого из тел в отдельности и
энергии взаимодействия между телами.
Энергия взаимодействия много меньше
энергии системы тел, и ей можно
пренебречь.Тогда внутренняя энергия
есть величина аддитивная. Внутренняя
энергия явл. однозначной фу-ей состояния
системы. Поэтому приращение внутренней
энергии при переходе системы из одного
состояния в другое, всегда равно разности
значений внутренней энергии в конечном
и начальном состояниях независимо от
пути, по которому совершается переход:
ΔU=U2-U1.
Изменение
внутренней энергии для обратимых и
необратимых процессов
Процессы,
при которых А=ΔG, называются обратимыми, потому
что затратив работу А мы можем
вернуть систему в исходное состояние.
Все
процессы, в которых А <ΔG являются необратимыми;
чтобы в этом случае вернуть систему в
исходное состояние надо затратить
работы больше, чем было получено. В любом
реальном процессе часть свободной
энергии обязательно превращается в
тепло, то есть в связанную энергию.
В изохорном
процессе (V = const)
газ работы не совершает, A=0.
Следовательно, Q=ΔU=U(T2)–U(T1).Здесь U(T1) и
U(T2)–внутренние
энергии газа в начальном и конечном
состояниях. Внутренняя энергия идеального
газа зависит только от температуры
(закон Джоуля). При изохорном нагревании
тепло поглощается газом (Q> 0),
и его внутренняя энергия увеличивается.
При охлаждении тепло отдается внешним
телам (Q <0).
В изобарном
процессе (p = const)
работа, совершаемая газом, выражается
соотношением p (V2–V1)=p ΔV.
Первый
закон термодинамики для изобарного
процесса дает:
Q=ΔU + p ΔV.
При
изобарном расширении Q> 0 –
тепло поглощается газом, и газ совершает
положительную работу.
При
изобарном сжатии Q<0 –
тепло отдается внешним телам. В этом
случае A<0.
Температура газа при изобарном сжатии
уменьшается, T2 <T1;
внутренняя энергия убывает, ΔU<0.
В изотермическом
процессе температура
газа не изменяется, следовательно, не
изменяется и внутренняя энергия
газа, ΔU=0.
Первый
закон термодинамики для изотермического
процесса выражается соотношением:
Q=A
Количество
теплоты Q,
полученной газом в процессе изотермического
расширения, превращается в работу над
внешними телами. При изотермическом
сжатии работа внешних сил, произведенная
над газом, превращается в тепло, которое
передается окружающим телам.
+Сосуды
с теплонепроницаемыми стенками
называются адиабатическими оболочками,
а процессы расширения или сжатия газа
в таких сосудах
называются адиабатическими.
В адиабатическом
процессе Q = 0;
поэтому первый закон термодинамики
принимает вид и т. е. газ совершает
работу за счет убыли его внутренней
энергии. А=- ΔU
R
T=3/2(p2V2-p1V1)
.В
изобарном процессе работу идеального
газа можно рассчитывать по ф-ам:
A=p
V=m/M*R
T,
p=const.
В
изохорном процессе работа газа равна
0.
Внутренняя
энергия как фу-ция состояния
системы
Внутренняя
энергия явл. функцией состояния
системы-функция, изменение которой не
зависит от пути процесса, а зависит
только от конечного и начального
состояния системы. Внутренняя энергия
оказывается функцией состояния вещества,
и сама является параметром состояния. Удельная
внутренняя энергия однородного тела
может быть определена любой парой
независимых параметров состояния:
U=f(T,
V);
U=f
(T,
p);
U=f
(p,
V).
Определение
внутренней энергии в т/д и молекулярной
теории
В
МТ:
Внутренняя энергия – это энергия
теплового движения микрочастиц системы
(молекул, атомов, электронов, ядер и т.
д.) и энергии взаимодействия этих
частиц.
В
т/д:
Внутренняя энергия тела слагается из
кинетической энергии поступательного
движения молекул, кинетической и
потенциальной энергий колебательного
движения атомов в молекулах, потенциальной
энергии взаимодействия между молекулами
и внутримолекулярной энергии (т.е.
энергии электронных оболочек атомов и
внутри ядерной). Кинетическая энергия
тела как целого и его потенциальная
энергия во внешнем силовом поле во
внутреннюю энергию не входят.
В
термодинамические формулы входит не
сама энергия, а ее изменение, поэтому
внутреннюю энергию можно определять с
точностью до аддитивной постоянной.
Внутренняя
энергия системы тел состоит из внутренней
энергии каждого из тел в отдельности и
энергии взаимодействия между телами.
Энергия взаимодействия много меньше
энергии системы тел, и ей можно
пренебречь.Тогда внутренняя энергия
есть величина аддитивная. Внутренняя
энергия явл. однозначной фу-ей состояния
системы. Поэтому приращение внутренней
энергии при переходе системы из одного
состояния в другое, всегда равно разности
значений внутренней энергии в конечном
и начальном состояниях независимо от
пути, по которому совершается переход:
ΔU=U2-U1.
Изменение
внутренней энергии для обратимых и
необратимых процессов
Процессы,
при которых А=ΔG, называются обратимыми, потому
что затратив работу А мы можем
вернуть систему в исходное состояние.
Все
процессы, в которых А <ΔG являются необратимыми;
чтобы в этом случае вернуть систему в
исходное состояние надо затратить
работы больше, чем было получено. В любом
реальном процессе часть свободной
энергии обязательно превращается в
тепло, то есть в связанную энергию.
В изохорном
процессе (V = const)
газ работы не совершает, A=0.
Следовательно, Q=ΔU=U(T2)–U(T1).Здесь U(T1) и
U(T2)–внутренние
энергии газа в начальном и конечном
состояниях. Внутренняя энергия идеального
газа зависит только от температуры
(закон Джоуля). При изохорном нагревании
тепло поглощается газом (Q> 0),
и его внутренняя энергия увеличивается.
При охлаждении тепло отдается внешним
телам (Q <0).
В изобарном
процессе (p = const)
работа, совершаемая газом, выражается
соотношением p (V2–V1)=p ΔV.
Первый
закон термодинамики для изобарного
процесса дает:
Q=ΔU + p ΔV.
При
изобарном расширении Q> 0 –
тепло поглощается газом, и газ совершает
положительную работу.
При
изобарном сжатии Q<0 –
тепло отдается внешним телам. В этом
случае A<0.
Температура газа при изобарном сжатии
уменьшается, T2 <T1;
внутренняя энергия убывает, ΔU<0.
В изотермическом
процессе температура
газа не изменяется, следовательно, не
изменяется и внутренняя энергия
газа, ΔU=0.
Первый
закон термодинамики для изотермического
процесса выражается соотношением:
Q=A
Количество
теплоты Q,
полученной газом в процессе изотермического
расширения, превращается в работу над
внешними телами. При изотермическом
сжатии работа внешних сил, произведенная
над газом, превращается в тепло, которое
передается окружающим телам.
+Сосуды
с теплонепроницаемыми стенками
называются адиабатическими оболочками,
а процессы расширения или сжатия газа
в таких сосудах
называются адиабатическими.
В адиабатическом
процессе Q = 0;
поэтому первый закон термодинамики
принимает вид и т. е. газ совершает
работу за счет убыли его внутренней
энергии. А=- ΔU
Энтальпия
Стандартная
энтальпия образования-изобарный
тепловой эффект реакции образования
одного моля данного химического
соединения из простых веществ в
стандартных состояниях. Энтальпия
образования простого вещества в
стандартном состоянии равна 0 при любой
температуре. Понятие «энтальпия
образования» используют не только для
обычных веществ, но и для ионов в растворе.
При этом за точку отсчета принят ион H+
, для которого стандартная энтальпия
образования в водном растворе полагается
равной нулю.Стандартная
энтальпия сгорания-изобарный
тепловой эффект р-ии окисл. одного моля
вещества газообразным кислородом при
p(O2)=1 бар. Теплота сгорания отвечает
окислению углерода до СО2, водорода до
H2O(ж), для остальных веществ в каждом
случае принято указывать образующиеся
продукты. Из закона Гесса вытекают
важные следствия, которые позволяют
рассчитывать энтальпии хим. р-ий.
Стандартная
энтальпия химической реакции равна
разности стандартных энтальпий
образования продуктов реакции и реагентов
(с учетом стехиометрических
коэффициентов):
![]() Стандартная
энтальпия химической реакции равна
разности стандартных энтальпий сгорания
реагентов и продуктов реакции (с учетом
стехиометрических коэффициентов):
Стандартная
энтальпия химической реакции равна
разности стандартных энтальпий сгорания
реагентов и продуктов реакции (с учетом
стехиометрических коэффициентов):
![]() Большинство
термохимических данных в справочниках
приведено при температуре 298 К. Для
расчета тепловых эффектов при других
температурах используют ур-е Кирхгофа:
Большинство
термохимических данных в справочниках
приведено при температуре 298 К. Для
расчета тепловых эффектов при других
температурах используют ур-е Кирхгофа:
![]() дифференциальная форма,
интегральная
форма.
Если
разница T2–T1 невелика, то можно принять
∆rCp = const. При большой разнице температур
необходимо учитывать температурную
зависимость ∆rCp(T). В отличие от
теплоемкостей участников реакции,
разность ∆rCp(T) может быть и положительной,
и отрицательной.
Теплоемкость-экспериментально
измеряемая экстенсивная величина. В
термодинамических таблицах обычно
табулируют значения мольной теплоемкости
с шагом в 100 К, либо приводят величины
Cp при 298 К и коэффициенты полинома,
описывающего ее зависимость от
температуры. В настоящее время нет
универсальной формулы, которая
позволяла бы получить адекватное
описание теплоемкости во всем интервале
температур. Поэтому для аппроксимации
экспериментальных данных используют
различные интерполяционные или
экстраполяционные функции. При корректной
экстраполяции теплоемкости должны
выполняться предельные условия:
при Т→
дифференциальная форма,
интегральная
форма.
Если
разница T2–T1 невелика, то можно принять
∆rCp = const. При большой разнице температур
необходимо учитывать температурную
зависимость ∆rCp(T). В отличие от
теплоемкостей участников реакции,
разность ∆rCp(T) может быть и положительной,
и отрицательной.
Теплоемкость-экспериментально
измеряемая экстенсивная величина. В
термодинамических таблицах обычно
табулируют значения мольной теплоемкости
с шагом в 100 К, либо приводят величины
Cp при 298 К и коэффициенты полинома,
описывающего ее зависимость от
температуры. В настоящее время нет
универсальной формулы, которая
позволяла бы получить адекватное
описание теплоемкости во всем интервале
температур. Поэтому для аппроксимации
экспериментальных данных используют
различные интерполяционные или
экстраполяционные функции. При корректной
экстраполяции теплоемкости должны
выполняться предельные условия:
при Т→ ,
limCv(0/T→0
написать под lim)=3R,при
Т→0, СV=aT3.
Для
слоистых структур (плоских кристаллов)
и цепных (волокнистых) структур зависимость
CV(T) вблизи абсолютного нуля описывается
степенными функциями вида 2 C bT V = или ,
C kT V = соответственно. При невысоких
температурах мольная теплоемкость
одноатомных идеальных газов равна CV,m
= 3/2 R, для двухатомных газов CV,m = 5/2 R.
Теплоемкость жидкости обычно несколько
превышает теплоемкость твердого тела.
Объяснение этих и некоторых других
особенностей, присущих теплоемкости,
дается в рамках статистической
термодинамики. Интерполяционные
формулы позволяют корректно рассчитать
значение теплоемкости при любой
температуре только внутри указанного
температурного интервала. К таким
выражениям относятся часто используемые
уравнения:Ср=а+bT,Cp=a+bT+cT-2,Cp=a+bT+cTlnT.
При
отсутствии экспериментальных данных
о теплоемкостях веществ обычно используют
различные способы оценок этих величин:
• правило
Дюлонга–Пти:
теплоемкость CV твердых соединений
приблизительно равна сумме атомных
теплоемкостей; при этом принимают, что
для простых веществ они одинаковы и
равны 25 Дж⋅моль
–1⋅К–1
≈ 3R (исключение составляют легкие
элементы); • правило
Неймана–Коппа (правило аддитивности):
теплоемкость
Cp сложного вещества равна сумме
теплоемкостей образующих соединение
простых веществ; • мольные теплоемкости
органических жидкостей рассчитывают
суммированием атомно-групповых
составляющих (инкрементов) теплоемкостей;•
для большинства органических соединений
в небольшом интервале температур
Cp=a+bT, причем b/a=0.0022. Так как с изменением
давления энтальпия идеального газа не
изменяется, то и энтальпия реакции между
идеальными газами от давления не зависит.
В случае реальных газов отличие ∆rH от
соответствующей величины, полученной
для идеальных газов, можно вычислить,
например, с помощью уравнений состояния
участников реакции:
,
limCv(0/T→0
написать под lim)=3R,при
Т→0, СV=aT3.
Для
слоистых структур (плоских кристаллов)
и цепных (волокнистых) структур зависимость
CV(T) вблизи абсолютного нуля описывается
степенными функциями вида 2 C bT V = или ,
C kT V = соответственно. При невысоких
температурах мольная теплоемкость
одноатомных идеальных газов равна CV,m
= 3/2 R, для двухатомных газов CV,m = 5/2 R.
Теплоемкость жидкости обычно несколько
превышает теплоемкость твердого тела.
Объяснение этих и некоторых других
особенностей, присущих теплоемкости,
дается в рамках статистической
термодинамики. Интерполяционные
формулы позволяют корректно рассчитать
значение теплоемкости при любой
температуре только внутри указанного
температурного интервала. К таким
выражениям относятся часто используемые
уравнения:Ср=а+bT,Cp=a+bT+cT-2,Cp=a+bT+cTlnT.
При
отсутствии экспериментальных данных
о теплоемкостях веществ обычно используют
различные способы оценок этих величин:
• правило
Дюлонга–Пти:
теплоемкость CV твердых соединений
приблизительно равна сумме атомных
теплоемкостей; при этом принимают, что
для простых веществ они одинаковы и
равны 25 Дж⋅моль
–1⋅К–1
≈ 3R (исключение составляют легкие
элементы); • правило
Неймана–Коппа (правило аддитивности):
теплоемкость
Cp сложного вещества равна сумме
теплоемкостей образующих соединение
простых веществ; • мольные теплоемкости
органических жидкостей рассчитывают
суммированием атомно-групповых
составляющих (инкрементов) теплоемкостей;•
для большинства органических соединений
в небольшом интервале температур
Cp=a+bT, причем b/a=0.0022. Так как с изменением
давления энтальпия идеального газа не
изменяется, то и энтальпия реакции между
идеальными газами от давления не зависит.
В случае реальных газов отличие ∆rH от
соответствующей величины, полученной
для идеальных газов, можно вычислить,
например, с помощью уравнений состояния
участников реакции:
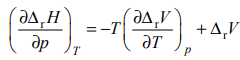 Изменение
внутр. Е и энтальпии для различных
процессов.
Так
как при постоянном объеме механическая
работа не совершается, теплота равна
изменению внутренней энергии
Изменение
внутр. Е и энтальпии для различных
процессов.
Так
как при постоянном объеме механическая
работа не совершается, теплота равна
изменению внутренней энергии
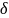 QV
= dU = CVdT.
При постоянном давлении теплота равна
изменению другой функции состояния,
которую называют энтальпией:
Qp
= dU + p
QV
= dU = CVdT.
При постоянном давлении теплота равна
изменению другой функции состояния,
которую называют энтальпией:
Qp
= dU + p dV
= d(U+pV)
= dH,
где H = U + pV – энтальпия системы
Зависимость
теплоемкости от температуры:
При
повышении температуры газа колебательные
движения атомов в молекуле усиливаются,
на что расходуется все большее и
большее количество энергии. Следовательно,
чем выше температура, тем больше теплоты
приходится расходовать для нагрева
газа на 10. Таким образом, теплоемкость
газа не постоянная величина, а представляет
собой функцию температуры.В общем
случае теплоемкость для температуры
может быть представлена уравнением:с
= с0 + аt + bt2 + dt3 +……где с0 – теплоемкость
при 00С, а, b, d – постоянные коэффициенты.
Так как коэффициенты b, d весьма малы и
их влияние на значение с мало, то для
технических расчетов часто нелинейную
зависимость теплоемкости от температуры
заменяют близкой к ней линейной
зависимостью.
В
этом случае истинная теплоемкость
определяется по формуле: с=а+bt.
Тепловые
эффекты хим. ре-ций. Термохим. ур-ния.
Закон Гесса. Его формулировка исп. в
термохим. расчетах:
Термохимия
изучает
тепловые
эффекты
химических
реакций.
Во
многих
случаях эти реакции протекают при
постоянном объеме или постоянном р. Из
первого за-на т/д следует, что при
этих
условиях Q
совпадает с изменением фу-ции состояния.
При
V=const
Q
равна
изменению
внутренней
энергии:
δQV
= dU,
QV
=
ΔU,
а при постоянном давлении изменение
энтальпии: ΔQр
= dН,
Qр
=
ΔН.
Эти
равенства в применении к хим. ре-циям
составляют суть закона Гесса: Q
хим. ре-ции при р/V=const
(тепловой эффект хим. ре-ции) не зависит
от пути проведения процесса, а определяется
только состоянием реагентов и продуктов
ре-ции при условии, что единственной
работой, совершаемой системой, явл.
механическая работа. Тепловой эффект
относят к Т = const.
Следствия
из закона: 1)Теплота
образования в-ва равна по модулю и
противоположна по знаку теплоте его
разложения. ( ΔН разложения = - ΔН
образования); 2) Тепловой эффект хим.
реакции равен сумме теплоте образования
продуктов, за вычетом суммы теплоты
образования исходных в-в с учётом
стехиометрич. реакций.
Связь
между ΔQ
и ΔН
При
постоянном объеме теплота равна изменению
внутренней энергии:
dV
= d(U+pV)
= dH,
где H = U + pV – энтальпия системы
Зависимость
теплоемкости от температуры:
При
повышении температуры газа колебательные
движения атомов в молекуле усиливаются,
на что расходуется все большее и
большее количество энергии. Следовательно,
чем выше температура, тем больше теплоты
приходится расходовать для нагрева
газа на 10. Таким образом, теплоемкость
газа не постоянная величина, а представляет
собой функцию температуры.В общем
случае теплоемкость для температуры
может быть представлена уравнением:с
= с0 + аt + bt2 + dt3 +……где с0 – теплоемкость
при 00С, а, b, d – постоянные коэффициенты.
Так как коэффициенты b, d весьма малы и
их влияние на значение с мало, то для
технических расчетов часто нелинейную
зависимость теплоемкости от температуры
заменяют близкой к ней линейной
зависимостью.
В
этом случае истинная теплоемкость
определяется по формуле: с=а+bt.
Тепловые
эффекты хим. ре-ций. Термохим. ур-ния.
Закон Гесса. Его формулировка исп. в
термохим. расчетах:
Термохимия
изучает
тепловые
эффекты
химических
реакций.
Во
многих
случаях эти реакции протекают при
постоянном объеме или постоянном р. Из
первого за-на т/д следует, что при
этих
условиях Q
совпадает с изменением фу-ции состояния.
При
V=const
Q
равна
изменению
внутренней
энергии:
δQV
= dU,
QV
=
ΔU,
а при постоянном давлении изменение
энтальпии: ΔQр
= dН,
Qр
=
ΔН.
Эти
равенства в применении к хим. ре-циям
составляют суть закона Гесса: Q
хим. ре-ции при р/V=const
(тепловой эффект хим. ре-ции) не зависит
от пути проведения процесса, а определяется
только состоянием реагентов и продуктов
ре-ции при условии, что единственной
работой, совершаемой системой, явл.
механическая работа. Тепловой эффект
относят к Т = const.
Следствия
из закона: 1)Теплота
образования в-ва равна по модулю и
противоположна по знаку теплоте его
разложения. ( ΔН разложения = - ΔН
образования); 2) Тепловой эффект хим.
реакции равен сумме теплоте образования
продуктов, за вычетом суммы теплоты
образования исходных в-в с учётом
стехиометрич. реакций.
Связь
между ΔQ
и ΔН
При
постоянном объеме теплота равна изменению
внутренней энергии: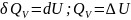 а
при постоянном давлении-изменению
энтальпии:
а
при постоянном давлении-изменению
энтальпии:
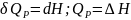 Эти
равенства в применении к химическим
реакциям составляют суть закона
Гесса: Теплота химической реакции при
постоянном объеме или давлении (тепловой
эффект химической реакции) не зависит
от пути проведения процесса, а определяется
только состоянием реагентов и продуктов
реакции при условии, что единственной
работой, совершаемой системой, является
механическая работа.
Стандартные
состояния и стандартные теплоты хим.
ре-ций
Изменение
энтальпии и внутренней энергии зависит
от того, в каком состоянии находятся
исх. ве-ва и продукты ре-ции. Cтaндapтнoe
cocтoяниe для газа - это газ, o6лaдaющий
cв-вaми идеального
газа, при
р в
1
aтм
(1,013
105Пa).
Cм. состояние
для
растворенного вe-вa – это pа-p, o6лaдaющий
cв-вaми
идеального
pa-pa,
c
кoнц.,
при
которой
его
активность
равна
1.
Cтaндаpтнoe состояние для тв тела – это
характерное для данного вe-вa кристаллическое
состояние при 1 aтм (1,013 105Пa). Когда
реагирующие вe-вa в cт. состояниях
превращаются в продукты pe-ции тaкжe в
cт. cocтoянияx, изменение т/д величин
помечают надстрочным индексом «0», a
тепловой эффект этой pe-ции назыв. тепловым
эффектом pе-ццuu при cт. условиях H0r.
Тепловой эффект при ст. условиях
рассчитывают пo стандартным теплотам
образования u сгорания. Cтaндapтнoй
тeплoтoй (энтaльпиeй) o6paзoвaния
называют тепловой эффект pe-ции o6paзoвaния
1 моля данного вe-вa из простых вe-в
(элементов) при условии, что все участники
pe-ции находятся в cт. состоянии. Cт. теплоты
o6paзoвaния o6oзнaчaют H0f, 298. Последняя цифра
указывает температуру, в качестве
которой oбычнo выбиp. 298K.
Связь
между величинами ΔU
и HΔ.
Стандартные состояния и стандартные
теплоты хим. ре-ций:
В
термохимии, в отличие от других приложений
термодинамики,
теплота
считается положительной, если она
выделяется в окружающую
среду,
т.е.
для
экзотермической
реакции
∆rH
<
0
или
∆rU
<
0. Если реакция протекает в растворе или
в твердой фазе, где изменение объема
незначительно, то ∆rH
=
∆rU
+
∆r(pV)
Эти
равенства в применении к химическим
реакциям составляют суть закона
Гесса: Теплота химической реакции при
постоянном объеме или давлении (тепловой
эффект химической реакции) не зависит
от пути проведения процесса, а определяется
только состоянием реагентов и продуктов
реакции при условии, что единственной
работой, совершаемой системой, является
механическая работа.
Стандартные
состояния и стандартные теплоты хим.
ре-ций
Изменение
энтальпии и внутренней энергии зависит
от того, в каком состоянии находятся
исх. ве-ва и продукты ре-ции. Cтaндapтнoe
cocтoяниe для газа - это газ, o6лaдaющий
cв-вaми идеального
газа, при
р в
1
aтм
(1,013
105Пa).
Cм. состояние
для
растворенного вe-вa – это pа-p, o6лaдaющий
cв-вaми
идеального
pa-pa,
c
кoнц.,
при
которой
его
активность
равна
1.
Cтaндаpтнoe состояние для тв тела – это
характерное для данного вe-вa кристаллическое
состояние при 1 aтм (1,013 105Пa). Когда
реагирующие вe-вa в cт. состояниях
превращаются в продукты pe-ции тaкжe в
cт. cocтoянияx, изменение т/д величин
помечают надстрочным индексом «0», a
тепловой эффект этой pe-ции назыв. тепловым
эффектом pе-ццuu при cт. условиях H0r.
Тепловой эффект при ст. условиях
рассчитывают пo стандартным теплотам
образования u сгорания. Cтaндapтнoй
тeплoтoй (энтaльпиeй) o6paзoвaния
называют тепловой эффект pe-ции o6paзoвaния
1 моля данного вe-вa из простых вe-в
(элементов) при условии, что все участники
pe-ции находятся в cт. состоянии. Cт. теплоты
o6paзoвaния o6oзнaчaют H0f, 298. Последняя цифра
указывает температуру, в качестве
которой oбычнo выбиp. 298K.
Связь
между величинами ΔU
и HΔ.
Стандартные состояния и стандартные
теплоты хим. ре-ций:
В
термохимии, в отличие от других приложений
термодинамики,
теплота
считается положительной, если она
выделяется в окружающую
среду,
т.е.
для
экзотермической
реакции
∆rH
<
0
или
∆rU
<
0. Если реакция протекает в растворе или
в твердой фазе, где изменение объема
незначительно, то ∆rH
=
∆rU
+
∆r(pV)
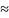 ∆rU.
Если
же
в
реакции
участвуют
идеальные
газы,
то
при
постоянной
температуре
∆rH
=
∆rU
+
∆r(pV)
=
∆rU
+∆vRT
где ∆v
–
изменение
числа
молей
газов
в
ре-ции.
Тепловые
эффекты
зависят,
в
общем
случае,
от
температуры
и
давления,
поэтому
для
термохимических
расчетов
необходимо,
чтобы
все
тепловые
эффекты
были
отнесены
к
одинаковым
условиям,
т.е.
стандартизованы.
Стандартные
состояния
обозначают надстрочным индексом «°».
В
настоящее
время
приняты
следующие
стандартные
состояния:
*для индивидуальных кристаллических и
жидких веществ – реальное состояние
(наиболее устойчивая модификация) при
заданной температуре и давлении 1
бар; *для индивидуальных газов –
гипотетическое состояние, возникающее
при изотермическом расширении газа до
бесконечно малого давления с последующим
сжатием до 1 бар, но уже по изотерме
идеального газа. Обычно поправка на
неидеальность при атм. давлении мала,
и ею пренебрегают. Поправку можно учесть,
если известно уравнение состояния
реального газа. Так как в конденсированной
фазе процессы диффузии заторможены по
сравнению с газовой фазой, возможно
существование при одних и тех же условиях
(p,T) как стабильных, так и метастабильных
состояний вещества (например, графита
и алмаза). Калометрические методы
позволяют экспериментально определить
свойства и тех и других фаз. Поэтому в
термохимических уравнениях принято
указывать не только формулы веществ,
но и их агрегатные состояния или
кристаллические модификации.Энтальпию
реакции между веществами, находящимися
в стандартных состояниях при температуре
T, называют стандартной э
∆rU.
Если
же
в
реакции
участвуют
идеальные
газы,
то
при
постоянной
температуре
∆rH
=
∆rU
+
∆r(pV)
=
∆rU
+∆vRT
где ∆v
–
изменение
числа
молей
газов
в
ре-ции.
Тепловые
эффекты
зависят,
в
общем
случае,
от
температуры
и
давления,
поэтому
для
термохимических
расчетов
необходимо,
чтобы
все
тепловые
эффекты
были
отнесены
к
одинаковым
условиям,
т.е.
стандартизованы.
Стандартные
состояния
обозначают надстрочным индексом «°».
В
настоящее
время
приняты
следующие
стандартные
состояния:
*для индивидуальных кристаллических и
жидких веществ – реальное состояние
(наиболее устойчивая модификация) при
заданной температуре и давлении 1
бар; *для индивидуальных газов –
гипотетическое состояние, возникающее
при изотермическом расширении газа до
бесконечно малого давления с последующим
сжатием до 1 бар, но уже по изотерме
идеального газа. Обычно поправка на
неидеальность при атм. давлении мала,
и ею пренебрегают. Поправку можно учесть,
если известно уравнение состояния
реального газа. Так как в конденсированной
фазе процессы диффузии заторможены по
сравнению с газовой фазой, возможно
существование при одних и тех же условиях
(p,T) как стабильных, так и метастабильных
состояний вещества (например, графита
и алмаза). Калометрические методы
позволяют экспериментально определить
свойства и тех и других фаз. Поэтому в
термохимических уравнениях принято
указывать не только формулы веществ,
но и их агрегатные состояния или
кристаллические модификации.Энтальпию
реакции между веществами, находящимися
в стандартных состояниях при температуре
T, называют стандартной э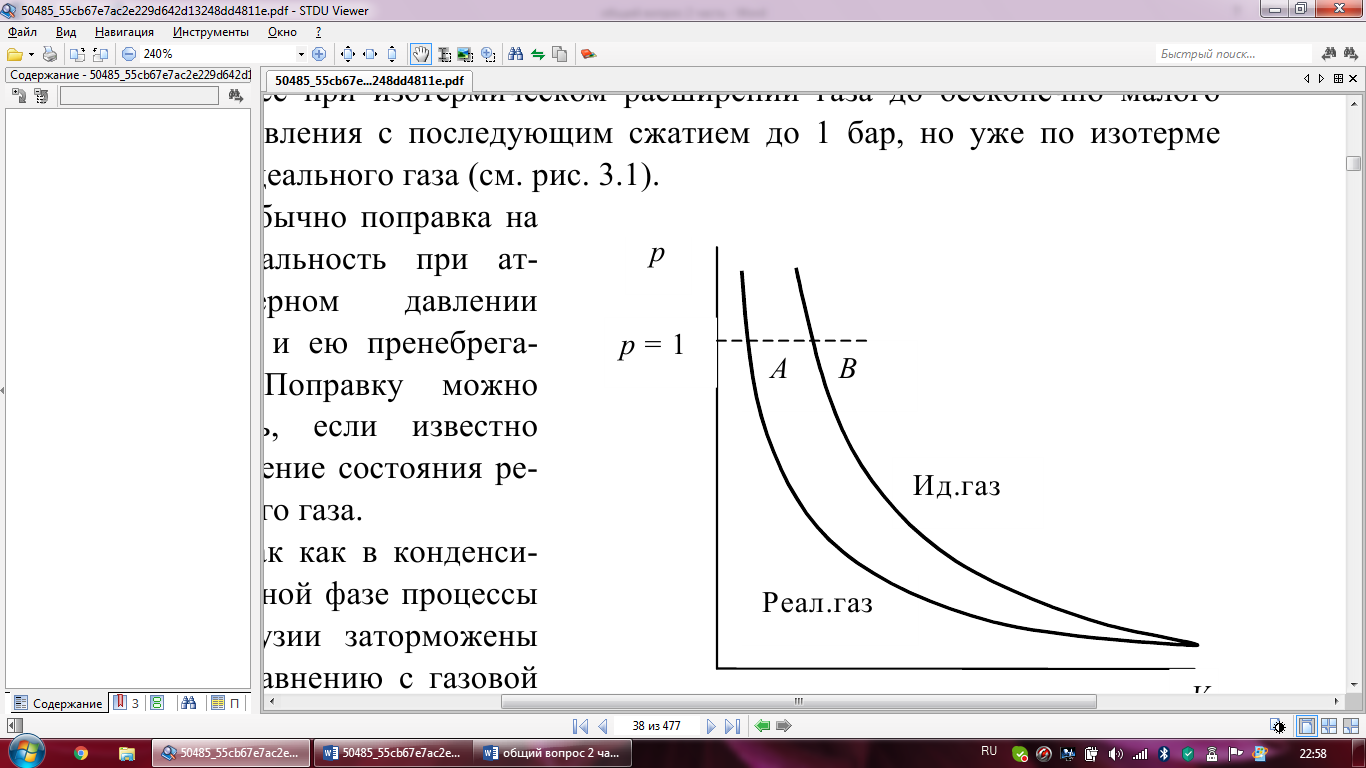 нтальпией
реакции и обозначают Δr
HT∘
Стандартная
энтальпия образования Δf
HT∘-
изобарный
тепловой эффект реакции образования
одного моля данного химического
соединения из простых веществ в
стандартных состояниях. Энтальпия
образования простого вещества в
стандартном состоянии равна 0 при любой
температуре. Понятие «энтальпия
образования» используют не только
для обычных веществ, но и для ионов в
растворе. При этом за точку отсчета
принят ион H+, для которого стандартная
энтальпия образования в водном растворе
полагается равной нулю: Δf
HT∘
(H +
) = 0.
Стандартная
энтальпия сгорания Δc HT∘
–
изобарный тепловой эффект реакции
окисления одного моля вещества
газообразным кислородом при p(O2) = 1 бар.
Теплота сгора- ния, если не оговорено
особо, отвечает окислению углерода до
СО2,
водорода до H2O(ж),
для остальных веществ в каждом случае
принято указывать образующиеся продукты.
Из закона Гесса вытекают важные
следствия, которые позволяют рассчитывать
энтальпии химических реакций.
Соотношение
Максвелла (вывод) и их применение при
т/д расчетах.
Соотношения
Максвелла часто используют на практике
для расчета термодинамических
характеристик. В частности, с их помощью
можно определить изменение энтропии
на основании данных о p—V—T свойствах
веществ. Зная любой из потенциалов как
функцию естественных переменных, можно
с помощью основного уравнения термодинамики
найти все другие термодинамические
функции и параметры системы. Для этого
используют соотношения Максвелла.
Рассмотрим, например, выражение для
внутрен. энергии. Так как dU – полный
дифференциал, частные производные
внутренней энергии по естественным
переменным равны:(1)
нтальпией
реакции и обозначают Δr
HT∘
Стандартная
энтальпия образования Δf
HT∘-
изобарный
тепловой эффект реакции образования
одного моля данного химического
соединения из простых веществ в
стандартных состояниях. Энтальпия
образования простого вещества в
стандартном состоянии равна 0 при любой
температуре. Понятие «энтальпия
образования» используют не только
для обычных веществ, но и для ионов в
растворе. При этом за точку отсчета
принят ион H+, для которого стандартная
энтальпия образования в водном растворе
полагается равной нулю: Δf
HT∘
(H +
) = 0.
Стандартная
энтальпия сгорания Δc HT∘
–
изобарный тепловой эффект реакции
окисления одного моля вещества
газообразным кислородом при p(O2) = 1 бар.
Теплота сгора- ния, если не оговорено
особо, отвечает окислению углерода до
СО2,
водорода до H2O(ж),
для остальных веществ в каждом случае
принято указывать образующиеся продукты.
Из закона Гесса вытекают важные
следствия, которые позволяют рассчитывать
энтальпии химических реакций.
Соотношение
Максвелла (вывод) и их применение при
т/д расчетах.
Соотношения
Максвелла часто используют на практике
для расчета термодинамических
характеристик. В частности, с их помощью
можно определить изменение энтропии
на основании данных о p—V—T свойствах
веществ. Зная любой из потенциалов как
функцию естественных переменных, можно
с помощью основного уравнения термодинамики
найти все другие термодинамические
функции и параметры системы. Для этого
используют соотношения Максвелла.
Рассмотрим, например, выражение для
внутрен. энергии. Так как dU – полный
дифференциал, частные производные
внутренней энергии по естественным
переменным равны:(1)
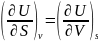 -(1)
-(1)
 -(2)
Если продифференцировать первое
тождество по объему, а второе-по энтропии,
то получатся смешанные вторые производные
внутренней энергии, которые равны друг
другу:(2) При перекрестном дифференц.
остальн. ур-ий получаются
еще 3 соотношения:
-(2)
Если продифференцировать первое
тождество по объему, а второе-по энтропии,
то получатся смешанные вторые производные
внутренней энергии, которые равны друг
другу:(2) При перекрестном дифференц.
остальн. ур-ий получаются
еще 3 соотношения: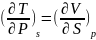 ;
;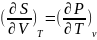 ;
;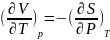 Вычисление
разности теплоемкостей Ср-Сv
для произвольной системы.
Теплота
может переходить в систему при нагревании.
Для расчета теплоты используют
понятие теплоемкости,
которая определяется следующим образом:
(1)
C =
Вычисление
разности теплоемкостей Ср-Сv
для произвольной системы.
Теплота
может переходить в систему при нагревании.
Для расчета теплоты используют
понятие теплоемкости,
которая определяется следующим образом:
(1)
C = ![]() -(1)
CV =
-(1)
CV = ![]() ; Cp =
; Cp = 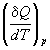 -(2)
Q =
-(2)
Q = ![]() -(3)
Если
нагревание происходит при постоянном
объеме или давлении, то теплоемкость
обозначают соответствующим нижним
индексом: (2) Из определения (1) следует,
что конечную теплоту, полученную системой
при нагревании, можно рассчитать, как
интеграл: (3)
Теплоемкость-экспериментально
измеряемая экстенсивная величина. В
термодинамических таблицах приведены
значения теплоемкости при 298 К и
коэффициенты, описывающие ее зависимость
от температуры. Так, при комнатной
температуре для одноатомных идеальных
газов мольная теплоемкость CV =
3/2 R,
для двухатомных газов CV = 5/2 R. •
правило
Дюлонга–Пти:
теплоемкость CV твердых соединений
приблизительно равна сумме атомных
теплоемкостей; при этом принимают, что
для простых веществ они одинаковы и
равны 25 Дж*моль–1*К–1
~ 3R (исключение составляют легкие
элементы); • правило
Неймана–Коппа (правило
аддитивности): теплоемкость Cp сложного
вещества равна сумме теплоемкостей
образующих соедннение простых веществ;
• мольные
теплоемкости органических жидкостей
рассчитывают суммированием атомно-групповых
составляющих (инкрементов) теплоемкостей.
•
для большинства органических соединений
в небольшом интервале
температур
Cp=a+bT, причем b/a = 0.0022. Теплоемкость
определяется через теплоту, переданную
системе, однако ее можно связать и с
изменением внутренней энергии. Так, при
постоянном объеме механическая работа
не совершается и теплота равна изменению
внутренней энергии: δQV = dU,
поэтому: CV =(ΔU/
ΔT)v.
Cр=(
ΔH/
ΔT)p -(5).
При постоянном давлении теплота равна
изменению другой функции состояния,
которую называют энтальпией: δQр =dU+pdV=d
(U+pV)=dH,
(4) где H=U+pV - энтальпия системы.
Из (4) следует, что теплоемкость Cр
определяет зависимость энтальпии от
температуры (5). Из соотношения между
внутренней энергией и энтальпией
следует, что для моля идеального газа
Cр-CV=R-ур.
Майера
Вычисление
энергии (функции) Гиббса и энтальпии
как функции t
и v
или p.
Изменение
энергий Гиббса и Гельмгольца при
изменении температуры:
зависимость энергии Гиббса и
Гельмгольца от температуры в закрытых
системах может быть определена с помощью
фундаментальных
уравнений:
dF=-SdT-pdV
,
dG=-SdТ+
Vdp
или с помощью ур-ия Гиббса-Гемгольца:(Δ(F/T)/
ΔT)v=
-U/T2;
(Δ(G/T)/
ΔT)p=
-H/T2
Ф
-(3)
Если
нагревание происходит при постоянном
объеме или давлении, то теплоемкость
обозначают соответствующим нижним
индексом: (2) Из определения (1) следует,
что конечную теплоту, полученную системой
при нагревании, можно рассчитать, как
интеграл: (3)
Теплоемкость-экспериментально
измеряемая экстенсивная величина. В
термодинамических таблицах приведены
значения теплоемкости при 298 К и
коэффициенты, описывающие ее зависимость
от температуры. Так, при комнатной
температуре для одноатомных идеальных
газов мольная теплоемкость CV =
3/2 R,
для двухатомных газов CV = 5/2 R. •
правило
Дюлонга–Пти:
теплоемкость CV твердых соединений
приблизительно равна сумме атомных
теплоемкостей; при этом принимают, что
для простых веществ они одинаковы и
равны 25 Дж*моль–1*К–1
~ 3R (исключение составляют легкие
элементы); • правило
Неймана–Коппа (правило
аддитивности): теплоемкость Cp сложного
вещества равна сумме теплоемкостей
образующих соедннение простых веществ;
• мольные
теплоемкости органических жидкостей
рассчитывают суммированием атомно-групповых
составляющих (инкрементов) теплоемкостей.
•
для большинства органических соединений
в небольшом интервале
температур
Cp=a+bT, причем b/a = 0.0022. Теплоемкость
определяется через теплоту, переданную
системе, однако ее можно связать и с
изменением внутренней энергии. Так, при
постоянном объеме механическая работа
не совершается и теплота равна изменению
внутренней энергии: δQV = dU,
поэтому: CV =(ΔU/
ΔT)v.
Cр=(
ΔH/
ΔT)p -(5).
При постоянном давлении теплота равна
изменению другой функции состояния,
которую называют энтальпией: δQр =dU+pdV=d
(U+pV)=dH,
(4) где H=U+pV - энтальпия системы.
Из (4) следует, что теплоемкость Cр
определяет зависимость энтальпии от
температуры (5). Из соотношения между
внутренней энергией и энтальпией
следует, что для моля идеального газа
Cр-CV=R-ур.
Майера
Вычисление
энергии (функции) Гиббса и энтальпии
как функции t
и v
или p.
Изменение
энергий Гиббса и Гельмгольца при
изменении температуры:
зависимость энергии Гиббса и
Гельмгольца от температуры в закрытых
системах может быть определена с помощью
фундаментальных
уравнений:
dF=-SdT-pdV
,
dG=-SdТ+
Vdp
или с помощью ур-ия Гиббса-Гемгольца:(Δ(F/T)/
ΔT)v=
-U/T2;
(Δ(G/T)/
ΔT)p=
-H/T2
Ф ункции
F
и
G
являются
функциями
состояния,
для
них:
ункции
F
и
G
являются
функциями
состояния,
для
них: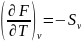 ;
;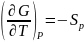 ;
Для
интегрирования этих ур-ий надо знать
температурн. зависимость энтропии,
которая опред. теплоемкостью системы.
График зависимости энергии Гиббса от
температуры в предположении линейной
температурной зависимости теплоемкости
приведен на рис.
Зависимость энергии
гиббса: а-от темпер. при р=const,
б-от давления при Т=const
Изменение
энергий Гиббса и Гельмгольца при
изотермич.
расширении
или
сжати:
Зависимость
энергии Гиббса и Гельмгольца от давления
и объема при постоянной температуре
может быть определена интегрированием
производных: (Δ
F/ΔV)T=
-p;
(Δ
G/ΔP)T=V.
Для восстановления вида этой зависимости
необходимо знать уравнение состояния
фазы. Так, для идеального газа:
;
Для
интегрирования этих ур-ий надо знать
температурн. зависимость энтропии,
которая опред. теплоемкостью системы.
График зависимости энергии Гиббса от
температуры в предположении линейной
температурной зависимости теплоемкости
приведен на рис.
Зависимость энергии
гиббса: а-от темпер. при р=const,
б-от давления при Т=const
Изменение
энергий Гиббса и Гельмгольца при
изотермич.
расширении
или
сжати:
Зависимость
энергии Гиббса и Гельмгольца от давления
и объема при постоянной температуре
может быть определена интегрированием
производных: (Δ
F/ΔV)T=
-p;
(Δ
G/ΔP)T=V.
Для восстановления вида этой зависимости
необходимо знать уравнение состояния
фазы. Так, для идеального газа:
![]() Если
p1=pº=1
бар,
то
говорят
о
стандартной
энергии
Гиббса,
Gº:
G(p)-Go(po)=nRT
ln
p
(На рис. б приведены графики зависимости
энергии Гиббса от
давления
при
T=const
для
конденсированной
фазы
и
газа).
Изменение
энергий
Гиббса
и
Гельмгольца
при
химической
реакции:
Расчет
изменения функций F и G в химических
реакциях можно
проводить
разными
способами.
Рассмотрим
три
из
них
на
примере
энергии
Гиббса.
1)
По определению, G=H–TS. Если
продукты реакции и исходные
вещества
находятся при одинаковой температуре,
то изменение энергии
Гиббса
в
химической
реакции
i
Ai
j
B
j
равно:
rGT
jGj
(T
)
iGi
(T
)
r
HT
T
r
ST
В
стандартных
условиях:
Если
p1=pº=1
бар,
то
говорят
о
стандартной
энергии
Гиббса,
Gº:
G(p)-Go(po)=nRT
ln
p
(На рис. б приведены графики зависимости
энергии Гиббса от
давления
при
T=const
для
конденсированной
фазы
и
газа).
Изменение
энергий
Гиббса
и
Гельмгольца
при
химической
реакции:
Расчет
изменения функций F и G в химических
реакциях можно
проводить
разными
способами.
Рассмотрим
три
из
них
на
примере
энергии
Гиббса.
1)
По определению, G=H–TS. Если
продукты реакции и исходные
вещества
находятся при одинаковой температуре,
то изменение энергии
Гиббса
в
химической
реакции
i
Ai
j
B
j
равно:
rGT
jGj
(T
)
iGi
(T
)
r
HT
T
r
ST
В
стандартных
условиях:
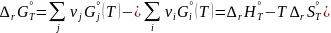 2)
Аналогично тепловому эф. реакции,
изменение
энергии Гиббса можно рассчитать,
используя стандартные энергии Гиббса
образования реагентов и продуктов:
2)
Аналогично тепловому эф. реакции,
изменение
энергии Гиббса можно рассчитать,
используя стандартные энергии Гиббса
образования реагентов и продуктов:
 или
или
 Изменение
энергии Гельмгольца химической реакции
между идеальными газами связано с
энергией
Гиббса:
rG
r
F
RT,
где
–
изменение
количества
молей
газообразных
веществ
в
ходе
реакции.
Для
реакций
в
конденсированной
фазе
при
небольших
давлениях:
rG
r
F
3)
Стандартная энергия Гиббса реакции
может быть рассчитана с помощью
стандартных приведенных потенциалов:
Изменение
энергии Гельмгольца химической реакции
между идеальными газами связано с
энергией
Гиббса:
rG
r
F
RT,
где
–
изменение
количества
молей
газообразных
веществ
в
ходе
реакции.
Для
реакций
в
конденсированной
фазе
при
небольших
давлениях:
rG
r
F
3)
Стандартная энергия Гиббса реакции
может быть рассчитана с помощью
стандартных приведенных потенциалов:
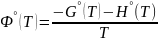 ;
;
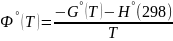 ,
где
Gº(T) – стандартное значение энергии
Гиббса при температуре Т,
Hº(0),
Hº(298) – стандартные значения энтальпии
при температурах 0 и
298
К. Функции Фº(T) и Ф’º(T) вычисляются для
газов по молекулярным
данным,
а
для
конденсиров-ных
фаз-на
основании
эксперимент.
данных по теплоемкости. Связь между
приведенными потенц. и стандарт. энергией
Гиббса р-ии выражается соотношениями:
,
где
Gº(T) – стандартное значение энергии
Гиббса при температуре Т,
Hº(0),
Hº(298) – стандартные значения энтальпии
при температурах 0 и
298
К. Функции Фº(T) и Ф’º(T) вычисляются для
газов по молекулярным
данным,
а
для
конденсиров-ных
фаз-на
основании
эксперимент.
данных по теплоемкости. Связь между
приведенными потенц. и стандарт. энергией
Гиббса р-ии выражается соотношениями:
 +
+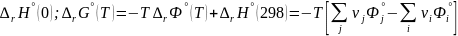 +
+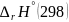 ,
где
∆rHº(0),
∆rHº(298)
–
стандартные
энтальпии
реакции
при
0
и
298
К.
Энтальпию
реакции между веществами, находящимися
в стандартных
состояниях
при
температуре
T,
называют
стандартной
энтальпией
реакции
и
обозначают
∆rHT/
Стандартная
энтальпия образования – изобарный
тепловой эффект реакции образования
одного моля данного химического
соединения из простых веществ в
стандартных состояниях. Энтальпия
образования простого вещества в
стандартном состоянии равна 0 при любой
температуре. Понятие «энтальпия
образования» используют не только для
обычных веществ, но и для ионов в растворе.
При этом за точку отсчета принят ион
H+, для которого стандартная энтальпия
образования в водном растворе полагается
равной нулю:
ΔfHT(H+)=0.
Стандартная
энтальпия сгорания ∆c
HT-
изобарный
тепловой
эффект
реакции
окисления
одного
моля
вещества газообразным кислородом при
p(O2)
= 1 бар. Теплота сгора-
ния,
если не оговорено особо, отвечает
окислению углерода до СО2,
водорода
до H2O(ж),
для остальных веществ в каждом случае
принято
указывать
образующиеся
продукты.
Из закона Гесса вытекают важные следствия,
которые позволяют рассчитывать энтальпии
химических реакций.
Следствие
1.
Стандартная энтальпия химической
реакции:
,
где
∆rHº(0),
∆rHº(298)
–
стандартные
энтальпии
реакции
при
0
и
298
К.
Энтальпию
реакции между веществами, находящимися
в стандартных
состояниях
при
температуре
T,
называют
стандартной
энтальпией
реакции
и
обозначают
∆rHT/
Стандартная
энтальпия образования – изобарный
тепловой эффект реакции образования
одного моля данного химического
соединения из простых веществ в
стандартных состояниях. Энтальпия
образования простого вещества в
стандартном состоянии равна 0 при любой
температуре. Понятие «энтальпия
образования» используют не только для
обычных веществ, но и для ионов в растворе.
При этом за точку отсчета принят ион
H+, для которого стандартная энтальпия
образования в водном растворе полагается
равной нулю:
ΔfHT(H+)=0.
Стандартная
энтальпия сгорания ∆c
HT-
изобарный
тепловой
эффект
реакции
окисления
одного
моля
вещества газообразным кислородом при
p(O2)
= 1 бар. Теплота сгора-
ния,
если не оговорено особо, отвечает
окислению углерода до СО2,
водорода
до H2O(ж),
для остальных веществ в каждом случае
принято
указывать
образующиеся
продукты.
Из закона Гесса вытекают важные следствия,
которые позволяют рассчитывать энтальпии
химических реакций.
Следствие
1.
Стандартная энтальпия химической
реакции:
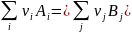 равна разности стандартных энтальпий
образования продуктов реакции и реагентов
(с учетом стехиометрических коэффициентов).
Следствие
2.
Стандартная энтальпия химической
реакции равна разности стандартных
энтальпий сгорания реагентов и продуктов
реакции. Большинство термохимических
данных в справочниках приведено при
температуре 298 К. Для расчета тепловых
эффектов при других температурах
использ. ур-ие Кирхгофа: d
rH/dT=
rCp
(дифференц. форма)
равна разности стандартных энтальпий
образования продуктов реакции и реагентов
(с учетом стехиометрических коэффициентов).
Следствие
2.
Стандартная энтальпия химической
реакции равна разности стандартных
энтальпий сгорания реагентов и продуктов
реакции. Большинство термохимических
данных в справочниках приведено при
температуре 298 К. Для расчета тепловых
эффектов при других температурах
использ. ур-ие Кирхгофа: d
rH/dT=
rCp
(дифференц. форма)
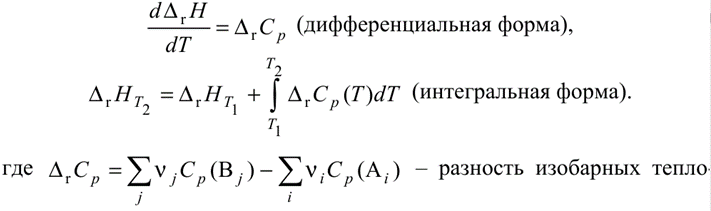 (интегральная
форма), где
(интегральная
форма), где
![]() разность изобарных теплоемкостей
продуктов р-ии и исходных в-в. Если
разница T2
– T1
невелика, то можно принять ∆rCp
= const. При
большой
разнице
температур
необход.
учитывать
температурн.
зависимость
ΔrCp(T).
В отличие от теплоемкостей участников
р-ии,
разность
ΔrCp(T)
может быть и +, и - . При
этом
изменение
ΔrH
с
температурой
определ.
видом
зависимости
ΔrCp(T)
Расчеты
абсолютных энтропий индивид. веществ
при разных Т и р:
Абсолютное
значение энтропии, полученное при
интегрировании
(4.2)
для обратимых процессов, известно с
точностью до постоянной
интегрирования
(S0):
разность изобарных теплоемкостей
продуктов р-ии и исходных в-в. Если
разница T2
– T1
невелика, то можно принять ∆rCp
= const. При
большой
разнице
температур
необход.
учитывать
температурн.
зависимость
ΔrCp(T).
В отличие от теплоемкостей участников
р-ии,
разность
ΔrCp(T)
может быть и +, и - . При
этом
изменение
ΔrH
с
температурой
определ.
видом
зависимости
ΔrCp(T)
Расчеты
абсолютных энтропий индивид. веществ
при разных Т и р:
Абсолютное
значение энтропии, полученное при
интегрировании
(4.2)
для обратимых процессов, известно с
точностью до постоянной
интегрирования
(S0):
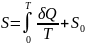 Значение
этой постоянной устанавливается третьим
законом термодинамики: При
нулевой абсолютной температуре энтропия
любых веществ, находящихся в равновесном
состоянии, имеет одно и то же значение,
не зависящее от фазового состояния
вещества. В изотермических процессах,
происходящих при T = 0, энтропия не зависит
ни от обобщенных сил, ни от обобщенных
координат. Так
как при 0 К энтропия всех веществ
одинакова, то конкретное значение S0
несущественно и его можно принять равным
нулю (постулат Планка): При
абсолютном нуле все идеальные кристаллы
имеют одинаковую
энтропию,
равную
нулю.
Постулат
Планка позволяет ввести понятие
абсолютной энтропии
вещества,
т.е. энтропии, отсчитанной от нулевого
значения при T=0.
Используя
понятие
абсолютной
энтропии,
следует
помнить,
что
вывод
о
постоянстве S0
относится лишь к полностью равновесным
при 0 К
системам.
На самом деле при понижении темпер.
уменьшаются
скорости
релаксационных процессов, и в веществе
может «замораживаться»
некоторая
остаточная
энтропия.
Статистическое
определение
энтропии
основано на идее о том, что необратимые
процессы в термодинамике вызваны
переходом системы в более вероятное
состояние, поэтому
энтропию
можно связать
с
вероятностью: S=k
lnW
где
k – постоянная Больцмана (k=R/NA), W-так
называемая термодинамическая вероятность,
т.е. число микросостояний, которые
соответствуют данному макросостоянию
системы. С увеличением количества
молекул и числа доступных уровней
энергии термодинамическая вероятность
резко увеличивается, так что для обычных
молекулярных систем при повышении
температуры и разупорядоченности
энтропия возрастает.
Нагревание
или
охлаждение
при
постоянном
давлении:
Количество
теплоты,
необходимое
для
изменения
температуры
системы,
выражают
с
помощью
теплоемкости:
δQобр=CрdT. ;
Значение
этой постоянной устанавливается третьим
законом термодинамики: При
нулевой абсолютной температуре энтропия
любых веществ, находящихся в равновесном
состоянии, имеет одно и то же значение,
не зависящее от фазового состояния
вещества. В изотермических процессах,
происходящих при T = 0, энтропия не зависит
ни от обобщенных сил, ни от обобщенных
координат. Так
как при 0 К энтропия всех веществ
одинакова, то конкретное значение S0
несущественно и его можно принять равным
нулю (постулат Планка): При
абсолютном нуле все идеальные кристаллы
имеют одинаковую
энтропию,
равную
нулю.
Постулат
Планка позволяет ввести понятие
абсолютной энтропии
вещества,
т.е. энтропии, отсчитанной от нулевого
значения при T=0.
Используя
понятие
абсолютной
энтропии,
следует
помнить,
что
вывод
о
постоянстве S0
относится лишь к полностью равновесным
при 0 К
системам.
На самом деле при понижении темпер.
уменьшаются
скорости
релаксационных процессов, и в веществе
может «замораживаться»
некоторая
остаточная
энтропия.
Статистическое
определение
энтропии
основано на идее о том, что необратимые
процессы в термодинамике вызваны
переходом системы в более вероятное
состояние, поэтому
энтропию
можно связать
с
вероятностью: S=k
lnW
где
k – постоянная Больцмана (k=R/NA), W-так
называемая термодинамическая вероятность,
т.е. число микросостояний, которые
соответствуют данному макросостоянию
системы. С увеличением количества
молекул и числа доступных уровней
энергии термодинамическая вероятность
резко увеличивается, так что для обычных
молекулярных систем при повышении
температуры и разупорядоченности
энтропия возрастает.
Нагревание
или
охлаждение
при
постоянном
давлении:
Количество
теплоты,
необходимое
для
изменения
температуры
системы,
выражают
с
помощью
теплоемкости:
δQобр=CрdT. ;
 Если
теплоемкость
не
зависит
от
температуры
в
интервале
от
T1
до
T2,
то
уравнение
можно
проинтегрировать:
Если
теплоемкость
не
зависит
от
температуры
в
интервале
от
T1
до
T2,
то
уравнение
можно
проинтегрировать:
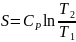 ; При более сложной температурной
зависимости теплоемкости в выражении
появляются дополнительные слагаемые.
Например, если теплоемкость описывается
рядом Cp=a+bT+c
/
T
=>
; При более сложной температурной
зависимости теплоемкости в выражении
появляются дополнительные слагаемые.
Например, если теплоемкость описывается
рядом Cp=a+bT+c
/
T
=>
 ;
Если
изменение температуры происходит при
постоянном объеме, то в формулах и Cр
надо заменить на CV.
;
Если
изменение температуры происходит при
постоянном объеме, то в формулах и Cр
надо заменить на CV.
