
6 семестр / Физическая химия 2-ая аттестация 6 семестр
.docxРа-ры в различных агрегатных состояниях. В зависимости от агрегатного состояния ра-р может быть газовым (то же, что смесь газов), жидким или твёрдым. Обычно, говоря о ра-ре, имеют в виду жидкий ра-р. Единицы концентрации. Концентрация — это отношение массы ра-ренного вещества к объему ра-ра (массовая концентрация) или отношение количества вещества к объему ра-ра (молярная концентрация). Единицами этих концентраций служат соответственно г/л и моль/л. Смеси идеальных газов и свойства идеальных газовых ра-ров. В идеальных газовых смесях количество компонента и его парциальное давление прямо пропорциональны друг другу, поэтому для установления вида зависимости химического потенциала от состава можно воспользоваться соотношением (6.11.б). Интегрируя уравнение (6.11.б) от pо = 1 бар до текущего значения парциального давления pi с учетом закона Амага (6.2) получаем:
 , (6.17.а)
, (6.17.а)
где
 – стандартный химический потенциал
i-го
газа, т.е. его потенциал в состоянии
чистого вещества при заданной температуре
и давлении 1 бар. Так как при выборе
уровня отсчета химического потенциала
газа давление фиксировано,
– стандартный химический потенциал
i-го
газа, т.е. его потенциал в состоянии
чистого вещества при заданной температуре
и давлении 1 бар. Так как при выборе
уровня отсчета химического потенциала
газа давление фиксировано,
 является функцией только температуры.
Выражение (6.17.а) с учетом закона Дальтона
преобразуется к виду
является функцией только температуры.
Выражение (6.17.а) с учетом закона Дальтона
преобразуется к виду
 , (6.17.б)
, (6.17.б)
где yi – мольная доля i-го вещества в газовой смеси, p – общее давление в системе.
Энтропия
и энергия Гиббса для смеси идеальных
газов. Энергия
Гиббса ра-ра – однородная функция
первой степени количеств веществ,
поэтому для фазы, содержащей К компонентов,
в соответствии с теоремой Эйлера ее
можно представить в виде суммы:
G= (6.28.а)
или для одного моля двухкомпонентного
ра-ра: Gm=(1-x)μA+xμB. (6.28.б)
Если воспользоваться выражением для
химического потенциала компонента
реального конденсированного ра-ра, то
мольная энергия Гиббса этой фазы
запишется следующим образом:
(6.28.а)
или для одного моля двухкомпонентного
ра-ра: Gm=(1-x)μA+xμB. (6.28.б)
Если воспользоваться выражением для
химического потенциала компонента
реального конденсированного ра-ра, то
мольная энергия Гиббса этой фазы
запишется следующим образом:
 .
.
После выполнения алгебраических преобразований приходим к выражению: (6.29)

в котором первая группа слагаемых в квадратных скобках представляет собой сумму стандартных хим. потенц. компонентов ра-ра, т.е., уровень отсчета свойств ра-ра.
Вторая сумма в квадратных скобках (6.29) соответствует энергии случайного распределению частиц в объеме фазы, что характерно для идеального ра-ра. В сумме первые две группы слагаемых (6.29) дают энергию Гиббса идеального ра-ра.
Энтропия — функция состояния, следовательно, ΔS = SII — SI, (3)
где SI -энтропия системы в начальном состоянии; SII - энтропия в конечном состоянии. Согласно первому закону термодинамики δQ = dU + δA , (4) где U — внутренняя энергия системы, δA-работа процесса. Для идеальных газов справедливы уравнения: piVi = niRTi, (5) δA = pdV, (6) (∂U/∂V)(T=const) = 0, (7) где pi -давление, Vi -объем, Ti -температура, R-универсальная газовая постоянная, ni -число молей i-го газа.
Различные выражения для химических потенциалов в смеси идеальных газов.
В
симметричной
системе сравнения
за уровень отсчета принимают свойства
чистых компонентов при заданной
температуре и давлении 1 бар. Оба
компонента равноправны, так что деление
на ра-ритель и ра-ренное вещество можно
считать условным. Стандартные значения
химических потенциалов равны мольным
энергиям Гиббса чистых компонентов.
Для всех компонентов ра-ра

 i→1
при хi→1,
ai→xi.
При таком способе нормировки коэффициент
активности ра-рителя в разбавленном
ра-ре стремится к единице, в то время
как коэффициент активности ра-ренного
вещества стремится к постоянному
значению g¥,
которое может изменяться в широких
пределах (до нескольких порядков).
i→1
при хi→1,
ai→xi.
При таком способе нормировки коэффициент
активности ра-рителя в разбавленном
ра-ре стремится к единице, в то время
как коэффициент активности ра-ренного
вещества стремится к постоянному
значению g¥,
которое может изменяться в широких
пределах (до нескольких порядков).
В
асимметрической система сравнения
компоненты неравноправны, только один
из них выступает в качестве ра-рителя.
Такой
способ нормировки используют при
рассмотрении ра-ров твердых или
газообразных веществ в жидких ра-рителях.
Принимают, что коэффициент активности
стремится к единице для ра-рителя вблизи
чистого вещества и для ра-ренного
компонента – в бесконечно разбавленном
ра-ре. В этом случае химические потенциалы
ра-рителя А и ра-ренного вещества В в
бинарном ра-ре записывают в виде:
 (6.35.а)
gA
®
1 при xA
®
1, aA®
xA,
(6.35.а)
gA
®
1 при xA
®
1, aA®
xA,
 (6.35.б)
g*В
®
1 при xВ
®
0, aВ®
xВ.
(6.35.б)
g*В
®
1 при xВ
®
0, aВ®
xВ.
Абсолютные значения химического потенциала определяются природой вещества, температурой, давлением, поэтому они не зависят от выбора системы сравнения, типа концентрационной шкалы и одинаковы при любой нормировке:
 .
.
Это
позволяет выразить друг через друга
стандартные химические потенциалы и
коэффициенты активности ра-ренного
вещества в разных системах сравнения:
 (6.36.а),
(6.36.а),
 .
.
Общее определение идеальных ра-ров в любых агрегатных состояниях. Идеальными ра-рами называют ра-ры, в которых предполагается отсутствие взаимодействий между частицами составляющих веществ, а химический потенциал каждого компонента имеет простую зависимость от концентрации. Это ра-р с термодинамическими свойствами аналогичными смеси идеальных газов. Для идеальных ра-ров энтальпия (энергия, доступная для преобразования в теплоту при определённом постоянном давлении) смешения и изменения объёма при смешении равны нулю, энтропия смешения определяется так же, как и для идеальных газов. Для идеальных ра-ров выполняются законы Рауля и Генри. Идеальные ра-ры делятся на предельно разбавленные и совершенные. Коллигативные свойства ра-ров. Свойства разбавленных ра-ров, зависящие только от количества ра-ренного вещества, называют коллигативными свойствами. К ним относятся: понижение давления пара ра-рителя над ра-ром, повышение температуры кипения и понижение температуры замерзания ра-ра, а также осмотическое давление.
Понижение температуры замерзания и повышение температуры ки- пения ра-ра по сравнению с чистым ра-рителем описывается формулами:
 где
m2
-моляльность ра-ра, KК
и KЭ
-криоскопическая и эбулиоскопическая
постоянные ра-рителя, x2-мольная доля
ра-ренного вещества, ΔплH
и ΔиспH-энтальпии
плавления и испарения ра-рителя, Tпл
и Tкип-температуры
плавления и кипения ра-рителя, M1-
молярная масса ра-рителя.
где
m2
-моляльность ра-ра, KК
и KЭ
-криоскопическая и эбулиоскопическая
постоянные ра-рителя, x2-мольная доля
ра-ренного вещества, ΔплH
и ΔиспH-энтальпии
плавления и испарения ра-рителя, Tпл
и Tкип-температуры
плавления и кипения ра-рителя, M1-
молярная масса ра-рителя.
Осмотическое давление ᴨ в разбавленных ра-рах можно рассчитать по ур.:
![]() где
a1-активность
ра-рителя (~ x1),
x2-мольная
доля ра-ренного вещества, V1-мольный
объем ра-рителя. В разбавленных ра-рах
это выражение преобразуется в уравнение
Вант-Гоффа: ᴨ=cRT,
где с-молярность ра-ра.
где
a1-активность
ра-рителя (~ x1),
x2-мольная
доля ра-ренного вещества, V1-мольный
объем ра-рителя. В разбавленных ра-рах
это выражение преобразуется в уравнение
Вант-Гоффа: ᴨ=cRT,
где с-молярность ра-ра.
Неидеальные ра-ры и их термодинамическое описание. Неидеальными называются ра-ры, которые не подчиняются законам идеальных и предельно разбавленных ра-ров.
Для представления концентрационной зависимости химического потенциала i-го компонента реального ра-ра используют тот же искусственный прием, как и в случае реальных газов: вместо концентрации вводят понятие активности (аi):
 (6.26)
Активность ai-безразмерная
величина, которая может быть представлена
в виде произведения мольной доли xi
компонента на его коэффициент активности
i:
ai
= ixi.(6.27.а)
Если активность выражать через другие
концентрации, соответственно, будет
изменяться и значение коэффициента
активности :
a
= xx
= cc
= mm.
(6.27.б)
(6.26)
Активность ai-безразмерная
величина, которая может быть представлена
в виде произведения мольной доли xi
компонента на его коэффициент активности
i:
ai
= ixi.(6.27.а)
Если активность выражать через другие
концентрации, соответственно, будет
изменяться и значение коэффициента
активности :
a
= xx
= cc
= mm.
(6.27.б)
Коэффициенты
активности-также
безразмерные величины, они характеризуют
работу, которую надо совершить при
перемещении i-го
компонента из идеального ра-ра в реальный
при постоянной температуре, давлении
и концентрации. Для того, чтобы в
уравнении (6.27) не возникало проблем с
размерностями, при расчетах следует
использовать приведенные (безразмерные)
концентрации, т.е. отнесенные к
соответствующей единичной концентрации,
например, 1 мольл-1
(с0)
или 1 молькг-1
(mo)2.
В
общем случае мольная энергия Гиббса
неидеального бинарного ра-ра может
быть представлена в виде суммы:
![]() =
=
Метод активностей Льюиса. Льюис ввел понятие о средних ионных величинах: активности, коэффициенте активности и моляльности, относящихся к электролиту в целом. Средние величины им определены как среднегеометрические.
Чтобы при описании реальных смесей сохранить простую математическую форму, которую имеют термодинамические зависимости для идеального газа, Г.Н. Льюис предложил вместо парциального давления использовать летучесть (или фугитивность) fi: μi(T,p)=μi0(T)+RTln(fi/p0=1).
Вычисление коэффициентов активностей по давлению пара компонентов ра-ра, по данным криоскопии и осмотическому давлению для ра-ров неэлектролитов.
Для
описания свойств реальных ра-ров
вводится понятие активности.
Активность ai выражается
в виде произведения мольной
доли Xi компонента
на его коэффициент
активности
![]() i:
ai =
iXi.
i:
ai =
iXi.
Коэффициенты
активности ра-рителя можно рассчитать
на основании отклонений от закона
Рауля:
i=
Pi/XiPi0 .
При Xi ![]() 1
i
1,
то есть ai
Xi.
1
i
1,
то есть ai
Xi.
Коэффициенты активности ра-ренного вещества можно рассчитать на основании отклонений от закона Генри: i = Pi/XiKi. При Xi 0 i 1, то есть ai Xi.
Осмотический коэффициент ра-рителя и его опытное определение.
Осмотический коэф. непосредственно связан с коэф. активности ра-ра и явл., наряду с последним, важным т/д параметром. Осмотический коэф., характеризуя изменение активности ра-рителя, выражает способность электролита связывать воду с учетом всех его индивидуальных св-в. Активность компонента ai связана с его хим. потенциалом μi в ра-ре: μi= μi0+RTln ai .ai=γici, где γ-рациональный коэф. активности; μi0-хим. потенциал i-того компонента при ai=1.
Стандартные состояния для хим потенциала
Хим потенциал представляет собой частную производную термодинамических потенциалов по количеству i-го компонента при фиксированных естественных переменных:
 (6.16)
(6.16)
т.е. он показывает, насколько изменяется соответствующий термодинамический потенциал при добавлении бесконечно малого количества i-го компонента к 1 молю ра-ра.
Для того чтобы можно было использовать химический потенциал при решении практических задач, необходимо установить вид его зависимости от измеримых термодинамических переменных – температуры, давления и состава. Химический потенциал – парциальная мольная энергия Гиббса, формулы, справедливые для функции G, можно использовать и для функции i, дифференцируя соответствующие зависимости по количеству i-го компонента (см., например, (6.11.а) и (6.11.б)).
В идеальных газовых смесях количество компонента и его парциальное давление прямо пропорциональны друг другу, поэтому для установления вида зависимости химического потенциала от состава можно воспользоваться соотношением (6.11.б). Интегрируя уравнение (6.11.б) от pо = 1 бар до текущего значения парциального давления pi с учетом закона Амага (6.2) получаем:
,(6.17.а) где - стандартный химический потенциал i-го газа, т.е. его потенциал в состоянии чистого вещества при заданной температуре и давлении 1 бар. Так как при выборе уровня отсчета химического потенциала газа давление фиксировано, является функцией только температуры. Выражение (6.17.а) с учетом закона Дальтона преобразуется к виду
,(6.17.б) где yi – мольная доля i-го вещества в газовой смеси, p – общее давление в системе. Реальные газовые смеси. Рассуждения, проведенные выше, можно было бы попытаться распространить и на случай реальных газов, воспользовавшись, например, вириальным ур-ем состояния:

При этом придется прибегнуть к ряду допущений, так как для реальных газов, вообще говоря, условия аддитивности (6.1) и (6.2) не выполняются. Чтобы при описании реальных смесей сохранить простую математическую форму, которую имеют термодинамические зависимости для идеального газа, Г.Н. Льюис предложил вместо парциального давления использовать летучесть (или фугитивность) fi:
 .(6.18)
Стандартные сост. реального и идеального
газа совпадают, поэтому в ур-ях (6.17) и
(6.18) фигурирует одно и то же слагаемое
.
.(6.18)
Стандартные сост. реального и идеального
газа совпадают, поэтому в ур-ях (6.17) и
(6.18) фигурирует одно и то же слагаемое
.
Симметричная и нессиметричная системы отсчета. Так как фазовые состояния компонентов и ра-ра могут различаться, при термодинамическом описании ра-ров принято использовать две системы нормировки свойств – симметричную и асимметричную. В симметричной системе сравнения за уровень отсчета принимают свойства чистых компонентов при заданной температуре и давлении 1 бар. Оба компонента равноправны, так что деление на ра-ритель и ра-ренное вещество можно считать условным. Стандартные значения химических потенциалов равны мольным энергиям Гиббса чистых компонентов. Для всех компонентов ра-ра
,(6.34) gi ® 1 при xi ® 1, ai ® xi . При таком способе нормировки коэффициент активности ра-рителя в разбавленном ра-ре стремится к единице, в то время как коэффициент активности ра-ренного вещества стремится к постоянному значению g¥, которое может изменяться в широких пределах (до нескольких порядков). Коэффициенты активности ра-ренного вещества при бесконечном разведении отражают особенности межмолекулярных взаимодействий в ра-ре; чем больше значение g¥, тем уже область, в которой выполняется закон Генри. Симметричную систему сравнения используют при описании газовых смесей, ра-ров жидких компонентов и твердых ра-ров. В последнем случае кристаллографические структуры компонентов и ра-ров не всегда совпадают, но их свойства, как правило, можно привести к одному уровню с помощью упомянутых выше параметров стабильности, т.е. разностей энергий Гиббса двух кристаллических модификаций вещества.
В асимметричной системе сравнения компоненты неравноправны, только один из них выступает в качестве ра-рителя. Такой способ нормировки используют при рассмотрении ра-ров твердых или газообразных веществ в жидких ра-рителях. Принимают, что коэффициент активности стремится к единице для ра-рителя вблизи чистого вещества и для ра-ренного компонента – в бесконечно разбавленном ра-ре. В этом случае химические потенциалы ра-рителя А и ра-ренного вещества В бинарном ра-ре записывают в виде: ,(6.35.а) gA ® 1 при xA ® 1, aA® xA,
,(6.35.б)
g*В
®
1 при xВ
®
0, aВ®
xВ.
В отличие от симметричной системы
сравнения, стандартный хим. потенциал
ра-ренного вещества
 представляет собой хим. потенциал
компонента в гипотетической системе,
образованной молекулами В, в которой
частицы в среднем находятся в том же
энергетическом состоянии, что и в ра-ре,
бесконечно разбавленном по компоненту
В.
Функции
смешения.это
изменение термодинамических функций Е при
образовании ра-ра из чистых компонентов.
Принято рассматривать процесс смешения,
когда все компоненты находятся в
одинаковом агрегатном состоянии, при
одной и той же температуре, и одинаковом
давлении.
В
обозначении этой функции присутствует
оператор
представляет собой хим. потенциал
компонента в гипотетической системе,
образованной молекулами В, в которой
частицы в среднем находятся в том же
энергетическом состоянии, что и в ра-ре,
бесконечно разбавленном по компоненту
В.
Функции
смешения.это
изменение термодинамических функций Е при
образовании ра-ра из чистых компонентов.
Принято рассматривать процесс смешения,
когда все компоненты находятся в
одинаковом агрегатном состоянии, при
одной и той же температуре, и одинаковом
давлении.
В
обозначении этой функции присутствует
оператор ![]() и
верхний индексm от
англ. mix.
Известны парциальные мольные функции
смешения (Δekm),
мольные функции смешения (Δem)
и полные (или интегральные) функции
смешения (
и
верхний индексm от
англ. mix.
Известны парциальные мольные функции
смешения (Δekm),
мольные функции смешения (Δem)
и полные (или интегральные) функции
смешения (![]() ).
Между ними существуют те же соотношения,
что и между парциальными мольными
свойствами компонентов, мольными и
полными свойствами ра-ра.
).
Между ними существуют те же соотношения,
что и между парциальными мольными
свойствами компонентов, мольными и
полными свойствами ра-ра.
Рассмотрение этих соотношений удобно начать с парциальной мольной функции смешения, записанной для любого экстенсивного свойства E: Δekm=ek-ek0 (37)
где Δekm -парциальная мольная функция смешения компонента k; ek -парциальное мольное свойство компонента k в ра-ре; ek0мольное свойство чистого вещества k.
Мольная
функция смешения будет равна Δem=ΔEm/n=
![]() .
(38) Полная функция смешения найдется
из соотношения ΔEm=nΔem=
.
(38) Полная функция смешения найдется
из соотношения ΔEm=nΔem=![]() .
(39) Запишем некоторые функции смешения.
Начнем с химического потенциала смешения
(или парциальной мольной функции Гиббса
смешения), причем запишем ее для реального
ра-ра в
симметричной системе сравнения на
основе идеального совершенного ра-ра.
Подстановка (32) в (38) дает следующее
выражение для парциальной мольной
функции Гиббса смешения:
.
(39) Запишем некоторые функции смешения.
Начнем с химического потенциала смешения
(или парциальной мольной функции Гиббса
смешения), причем запишем ее для реального
ра-ра в
симметричной системе сравнения на
основе идеального совершенного ра-ра.
Подстановка (32) в (38) дает следующее
выражение для парциальной мольной
функции Гиббса смешения:
![]() .
(40)
.
(40)
Опираясь на выражение (40), легко получить соотношения для остальных термодинамических функций. Остановимся только на энтропии, объеме и энтальпии смешения.
 ,
(41)
Δυ
,
(41)
Δυ ,
(42)
,
(42)
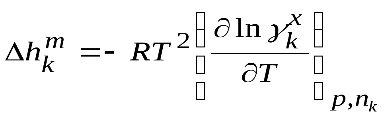 .
(43)
.
(43)
Если реальный ра-р близок к идеальному, т.е. имеем идеальный совершенный ра-р, в котором k0 равен 1, то соотношения (41) - (44) , характериз. ф-ии смешения идеального ра-ра, преобраз. к виду: Δμkm=RTlnNk , (44) ΔSkm=-RlnNk, (45) ΔUkm=0, Δhkm=0 (46)
+Отсюда следует вывод, что образование идеальных ра-ров происходит без тепловых эффектов, без изменения объема (расширения или сжатия). Этот процесс самопроизволен, так как изменение энергии Гиббса при образовании идеального ра-ра отрицательно. Действительно мольная доля компонента k изменяется при образовании ра-ра, уменьшаясь от единицы до какого-то значения. Значит, логарифм будет отрицательный и функция Гиббса смешения тоже отрицательна. А в условиях постоянства температуры и давления именно функция Гиббса, а точнее, ее изменение является критерием самопроизвольности протекания процесса.
Мольная функция Гиббса смешения идеального ра-ра может быть найдена:
![]() .
(47) Полная функция Гиббса смешения
рассчитывается по формуле:
ΔGm=nΔgm
.
(47) Полная функция Гиббса смешения
рассчитывается по формуле:
ΔGm=nΔgm![]() . (48)
. (48)
Избыточные
функции: Т/д
св-ва неидеального ра-ра принято
характеризовать избыточными т/д
фу-циями, которые представляют собой
разность между фу-циями смешения данного
ра-ра и идеального. Избыточные фу-ции
обозначают символом AE.
По отдельности AE
=
ΔAm
– ΔAmид
(A=U,H,G,F,S,V
и т.д.). Для индивидуальных ве-в (чистых
компонентов) все фу-ции смешения равны
нулю и, соответственно, AE
=
0. Для реального ра-ра любой природы
имеем:HE=ΔHm;VE=ΔVm;
SE=ΔSm+R
![]() μEi=Δμmi-RTlnxi.
Зависимость
коэффициентов активности от температуры
и давления.
μEi=Δμmi-RTlnxi.
Зависимость
коэффициентов активности от температуры
и давления.
Если пар вещества ведет себя как идеальный газ, то активность можно определить через экспериментально измеряемые величины: ai=pi /pis где pi -давление насыщенного пара i-го компонента над ра-ром, ps -давление насыщенного пара чистого i-го вещества при той же температуре T и в том же фазовом состоянии, что и ра-р.
В
общем случае зависимость коэф. активности
от состава, t и p имеет вид:
![]() где GE
– избыточная свободная энергия Гиббс
где GE
– избыточная свободная энергия Гиббс
Термодинамическая классификация ра-ров. Ра-ры, в которых энергия взаимодействия между всеми компонентами предполагается одинаковой, называются идеальными ра-рами. Ра-ры, в которых частицы ра-ренных веществ окружены молекулами ра-рителя и для которых энергия взаимодействия между собой намного меньше энергии взаимодействия с молекулами ра-рителя, называются разбавленными ра-рами. Природные ра-ры в основной своей массе-это разбавленные ра-ры. Ра-ры, в которых энергия взаимодействия между частицами ра-ренных веществ сравнима или превышает энергию взаимодействия с молекулами ра-рителя, называются реальными ра-рами. Атермальные, регулярные, строго регулярные ра-ры и их свойства. Для атермальных ра-ров теплота смешения равна нулю, но имеется избыточная энтропия смешения. Коэффициенты активности компонентов от температуры не зависят: lnγ1=(x2g01)/R, lnγ2=((1-x)2g01)/R). Регулярные и атермальные ра-ры традиционно принято выделять особо как наиболее простые классы неидеальных ра-ров. Для регулярных ра-ров энтропия смешения совпадает с энтропией смешения идеального ра-ра, а единственной причиной отклонения от идеальности является наличие теплоты смешения. Коэффициенты активности зависят от температуры: lnγ1=(x2g00)/RT, lnγ2=((1-x)2g00)/RT)
Строго
регулярные ра-ры
Предельно-разбавленные
ра-ры. В
реальных предельно разбавленных ра-рах
для ра-рителя выполняется закон Рауля,
а для ра-ренного вещества-закон Генри:
PB
= KГ,BxB,
(6.5) где KГ,B
– константа Генри ([Па, бар, атм]). В
идеальных ра-рах закон Генри совпадает
с законом Рауля ( ).
В реальных ра-рах могут наблюдаться
различные отклонения от закона Рауля
(рис. 6.1).
).
В реальных ра-рах могут наблюдаться
различные отклонения от закона Рауля
(рис. 6.1).
Р ис.
6.1.
Изотермы давления пара в системе с
положительными (I)
и знакопеременными (II)
отклонениями от закона Рауля.Области
выполнения законов Рауля и Генри для
реальных систем зависят от того,
насколько сильно отличаются св-ва
реального ра-ра от идеального. О границах
применимости з-на Генри обычно судят
по значениям коэффиц. активности при
предельном разбавлен. ()
ис.
6.1.
Изотермы давления пара в системе с
положительными (I)
и знакопеременными (II)
отклонениями от закона Рауля.Области
выполнения законов Рауля и Генри для
реальных систем зависят от того,
насколько сильно отличаются св-ва
реального ра-ра от идеального. О границах
применимости з-на Генри обычно судят
по значениям коэффиц. активности при
предельном разбавлен. ()
Уравнение
Гиббса-Дюгема. Несложно
показать, что уравнение Гиббса-Дюгема
можно вывести не только для функции
U(S,V,n).
Сравним полные дифференциалы функции
Z(T,
p,
n)
в общем виде и записанные через
парциальные мольные свойства
 :
:
 (6.12.а)
(6.12.а)
 .(6.12.б)
.(6.12.б)
Из равенства левых частей уравнений (6.12.а) и (6.12.б) следует
 .(6.13.а)
.(6.13.а)
Последнее
ур-ие представляет собой запись ур-ия
Гиббса-Дюгема в наиболее общем виде.
Если принять, что Z
= G,
то придем к уравнению (4.13): .
При
p,
T
= const,
это уравнение переходит в
.
При
p,
T
= const,
это уравнение переходит в
 .(6.13.б)
Уравнение
Гиббса-Дюгема широко используется в
практике термодинамических расчетов.
С его помощью по известной зависимости
от состава парциальной мольной величины
одного компонента можно рассчитывать
парциальные величины других компонентов
и далее – общие (интегральные) свойства
фазы.
.(6.13.б)
Уравнение
Гиббса-Дюгема широко используется в
практике термодинамических расчетов.
С его помощью по известной зависимости
от состава парциальной мольной величины
одного компонента можно рассчитывать
парциальные величины других компонентов
и далее – общие (интегральные) свойства
фазы.
Взаимосвязи парциальных мольных величин, вытекающие из ур. Гиббса-Дюгема.
Изменения
парциальных молярных величин при
изменении состояния системы связаны
между собой Гиббса-Дюгема
уравнением, которое в обобщенном
виде записывается след. образом:
 При Т, p = const (изотермо-изобарные условия)
При Т, p = const (изотермо-изобарные условия)
 Согласно этому ур-нию, в бинарной системе
парциальные молярные величины M1 и
M2 при изменении состава изменяются
в противоположных направлениях.
Экстремумы на кривых M1(x1) и M2(x1), если
таковые имеются, наблюдаются при одном
и том же составе и противоположны по
типу. Напр., для хим. потенциалов
Согласно этому ур-нию, в бинарной системе
парциальные молярные величины M1 и
M2 при изменении состава изменяются
в противоположных направлениях.
Экстремумы на кривых M1(x1) и M2(x1), если
таковые имеются, наблюдаются при одном
и том же составе и противоположны по
типу. Напр., для хим. потенциалов При
T, p = const
При
T, p = const
Это соотношение служит для расчета хим. потенциала компонента р-ра на основании концентрац. зависимости хим. потенциалов остальных компонентов, а также используется для проверки на термодинамич. согласованность эксперим. данных о зависимостях хим. потенциалов от состава, т-ры и т.п. Понятие парциальных молярных величин широко используют при рассмотрении хим. и фазовых равновесий.
Правило фаз Гиббса: число степеней свобод (С) равновесной т/д системы, на которую влияют только t и p, равно числу независимых компонентов (К) системы минус число фаз (Ф) плюс два.Рассмотрим закрытую систему, состоящую из К компонентов, каждый из которых может находиться в Ф фазах. Определим число степеней свободы системы, С, как число переменных, которые можно варьировать не изменяя фазового состояния системы. Оно равно разности между общим количеством переменных, описывающих состояние системы, и числом уравнений, связывающих эти переменные.
Состояние
системы определено, если заданы
количества компонентов и параметры,
характеризующие силовые (термический,
механический и т.п.) контакты системы
с окружением. Число таких контактов
(обозначим их через m) равно числу
слагаемых Pjdxj
в правой части уравнения В каждой фазе независимыми являются
(K – 1) концентраций компонентов (поскольку
сумма мольных долей компонентов в
каждой фазе равна единице). Если число
фаз равно Ф, то общее число переменных,
необходимых для полного описания
состояния системы, составляет
В каждой фазе независимыми являются
(K – 1) концентраций компонентов (поскольку
сумма мольных долей компонентов в
каждой фазе равна единице). Если число
фаз равно Ф, то общее число переменных,
необходимых для полного описания
состояния системы, составляет
