
ПУТИ ОБМЕНА АММИАКА. БИОСИНТЕЗ МОЧЕВИНЫ. (ОРНИТИНОВЫЙ ЦИКЛ)
..docxТЕМА : АЗОТИСТЫЙ ОБМЕН
Лекция 4
ПУТИ ОБМЕНА АММИАКА. БИОСИНТЕЗ МОЧЕВИНЫ. (ОРНИТИНОВЫЙ ЦИКЛ).
Обмен аммиака, источники аммиака в организме
Источники аммиака: 1) катаболизм аминокислот; 2) распад биогенных аминов, нуклеотидов; 3) гниение белков в кишечнике под действием микрофлоры, откуда он частично всасывается в воротную вену. Концентрация аммиака в крови очень мала, так как он быстро всасывается в клетках с образованием нетоксичных продуктов. Содержание аммиака в норме составляет 0,4-0,7 мг/л.
Выведение аммиака. Выводится почками в виде конечных продуктов азотистого обмена: мочевины (синтезируется в печени) и аммонийные соли (образуются в почках).
Основной реакцией обезвреживания аммиака во всех тканях является синтез глутамина под действием глутаминсинтетазы.
Глутамин является транспортной формой аммиака и азота – нейтральной аминокислотой, способной к облегченной диффузии. Амидная группа
глутамина используется для синтеза аспаргина, глюкозоамина, таким образом азот аммиака включается в структурно-функциональные компоненты клетки.
В кишечнике и мышцах глутамин под действием глутаминазы расщепляется на аммиак и глутамат, котороый с помощью аланинаминотрасферазы превращается в алаланин, который также является транспортной формой аммиака и азота.
В нервной системе
Обезвреживание аммиака происходит путем синтеза аспарагина и глутамина, который легко проходит через гематоэнцефалический барьер и с кровью доставляется с почки.
Обезвреживание аммиака мышцах, печени
Глутамин с помощью глутаминазы дезаминируется с образованием NH3 и глутамата. Образовавшийся глутамат с помощью аланинминотрансферазы (АЛАТ) превращается в аланин.
Образование аммиака в почках
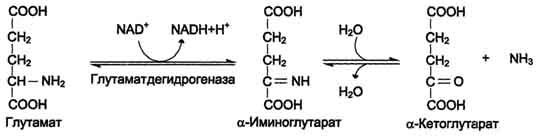
Аммиак в почках образуется главным образом из глутамина при действии глутаминазы и глутаматдегидрогена, образующийся при этом α-кетоглутарат используется как источник энергии.
В тканях аммиак находится в виде иона аммония в равновесии м неионизированным аммиаком: NH4+↔NH3+H+. Для иона аммония мембрана непроницаема
Обезвреживание аммиака в печени
Из NH3+CO2 образуется карбамоилфосфат, который включается в орнитиновый цикл Гензелейта (синтез мочевины)
Синтез мочевины. Орнитиновый цикл. Функции орнитинового цикла
В печени выполняет две функции: превращение азота аминокислот в мочевину, которая выводится из организма, помогая избежать накопление токсичного аммиака; синтез аргинина, из которого образуется мочевина
Основным механизмом обезвреживания аммиака в организме является биосинтез мочевины. Последняя выводится с мочой в качестве главного конечного продукта белкового (соответственно аминокислотного) обмена. На долю мочевины приходится до 80-85% от всего азота мочи. Впервые Г. Кребс и К. Гензелейт в 1932 г. вывели уравнение реакции синтеза мочевины, которые представлены в виде цикла, получив в литературе название орнитинивого цикла мочевинообразоавния Кребса. Следует указать, что в биохимии эта была первая циклическая система метаболизма, описание которой почти на 5 лет опередило открытие Г. Кребсом другого метаболического процесса-цикла трикарбоновых кислот. Благодаря исследования Г. Коена, С. Ратнер и сотр. были уточнены промежуточные этапы и ферментные системы, катализирующие образование мочевины.
Весь цикл мочевинообразования может быть представлен следующим образом. На 1-м этапе синтезируется макроэргическое соединение карбомоилфосфат – это метаболически активная форма аммиака, используемая в качестве исходного продукта для синтеза пиримидиновых нуклеотидов. Фермент – аммиакзависимая карбамоилфосфатсинтетаза:
пиримидин←карбамоилфосфат→аргинин→мочевина ↓ ↓ ↓ ДНК РНК белки
Реакция требует затрату 2 АТФ, происходит в митохондриях клеток печени. В качестве активного стимулирующего аллостерического эффектора действует N-ацетилглутамат.
На 2-м этапе цикла мочевинообразования происходит кондесанция карбамоилфосфата и орнитина с образованием цитруллина; реакцию катализирует орнитин-карабамоилфосфатрансфераза.
На 3-м этапе цитруллин превращается в аргинин в результате двух последовательно протекающих реакций. Первая из них– это энергозависимая конденсация цитуллина и аспарагиновой кислоты с образованием аргининосукцината (эту реакцию катализирует аргининосукцинатсинтетаза). Вторая из них – аргининсукцинат распадается на аргинин и фумарат при участии другого фермента – аргининсукцинатлиазы.
На 4-м этапе аргинин под действием аргиназы расщепляется на мочевину и орнитин, который вступает в новый оборот цикла, соединяясь с карбамоил-фосфатом, образуя цитруллин.
Необходимо подчеркнуть, что аргиназа содержится в печени тех животных, которые экскретируют с мочой мочевину как основной и конечный продукт азотистого обмена. В печени птиц, например, аргиназа отсутствует, поскольку птицы вместо мочевины выделяют мочевую кислоту.
Суммарная реакция синтеза мочевины без учета всех промежуточных продуктов может быть в следующем виде:
CO2+NH3+2АТФ+2H2O+аспартат→мочевина+2АДФ+АМФ+фумарат+
+2Н3РО4+Н4P2О7
Данная реакция сопровождается снижением свободной энергии (ΔG=-40кДж), поэтому процесс всегда протекает в направлении синтеза мочевины. Следует указать, что синтез мочевины энергетически дорого обходится организму. На синтез одной молекулы мочевины затрачивается четыре высокоэнергетических фосфатных группы: две молекулы АТФ расходуются на синтез карабамоилфосфата и одна – на образование аргининоянтарной кислоты, при этом АТФ расщепляется на АМФ и который при гидролизе также образует две молекулы Н3РО4.
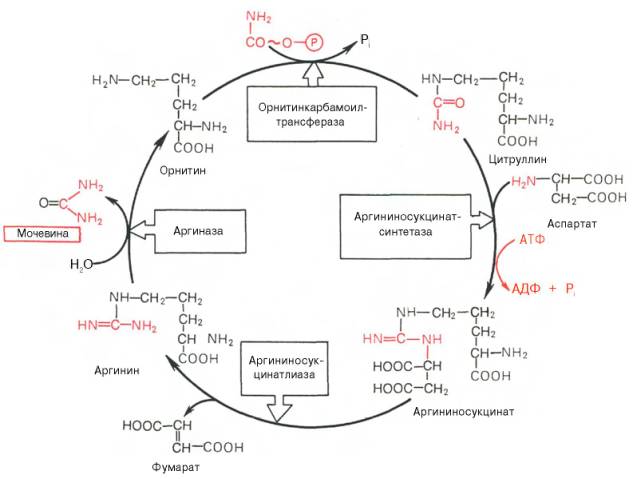
Орнтитиновый цикл синтеза мочевины в печени (цикл Гензелейта)
Связь орнитинового цикла с ЦТК.
Источникоми аспартата для орнитинового цикла является фумарат, который последовательно в реакциях ЦТК превращающается сначала в малат (фермент - фумараза), а затем в ОАА (фермент – малат-ДГ) с последующим трансаминированием в аспартат.
В процессе эволюции живые организмы выработали различные типы азотистого обмена. Это аммонителический тип, при котором главным конечным продуктом азотистого обмена является аммиак; он свойствен преимущественно рыбам. При уретелическом типе обмена основным конечным продуктом обмена белков является мочевина; такой тип характерен для человека и животных. Урикотетический тип характерен для птиц рептилий; главным конечным продуктом данного типа обмена является мочевая кислота.
Гипераммониемия и её причины
Аммиак превращается в мочевину в печени, поэтому при заболеваниях печени или наследственных дефектах ферментов обезвреживания аммиака наблюдается повышение содержания аммиака в крови (гипераммониемия), которая оакзывет токсическое действие на организм.
Гипераммониемия сопровождается следующими симптомами:
-тошнота, рвота
-головокружение, судороги
-потеря сознания, отек мозга
Эти симптомы связаны с действием аммиака на центральную нервную систему и прежде всего на головной мозг Механизмы токсического действия аммиака:
1) аммиак вызывает снижение содержания α-кетоглутарата, т.к. сдвигает реакцию, катализирующуюся глутаматдегидрогеназой (ГЛЮ-ДГ) в сторону образования глутамата. Этот процесс сопровождается угнетением ЦТК и реакций трансаминирования;
2) высокие концентрации аммиака вызывают синтез глутамина из глутамата в нервной ткани:
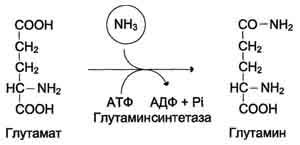
Снижение концентрации глутамата подавляет обмен аминокислот и синтез нейромедиаторов (ГАМК) – основного тормозного медиатора
При этом нарушается проведение нервного импульса, наблюдаются судороги. Накопление глутамина в нервных клетках повышает осмотическое давление, и может вызвать отек мозга.
В крови и цитозоле аммиак превращается в ион NH4+, накопление которого нарушает трансмембранный перенос одновалентных катионов Na+ и K+, что также влияет на проведение нервных импульсов.
Известно пять наследственных заболеваний, обусловленных дефектом ферментов орнитинового цикла. Нарушения этого цикла наблюдается при вирусных заболеваниях, так например, вирус гриппа подавляет синтез карбамоилфосфатсинтетазы-1.
Нарушения орнитинового цикла приводят к значительному повышению в крови концентрации: аммиака, глутамина, аланина.
Основным диагностическим признаком служит повышение концентрации аммиака в крови. Диагностика производится путем определения: содержания аммиака в крови, метаболитов орнитинового цикла в крови и моче, активности фермента в биоптатах печени.
Уровень аммиака может повышаться после белковой нагрузки.
Для снижения концентрации аммиака целесообразна малобелковая диета, а также использовать метаболическую коррекцию нарушений орнитинового цикла путём выведения аргинина, цитруллина , глутамата для выведения аммиака в обход нарушенных реакций, например, в составе фенилацетилглутамина и гиппуриновой кислоты.
Количественные характеристики обмена аминокислот.
Количество аммиака в сыворотке крови 25-40 мкмоль/л
Концентрация мочевины в сыворотке крови 2,5-8,4 мкммоль/л
Суточное выведение мочевины ~ 25 г/сутки
Содержание креатинина от 50-175 мкмоль/л в плазме крови
Клиническое значение определения показателей метаболома и активности ферментов в биологических жидкостях.
1.Определение активности γ-глутамилтрансферазы в плазме крови.
Данные определения используется для оценки степени повреждения гепатоцитов, клеток мозга, кишечника.
2.Определение оксидаз аминокислот ;по данным определения ферментов можно судить о нехарактерных для макроорганизма D-аминокислот, попавших с вирусами, бактериями и опухолевыми клетками.
3.Определение активности гистидазы целесообразно при поражениях печени, т.к. в норме ферменты отсутствуют в плазме крови.
4.Определяют трансаминазы для оценки состояния печени и миокарда
Соотношение АСГ/АЛГ (коэфф. Де Ритиса) =1,33. При заболеваниях печени резко уменьшается коэффициент АСТ/АЛТ <0,6 при инфаркте миокарда отношение АСТ/АЛГ>2.
5. При длительном голодании актвируется распад альбумина и тканевых белков.
Регистрация роста активности глутаматдегидрогеназы свидетельствует о накоплении свободных аминокислот, которые вступают в реакцию окислительного дезаминирования.
6.Определние активности карбомоилфосфатсинтетазы, орнитинкарбомоилтрансферазы и аргиназы: определяют для выявления нарушения синтеза мочевины. Снижение их активности при гепатите или циррозе печени сопровождается накоплением аммиака в тканях и плазме крови.
7.Определение повышенного уровня тирозиназы (вследствие экспрессии гена тирозиназы) используется для обнаружения меланомы(злокачественной опухоли)
8.Повышенное количество конечных продуктов распада катехоламинов в моче регистрируется при опухоли мозгового слоя надпочечников.
9.Дефицит дегидрогеназы α-кетокислоты с разветлённой цепью свидетельствует о накоплении аминокислот (лейцина,изолейцина и валина) и токсичных продуктов их метаболизма. Заболевание получило название болезнь кленового сиропа, характеризуется наличием сладкого запаха мочи (аналогично запаху кленового сиропа).
