
Билет 1
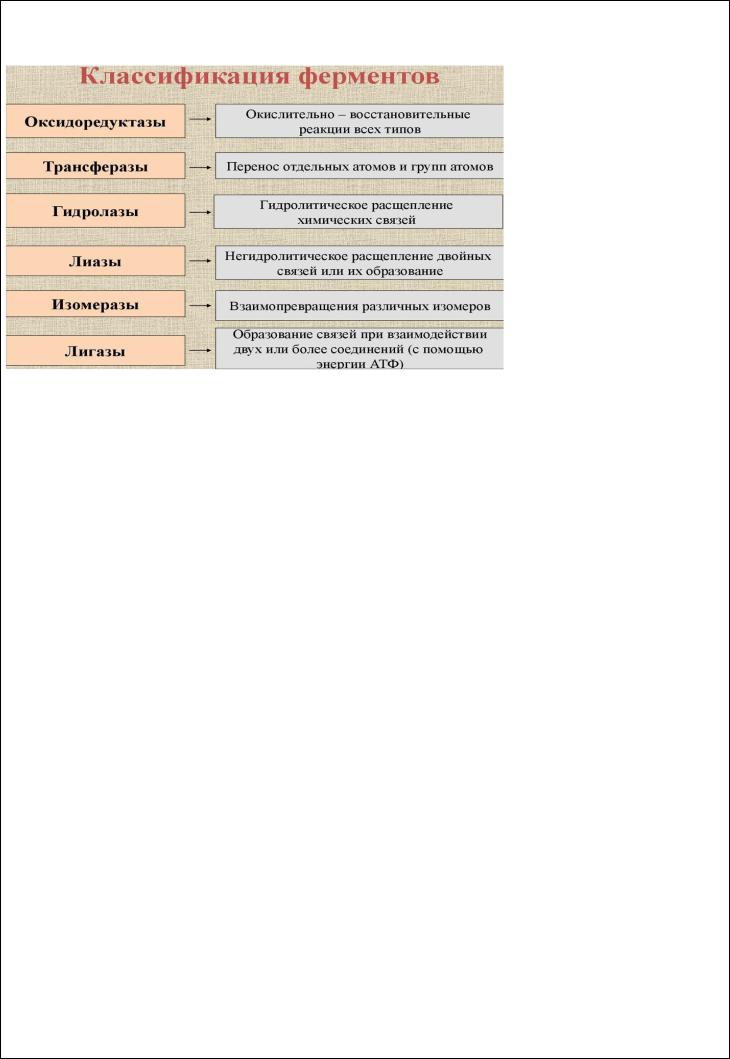
Вопрос 1) Ферменты. Классификация ферментов. Химическая кинетика.
Ферменты – это белки, выполняющие функции биологических катализаторов.
Вопрос 2) Глюкагон: химическая природа, механизм действия, органы-мишени, биологические эффекты.
Строение Представляет собой полипептид, включающий 29 аминокислот с молекулярной массой 3,5 кДа и
периодом полураспада 3-6 мин. Синтез
Осуществляется в клетках поджелудочной железы и в клетках тонкого кишечника. Регуляция синтеза и секреции Активируют: гипогликемия, адреналин.
Уменьшают: глюкоза, жирные кислоты. Механизм действия Аденилатциклазный активирующий. Мишени и эффекты
Конечным эффектом является повышение концентрации глюкозы и жирных кислот в крови. Жировая ткань
повышает активность внутриклеточной гормон-чувствительной ТАГ-липазы и, соответственно, стимулирует липолиз.
Печень
активация глюконеогенеза и гликогенолиза,
за счет повышенного поступления жирных кислот из жировой ткани усиливает кетогенез. Патология Гиперфункция
Глюкагонома – редко встречающееся новообразование из группы нейроэндокринных опухолей. У больных отмечается гипергликемия и поражение кожи и слизистых оболочек.
Вопрос 3) Мутации митохондриальных генов
Митохондриальные гены передаются потомкам только от матери. Это связано с тем, что всю цитоплазму с митохондриями потомки получают вместе с яйцеклеткой, а в сперматозоидах цитоплазма практически отсутствует. По этой причине женщина с митохондриальным заболеванием передаёт его всем своим детям, а больной мужчина - нет.
Мутации митохондриального генома можно условно разделить на 2 типа: хромосомные (структурные перестановки - дупликации и делеции, которые обычно являются единичными) и генные (мутации белков, тРНК, рРНК, затрагивающие 1 нуклеотид, в свою очередь подразделяющиеся на микроделеции/инсерции и однонуклеотидные замены).

1.Хромосомные мутации (Непереносимость нагрузок, хронический прогрессивный паралич наружных мышц глазного яблока, миопатия)
2.Генные мутации (Рак желудка, Расстройства слуха, Сахарный диабет типа 2, Муковисцидоз); проявляются, если находятся в кодирующей части или в участке регуляции транскрипции митохондриального гена.
Задача.
В крови пациента обнаружена повышенная концентрация неконъюгированного билирубина. Как иначе называется это вещество, каковы его свойства? На основании, каких симптомов, выявленных у пациента, врач назначил этот анализ? Назовите возможные причины повышения концентрации неконъюгированного билирубина в крови.
Ответ:
Непрямой (лабораторный сленг – для количественного определения данного метаболита реакцией с диазореактивом Эрлиха требуется предварительное осаждение метанолом), свободный билирубин. Жирорастворим, токсичен, транспортируется с альбуминами. На основании желтушной окраски слизистых оболочек и кожи пациента. Повышение концентрации неконъюгированного билирубина имеет место при надпечёночной желтухе, при врождённых дефектах систем его захвата и конъюгации в гепатоцитах.

Билет 2 1) Пути обезвреживания аммиака. Механизмы транспорта аммиака в организме: глутаминовый и глюкозо-аланиновый циклы.
Для удаления аммиака из организма используется включение его в состав мочевины в печени и выведение ее с мочой, и удаление почками в виде аммонийных солей.
Однако, так как аммиак является чрезвычайно токсичным соединением, то предварительно в тканях (!) происходят реакции его обезвреживания (временного связывания) для переноса в печень и почки. – синтез глутаминовой кислоты и глутамина, синтез аспарагина:
синтез глутаминовой кислоты (восстановительное аминирование) – взаимодействие α-
кетоглутарата с аммиаком. Реакция по сути обратна реакции окислительного дезаминирования, однако в качестве кофермента используется НАДФН. Происходит практически во всех тканях, кроме мышечной, но имеет небольшое значение, т.к. для глутаматдегидрогеназы предпочтительным субстратом является глутаминовая кислота и равновесие реакции сдвинуто в сторону α- кетоглутарата,
синтез глутамина – взаимодействие глутамата с аммиаком. Является главным способом уборки аммиака, наиболее активно происходит в нервной и мышечной тканях, в почках, сетчатке глаза, печени. Реакция протекает в митохондриях.
Образование большого количества глутамина обеспечивает высокие концентрации его в крови (0,5-0,7 ммоль/л).
Так как глутамин проникает через клеточные мембраны путем облегченной диффузии, то он легко попадает не только в гепатоциты, но и в другие клетки, где есть потребность в аминогруппах. Азот, переносимый глутамином, используется клетками для синтеза пуринового кольца и гуанозинмонофосфата (ГМФ), синтеза цитидинтрифосфата (ЦТФ), аспарагина, глюкозамино-6-фосфата (предшественник всех остальных аминосахаров).
синтез аспарагина – взаимодействие аспартата с аммиаком. Является второстепенным способом уборки аммиака, энергетически невыгоден, т.к. при этом тратятся 2 макроэргические связи,
Реакция синтеза аспарагина
Глюкозо-аланиновый цикл
Благодаря этому циклу аммиак транспортируется из внепеченочных тканей в печень в составе аминокислоты – аланина.
Вмышцах: в результате гликолиза глюкоза окисляется до пирувата. Далее, в результате восстановительного аминирования аммиак (NH3) встраивается в структуру пирувата с образованием аланина. Нетоксичный аланин секретируется в кровь и аммиак в составе аланина транспортируется в печень.
Впечени: из аланина путем прямого или непрямого дезаминирования высвобождается аммиак и аланин превращается в пируват. Далее из пирувата синтезируется глюкоза, которая выделяется в кровь, и цикл повторяется. Т.е. глюкозо-аланиновый цикл выполняет следующие функции:
· обезвреживает аммиак в мышцах; · транспортирует аммиак в форме аланина в мышцы; · обеспечивает глюкозой мышцы.
Таким образом, образовавшийся в тканях аммиак включается в состав «транспортных форм» - глутамина и аланина, которые переносят его по крови в печень и почки, где он высвобождается в свободном виде.
Печень и почки – это те органы, где происходит окончательное обезвреживание аммиака и образование конечных продуктов азотистого обмена – мочевины и аммонийных солей, которые удаляются из организма в составе мочи.
2) Факторы свертывания. Внешний и внутренний пути свёртывания.

Внутренний путь относится к множественным каскадам белковых взаимодействий, активируемых травмой внутри кровеносных сосудов. Он также активируется тромбоцитами, эндотелием или коллагеном. Как правило, внутренний путь занимает время, чтобы сформировать сгусток крови. Белки, участвующие в образовании тромба, известны как факторы свертывания крови. Они обозначены I-XIII. Механизм активации этих факторов известен как каскад свертывания. Факторами свертывания крови, участвующими во внутреннем пути, являются факторы VIII, IX, XI и XII.
Внутренний путь активируется связыванием фактора XII с отрицательно заряженной инородной поверхностью, которая подвергается воздействию крови. Это последовательно активирует факторы IX, X и XI, дополнительно активируя фактор II, который превращает протромбин в тромбин. Тромбин превращает фибриноген в фибрин. Тромбоциты задерживаются внутри фибриновой сетки, образуя сгусток крови.
Внешний путь относится к множеству каскадов белковых взаимодействий, активируемых поврежденными внешними поверхностями. Фактор III и тромбопластин участвуют во внешнем пути. Внешний путь короче, чем внутренний путь, и он быстрее, чем внутренний путь.
Тромбопластин является тканевым фактором (ТФ), который не подвергается воздействию крови в нормальных условиях. Но при повреждении сосудистых или эндотелиальных клеток воздействие тромбопластина активирует фактор VIIa и фосфолипиды, которые превращаются в фактор IX. Наконец, фактор X активируется фактором Xa из внешнего пути.
Сходства между внутренним и внешним путём
Внутренний и внешний пути представляют собой два типа путей, участвующих в образовании сгустка крови.
Как внутренние, так и внешние пути относятся к механизмам вторичного гемостаза.
Как внутренние, так и внешние пути участвуют в образовании активатора протромбина и фактора X.
И внутренний, и внешний путь заканчиваются на общем пути.
3) Состав и функции семейства клеточных рецепторов.
Задача.
Туристы, заблудились в тайге и голодали в течение 1 недели. Ни у одного из них не развилась гипогликемическая кома. Они благополучно добрались до населённого пункта, где и были обследованы. Концентрация глюкозы у всех оказалась на нижней границе нормы.
Какие процессы поддерживают концентрацию глюкозы при длительном голодании? Какие гормоны обеспечивают стимуляцию этих метаболических путей?
Распад гликогена, глюконеогенез. Гормоны: Глюкагон, кортизол, адреналин.

Билет 3
Вопрос 1) ЛПНП и ЛПОНП.
Липопротеины низкой плотности
Общая характеристика
образуются в гепатоцитах de novo и в сосудистой системе печени под воздействием печеночной ТАГ-липазы из ЛПОНП,
в составе преобладают холестерол и его эфиры, другую половину массы делят белки и фосфолипиды (38% эфиров ХС, 8% свободного ХС, 25% белки, 22% фосфолипидов, 7% триацилглицеролов),
основным апобелком является апоВ-100,
нормальное содержание в крови 3,2-4,5 г/л,
самые атерогенные.
Функция
1.Транспорт холестерола в клетки, использующих его
для реакций синтеза половых гормонов (половые железы), глюкокортикоидов и минералокортикоидов (кора надпочечников),
для превращения в холекальциферол (кожа),
для образования желчных кислот (печень),
для выведения в составе желчи (печень).
2.Транспорт полиеновых жирных кислот в виде эфиров ХС в некоторые клетки рыхлой соединительной ткани (фибробласты, тромбоциты, эндотелий, гладкомышечные клетки), в эпителий гломерулярной мембраны почек, в клетки костного мозга, в клетки роговицы глаз, в нейроциты, в базофилы аденогипофиза.
Клетки рыхлой соединительной ткани активно синтезируют эйкозаноиды. Поэтому им необходим постоянный приток полиненасыщенных жирных кислот (ПНЖК), что осуществляется через апо-В-100- рецептор, т.е. регулируемым поглощением ЛПНП, которые несут ПНЖК в составе эфиров холестерола. Особенностью клеток, поглощающих ЛПНП, является наличие лизосомальных кислых гидролаз, расщепляющих эфиры ХС. У других клеток таких ферментов нет.
Иллюстрацией значимости транспорта ПНЖК в указанные клетки служит ингибирование салицилатами фермента циклооксигеназы, образующей эйкозаноиды из ПНЖК. Салицилаты успешно применяются в кардиологии для подавления синтеза тромбоксанов и снижения тромбообразования, при лихорадке, как жаропонижающее средство за счет расслабления гладких мышц сосудов кожи и повышения теплоотдачи. Однако одним из побочных эффектов тех же салицилатов является подавление синтеза простагландинов в почках и снижение почечного кровобращения.
Также в мембраны всех клеток, как сказано выше (см "Метаболизм ЛПВП"), ПНЖК могут переходить в составе фосфолипидов от оболочки ЛПВП.
Метаболизм
1.В крови первичные ЛПНП взаимодействуют с ЛПВП, отдавая свободный ХС и получая этерифицированный. В результате в них происходит накопление эфиров ХС, увеличение гидрофобного ядра и "выталкивание" белка апоВ-100 на поверхность частицы. Таким образом, первичный ЛПНП переходит в зрелый.
2.На всех клетках, использующих ЛПНП, имеется высокоафинный рецептор, специфичный к ЛПНП
– апоВ-100-рецептор. Около 50% ЛПНП взаимодействует с апоВ-100-рецепторами разных тканей и примерно столько же поглощается гепатоцитами.
3.При взаимодействии ЛПНП с рецептором происходит эндоцитоз липопротеина и его лизосомальный распад на составные части – фосфолипиды, белки (и далее до аминокислот), глицерол, жирные кислоты, холестерол и его эфиры.
o ХС превращается в гормоны или включается в состав мембран, o излишки мембранного ХС удаляются с помощью ЛПВП,
oпринесенные с эфирами ХС ПНЖК используются для синтеза эйкозаноидов или фосфолипидов.

oпри невозможности удалить ХС часть его этерифицируется с олеиновой или линолевой кислотами ферментом ацил-SКоА:холестерол-ацилтрансферазой (АХАТ-реакция),
Липопротеины очень низкой плотности (ЛПОНП).
Образуются в печени Биологическая роль: транспорт эндогенного жира, синтезированного в печени из избытка углеводов, в жировую ткань Строение:
эндогенные триацилглицерины 55% эфиры холестерина и холестерина – 17% Фосфолипидов -18%
белковая часть -10%, представлена апоВ100
Вопрос 2) Особенности переваривания ак в мозге.
Вклетках головного мозга идет активный метаболизм аминокислот. Особенно высоким является уровень глутамата и аспартата. Эти аминокислоты образуются в реакции трансаминирования из промежуточных метаболитов цитратного цикла, 2- оксоглутарата и оксалоацетата.
Для нормального функционирования мозга особенно важной является реакция декарбоксилирования, в результате которой образуется гамма – аминомасляная кислота (ГАМК) (предшественник глутамат) и биогенные амины.
Биосинтез и деградация глутамата можно рассматривать, как побочный путь цитратного цикла (ГАМК
– шунт).
Некоторые аминокислоты: глицин, аспартат, глутамат, гамма – аминомасляная кислота, выполняют в нейронах функцию медиатора.
Вопрос 3) Метаболизм глу (Зоя просила формулы везде писать)
Аспарагиновая и глутаминовая кислоты являются отрицательно заряженными и заменимыми аминокислотами. Они легко образуются в клетках в реакциях трансаминирования, в которых оксалоацетат и α-кетоглутарат получают аминогруппы от других аминокислот.
Ворганизме аспартат и глутамат используются всеми клетками для синтеза пуриновых и пиримидиновых азотистых снований. Амидные производные этих аминокислот являются транспортными формами аммиака из тканей в почки и печень. Кроме этого, глутаминовая кислота входит в состав глутатиона – вещества, выполняющего две различные функции – перенос аминокислот через мембрану и ключевое звено в антиоксидантной системе клетки. Также глутамат и его производное γ-аминомасляная кислота являются медиаторами в ЦНС.
Задача При наследственной недостаточности глюкозо-6-фосфат-дегидрогеназы в эритроцитах они склонны к
преждевременному разрушению. Как связаны между собой эти явления?
Ответ.
Фермент глюкозо-6-фосфат-дегидрогеназа – участник пентозо-фосфатного пути катаболизма глюкозы. В ходе катализируемой данным ферментом реакции образуется НАДФН+Н+, необходимый для функционирования антиоксидантных систем.

Билет 4
1)Регуляция ферментов
2)Особенности метаболизма углеводов и энергетического обмена в нервной ткани
Энергетический обмен в нервной ткани. В ткани головного мозга увеличено клеточное дыхание (преобладают аэробные процессы). Мозг потребляет большее количество кислорода, чем постоянно работающее сердце. Глюкоза — основной источник энергии, так как через ГЭБ в нервные клетки поступает только глюкоза, которая, расщепляясь в аэробном гликолизе, образует ПВК, превращающуюся с помощью пируватдегидрогеназного комплекса в ацетил-КоА, который вступает в ЦТК, давая восстановленные эквиваленты для окислительного фосфорилирования, приводящего к образованию АТФ. В отличие от других тканей организма человека ВЖК не проникают через ГЭБ и не могут быть использованы в качестве энергетического материала. В пируватдегидрогеназный и акетоглутаратдегидрогеназный комплексы входит витамин В в виде тиаминпирофосфата, поэтому недостаток витамина В в первую очередь сказывается на функции нервной системы, в клетках которой будет нарушено образование АТФ. Это приводит к возникновению полиневритов. При голодании, сахарном диабете нервная ткань использует кетоновые тела в качестве энергетического материала.
Углеводный обмен. Исходным субстратом для окисления является глюкоза. Гипогликемия приводит к судорогам и, возможно, к смерти.85% глюкозы окисляется аэробно до углекислого газа и воды, 15% - анаэробно до лактата. Гликогена содержится немного – 0,1%, распад гликогена идет 2 путями:
-фосфорилический (с участием фосфорилазы);
-гидролитический - g-амилаза отщепляет остатки глюкозы.
Нарушения обмена углеводов ведут к нарушению функций головного мозга. При авитаминозе В1 нарушается превращение ПВК, следовательно развиваются полиневриты. Угнетение окисления углеводов ведет к развитию торможения в нервной системе. Во сне потребление глюкозы снижается, а при возбуждении увеличивается.
3) Механизмы действия наркотических веществ. Роль дофаминовой системы
Все наркотические вещества имеют общий механизм влияния на организм, так как являются ядами. При систематическом употреблении (для развлечения) они вызывают следующие фазы изменений в организме.
·Первая фаза — защитная реакция. При первом употреблении наркотические вещества оказывают на организм токсическое (отравляющее) действие, и это вызывает защитную реакцию — тошноту, рвоту, головокружение, головную боль и т.д. Никаких приятных ощущений при этом, как правило, не бывает.
·Вторая фаза — эйфория. При повторных приемах защитная реакция ослабевает, и возникает эйфория
— преувеличенное ощущение хорошего самочувствия. Она достигается возбуждением наркотиками рецепторов (чувствительных структур) мозга, родственных эндорфинам (естественным внутренним стимуляторам, вызывающим чувство удовольствия). Наркотик на этой стадии действует как эндорфин.
·Третья фаза — психическая зависимость от наркотиков. Наркотик, вызывающий эйфорию, нарушает синтез (выработку) эндорфинов в организме. Это приводит к ухудшению настроения человека, и он начинает стремиться получить удовольствие от приема наркотических веществ (алкоголь, наркотики и т.д.). Это еще более ухудшает синтез естественных «гормонов удовольствия» и усиливает желание принимать наркотические вещества. Постепенно развивается навязчивое влечение человека к наркотику (это уже болезнь), которое заключается в том, что он постоянно думает о приеме наркотических средств, о вызываемом им эффекте, и уже при мысли о предстоящем приеме наркотического вещества у него повышается настроение.
Представление о наркотике и его эффекте становится постоянным элементом сознания и содержания мыслей человека: о чем бы ни думал, чем бы ни занимался, он не забывает о наркотике. Как благоприятные он расценивает ситуации, способствующие добыванию наркотиков, а как

неблагоприятные — препятствующие этому. Однако на этой стадии заболевания окружающие, как правило, ничего особенного в его поведении еще не замечают.
· Четвертая фаза — физическая зависимость от наркотиков.Систематическое употребление наркотиков приводит к полному нарушению системы, синтезирующей эндорфины, и организм перестает их продуцировать. Поскольку эндорфины обладают болеутоляющим действием, то прекращение их синтеза организмом, принимающим наркотические вещества, вызывает физическую и эмоциональную боль.
Чтобы избавиться от этой боли, человек вынужден принимать большую дозу наркотического вещества. Так развивается физическая (химическая) зависимость от наркотических веществ. Решившись отказаться от приема наркотиков, человек привыкший к ним, должен пережить период приспособления, занимающий несколько дней, прежде чем мозг возобновит производство эндорфинов. Этот неприятный период называется периодом абстиненции («ломки»). Она проявляется в общем недомогании, снижении работоспособности, дрожании конечностей, ознобе, болях в различных частях тела. Многие болезненные симптомы хорошо заметны окружающим. Наиболее известное и хорошо изученное состояние абстиненции, например, после приема алкоголя — похмелье.
Постепенно влечение больного к наркотику становится неудержимым, у него появляется стремление немедленно, как можно скорее, во что бы то ни стало, вопреки любым преградам достать и принять наркотическое вещество. Это стремление подавляет все потребности и полностью подчиняет себе поведение человека. Он готов снять с себя и продать одежду, унести все из дома и т.д. Именно в таком состоянии больные идут на любые антисоциальные действия, в том числе преступления.
На этой стадии развития болезни человеку требуются значительно более высокие дозы наркотического вещества, чем в начале заболевания, потому что при систематическом употреблении его наступает устойчивость организма к яду (развивается толерантность).
· Пятая фаза — психосоциальная деградация личности. Она наступает при систематическом и длительном приеме наркотических веществ и включает эмоциональную, волевую и интеллектуальную деградацию.
Эмоциональная деградация заключается в ослаблении, а затем полном исчезновении наиболее сложных и тонких эмоций, в эмоциональной неустойчивости, проявляющейся в резких и беспричинных колебаниях настроения, а одновременно с этим и в нарастании дисфории — устойчивых нарушений настроения. К ним относятся постоянная озлобленность, подавленность, угнетенность. Волевая деградация проявляется в неспособности сделать над собой усилие, довести до конца начатое дело, в быстрой истощаемости намерений и побуждений. У этих больных все мимолетно, и верить их обещаниям и клятвам нельзя (обязательно подведут). Они способны проявить настойчивость только в стремлении раздобыть наркотическое вещество. Это состояние у них носит навязчивый характер. Интеллектуальная деградация проявляется в снижении сообразительности, неспособности сосредоточиться, выделить главное и существенное в разговоре, в забывчивости, в повторении одних и тех же банальных или глупых мыслей, стремлении рассказывать пошлые анекдоты и т.д.
Задача ответ кетоацидоз из-за сахарного диабета

5 билет
1. Стадии и схема катоболизма
Катаболизм – расщепление и окисление сложных органических молекул до более простых конечных продуктов. Оно сопровождается высвобождением энергии, заключенной в сложной структуре веществ. Большая часть высвобожденной энергии рассеивается в виде тепла. Меньшая часть этой энергии "перехватывается" коферментами окислительных реакций НАД и ФАД, некоторая часть сразу используется для синтеза АТФ.
Атомы водорода, высвобождаемые в реакциях окисления веществ, в основном используются клеткой по двум направлениям:
на анаболические реакции в составе НАДФН (например, синтез жирных кислот и холестерина),
на образование АТФ в митохондриях при окислении НАДН и ФАДН2.
Необходимо заметить, что молекулы НАДФН могут идти не только на реакции анаболизма. Например, они активно привлекаются к реакциям антиоксидантной защиты для нейтрализации свободных радикалов, а в фагоцитирующих клетках, наоборот, требуются для синтеза супероксид анион-радикала, используются для нейтрализации аммиака в реакции синтеза глутамата в реакции восстановительного аминирования и в ряде других процессов.
Весь катаболизм условно подразделяется на три этапа, включающие реакции общих и специфических путей.
Первый этап Происходит в кишечнике (переваривание пищи) или в лизосомах (самообновление клеток) при
расщеплении уже ненужных или лишних молекул. При этом освобождается около 1% энергии, заключенной в молекуле. Она рассеивается в виде тепла.
Второй этап Вещества, образованные при внутриклеточном гидролизе или проникающие в клетку из крови, на
втором этапе обычно превращаются
в пировиноградную кислоту (моносахариды в гликолизе),
в ацетил-SKoA, в пируват и другие кетокислоты (в катаболизме аминокислот),
в ацетил-SКоА (при β-окислении жирных кислот).
Локализация второго этапа – цитозоль и митохондрии. На этом этапе выделяется около 30% энергии, заключенной в молекуле, и при этом запасается около 13% от всей энергии вещества (или примерно 43% от выделенной на этом этапе энергии).
Под специфичными путями катаболизма понимают реакции, осуществляемые специфичными ферментами в специфичных, для разных классов веществ, реакциях 1 и 2 этапов. После того, как эти процессы закончатся, образуются пируват и ацетил-SКоА (в основном) и начинаются общие пути превращений. Подразумевается, что независимо от источника происхождения пирувата и ацетил-SKoA (из аминокислот, жирных кислот или моносахаридов) они попадают в общий путь катаболизма – 3 этап биологического окисления.
Третий этап
Все реакции этого этапа идут в митохондриях. Ацетил-SКоА (и кетокислоты) включается в реакции цикла трикарбоновых кислот, где углероды веществ окисляются до углекислого газа. Выделенные атомы водорода соединяются с НАД и ФАД, восстанавливают их и после этого НАДН и ФАДН2 переносят водород в цепь ферментов дыхательной цепи, расположенную на
внутренней мембране митохондрий. Сюда же отдают свои атомы водорода молекулы НАДН и ФАДН2, образованные на втором этапе (гликолиз, окисление жирных кислот и аминокислот). В третьем этапе выделяется до 70% всей энергии вещества. Из этого количества усваивается почти две трети (66%), что составляет около 46% от общей. Таким образом, из 100% энергии окисляемой молекулы клетка запасает больше половины – 59%.
На внутренней мембране митохондрий в результате процесса под названием "окислительное фосфорилирование" образуется вода и главный продукт биологического окисления – АТФ.
2. Стадии свободно-радикального окисления липидов.
Этапы СПОЛ Пути антиоксидантной защиты

Кислородная |
Антикислородное действие |
инициация |
Строение неповрежденной клеточной мембраны создает пространственное |
СПОЛ |
затруднение для проникновения кислорода в липидный слой мембран |
|
Уменьшение содержания О2в цитоплазме клетки обеспечивается возрастающей |
|
утилизацией О2в митохондриях |
Образование |
Антирадикальное действие |
||
свободных |
Супероксиддисмутаза катализирует взаимодействие супероксидных радикалов |
||
радикалов |
кислорода (дисмутации) |
. |
|
липидов |
|||
Серосодержащие аминокислоты (метионин, цистеин) акцептируют супероксидные |
|||
|
|||
|
радикалы и препятствуют образованию Н2О2 |
||
|
Экзогенные вещества - феруловая кислота, аскорбиновая кислота - представляют |
||
|
собой «ловушки» перекисных радикалов, они реагируют со свободными |
||
|
радикалами, обрывая цепь последующих реакций СПОЛ |
||
Образование |
Антиперекисное действие |
перекисей |
Глютатионпероксидаза, каталаза. Инактивация гидроперекисей липидов и |
липидов |
пероксида водорода (Н2О2) |
Свободные радикалы не только разрушают мембраны клеток, они подавляют активность восстановительных ферментов клетки (содержащих сульфгидрильные группы -SH). Благодаря этому окислительный потенциал клетки возрастает, ряд субстратов подвергается свободнорадикальному окислению и образуются первичные радиотоксины. Из фенолов образуются хиноны и семихиноны, из ненасыщенных жирных кислот мембран клеток и субклеточных структур - перекиси, эпоксиды и кетоны жирных кислот. Хиноны и семихиноны угнетают синтез ДНК, подавляют деление, рост и развитие клеток, а также вызывают в ядрах мутации. Липидные радиотоксины окисляют SH-группы ферментов, повреждают мембраны митохондрий и лизосом, угнетают образование АТФ. На более поздних этапах формирования лучевой болезни образуются вторичные радиотоксины - гистамин, продукты распада белков и др., которые усугубляют повреждение клеток организма. Они образуются в результате повреждающего действия первичных радиотоксинов.
Прежде всего гибнут клетки, характеризующиеся ускоренным метаболизмом: клетки кроветворных органов, селезёнки, волосяных луковиц, слизистой пищеварительного канала.
Степень радиационного поражения зависит от вида излучения, дозы и длительности его воздействия. Максимальное кратковременное однократное облучение человека в дозе 200 рад. переносится большинством людей без тяжёлых последствий. Превышение этой дозы или длительное облучение меньшими дозами, но превышающими в совокупности этот порог, приводит к развитию лучевой болезни. При остром и, особенно, хроническом лучевом поражении возникают отдалённые последствия, проявляющиеся в виде дефектов иммунной системы: часто возникают и тяжело протекают инфекционные болезни, чаще развиваются злокачественные опухоли, наблюдается преждевременное старение и сокращение продолжительности жизни. Повреждение генеративных клеток мужчин и, особенно, женщин представляет большую опасность, т.к. может привести к появлению генетических дефектов у потомства.
Успехи медикаментозного лечения лучевой болезни и её последствий пока невелики. Применяют антиоксиданты, средства, подавляющие активность обменных процессов и вещества, блокирующие действие радиотоксинов. Однако, защитный эффект этих веществ имеет место .лишь при профилактическом введении. Наиболее эффективным средством лечения лучевой болезни в настоящее время является пересадка костного мозга.
3. Роль нейраминидазы и гемаглютининов в вирусной репликации.
Улюдей, длительно употребляющих алкоголь, снижается эффективность некоторых лекарств, в том числе средств для наркоза. Как объяснить это явление?
Уних повышена активность ферментов микросомальной системы, в связи с этим, при приёме ряда препаратов нет ожидаемого эффекта, т.к. они быстро окисляются и выводятся из организма.

Билет 6
Вопрос 1.Субстратное фосфорилирование.
Синтез АТФ, протекающий помимо дыхательной цепи либо за счет окисления, либо за счет молекулярной перестройки субстрата, называют субстратным фосфорилированием. Синтез АТФ в значительно меньшем объеме может происходить и помимо дыхательной цепи за счет анаэробного окисления субстратов или их молекулярной перестройки – субстратное фосфорилирование. Пример преобразование 2-фосфоглицериновой кислоты в пировиноградную кислоту: 1)отщепление молекулы воды енолазой с запасанием высвободившейся энергии в макроэргической связи с остатком фосфорной кислоты; 2)перефосфорилированиес АДФ;
Субстратное фосфорилирование участвует в анаэробном расщеплении глюкозы. За счет субстратного фосфорилирования 1 молекулы глюкозы синтезируется 6 молекул АТФ.
Вопрос 2.Механизмы трансмембранной передачи гормонального сигнала в клетку.
Важное свойство мембран - способность воспринимать и передавать внутрь клетки сигналы из внешней среды. "Узнавание" сигнальных молекул осуществляется с помощью белков-рецепторов, встроенных в клеточную мембрану клеток-мишеней или находящихся в клетке. сли сигнал воспринимается мембранными рецепторами, то схему передачи информации можно представить так:
взаимодействие рецептора с сигнальной молекулой (первичным посредником);
активация мембранного фермента, ответственного за образование вторичного посредника;
образование вторичного посредника цАМФ, цГМФ, ИФ3, ДАТ или Са2+;
активация посредниками специфических белков, в основном протеинкиназ, которые, в свою очередь, фосфорилируя ферменты, оказьюают влияние на активность внутриклеточных процессов.

Вопрос 3.Эндотелиальная дисфункция и развитие ИБС. Роль NO
Задача:
Результат анализа мочи: суточный объём – 3,5 л, плотность – 1050 кг/м3, глюкоза (+), кетоновые тела
(+). Сравнить данные с нормальными показателями и сделайте предположение о состоянии пациента.
Ответ.
Сахарный диабет I типа. суточный диурез в норме составляет 1,5-2,0 л
Билет 7
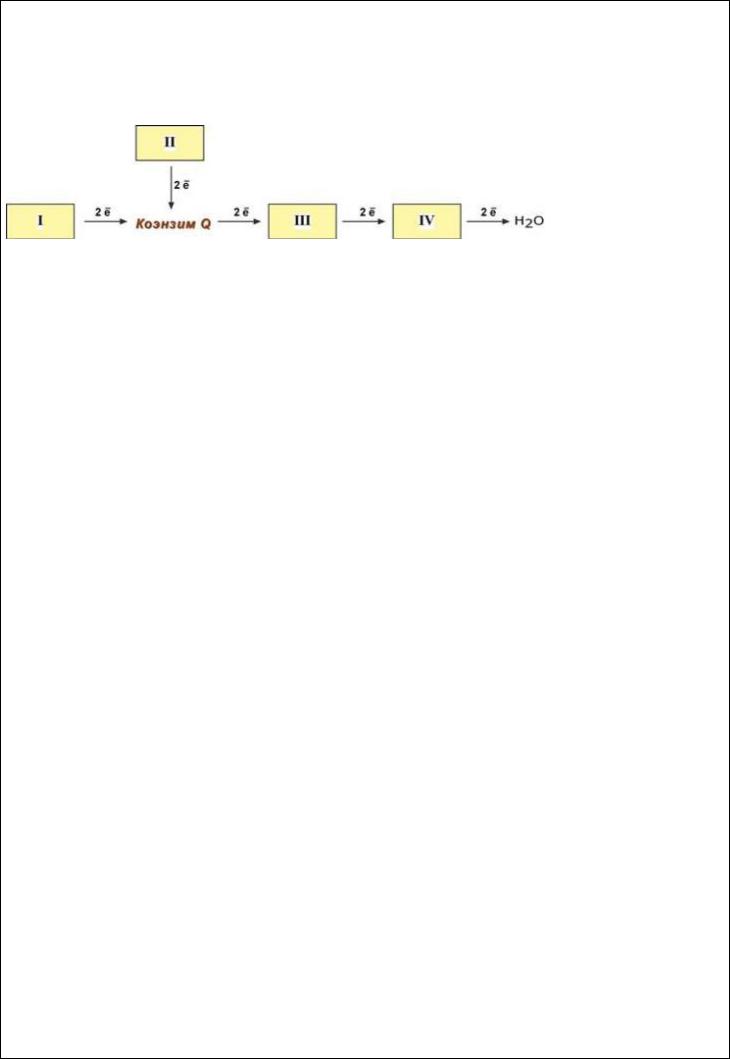
1. Цепь переноса электронов (ЦПЭ), сопряжение дыхания и синтеза АТФ в митохондриях, коэффициент окислительного фосфорилирования. Ингибиторы и разобщители ЦПЭ.
Всего цепь переноса электронов включает в себя разнообразные белки, которые организованы в 4 больших мембраносвязанных мульферментных комплекса. Также существует еще один комплекс, участвующий не в переносе электронов, а синтезирующий АТФ.
Блок-схема дыхательной цепи Строение ферментативных комплексов дыхательной цепи
1 комплекс. НАДН-КоQ-оксидоредуктаза
Этот комплекс также имеет рабочее название НАДН-дегидрогеназа, содержит ФМН, 42 белковых молекулы, из них не менее 6 железосерных белков.
Функция
1.Принимает электроны от НАДН и передает их на коэнзим Q (убихинон).
2.Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. Железосерные белки (FeS-белки) – это белки содержащие атомы железа, которые соединены с атомами серы и с серой остатков цистеина. В результате образуется железо-серный центр.
2 комплекс. ФАД-зависимые дегидрогеназы Данный комплекс как таковой не существует, его выделение условно. К нему относятся ФАД-
зависимые ферменты, расположенные на внутренней мембране – например, ацил-SКоА- дегидрогеназа (β-окисление жирных кислот), сукцинатдегидрогеназа (цикл трикарбоновых кислот),
митохондриальная глицерол-3-фосфат-дегидрогеназа (челночный механизм переноса атомов водорода). Функция
1.Восстановление ФАД в окислительно-восстановительных реакциях.
2.Обеспечение передачи электронов от ФАДН2 на железосерные белки внутренней мембраны митохондрий. Далее эти электроны попадают на коэнзим Q (убихинон).
3 комплекс. КоQ-цитохром c-оксидоредуктаза
По другому данный комплекс называется цитохром с редуктаза. В его составе имеются
молекулы цитохрома b и цитохрома c1, железо-серные белки. Комплекс представляет собой 2 мономера, в каждом из которых насчитывается 11 полипептидных цепей.
Функция
1.Принимает электроны от коэнзима Q и передает их на цитохром с.
2.Переносит 2 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. Имеются разногласия по поводу количества переносимых ионов H+ при участии 3-го и 4-го комплексов. По одним данным, третий комплекс переносит 2 иона H+ и четвертый комплекс переносит 4 иона H+. По другим авторам, наоборот, третий комплекс переносит 4 иона H+ и четвертый комплекс переносит 2 иона H+.
4 комплекс. Цитохром с-кислород-оксидоредуктаза
Вэтом комплексе находятся цитохромы а и а3, он называется также цитохромоксидаза, состоит из 13 субъединиц. В комплексе имеются ионы меди, соединенные с белками комплекса через HS-группы цистеина, и формирующие центры, подобные тем, что имеются в железо-серных белках.
Функция
1.Принимает электроны от цитохрома с и передает их на кислород с образованием воды.
2.Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
5 комплекс Пятый комплекс – это фермент АТФ-синтаза, состоящий из множества белковых цепей,
подразделенных на две большие группы:
одна группа формирует субъединицу Fo (произносится со звуком "о", а не "ноль" т.к олигомицин-чувствительная) – ее функция каналообразующая, по ней выкачанные наружу протоны водорода устремляются в матрикс.
другая группа образует субъединицу F1 – ее функция каталитическая, именно она, используя энергию протонов, синтезирует АТФ.
Механизм работы АТФ-синтазы получил название вращательный катализ.
Вопрос 2. Гормоны. Классификации гормонов. Иерархический принцип управления в эндокринной системе.
Гормоны -это органические соединения, вырабатываемыми клетками и предназначенные для управления обменом веществ и функ организма, их регуляцией.
Особенности действия гормонов:
· дистантность — могут вырабатываться далеко от клеток-мишеней;
·специфичность;
·избирательность;
·высокая активность в малых дозах. Классификация гормонов:
·белки и полипептиды — гормоны гипофиза, гипотоламуса, поджелудочной железы и некоторых других желез;
·производные аминокислот — адреналин, мелатонин,йодтиронинвв
·стероиды— глюкокортикоиды минералокортикоиды
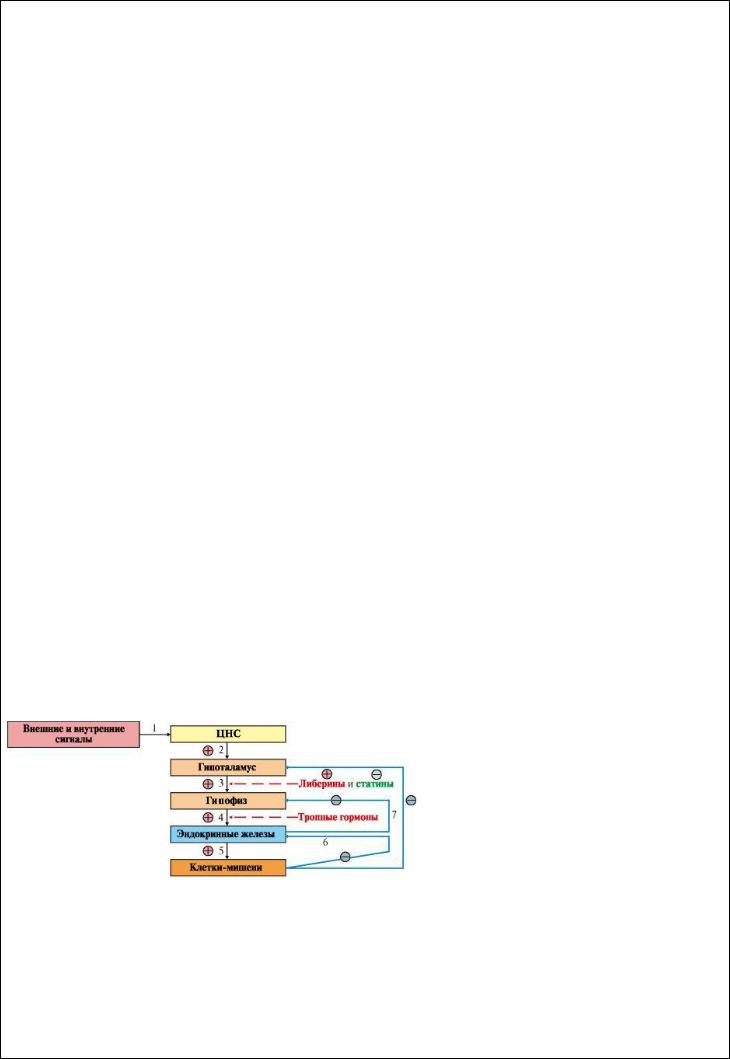
Вопрос 3. Иерархия регуляторных систем. Системы регуляции обмена веществ и функций организма образуют три иерархических уровня.
Первый уровень - центральная нервная система. Нервные клетки получают сигналы, поступающие из внешней и внутренней среды, преобразуют их в форму нервного импульса, который в синапсе вызывает освобождение медиатора. Медиаторы вызывают изменения метаболизма в эффекторных клетках через внутриклеточные механизмы регуляции.
Второй уровень - эндокринная система - включает гипоталамус, гипофиз, периферические эндокринные железы, а также специализированные клетки некоторых органов и тканей (ЖКТ, адипоциты), синтезирующие гормоны и высвобождающие их в кровь при действии соответствующего стимула. Третий уровень - внутриклеточный - составляют изменения метаболизма в пределах клетки или отдельного метаболического пути, происходящие в результате:
•изменения активности ферментов путем активации или ингибирования;
•изменения количества ферментов по механизму индукции или репрессии синтеза белков или изменения скорости их деградации;
•изменения скорости транспорта веществ через мембраны клеток.
секретируются в кровь (вазопрессин, окситоцин).
Задача.
Результат анализа мочи: суточный объём – 3,5 л, плотность – 1050 кг/м3, глюкоза (+), кетоновые тела
(+). Сравнить данные с нормальными показателями и сделайте предположение о состоянии пациента.
Сахарный диабет I типа. суточный диурез в норме составляет 1,5-2,0 л

Билет 8 1) Окислительное декарбоксилирование пировиноградной кислоты: схема процесса, связь с
синтезом АТФ. Строение пируватдегидрогеназного комплекса: ферменты, коферменты, регуляция процесса.
В процессе катаболизма белков, жиров, углеводов образуется ПВК, для дальнейшего окисления, необходим переход её в ацетил КоА. Этот процесс называется окислительным декарбоксилированием пировиноградной кислоты. В нём заключено два вида реакций: окисление и образование СО2 путём разрушения карбоксильной группы. Окислительное декарбоксилирование пирувата осуществляется при участии пируватдегидрогеназного комплекса.
Состав полиферментного пируватдегидрогеназного комплекса Пируватдегидрогеназный комплекс (ПДК) молекулярной массой 6*106 дальтон, включает в себя три вида ферментов (Е1-Е3) и пять видов коферментов. 2 кофермента НАД и HS-КоА находятся в свободном состоянии и входят в состав комплекса только в момент реакции.
Ферменты пируватдегидрогеназного комплекса:
Е1 – пируватдегидрогеназа (пируватдекарбоксилаза)
Е2 – дигидролипоилацетилтрансфераза (трансацетилаза) Е3 – дигидролипоилдегидрогеназа Коферменты пируватдегидрогеназного комплекса:
1.Тиаминдифосфат (ТДФ, ТПФ), содержащий витамин В1, кофактор пируватдегидрогеназы.
2.Липоевая кислота, кофактор трансацетилазы.
3.Кофермент ФАД, содержащий витамин В2, кофактор дегидрогеназы дигидролипоевой кислоты.
4.Кофермент НАД, содержащий витамин РР.
5.Кофермент НS-КоА, содержащий аденин, рибозу, два остатка фосфорной кислоты, пантотеновую кислоту (витамин В3).
Окислительное декарбоксилирование ПВК протекает в несколько стадий, в процессе которых двухуглеродный фрагмент, образующийся из ПВК, переносится на липоевую кислоту, а затем на HSКоА.
Биологическая роль окислительного декарбоксилирования пирувата заключается в том, что оно является важным этапом катаболизма, позволяющим включаться в цикл Кребса тем веществам, при распаде которых образуется ПВК. Образовавшаяся молекула НАДН2 окисляется в длинной дыхательной цепи с образованием 3-х молекул АТФ.
Окислительное декарбоксилирование пирувата протекает внутри митохондрий. Регуляция пируватдегидрогеназного комплекса осуществляется путём фосфолирирования, дефосфолирирования пируватдегидрогеназы Активаторами ПДК служат АДФ и НАД окисленный. Ингибиторами этого комплекса являются АТФ и НАДН2..
Всостав ПДК входит пять витаминов.
По механизму «обратной связи» работу пируватдегидрогеназного комплекса ингибируют конечные продукты окислительного декарбоксилирования - ацетил-KоА, НАДН + Н+, а также АТФ. Увеличивает активность комплекса пировиноградная кислота. Также имеется регуляция со стороны гормонов: инсулин увеличивает активность комплекса, глюкагон - снижает. Первую реакцию катализирует Е1, субстратами являются ПВК и дегидролипоевая кислота, являющаяся простетической группой Е2. От ПВК отщепляется карбоксильная группа и образуется СО2, а ацетильный остаток соединяется с атомомсеры липоевой кислоты в составе ацетилтрансферазы. Получается ацетиллипоат-Е2.
Во второй реакцииацетилтрансфераза (Е2) катализирует перенос ацетильного остатка, соединенного с его собственной простетической группой, на коэнзим А. Продукты этой реакции - дигидролипоевая кислота в составе Е2 и ацетил-КоА.
В третьей реакциипроисходит дегидрирование дигидролипоевой кислоты в составе ацетилтрансферазы при воздействии фермента Е3 (дегидрогеназа дигидролипоевой кислоты), содержащего ФАД. ФАД передает водород на НАД. Образуются НАДН, Н+ и дегидролипоевая кислота в составе Е2. Последний фермент снова вступает в окислительное декарбоксилирование ПВК.

2) Молекулярные механизмы малигнизации клеток.
Канцерогенез - это процесс развития опухолей любого типа. Последняя стадия опухолевого роста, с видимыми проявлениями , манифестация получил название малигнизации ( озлакочествление). Общие признаки малигнизации:
1.Клетка приобретает способность к бесконтрольному , безудержному размножению, делению
2.Гиперплазия параллельно с бесконтрольным делением клеток, наблюдается нарушение дифференцировки, остается незрелой, молодой ( это свойство называется анаплазией).
3.Автономность ( независимый от организма), от контролирующей, регулирующей процессы жизнедеятельности стимулов. Чем быстрее растет опухоль, тем как правило менее дифференцированны клетки и больше выражена автономность опухоли.
4.Доброкачественная опухоль характеризуется нарушением пролиферации, нет нарушения дифференцировки, при росте доброкачественной опухоли клетки просто увеличиваются в количестве, раздвигая или сдавливая окружающие ткани. А для злокачественных опухолей характерен так называемый инфильтративный рост, опухолевые клетки прорастают ( как клетки рака) разрушая окружающие ткани.
5.Способность к метастазированию. Метастазы - это клетки которые могут гематогенным, лимфогенным путем разноситься по всему организму и образовывать очаги опухолевого процесса. Метастазы - это признак злокачественной опухоли.
6.Опухолевая ткань оказывает на организм в целом негативное влияние : интоксикация, вызванная продуктами метаболизма опухоли, распада опухоли. Кроме того опухоль лишает организм необходимых питательных веществ, энергетических субстратов, пластических компонентов.
3) Антидиуретический гормон (вазопрессин): химическая природа, механизм действия, органымишени, биологические эффекты. Несахарный диабет.
Строение:
Представляет собой пептид, включающий 9 аминокислот, с периодом полураспада 2-4 минуты. Синтез:
Осуществляется в супраоптическом и паравентрикулярном ядрах гипоталамуса. Отсюда в точку секреции (заднюю долю гипофиза) вазопрессин отправляется в виде прогормона, состоящего из двух частей – собственно АДГ и нейрофизина. В ходе транспортировки происходит процессинг – гидролиз проАДГ на зрелый гормон и белок нейрофизин.
Регуляция синтеза и секреции: Уменьшают: этанол, глюкокортикоиды. Активируют:
• возбуждение осморецепторов в гипоталамусе и в портальной вене печени из-за повышения осмолярности плазмы при обезвоживании, почечной или печеночной недостаточности, накоплении осмотически активных веществ (глюкоза),
• активация барорецепторов сердца и каротидного синуса при снижении объема крови в сосудистом русле (кровопотери, обезвоживание),
• эмоциональный и физический стресс,
• никотин, ангиотензин II, интерлейкин 6, морфин, ацетилхолин. Механизм действия:
Зависит от рецепторов:
1.Кальций-фосфолипидный механизм, сопряжен:
• с V1-рецепторами гладких мышц артериол, печени, тромбоцитов,
• с V3-рецепторами аденогипофиза и структур головного мозга.
2.Аденилатциклазный механизм – с V2-рецепторами почечных канальцев. Мишени и эффекты:
Почки:
Увеличивает реабсорбцию воды в эпителиоцитах дистальных канальцев и собирательных трубочек, благодаря "выставлению" на мембрану транспортных белков для воды – аквапоринов:

•через аденилатциклазный механизм вызывает фосфорилирование молекул аквапоринов (только тип 2, AQP2), их взаимодействие с белками микротубул и путем экзоцитоза встраивание аквапоринов в апикальную мембрану,
•по тому же механизму стимулирует синтез аквапоринов de novo.
Сосудистая система:
Поддерживает стабильное давление крови, стимулируя тонус сосудов:
•повышает тонус гладких мышц сосудов кожи, скелетных мышц и миокарда (в меньшей степени),
•повышает чувствительность механорецепторов в каротидных синусах к изменениям артериального давления, Иные эффекты:
Метаболические эффекты:
Избыточное количество вазопрессина в крови:
•у голодных животных в печени активирует гликогенолиз, что вызывает выход глюкозы в кровь,
•у сытых животных в печени стимулирует гликолиз, который здесь является началом синтеза ТАГ и холестерола,
•усиливает секрецию глюкагона,
•понижает липолитический эффект катехоламинов в жировой ткани,
•усиливает секрецию АКТГ и, следовательно, синтез глюкокортикоидов.
В целом эффект вазопрессина на гормональный и метаболический статус организма сводится к гипергликемии и накоплению липидов.
Головной мозг:
•участвует в механизмах памяти и поведенческих аспектах стресса,
•через V3-рецепторы стимулирует в кортикотрофах секрецию АКТГи пролактина,
•повышает болевой порог чувствительности,
•повышение концентрации вазопрессина и дисбаланс вазопрессин/окситоцин отмечается при депрессии, тревоге, шизофрении, аутизме, расстройствах личности. В эксперименте вазопрессин вызывает у крыс агрессивное поведение и тревожность.
Костная ткань:
•Поддерживает обновление структур и минерализацию кости, усиливая активность как остеобластов, так и остеокластов.
Сосудистая система:
Влияет на гемостаз, в целом повышая вязкость крови:
•в эндотелии вызывает образование фактора Виллебранда, антигемофильного глобулина А
(фактора свертывания VIII) и тканевого активатора плазминогена (t-PA),
•в печени также повышает синтез VIII фактора свертывания,
•усиливает агрегацию и дегрануляцию тромбоцитов.
Гипофункция проявляется в виде несахарного диабета, частота примерно 0,5% всех эндокринных заболеваний. Проявляется большим объемом мочи до 8 л/сутки, жаждой и полидипсией, сухостью кожи и слизистых, вялостью, раздражительностью.
Существуют разные причины гипофункции:
1.Первичный несахарный – дефицит АДГ при нарушении синтеза или повреждениях гипоталамогипофизарного тракта (переломы, инфекции, опухоли);
2.Нефрогенный несахарный диабет:
•наследственный – нарушение рецепции АДГ в канальцах почек,
•приобретенный – заболевания почек, повреждение канальцев солями лития при лечении больных психозами.
3. Гестагенный (при беременности) – повышенный распад вазопрессина аргинин-аминопептидазой плаценты.
4. Функциональный – временное (у детей до года) повышение активности фосфодиэстеразы в почках, приводящее к нарушению действия вазопрессина.
Билет 9
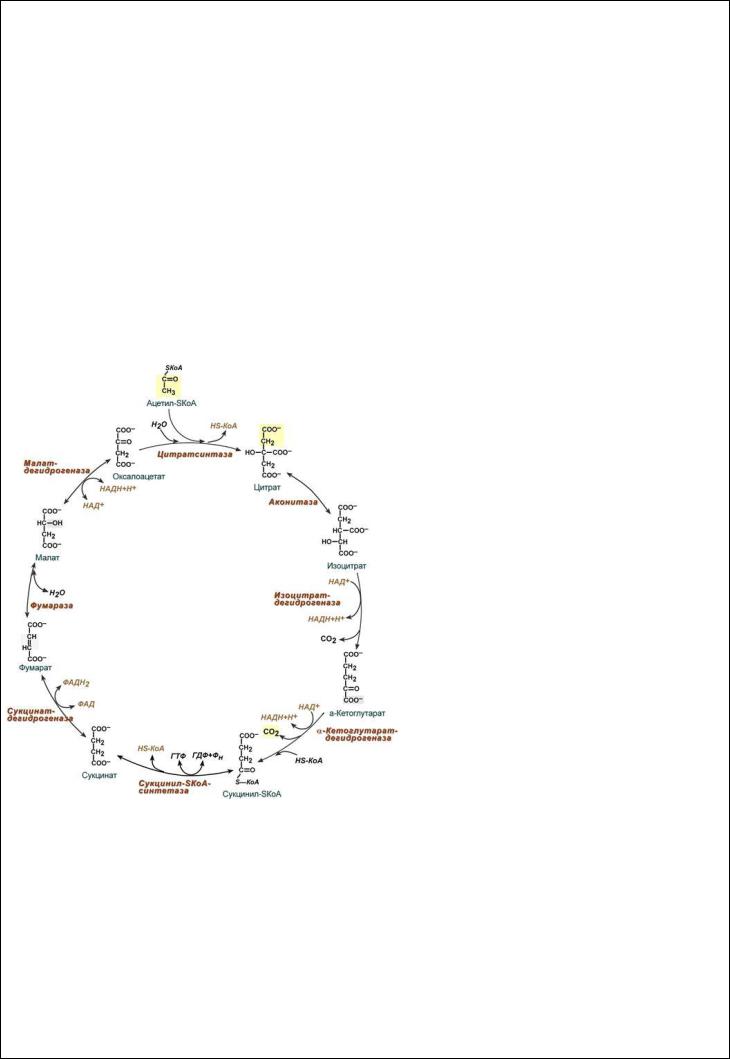
Вопрос 1) ЦТК
Цикл протекает в матриксе митохондрий и представляет собой окисление молекулы ацетил-SКоА в восьми последовательных реакциях.
Впервой реакции связываются ацетил и оксалоацетат (щавелевоуксусная кислота) с образованием цитрата (лимонной кислоты), далее происходит изомеризация лимонной кислоты
до изоцитрата и две реакции дегидрирования с сопутствующим выделением СО2 и восстановлением НАД.
Впятой реакции образуется ГТФ, это реакция субстратного фосфорилирования. Далее последовательно происходит ФАД-зависимое дегидрирование сукцината (янтарной кислоты), гидратация фумаровой кислоты до малата (яблочная кислота), далее НАД-зависимое дегидрирование с образованием оксалоацетата.
Витоге после восьми реакций цикла вновь образуется оксалоацетат.
Последние три реакции составляют так называемый биохимический мотив (ФАД-зависимое дегидрирование, гидратация и НАД-зависимое дегидрирование, он используется для введения кетогруппы в структуру сукцината. Этот мотив также присутствует в реакциях β-окисления жирных кислот. В обратной последовательности (восстановление, дегидратация и восстановление) этот мотив наблюдается в реакциях синтеза жирных кислот.
Функции ЦТК
1.Энергетическая
генерация атомов водорода для работы дыхательной цепи, а именно трех молекул НАДН и одной молекулы ФАДН2,
синтез одной молекулы ГТФ (эквивалентна АТФ).
2.Анаболическая. В ЦТК образуются
предшественник гема – сукцинил-SКоА,
кетокислоты, способные превращаться в аминокислоты – α-кетоглутарат для глутаминовой кислоты, оксалоацетат для аспарагиновой,
лимонная кислота, используемая для синтеза жирных кислот,
оксалоацетат, используемый для синтеза глюкозы.
Вопрос 2) Особенности метаболизма в эритроцитах и лейкоцитах

Эритроциты - высокоспециализированные клетки, которые переносят кислород от легких к тканям и диоксид углерода. В результате дифференцировки эритроциты теряют ядро, рибосомы, митохондрии, эндоплазматический ретикулум. Эти клетки имеют только плазматическую мембрану и цитоплазму. Они не содержат ядра, поэтому неспособны к самовоспроизведению и репарации возникающих в них повреждений.
Метаболизм глюкозы в эритроцитах представлен анаэробным гликолизом и пентозофосфатным путем превращения глюкозы. Эти процессы обусловливают сохранение структуры и функций гемоглобина, целостность клеточной мембраны и образование энергии для работы ионных насосов.
Энзимопатии, обусловливающие гемолиз эритроцитов. ВОЗНИКАЕТ вследствие генетического дефекта глюкозо-6-фосфодегидрогеназы снижает продолж жизни эрит 30 процентов Лейкоциты:
1.Лейкоциты являются полноценными клетками с большим ядром, митохондриями и высоким содержанием нуклеиновых кислот.
2.В лейкоцитах активно протекают процессы биосинтеза нуклеиновых кислот и белков.
3.Основной путь получения энергии – аэробный гликолиз. АТФ образуется также в реакциях β- окисления жирных кислот.
4.В лейкоцитах сосредоточен весь гликоген крови, который является источником энергии при недостаточном её поступлении.
5.В лизосомах лейкоцитов локализована мощная система протеолитических ферментов – протеазы, фосфатазы, эстеразы, ДНК-азы, РНК-азы, что обеспечивает участие этих клеток в защитных реакциях организма. В результате действия этих ферментов разрушаются полимерные молекулы микроорганизмов и образуются мономеры (моносахариды, аминокислоты, нуклеотиды), которые поступают в цитозоль и могут использоваться клеткой.
6.Поглощение бактерий лейкоцитами в процессе фагоцитоза сопровождаются резким увеличением потребления кислорода с образованием супероксидного аниона и пероксида водорода, которые оказывают бактерицидное действие. Это явление называется «распираторным взрывом».
Вопрос 3) Биохимические отличия злокачественных клеток от здоровых. Митогены.
Задача.
Результат анализа мочи: суточный объём – 5,8 л, цвет – светло-жёлтый, прозрачность – полная, плотность – 1035 кг/м3 , реакция – кислая, осадок – нет, белок – нет, глюкоза – (+), кетоновые тела – нет, 17-кетостероиды - ↑, цилиндры – отсутствуют, эпителий почек – 0-1×', эритроциты – отсутствуют, лейкоциты – 2-3×', кристаллы – отсутствуют. Имеются ли отклонения от нормы у данного пациента
Да, характерные для вторичного сахарного диабета вследствие гиперпродукции кортизола (стероидный диабет)

билет 10 1. Пищевые углеводы. Схема переваривания углеводов в ЖКТ. Причины непереносимости молока.
Всостав пищи людей, наравне с другими питательными веществами, обязательно должны входить углеводы.
Прямым назначением углеводов является воспроизводство в организме теплоты и мускульной энергии. Принятые в избыточном количестве, превышающем текущий расход, углеводы в организме могут превращаться в жиры, которые потом идут на построение тканей. Кроме того, при избытке введенных в
организм углеводов часть их может отложиться в печени и в мышцах в виде запасного вещества — животного крахмала — гликогена.
Из огромного числа известных в химии углеводов далеко не все могут усваиваться человеческим организмом. Так, например, очень распространенный и легко доступный углевод — целлюлоза не усваивается человеком. Число усваиваемых человеческим организмом пищевых углеводов очень незначительно: их насчитывают пока только девять видов.
Пищевые углеводы в зависимости от химического строения разделяются на три группы: I группа — моносахариды: глюкоза, фруктоза, галактоза.
II группа — дисахариды: сахароза, лактоза, мальтоза. III группа — полисахариды: крахмал, инулин, гликоген.
Моносахариды очень легко и полно усваиваются человеческим организмом. Принятые с пищей они непосредственно всасываются стенками желудка и тонких кишок и затем переходят в кровь без всяких изменений. Содержание моносахаридов в крови человека регулируется самим организмом в очень узких пределах, причем основным регулирующим органом является печень. Нормальным содержанием моносахаридов в крови считается 0,10% по весу крови. Если же содержание моносахаридов в крови превышает норму, то при прохождении крови через печень избыточное количество моносахаридов откладывается в печени в виде гликогена. При прохождении через печень крови с недостаточным против нормы содержанием моносахаридов происходит обратное явление: гликоген переводит в глюкозу или фруктозу и присоединяется к крови. Таким образом, кровь выходит из печени всегда со строго отрегулированным содержанием моносахаридов. Иногда, когда печень бывает перегружена гликогеном, часть его может отложиться в мышцах, переходя обратно в кровь, если содержание моносахаридов в ней будет ниже нормы.
Дисахариды, сначала превращаются в моносахариды и уже в виде моносахаридов усваиваются организмом. Переход дисахаридов в моносахариды начинается в полости рта под действием фермента слюны — птиалина. Окончательно это превращение завершается в желудке и тонких кишках. Дисахариды усваиваются почти так же полно, как и моносахариды.
Полисахариды ведут себя несколько иначе.
Под действием ферментов слюны и желудочного сока полисахариды гидролизируются и превращаются в моносахариды. Однако переход полисахаридов в моносахариды совершается через ряд промежуточных соединений, причем процессы превращения никогда не доходят до конца. То, что успеет превратиться в моносахариды, усваивается организмом, а то, что не успеет перейти в моносахариды, уходит неиспользованным. Таким образом, полисахариды усваиваются неполно.
Переваривание углеводов
Перевариваниеэто процесс гидролиза веществ до их ассимилируемых форм. Переваривание бывает: 1). Внутриклеточное (в лизосомах); 2). Внеклеточное (в ЖКТ): а). полостное (дистантное); б). пристеночное (контактное).
Переваривание углеводов в ротовой полости (полостное)
Вротовой полости пища измельчается при пережёвывании и смачивается слюной. Слюна состоит на 99% из воды и обычно имеет рН 6,8. В слюне присутствует эндогликозидаза α-амилаза (α-1,4- гликозидаза), расщепляющая в крахмале внутренние α-1,4-гликозидные связи с образованием крупных фрагментов — декстринов и небольшого количества мальтозы и изомальтозы. Необходим ион Cl-. Переваривание углеводов в желудке (полостное)
Действие амилазы слюны прекращается в кислой среде (рН <4) содержимого желудка, однако, внутри пищевого комка активность амилазы может некоторое время сохраняться. Желудочный сок не содержит

ферментов, расщепляющих углеводы, в нем возможен лишь незначительный кислотный гидролиз гликозидных связей.
Переваривание углеводов в тонком кишечнике (полостное и пристеночное)
В двенадцатиперстной кишке кислое содержимое желудка нейтрализуется соком поджелудочной железы (рН 7,5—8,0 за счет бикарбонатов). С соком поджелудочной железы в кишечник поступает панкреатическая α-амилаза. Эта эндогликозидаза гидролизует внутренние α-1,4-
гликозидные связи в крахмале и декстринах с образованием мальтозы (2 остатка глюкозы, связанные α- 1,4-гликозидной связью), изомальтозы (2 остатка глюкозы, связанные α-1,6-гликозидной связью) и олигосахаридов, содержащих 3—8 остатков глюкозы, связанных α-1,4- и α-1,6-гликозидными связями. Переваривание мальтозы, изомальтозы и олигосахаридов происходит под действием специфических ферментов - экзогликозидаз, образующих ферментативные комплексы. Эти комплексы находятся на поверхности эпителиальных клеток тонкого кишечника и осуществляют пристеночное пищеварение. Сахаразо-изомальтазный комплекс состоит из 2 пептидов, имеет доменное строение. Из первого пептида образован цитоплазматический, трансмембранный (фиксирует комплекс на мембране энтероцитов) и связывающий домены и изомальтазная субъединица. Из второго - сахаразная субъединица. Сахаразная субъединица гидролизует α-1,2-гликозидные связи в сахарозе, изомальтазная субъединица - α-1,6-гликозидные связи в изомальтозе, α-1,4-гликозидные
связи в мальтозе и мальтотриозе. Комплекса много в тощей кишке, меньше в проксимальной и дистальной частях кишечника.
Гликоамилазный комплекс, содержит две каталитические субъединицы, имеющие небольшие различия в субстратной специфичности. Гидролизует α-1,4-гликозидные связи в олигосахаридах (с восстанавливающего конца) и в мальтозе. Наибольшая активность в нижних отделах тонкого кишечника.
β-Гликозидазный комплекс (лактаза) гликопротеин, гидролизует β-1,4-гликозидные связи в лактозе. Активность лактазы зависит от возраста. У плода она особенно повышена в поздние сроки беременности и сохраняется на высоком уровне до 5-7-летнего возраста. Затем активность лактазы снижается, составляя у взрослых 10% от уровня активности, характерного для детей.
Трегалаза гликозидазный комплекс, гидролизует α-1,1-гликозидные связи между глюкозами в трегалозе
— дисахариде грибов.
Переваривание углеводов заканчивается образованием моносахаридов – в основном глюкозы, меньше образуется фруктозы и галактозы, еще меньше – маннозы, ксилозы и арабинозы.
Главное условие усвоения углеводов в организме — их растворимость. Этим качеством обладают моносахариды. Поэтому процесс переваривания углеводов в ЖКТ сводится к расщеплению высокомолекулярных углеводов до моносахаридов.
1.Полость рта. Под действием фермента амилазы полисахариды частично расщепляются до декстринов.
2.Желудок. Переваривание углеводов не происходит из-за кислой среды в желудке.
3.Тонкий кишечник. Много ферментов, среда слабощелочная pH 7,8-8,2 обеспечивает оптимальную активность ферментов. Здесь происходит полное переваривание углеводов. Под действием амилазы крахмал расщепляется до декстринов, а затем до мальтозы. Ферментами дисахаризадами дисахариды расщепляются до моносахаридов. Сахароза: на глюкозу и фруктозу. Мальтоза: на две молекулы глюкозы. Лактоза: на глюкозу и галактозу. Моносахариды всасываются через стенку тонкого кишечника в кровь. Из углеводов только клетчатка не гидролизуется из-за отсутствия ферментов, а поступает в толстый кишечник.
4.Толстый кишечник. Клетчатка под действием фермента бета-глюкозидазы, выделяемой микробами, распадается. Часть ее используется для жизнедеятельности самих микроорганизмов, другая часть участвует в образовании кала и выводится из организма. Биологическое значение клетчатки: создает объем пищи, усиливает перистальтику кишечника, очищает ворсинки тонкого кишечника.
5.Печень. В печень моносахариды поступают по воротной вене. В печени галактоза и фруктоза и другие моносахариды преобразуются в глюкозу. В крови находится только глюкоза. В печени происходит: синтез гликогена и его отложение, при необходимости распад гликогена до глюкозы;

образование глюкозы из неуглеводных компонентов (молочной кислоты, глицерина и некоторых аминокислот). Этот процесс называется глюконеогенезом.
Лактоза – это дисахарид, который содержится в молоке всех млекопитающих и состоит из глюкозы и галактозы, связанных между собой. В разных молочных продуктах его количество отличается.
Впищеварительном тракте человека лактоза расщепляется ферментом лактазой и используется для строительства и получения энергии, как и все углеводы в нашем рационе. Лактоза гидролизуется в тонком кишечнике до глюкозы и галактозы, а та лактоза, которая не подверглась обработке, быстро переносится в толстый кишечник. Там ее расщепляют кишечные бактерии на короткоцепочечные жирные кислоты (уксусную, масляную и пропионовую кислоты) и газообразный водород. Короткоцепочечные жирные кислоты абсорбируются слизистой оболочкой толстой кишки, таким образом, неабсорбированная лактоза используется для производства энергии. Это механизм, который позволяет использовать молочный сахар у новорожденных и у взрослых с недостаточной активностью ферментов в тонком кишечнике.
2. Пигментный обмен. Роль печени в пигментном обмене. Виды желтух и причины их возникновения. Физиологическая желтуха новорожденных
Вэритроцитах имеется пигмент красного цвета – гемоглобин. Эритроциты живут около 120дней. Стареющие эритроциты улавливаются клетками РЭС – ретикулоэндотелиальной системы (селезенки, купферовскими клетками печени), в которых начинается распад гемоглобина. Сначала из гемоглобина образуется вердоглобин, затем биливердин (пигмент желтого цвета), который восстанавливается до билирубина (БР). БР, образованный в клетках РЭС, называют свободным (неконъюгированным с глюкуроновой кислотой), его же называют непрямым. Он гидрофобен и высоко токсичен. Выходя в кровь, он связывается с альбуминами и в таком комплексе доставляется в печень. В клетках печени – гепатоцитах БР связывается с глюкуроновой кислотой, образуя растворимый в воде связанный или прямой БР. Часть прямого БР из гепатоцитов выводится в кровяное русло, а большая часть активным транспортом выводится в желчные капилляры и попадает с током желчи в тонкий кишечник (рис.26). В кишечникеотсвязанного БР отщепляется глюкуроновая кислота и он снова становится свободным. Ферменты кишечной микрофлоры восстанавливают БР до бесцветного стеркобилиногена, который, окисляясь, превращается в стеркобилин – пигмент коричневого цвета, выводимый с калом. Часть стеркобилиногена всасывается по геморроидальным венам, попадает в почки и, окисляясь, выводится с мочой в виде стеркобилина мочи (уробилина).
Таким образом, в норме в крови присутствует и свободный (из клеток РЭС), и связанный (из гепатоцитов) БР. Концентрация общего БР в норме составляет 1,7 – 20 мкмоль/л, из них 25% приходится на связанный БР и 75% – на свободный. В норме в моче и кале присутствует стеркобилин, БР в моче нет, т.к. в крови преобладает сводный, гидрофобный БР, который не может выделяться с мочой.Повышение концентрации БР в крови называется гипербилирубинемией. При достижении определенной концентрации он диффундирует в ткани, окрашивая их в желтый цвет. Пожелтение тканей из-за отложения в них БР называют желтухой. Клинически желтуха может не проявляться до тех пор, пока концентрация БР не станет выше 50 мкмоль/л. По механизму развития различают три вида желтух.
Гемолитическая желтуха (надпеченочная) – результат интенсивного гемолиза эритроцитов (резусконфликт, переливание несовместимых групп крови, отравление гемолитическими ядами, укус змеи). Хотя способность печени образовывать связанный БР и выделять его в желчь в 3–4 раза превышает их образование в физиологических условиях, из-за усиленного гемолиза свободного БР образуется так много, что он не успевает весь захватываться гепатоцитами и остается в крови. Поэтому один из главных признаков этой желтухи – повышение содержания в крови свободного БР. Это позволяет легко отличить гемолитическую желтуху от механической и печеночной желтух. По сравнению с нормой в печени образуется больше связанного БР и большее количество его выделяется в кишечник, что ведет к усиленному образованию и выделению с мочой и калом стеркобилина и более интенсивному их окрашиванию. В моче БР отсутствует, т.к. в крови накапливается гидрофобный свободный БР, который не фильтруется в мочу. Свободный БР легко преодолевает ГЭБ, поражает головной мозг, вызывая энцефалопатию.
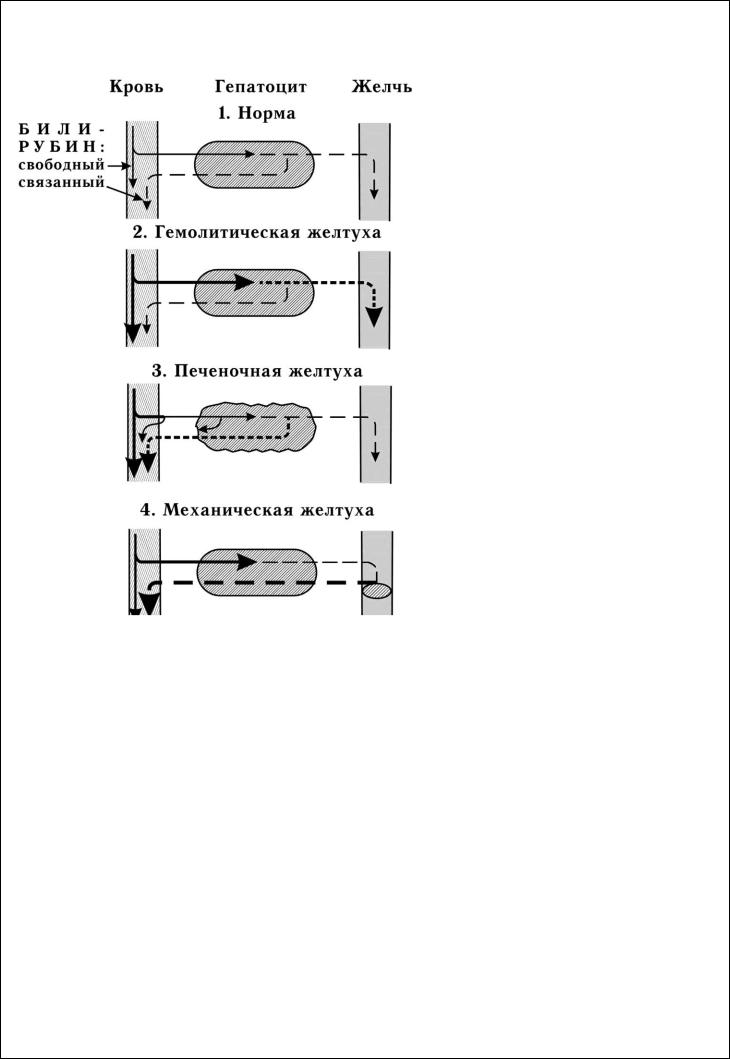
Механическая, или обтурационная желтуха (подпеченочная) развивается при нарушении оттока желчи в двенадцатиперстную кишку (при желчнокаменной болезни, опухоли желчного пузыря, головки поджелудочной железы). При полной закупорке общего
Рис.26.Патогенез желтух желчного протока связанный БР в составе желчи не поступает в кишечник, поэтому продуктов его
катаболизма – стеркобилинов в моче и кале нет. Кал обесцвечен. Так как экскреция связанного БР в желчь нарушена, происходит его выделение в кровь, поэтому в крови повышено содержание связанного БР. Этот растворимый БР экскретируется с мочой, придавая ей насыщенный оранжево-коричневый цвет. В сыворотке крови у больных повышена активность ферментов эпителия желчевыводящих путей
– щелочной фосфатазы и g- глутамилтрансферазы.
Печеночная желтуха обусловлена повреждением гепатоцитов, например, при вирусных гепатитах. Пораженные гепатоциты хуже захватывают свободный БР из крови и хуже экскретируют его в желчь против градиента концентрации. Поэтому при этой желтухе в крови повышается содержание как свободного, так и связанного БР, но прирост связанного более значителен. Поскольку экскреция желчи в кишечник нарушена, БР в кишечник поступает меньше, чем в норме, поэтому количество образующегося стеркобилиногена также снижено. Кал может быть гипохоличным, т.е. менее окрашенным. Моча, наоборот, имеет более интенсивную окраску за счет присутствия там не только стеркобилина, но связанного БР, который хорошо растворим в воде и экскретируется с мочой. В сыворотке крови больных повышена активность ЛДГ5, АлАТ> АсАТ.
У новорожденных бывает либо физиологическая, либо патологическая желтуха. Причины физиологической: эритроциты плода живут не 120 дней, а 80. У новорожденного ребёнка усилен гемолиз эритроцитов, следовательно, образуется больше гемоглобина и билирубина. Связывание и удаление билирубина замедлены из-за возрастной незрелости печени (отсутствуют некоторые белки и ферменты). Физиологическая желтуха неопасна, быстро проходит (~7 дней). Патологическая желтуха новорожденных чаще всего бывает гемолитической, длится более 7-ми дней. Возникает у резус-

положительного плода и резус-отрицательной матери, в тяжелых случаях может вызвать смерть плода. Кроме того, патологическая желтуха может быть связана с нарушением захвата билирубина гепатоцитами (синдром Жильбера), нарушением конъюгации с УДФ-глюкуроновой кислотой – наследственный дефект глюкуронилтрансфераз (синдром Криглера-Найяра) или с нарушением экскреции связанного билирубина в желчь (синдром Дабина-Джонсона).
Ацетилсалициловая кислота (аспирин) широко применяется как противовоспалительное и жаропонижающее средство. Как связан механизм действия аспирина с указанными эффектами?
Ацетилсалициловая кислота – неконкурентный, необратимый ингибитор фермента циклооксигеназы, контролирующего ключевой этап превращения полиеновых жирных кислот (в основном, арахидоновой [20:4, ω-6], в меньшем количестве эйкозапентаеновой [20:5, ω-3] и эйкозатриеновой [20:3, ω-6] кислот) в эйкозаноиды, многие из которых являются медиаторами воспаления.

Билет 11
1) Синтез гликогена в печени и скелетных мышцах. Регуляция процесса
Накопление гликогена в мышцах отмечается в период восстановления после работы, особенно при приеме богатой углеводами пищи.
В печени гликоген накапливается только после еды, при гипергликемии. Такие отличия печени и мышц обусловлены наличием различных изоферментов гексокиназы, фосфорилирующей глюкозу в глюкозо- 6-фосфат. Для печени характерен изофермент (гексокиназа IV), получивший собственное название – глюкокиназа. Отличиями этого фермента от других гексокиназ являются:
- низкое сродство к глюкозе, что ведет к захвату глюкозы печенью только при ее высокой концентрации
вкрови, продукт реакции (глюкозо-6-фосфат) не ингибирует фермент, в то время как в других тканях гексокиназа чувствительна к такому влиянию. Это позволяет гепатоциту в единицу времени захватывать глюкозы больше, чем он может сразу же утилизовать. Благодаря особенностям глюкокиназы гепатоцит эффективно захватывает глюкозу после еды и впоследствии метаболизирует ее
влюбом направлении. При нормальных концентрациях глюкозы в крови ее захват печенью не производится.
Регулирование: - Два гормона — адреналин и глюкагон — могут активировать фосфорилазу и таким образом ускорять процессы гликогенолиза. Начальные моменты влияний этих гормонов связаны с образованием в клетках циклического аденозинмонофосфатау который затем запускает каскад химических реакций, активирующих фосфорилазу. - Адреналин выделяется из мозгового вещества надпочечников под влиянием активации симпатической нервной системы, поэтому одна из ее функций заключается в обеспечении обменных процессов. Эффект адреналина особенно заметен в отношении клеток печени и скелетных мышц, что обеспечивает наряду с влияниями симпатической нервной системы готовность организма к действию. - Глюкагон — гормон, выделяемый альфа-клетками поджелудочной железы, когда концентрация глюкозы в крови снижается до слишком низких значений. Он стимулирует образование циклического АМФ главным образом в клетках печени, что, в свою очередь, обеспечивает превращение в печени гликогена в глюкозу и ее высвобождение в кровь, повышая таким образом концентрацию глюкозы в крови.
2) Антисвёртывающая и фибринолитическая системы крови.
противосвертывающая (антикоагулянтная) система крови.
-антитромбин-3 (механизм его действия - блокада тромбина);
-гепарин (механизм его действия – снижение адгезии и агрегации тромбоцитов); Антитромбин-3 и гепарин обеспечивают 80 % антикоагулянтной активности.
-2 – Макроглобулин (прогрессивный ингибитор тромбина, калликреина, плазмина и трипсина) дает 10%; - Протеины С, S и другие антикоагулянты.
Вторичные физиологические антикоагулянты – образуются в процессе свертывания крови и фибринолиза в результате ферментативной деградации ряда факторов свертывания, в следствии чего после начальной активации они утрачивают способность участвовать в гемокоагуляционном процессе и приобретают свойства антикоагулянтов (фибрин, антитромбин-4, продукты расщепления фибрина)
Существуют 2 противосвертывающие системы: 1. Естественные антикоагулянты, которые обеспечивают нейтрализацию небольшого избытка протромбина на местном уровне, без привлечения других систем организма. Сюда же входят клетки макрофаги, которые способны поглощать факторы свертывания. 2. Включается через рецепторные окончания, избытком тромбина в крови. Рефлекторно повышается выделение естественных антикоагулянтов и активаторов фибринолиза.
Фибринолитическая (плазминовая) система крови. Фибринолиз – процесс расщепления фибринового сгустка, в результате которого происходит расщепление просвета сосуда. Плазминовая система состоит из 4х основных компонентов: 1. Плазминоген; 2. Плазмин; 3. Активаторы проферментов фибринолиза; 4. Ингибиторы фибринолиза.
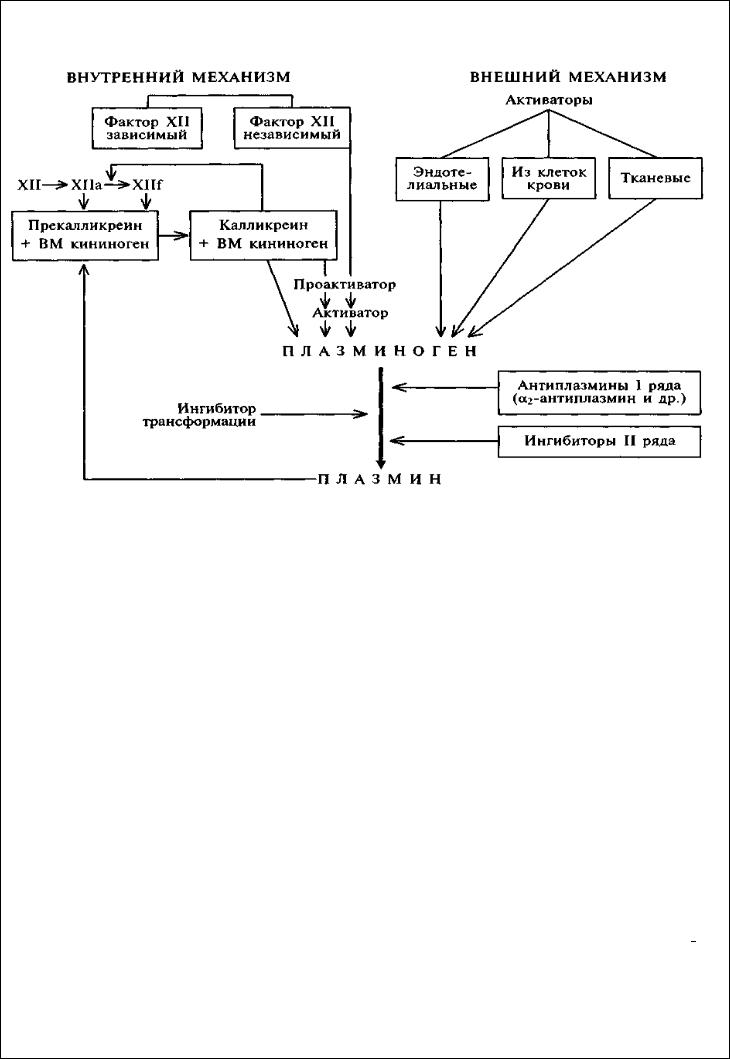
схема фибринолиза
3) Маркеры заболеваний бронхолёгочной системы. Механизмы повреждающего действия полимеров α1-антитрипсина.
1.α-1антитрипсин относится к белкам острой фазы. Воспалительные процессы могут усиливать его образование и способствовать повреждению печени. α-1антитрипсин тормозит не только действие трипсина, но и химотрипсина, эластазы, калликреина, катепсинов, и других тканевых протеаз.
α -1антитрипсин является генетическим маркером оценки устойчивости бронхолегочной системы. Недостаточность α-1антитрипсина приводит к расщеплению структуры соединительной ткани особенно в легких, при этом разрушаются альвеолярные перегородки. В легких вместо отдельных альвеол, образуются полости, способность к обмену О2 и СО2 снижается из-за малой площади поверхности. Развивается энфизема 2.Гаптоглобин - относится к белкам острой фазы. Основной функцией является сохранение железа в
организме, а комплекс гемоглобин-гаптоглобин обладает пероксидазной активностью направленный на процессы ПОЛ.
3. С3 ключевой компонент комплемента, образуется в печени, входит в состав иммунных комплексов. Система комплемента состоит из 9-ти компонентов и 3-х ингибиторов. Для лизиса бактерий требуется активация от С3 до С9 компонентов системы. Снижение уровня С3 компонента в крови приводит к ослаблению опсонизирующей функции крови и фагоцитоза. Увеличение С3 в сыворотке характерно для острой фазы воспаления. 4. и также целесообразно определение в крови маркеров СРО (МДА) и миелопероксидазы, амелоид А.
Механизм повреждающего действия полимеров α -1антитрипсинов. Замена аминокислот в функционально активных участках ингибиторов протеолиза ведет к их внутриклеточной агрегации. 1. В некоторых случаях с β-структурным участком ингибитора взаимодействует не собственная петля, а петля другой молекулы ингибитора, что приводит к образованию димера молекул, при этом инициируется дальнейшая полимеризация ингибитора с образование агрегатов. 2. Полимеры α - 1антитрипсина в легких служат хемоаттрактантами для нейтрофилов. Оказывая

противовоспалительный эффект полимеры ингибитора способствуют развитию воспаления и закислению среды.
Билет 12
Вопрос 1. Гликолиз: общая характеристика*, стадии, реакции процесса**, регулируемые ферменты, энергетический эффект***.
Глико́лиз — процесс окисления глюкозы, при котором из одной молекулы глюкозы образуются две молекулы пировиноградной кислоты. Гликолиз состоит из цепи последовательных ферментативных реакций и сопровождается запасанием энергии в форме АТФ и НАДH. Суммарное: Глюкоза +
2НАД+ + 2АДФ + 2P → 2 пируват + 2НАДH + 2Н+ + 2АТФ + 2Н2O.
Кислород не требуется для протекания гликолиза. В аэробных условиях пировиноградная кислота далее декарбоксилируется, соединяется с коферментом А и вовлекается в цикл Кребса. В анаэробных условиях (при гипоксии) пируват восстанавливается до молочной кислоты либо претерпевает дальнейшие превращения в ходе брожения.
**Распад шестиуглеродного сахара глюкозы на две молекулы трёхуглеродного пирувата осуществляется в 10 стадий, первые 5 которых составляют подготовительный этап с затратой АТФ, а 5 последующих — этап, сопряжённый с образованием АТФ. Все сахара и их производные, образующиеся при гликолизе, являются D-изомерами.
***Энергетический эфф-т гликолиза: на начальных этапах энергия затрачивается: при превращениях 1 мол. Глюкозы – 2 мол. АТФ; при превращениях 1 глюкозного фрагмента гликогена – 1 мол. АТФ.
Вопрос 2) Гемоглобин
Гемоглобин - основной белок крови Гемоглобин входит в состав группы белков гемопротеины, которые сами являются подвидом
хромопротеинов и подразделяются на неферментативные белки (гемоглобин, миоглобин)
и ферменты (цитохромы, каталаза, пероксидаза). Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
Строение гемоглобина
Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями, при этом они взаимодействуют не произвольно, а определенным участком – контактной поверхностью. Этот процесс высокоспецифичен, контакт происходит одновременно в десятках точек по принципу комплементарности. Взаимодействие осуществляют разноименно заряженные группы, гидрофобные участки, неровности на поверхности белка.
Белковые субъединицы в нормальном гемоглобине могут быть представлены различными типами полипептидных цепей: α, β, γ, δ, ε, ξ (соответственно, греч. - альфа, бета, гамма, дельта, эпсилон, кси). В состав молекулы гемоглобина входят по две цепи двух разных типов.
Гем соединяется с белковой субъединицей, во-первых, через остаток гистидина координационной связью железа, во-вторых, через гидрофобные связи пиррольных колец и гидрофобных аминокислот. Гем располагается как бы "в кармане" своей цепи и формируется гемсодержащий протомер.
Нормальные формы гемоглобина
Существует несколько нормальных вариантов гемоглобина:
HbР (primitive) – примитивный гемоглобин, содержит 2ξ- и 2ε-цепи, встречается в эмбрионе между 7-12 неделями жизни,
HbF (foetal) – фетальный гемоглобин, содержит 2α- и 2γ-цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев,
HbA (adult) – гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина,
HbA2 – гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи,
HbO2 – оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98% от всего количества гемоглобина,
HbCO2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
Патологические формы гемоглобина
HbS – гемоглобин серповидно-клеточной анемии.
MetHb – метгемоглобин, форма гемоглобина, включающая трехвалентный ион железа вместо двухвалентного.
Hb-CO – карбоксигемоглобин, образуется при наличии СО (угарный газ) во вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях, но его доля может колебаться от условий и образа жизни.
HbA1С – гликозилированный гемоглобин. Концентрация его нарастает при хронической гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени (время жизни эритроцита, 3-4 месяца).
Вопрос 3) Синдром дыхательных расстройств
Задача.
Холестерин легко встраивается в мембрану. Предложите механизмы удаления избытка холестерола из мембраны, исходя из строения молекулы данного вещества.
Холестерин – амфифильное вещество с преобладанием гидрофобных свойств. При его этерификации под действием фермента ацилхолестеролацилтрансфераза (АХАТ) образуется эфир, мене растворимый в липидном бислое. Кроме того, избыточный холестерин из мембран клеток эндотелия акцептируется ЛПВП.
13билет
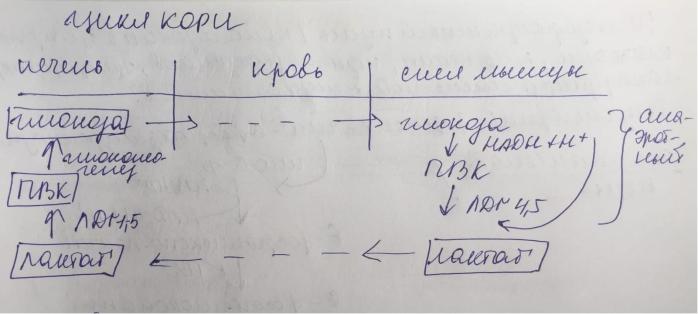
1)Биосинтез глюкозы (глюконеогенез). Субстраты, энергетические затраты, регулируемые ферменты. Цикл Кори.
ЦИКЛ КОРИ
мышцы перекладывают нагрузку на печень, те кровью лактат доставляется из мышц в печень, где вновь из лактата синтезируется глюкоза для поддержания нормы в крови 3,5-6 ммоль/л
(глюконеогенез). На карбоксилирование 2 молекул пирувата затрачивается 2 молекулы АТФ. Далее 2 молекулы ГТФ требуются для образования фосфоенолпирувата из оксалоацетата. И ещё 2 молекулы АТФ необходимы для фосфорилирования 2 молекул 3-фосфо- глицерата до 1,3- бисфосфоглицерата. Энергия восстановительных эквивалентов (NADH) нужна для образования глицеральдегид-3-фосфата. Если привести все энергоносители к одному знаменателю (АТФ), то мы получим, что в ходе глюконеогенеза затрачивается:
1.4 молекулы АТФ и 2 молекулы ГТФ (эквивалентны 2 молекулам АТФ); 2.2 молекулы NADH (эквивалентны 6 молекулам АТФ).
Суммируем все затраты и получаем: 4 АТФ + 2 АТФ + 6 АТФ = 12 АТФ
2) Кортизол: химическая природа, механизм действия, органымишени, биологические эффекты. Биосинтез. Кортизол синтезируется корой надпочечников из холестерола.
Механизм действия кортизолаЦитозольный.
Нервная система реагирует на внешние воздействия , посылая нервные импульсы в гипоталамус. В ответ на сигнал гипоталамус секретирует кортиколиберин, который переносится кровью по т.н. воротной системе прямо в гипофиз и стимулирует секрецию им АКТГ. Последний поступает в общий кровоток и, попав в надпочечники, стимулирует выработку и секрецию корой надпочечников кортизола.
Выделившийся в кровь кортизол достигает клеток-мишеней (в частности, клеток печени), проникает путем диффузии в их цитоплазму и связывается там со специальными белками – рецепторами кортизола. Образовавшиеся гормон-рецепторные комплексы после «активации» связываются с соответствующей областью ДНК и активируют определенные гены, что в итоге приводит к увеличению выработки специфических белков. Именно эти белки и определяют ответнуюреакцию организма на кортизол, а значит, и на внешнее воздействие, послужившее причиной его секреции. Реакция состоит, с одной стороны, в усилении синтеза глюкозы в печени и в проявлении (разрешении) действия многих других гормонов на обменные процессы, а с другой – в замедлении распада глюкозы и синтеза белков в ряде тканей, в том числе мышечной. Таким образом, эта реакция направлена в основном на экономию имеющихся энергетических ресурсов организма (снижение их расходования мышечной тканью) и восполнение утраченных: синтезируемая в печени глюкоза может запасаться в виде гликогена – легко мобилизуемого потенциального источника энергии. Мишенью является лимфоидная, эпителиальная(слизистые оболочки и кожа), жировая, костная и мышечнаяткани, печень.
Биологические эффекты:
1.Белковый обмен· значительное повышение катаболизма белков в мишеневых тканях. Однако в печени в целом стимулирует анаболизм белков. · стимуляция реакций трансаминирования через синтез аминотрансфераз, обеспечивающих удаление аминогрупп от аминокислот и получение углеродного скелета кетокислот, 2.Углеводный обмен В целом вызывают повышение концентрации глюкозы крови:· усиление
мощности глюконеогенеза · увеличение синтеза гликогена в печени · снижение проницаемости мембран для глюкозы в инсулинзависимых тканях.
3.Липидный обмен· стимуляция липолиза в жировой 5.Противовоспалительное и иммунодепрессивное действие 6.Повышает чувствительность бронхов и сосудов к катехоламинам, что обеспечивает нормальное функционирование сердечно-сосудистой и бронхолегочной систем.
3) Молекулярные механизмы патогенеза острого панкреатита
Важным звеном в патогенезе панкреатита независимо от этиологии является окислительный стресс .
Вкрови повышается концентрация активных форм кислорода (АФК) и уровень ПОЛ, наблюдается истощение запасов аскобиновой кислоты, имеющей антиоксидантные свойства.
Вподжелудочной железе развивается воспаление. Нейтрофилы включаются в механизмы воспаления и уровень АФК растет ( более чем в 100 раз). Активация проферментов и выход трипсина способствует прогрессированию панкреатита и развитию осложнений, в частности, поражению легких. Это приводит к росту сосудистой проницаемости и нарушению кровоснабжения ткани. С одной стороны, продуцируемые нейтрофилами АФК и лейкотриены вызывают агрегацию тромбоцитов, а с другой - продукты активации тромбоцитов, такие как серотонин, эпинефрин, АДФ, АТФ усиливают адгезивные свойства нейтрофилов. Присутствие тромбоцитов индуцирует хемотаксис нейтрофилов, а также генерацию ими АФК.
Помимо усиления продукции АФК при панкреатитах наблюдаются и другие проявления окислительного стресса: повышение уровня МДА, снижение содержания аскорбиновой кислоты, повышение уровня фосфолипазы А2 и эластазы сегментоядерных лейкоцитов. Активация ферментов антиоксидантной защиты-СОД, каталазы, глутатионпероксидазы наблюдается на начальных стадиях заболевания, а затем активность их снижается.
Задача.
Лечебные препараты лидаза и ронадаза содержат фермент гиалуронидазу. C какой целью можно использовать эти препараты?
Ответ:
Показаниями для их применения являются рубцы после ожогов и операций, тугоподвижность суставов после воспалительных процессов и травм, спаечная болезнь. Во всех этих случаях гиалуронидаза обеспечивает расщепление гиалуроновой кислоты в составе спаек, рубцов, способствуя их рассасыванию.
14 билет
Вопрос 1) Липопротеины высокой плотности, функции и тд
Общая характеристика
образуются в печени de novo, в плазме крови при распаде хиломикронов, некоторое количество в стенке кишечника,
в составе частицы примерно половину занимают белки, еще четверть фосфолипиды, остальное холестерин и ТАГ (50% белка, 25% ФЛ, 13% эфиров ХС и 5% свободного ХС, 7% ТАГ),
структурным апобелком является апо А1, также содержат апоЕ и апоСII.
Функция
1.Транспорт свободного ХС от тканей к печени.
2.Фосфолипиды ЛПВП являются источником полиеновых кислот для синтеза клеточных фосфолипидов и эйкозаноидов.
Метаболизм 1. Синтезированные в печени частицы (насцентные или первичные ЛПВП) содержат в основном
фосфолипиды и апобелки. Остальные липидные компоненты накапливаются в ЛПВП по мере метаболизма в плазме крови.
2-3. В плазме крови насцентный ЛПВП сначала превращается в ЛПВП3 (условно его можно назвать "зрелый"). В этом превращении главным является то, что ЛПВП
забирает от клеточных мембран свободный холестерин при непосредственном контакте или при участии специфических транспортных белков,
взаимодействуя с мембранами клеток, отдает им часть фосфолипидов из своей оболочки, доставляя таким образом полиеновые жирные кислоты в клетки,
тесно взаимодействует с ЛПНП и ЛПОНП, получая от них свободный холестерин. В обмен ЛПВП3 отдают эфиры ХС, образованные благодаря переносу жирной кислоты от фосфатидилхолина (ФХ) на холестерин (ЛХАТ-реакция, см п.4).
4.Внутри ЛПВП активно протекает реакция при участии лецитин:холестерол-
ацилтрансферазы (ЛХАТ-реакция). В этой реакции остаток полиненасыщенной жирной кислоты переносится от 2-го положения фосфатидилхолина (из оболочки самого ЛПВП) на получаемый свободный холестерин с образованием лизофосфатидилхолина (лизоФХ) и эфиров ХС. ЛизоФХ остается внутри ЛПВП, эфир холестерина отправляется в ЛПНП.
5. В результате первичный ЛПВП постепенно, через зрелую форму ЛПВП3, преобразуется в ЛПВП2 (остаточный, ремнантный). При этом происходят и дополнительные события:
взаимодействуя с разными формами ЛПОНП и ХМ, ЛПВП получают ацил-глицеролы (МАГ, ДАГ, ТАГ), и обмениваются холестерином и его эфирами,
ЛПВП отдают апоЕ- и апоСII-белки на первичные формы ЛПОНП и ХМ, и потом забирают обратно апоСII-белки от остаточных форм.
Таким образом, при метаболизме ЛПВП в нем происходит накопление свободного ХС, МАГ, ДАГ, ТАГ, лизоФХ и утрата фосфолипидной оболочки. Функциональные способности ЛПВП снижаются. 6. Далее ЛПВП2 захватывается гепатоцитами при помощи апоА-1-рецептора, происходит эндоцитоз и частица разрушается.
Вопрос 2) Функции сосудистого эндотелия, субэндотелия, тромбоцитов
Сосудистое звено представлено: эндотелием, субэндотелием, гмк 1.Сосудистый эндотелийимеет ряд функций, создающих мощную антикоагулянтную поверхность предотвращающую тромбообразование.
Функции:а) обладает контактной инертностью, т.е. имеет отрицательный заряд за счет отрицательно заряженных гепарансульфата и дерматан-сувльфата, которые отталкивают отрицательнозаряженные клетки крови, тромбоциты
Б) синтезируют биологически активные вещества: простациклин и NO,вызывающие вазадилятацию В) содержит факторы препятствующие свёртыванию крови :тромбомодулин , протеинS, антиконвертин,тканевой активатор плазминогена
Г) Обесп структурную и функциональную целостность сосудистой стенки 2.Субэндотелий Структурная целостность обесп коллагеном, эластином, фибронектином А) содержит плазменные факторы свертывания: тканевой тромбопластин.5,7 фактор Б)содержит вазоконстрикторы: эндотелин 1, норадреналин
3.ГМК регулирует просвет сосуда, при сокращении –уменьш просвет сосуда,при расслаблении увел Тромбоциты – это клетки, ответственные за формирование первичной тромбоцитарной пробки в зоне повреждения за счет адгезии и последующей агрегации.
1. α-Гранулы содержат тромбоцитарные факторы , участвующие в гемостазе, которые обозначают буквой Р.11 тромбоцитарных факторов ,10 участвуют в в процессе свертывания: тромбоцитарный проакцелерин, тромбопластин, антигепаринвый фактор , фибриноген, тромбостенин, антифибринолитический фактор, фибринстабилизирующий фактор,серотонин активавтор фибринолиза
2.плотные гранулы-представляют с собой хранилище АДФ,АТФ, серотонина и ионов Са 2+
3.Пероксисомы –вырабатвываютH2O2.который способствует выработке тромбоксана,который вызывает агрегацию тромбоцитов
4.Лизосомальные гранулы-содержат гидролитический фермент –гидролазу.
Первичный гемостаз обеспечивает остановку кровотечения из мелких сосудов за счет обеспечения их спазма, адгезии, агрегации, секреции из тромбоцитов биологически активных веществ с образованием белого тромбоцитарного тромба.
2. Адгезия тромбоцитов. Происходит в первую очередь вследствие изменения заряда сосудистой стенки на положительный. В результате тромбоциты, имеющие отрицательный заряд задерживаются у травмированного участка. Они меняют свою форму и превращаются в клетки с длинными отростками и контактируют с соединительной тканью сосудистой стенки.
Вопрос 3) Диагностика панкреатита
Убольных острым и хроническим панкреатитами исследуют кровь, мочу, слюну, каловые массы, дуоденальное и перитонеальное содержимое.
При исследовании гемограммы больных с острым и хроническим панкреатитом (рецидивирующая форма) могут быть обнаружены лейкоцитоз со сдвигом лейкоцитарной формулы влево до нейтрофильных гранулоцитов, эозинофилия, увеличение СОЭ. Иногда при тяжелых формах хронического панкреатита развивается гипохромная анемия и лейкопения, особенно при нарушении кишечного всасывания.
При биохимическом исследовании крови больных с острым и хроническим рецидивирующим панкреатитами отмечаются повышение уровней а1- и а2-глобулинов, уменьшение количества альбумина, снижение альбумин-глобулинового коэффициента и определяется активность С- реактивного белка.
Убольных острым и хроническим панкреатитами в стадии обострения может нарушаться электролитный обмен, что проявляется снижением в крови количества натрия и кальция, повышением уровня калия при нормальном содержании магния. Однако, учитывая этиологическую роль гиперкальциемии в развитии острого и хронического рецидивирующего панкреатитов при аденоматозе паращитовидных желез, сопровождающемся увеличением содержания в крови паратгормона, становится понятно, что некоторые его формы сопровождаются гиперкальциемией. При билиарном панкреатите, выраженном отеке и фиброзе головки поджелудочной железы могут наблюдаться упорная гипербилирубинемия, увеличение уровня щелочной фосфатазы в крови, а при сопутствующем хроническом неспецифическом реактивном гепатите нарастает тимоловая проба. Для диагностики острого и хронического рецидивирующего панкреатитов, сопровождающихся аутолизом ткани поджелудочной железы, используют повышение содержания аланин (АлАТ) и аспартатаминотрансферазы (АсАТ) в крови. Повышение уровня трансаминаз в крови не специфично для поражений поджелудочной железы и поэтому определение их активности при панкреатитах ограничено. Наибольшее диагностическое значение имеет выявление повышенного уровня АсАТ, наблюдаемого при билиарных панкреатитах и сочетанных гепатитах, например, при злоупотреблении алкоголем.
Для диагностики заболеваний поджелудочной железы применяют иммунологические методы, которые можно разделить на три группы:
1.Определение содержания нормальных и измененных антигенов ткани, а также отдельных составных компонентов поджелудочной железы в крови и биологических жидкостях.
2.Определение количества антител или сенсибилизированных лимфоцитов против антигенов поджелудочной железы или ее отдельных компонентов, комплексов антиген - антитело как показателей иммунного ответа.
3.Определение иммунологических показателей, характеризующих состояние клеточного и гуморального иммунитета, степень реактивности иммунной системы.
При патологических состояниях поджелудочной железы часто продуцируется и поступает в кровоток избыточное количество различных ее антигенных компонентов, определение содержания которых может служить диагностическим тестом.
Задача.
В крови пациента обнаружена повышенная концентрация неконъюгированного билирубина. Как иначе называется это вещество, каковы его свойства? На основании, каких симптомов, выявленных у пациента, врач назначил этот анализ? Назовите возможные причины повышения концентрации неконъюгированного билирубина в крови.
Билет 15 1) Переваривание белков. Схема процесса. Характеристика ферментов
Процесс переваривания начинается в желудке и продолжается в тонком кишечнике под действием пептидгидролаз.
Вжелудке белки пищи денатурируются и гидролизуются до высокомолекулярных пептидов.
Вкишечнике панкреатические пептидазы продолжают гидролиз высокомолекулярных пептидов до олиго- три-, дипептидов и свободных аминокислот. Короткие пептиды расщепляются до свободных аминокислот в процессе пристеночного пищеварения в клетках кишечного эпителия. Затем происходит их всасывание и транспорт в кровеносное русло. Характеристика протеолитических ферментов
ЖКТ
Протеолитические ферменты ЖКТ относят к классу гидролаз и обладают относительной субстратной специфичностью.. Основные пептидазы синтезируются в клетках желудка, поджелудочной железы и кишечника. В зависимости от места гидролиза пептидной связи в полипептидной цепи белка все пептидазы делятся на эндопептидазы и экзопептидазы. Экзопептидазы (карбоксипептидазы А и В, аминопептидазы) отщепляют концевые N- и C-аминокислоты. Эндопептидазы (пепсин, трипсин, химотрипсин, эластаза) расщепляют внутренние пептидные связи.
Желудочные и панкреатические пептидазы вырабатываются а неактивной форме в виде проферментов, активируются за счёт ковалентной модификации путём частичного протеолиза. Место синтеза проферментов и место их активации пространственно разделены (синтез протекает в клетках, а активация - в просвете ЖКТ). Такой механизм образования активных форм ферментов необходим для защиты секреторных клеток желудка и поджелудочной железы от самопереваривания. Частичный протеолиз лежит в основе активации пепсина, трипсина, химотрипсина, эластазы, карбоксипептидаз А и В.
Ферменты эпителия кишечника (аминопептидаза, ди- и трипептидазы) синтезируются сразу в активной форме.
Переваривание белков в желудке В желудке пища подвергается воздействию желудочного сока, включающего соляную кислоту и ферменты. Значение рН желудочного сока 1,5- 2,5. Слизистая оболочка желудка вырабатывает соляную кислоту и пепсиноген. В образовании соляной кислоты принимают участие париетальные (обкладочные) клетки желудка, образующие ионы Н+ и переносящие ионы Сl– из крови в полость, желудка.
Полостное переваривание белков в кишечнике. Желудочное содержимое (химус) в процессе переваривания поступает в 12-кишку, где при рН=7,8-8,9 под действием панкреатических ферментов до низкомолекулярных пептидов, ди-, три-пептидов и свободных аминокислот.
Пристеночное переваривание в кишечнике Последний этап переваривания происходит в пристеночном слое кишечника под действием ферментов аминопептидаз, ди- и трипептидаз, которые синтезируются клетками кишечного эпителия в активной форме. Дипептидазы, трипептидазы расщепляют ди-и трипептиды на свободные аминокислоты.
Врезультате последовательных действий всех пищеварительных протеаз большинство пищевых белков в ЖКТ расщепляется до свободных аминокислот, которые поступают в кровеносное русло и разносятся во все органы и ткани организма.
2) биологические мембраны. Строение. свойства. Функции.
Биологические мембраны – это биологические структуры ограничивающие клетки и внутриклеточные органеллы. выполняют функции:• барьерную: отделяют клетки от окружающей среды; • транспортную
- осуществляют транспорт огромного числа веществ в клетку; • информационносигнальную - участвуют в обеспечении межклеточных взаимодействий, передаче внутрь клетки сигналов; • каталитическую – некоторые белки мембран обладают ферментативной активностью. свойства: • текучесть (жидкостность) - способность компонентов мембраны к движению. • избирательная проницаемость: мембраны регулируют обмен веществами с окружающей средой; обеспечивают поддержание трансмембранного градиента ионов; • динамичность – молекулы липидов с высокой скоростью двигаются в плоскости мембраны (латеральная диффузия), быстро вращаются вокруг своих продольных осей (вращательная диффузия.
Липидный состав мембран В мембранах присутствуют следующие типы липидов: фосфолипиды, гликолипиды и холестерин. Фосфолипиды мембран можно разделить на 2 группы - глицерофосфолипиды и сфингофосфолипиды Белки мембран Белки по их расположению в мембране и способу ассоциации с липидным бислоем
делят на: • поверхностные (периферические) - связанные с гидрофильной поверхностью липидного бислоя; • интегральные - погруженные в гидрофобную область бислоя.
По выполняемым функциям мембранные белки можно разделить на две группы: структурные и динамические. Структурные белки поддерживают структуру всей мембраны. Динамические Выделяют три класса таких белков: • транспортные – участвующие в трансмембранном переносе веществ; • каталитические – это ферменты, интегрированные в мембрану и катализирующие происходящие там реакции;• рецепторные – это мембранные рецепторы, специфически связывающие такие соединения, как гормоны, нейромедиаторы, токсины Углеводы мембран. Находятся только в соединении с белками (гликопротеины и протеогликаны) и
липидами (гликолипиды). В мембране гликозилировано около 10% всех белков и 5–25% липидов. Углеводные цепи белков колеблются по составу от 2-членных структур до разветвленных 18-членных полисахаридов.
3) Патогенетические особенности нейродегенеративных заболеваний нервной системы
Такие заболевания как болезнь Альцгеймера, Хантингтона, Паркинсона являются результатом нарушения нормального процесса формирования структуры белка. Растворимый белок за счет неправильного фолдинга белка превращается в нерастворимые внеклеточные амилодные волокна. Такие заболевания относят к амилоидозам.
Отложение амилоида приводит к разрушению клеток. Болезнь Альцгеймера вызвана отложением внеклеточного амилоида нейронами при участии белка βамилоида. Отложение амилоида является одной из ведущих причин заболевания, кроме того у таких больных происходит агрегация белка тау, который вызывает лобно-височную деменцию. С возрастом значительно увеличивается количество окисленных белков, в ходе таких реакций образуются альдегиды и свободные радикалы. Образующиеся β-амилоидные агрегты усиливают образование пероксида водорода, формируется окислительный стресс.
Сывороточный белок амилоид яляется нормальным белкомпредшественником фибрилярного тканевого белка, синтезирующегося в печени.
Задача.
Болезнь Паркинсона – заболевание, характеризующееся повышенным тонусом скелетных мышц (дрожанием конечностей), иногда ограниченностью в движениях. При этом заболевании нарушен обмен дофамина, концентрация которого резко снижается. Для лечения применяют производные ДОФА или ингибиторы МАО. Объясните действие этих препаратов.
Ответ:
Диоксифенилаланин (ДОФА) – предшественник медиатора – дофамина, ингибиторы моноаминооксидазы (МАО) замедляют окисление (инактивацию) этого биогенного амина.
16 билет.
Вопрос 1.Трансаминирование АК
*Под трансаминированием подразумевают реакции межмолекулярного переноса аминогруппы (NH2—) от аминокислоты на α-кетокислоту без промежуточного образования аммиака. Реакции трансаминирования являются обратимыми и универсальными для всех живых организмов. Реакции катализируют ферменты аминотрансферазы.
Реакции трансаминирования протекают в 2 стадии. На первой стадии к пиридоксальфосфату
вактивном центре фермента присоединяется аминогруппа от первого субстрата – аминокислоты. Образуется комплекс фермент-пиридоксаминфосфат и кетокислота – первый продукт реакции. Этот процесс включает промежуточное образование 2 шиффовых оснований (альдимин и кетимин).
На второй стадии пиридоксаминфосфат соединяется с новой кетокислотой (второй субстрат) и снова через промежуточное образование 2 шиффовых оснований передает аминогруппу на кетокислоту. В результате фермент возвращается в свою нативную форму, и образуется новая аминокислота – второй продукт реакции.
**Трансаминирование осуществляется несколькими ферментами, в том числе аминотрансферазами, которые являются производными пиридоксина — одного из витаминов группы В (В6). Без этого витамина синтез аминокислот затрудняется, что снижает нормальную продукцию белка.
Вопрос 2.Роль АФК в механизме фагоцитоза. Кислород зависимые и кислороднезависимые механизмы фагоцитоза. Роль АФК в антимикробной защите грудного молока
*Свободные радикалы в иммунитете в фагоцитозе осуществляется микро и макрофагами: нейтрофилами, моноцитами, тканевыми макрофагами, остеокластами, клетками микроглии. После того как микроб свяжется с рецепторами фагоцитирующих клеток, начинается образование пищеварительной вакуоли, или фагосомы. Вскоре с фагосомой сливаются лизосомы, в нейтрофилах их роль выполняют азурофильные гранулы. Микроорганизм разрушается, непереваренные остатки выбрасываются наружу.
Узнавание микроба резко изменяет метаболизм фагоцита, происходит его активация, выражающаяся в усилении поглощения кислорода. Это явление получило название "дыхательного" или "респираторного" взрыва. Потребление кислорода клеткой возрастает в 20-40 раз. При этом 90% потребляемого клеткой кислорода быстро превращается
всупероксид анион-радикал под действием мембранного фермента НАДФН-оксидазы (NOX) и выделяется во внеклеточное пространство (цитотоксический эффект) или внутрь фаголизосомы (бактерицидный эффект).
** Кислороднезависимые механизмы внутриклеточной цитотоксичности фагоцита обеспечиваются действием лизосомальных ферментов, разрушающих объект фагоцитоза. 1. Лизоцим разрушает клеточную стенку бактерий. 2. Катионные белки повреждают бактериальную цитоплазматическую мембрану. 3. Рибонуклеаза разрушает РНК
микроорганизмов. Дезоксирибонуклеаза разрушает ДНК микробов. 4. Лактоферрин активно связывает железо, необходимое для размножения бактерий.
Б. Кислородзависимые механизмы внутриклеточной цитотоксичности фагоцита описываются как «респираторный взрыв». 1. После поглощения объекта фагоцитоза у фагоцита возрастает потребность в кислороде, вследствие которой происходит интенсификация метаболизма О2.
2. В результате резко повышается синтез токсических кислородных продуктов, обладающих микробоцидной активностью (ведущий из них – синглетный кислород; кроме него к этой группе веществ относятся супероксидный радикал, перекись водорода и катализирующая ее
токсическое воздействие на микроорганизмы миелопероксидаза, гидроксильный радикал, хлорноватистая кислота).
*** Различают специфические и неспецифические факторы антимикробной защиты грудного молока. К специфическим относят иммуноглобулины. К неспецифическим факторам относят ксантиноксидазу, лактопероксидазу, лактоферрин, лизоцим, компоненты комплемента, а также клеточные элементы, обладающие фагоцитирующей активностью и способностью вырабатывать нейтрофилы и макрофаги.
Механизм заключается в том, что ксантиноксидаза окисляет ксантин либо гипоксантин и образует супероксидный анион-радикал – ведущую активную форму кислорода в процессах свободнорадикального окисления. Нейтрализуя супероксидный анион-радикал путём образования перекиси водорода, патогенные вирулентные бактерии вызывают ещё больший огонь на себя, запуская в действие лактопероксидазу, для которой перекись водорода является необходимым субстратом. Лактоферрин освобождает двухвалентное железо и катализирует распад перекиси водорода с образованием гидроксильного радикала, атакующего жирные кислоты бактериальных липидов. Благодаря сочетанному действию этих и других факторов (лизоцим разрушает полисахариды клеточной бактериальной стенки) важнейшие структуры бактериальных клеток подвергаются деструкции, что и приводит к гибели бактерии.
Вопрос 3. Метаболические механизмы алкоголизма.
Системные поражения, которые вызывает в организме алкоголь: расстройство метаболизма (углеводного, липидного и белкового) и расстройства в нейромедиаторной системе (изменения содержания ацетилхолина и катехоламинов).
В окисление включается никотинадениндинуклеотид (НАД), что влечет за собой нарушение равновесия во многих цепях метаболизма. Привлечение ацетил-Ко-А вызывает нарушение цикла Кребса, в котором коэнзим служит субстратом. Углерод из молекулы этанола включается в синтез углеводов, жиров и белков, нарушая естественное течение этого синтеза; кроме того, молекулы этанола замещают жиры и углеводы в энергетическом обмене, вторично тем самым нарушая метаболизм этих основных субстанций.
Задача Больной, проживающий в местности с дефицитом йода, обратился с жалобами на зябкость,
«отсутствие энергии» для занятий спортом. При обследовании зафиксирована брадикардия, обнаружено увеличение щитовидной железы (зоб). Какова возможная причина этих симптомов у данного пациента? Что бы Вы ему посоветовали?
Химический элемент йод, в виде йодид-аниона, а также аминокислота тирозин необходимы для биосинтеза тиреоидных гормонов. Приведённый симптомы отражают их дефицит и попытку компенсации за счёт разрастания железистой ткани щитовидной железы (зоб).
Билет 17 1) Окислительное дезаминирование (прямое, непрямое) аминокислот. Схема процесса, стадии, ферменты. Биологическое значение процесса Дезаминирование – процесс удаления
α-аминогруппы из аминокислот и выделение ее в виде аммиака. При дезаминировании в отличие от трансаминирования общее количество аминокислот уменьшается. Значение дезаминирования состоит в выделении аммиака, который используется для синтеза мочевины, образовании α-кетокислот, используемых для различных метаболических процессов и окислении до углекислоты и воды с образованием энергии. Существует несколько видов дезаминирования: Окислительное (прямое– характерно только для глутаминовой кислоты и непрямое – характерно для остальных аминокислот) Неокислительное – характерно для серина, треонина, цистеина и гистидина; Прямое окислительное дезаминирование В организме коллектором всех аминокислотных аминогрупп является глутаминовая кислота, и только она подвергается окислительному дезаминированию с образованием аммиака и α--кетоглутаровой кислоты:
Самое распространенное в организме – непрямое окислительное дезаминирование, трансдезаминирование, которое проходят все аминокислоты на стадии катаболического превращения. Процесс идет в два этапа: 1) в результате реакций трансаминирования аминные группы собираются в составе глутаминовой кислоты В качестве кетокислоты-акцептора в организме обычно используется α- кетоглутаровая кислота, которая превращается в глутамат. 2) глутамат поступает в митохондрии, где подвергается прямому дезаминированию в глутаматдегидрогеназной реакции. α-лутарат, образующийся при дезаминировании глутаминовой кислоты, используется в ЦТК или для синтеза
глюкозы. 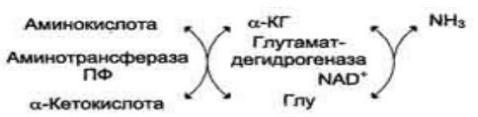
Дезаминирование серина и треонина происходит с отщеплением воды под действием серин- и треониндегидратазы. Из серина образуются пируват и аммиак, а из треонина α–кетобутират и NH3.
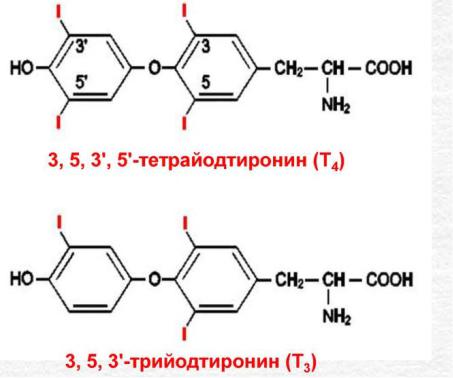
2) Гормоны щитовидной железы: химическая природа и структура, этапы биосинтеза.
Химическая природа: производные аминокислоты тирозина (гидроксифенил-аланин). Тиреоциты вырабатывают два тиреоидных гормона: Т3 и Т4. Место синтеза: щитовидная железа, клетки её эпителия –тироциты.
Биосинтез тиреоидных гормонов включает в себя 4 этапа. 1. этап — включение йода в щитовидную железу. Йод в виде органических и неорганических соединений поступает с пищей и водой в желудочно-кишечный тракт и всасывается в кишечнике в форме йодидов. Йодиды с кровью доставляются к щитовидной железе, которая благодаря действию системы активного транспортанта Na+-K+-АТФ-азы в базальной мембране тиреоцитов захватывает йодиды со скоростью 2 мкг в час и концентрирует их.
2 этап — окисление йодида в молекулярный йод I+. Этот этап происходит с помощью фермента пероксидазы и перекиси водорода (Н2О2) в качестве акцептора электронов. Пероксидаза непосредственно связана с мембраной тиреоцита.
3 этап— органификация йода. Молекулярная форма йода высокоактивна. I+ быстро связывается с молекулой аминокислоты тирозина, содержащейся в тиреоглобулине. При связывании йода с одной молекулой тирозина образуется монойодтирозин, с двумя молекулами — дийодтирозин.
4 этап — окислительная конденсация. Под влиянием окислительных ферментов из двух молекул дийодтирозина образуется тироксин (тетрайодтиронин), из монойодтирозина и дийодтирозина — трийодтиронин. Биологически активными являются лишь L-формы (L-изомеры) гормонов щитовидной железы. Процесс образования Т4 и Т3происходит в тиреоците на молекуле тиреоглобулина, затем T4 и Тз перемещаются в просвет фолликула, где и накапливаются. Количество тиреоидных гормонов, депонированных в щитовидной железе, таково, что их хватит для поддержания состояния эутиреоза более месяца.
Высвобождение и поступление гормонов в кровь происходит под влиянием тиреотропного гормона.
3) Метаболизм этанолаМетаболические превращения этанола осуществляется двумя путями:
окислительным и неокислительным. Окислительный путь является главным и сопровождается образованием ацетальдегида и активно протекает в печени, осуществляется 3 способами: 1)окисление в гепатоцитах с помощью фермента алкогольдегидрогеназы (АДГ) и кофактора НАД+ до 70-80% этанола. В ходе реакции образуется ацетальдегид и НАДН+.
2) Окисление микросомальной системой с участием изоформы цитохрома р450. Содержание цитохрома р450 в печени алкоголиков в 10 раз превышает норму. Этот путь играет определяющую роль в развитии метаболической толерантности к алкоголю. 3) Окисление с помощью каталазы, оксидаз и пероксидаз. В норме метаболизируется 13%, а при алкоголизме роль пути возрастает.
При неокислительном пути образуются эфиры этанола с жирными кислотами, накапливаясь они обладают повреждающим действием. В норме ацетоальдегид под воздействием альдегидрогеназы превращается в ацетат, который в ЦТК окисляется до СО2 и Н2О. При алкоголизме повышение концентрации ацетальдегида стимулируется ПОЛ, модифицируется система глютатиона в печени, нарушая процессы детоксикации, этанол повреждает мембраны, через мембрану и межклеточное пространство выходит в кровь и любую клетку организма.
Задача.
Больной жалуется на неутолимую жажду. Суточный объём мочи – 4,5 л, плотность – 1004 кг/м3. Глюкоза и кетоновые тела в моче не обнаружены. При каком заболевании может быть такая клиническая картина? Какова возможная причина таких симптомов?
Ответ: У больного – несахарный диабет, при котором нарушается концентрационная функция почек вследствие нехватки антидиуретического гормона (вазопрессина).
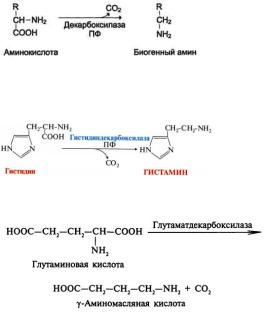
Билет 18
Вопрос 1. Декарбоксилирование аминокислот. Биологическое значение. Продукты и их судьба.
1) Декарбоксилирование – процесс отщепления карбоксильной группы аминокислот в виде СО2. Реакции декарбоксилирования необратимы и катализируются ферментами декарбоксилазами. Продуктами реакции являются СО2 и амины, Амины, образовавшиеся при декарбоксилировании аминокислот, часто являются биологически активными веществами. Они выполняют функцию нейромедиаторов (серотонин, дофамин, ГАМК и др.), гормонов (норадреналин, адреналин.
Гистамин образуется при декарбоксилировании гистидина, вызывает расширение капилляров, повышение их проницаемости, понижает АД, стимулирует секрецию слюны, усиливает секрецию соляной кислоты в желудке.
g-аминомасляная кислота (ГАМК) образуется при декарбоксилировании глутаминовой кислоты, оказывает тормозящее действие на ЦНС.
Дофамин образуется из тирозина в почках, надпочечниках, является нейромедиатором ингибирующего типа.ТИРОЗИН-----(тирозингидросилаза ,О2,Н2О,) 3,4-ДИОКСИФЕНИЛАЛАНИН-- --(декарбоксилаза ароматических аминокислот ,СО2) ДОФАМИН Серотонин образуется из триптофана , оказывает мощное сосудосуживающее действие, регулирует АД, температуру тела, дыхание, почечную фильтрацию.
2. Альдостерон: химическая природа, механизм действия, органы-мишени, биологические эффекты.
Альдостерон гормон коры надпочечников Механизм действия внутриклеточный
Органы мишени: почки, слюнные железы, жкт,миокард.
регуляция секреции Альдостерона тесно связана с механизмами водно-солевого гомеостаза
и кровообращения.(недостаток ионов Na в плазме крови,избыток в плазме ионов калия, действие ангиотензина-2.
Биоз н: регулирует обмен натрия, усиливает обратное всасывание натрия в почках. Альдостерон потенцирует действие катехоламинов и оказывает на сердце положительное инотропное действие. Высокая концентрация в плазме вызывает снижение секреции ренина почками.
Ингибирует синтез – ДОФа В почках в клетках ЮГА синтезируется ренин. Ренин участвует в регуляции сосудистого тонуса,
превращая ангиотензиноген в декапептид ангиотензин-I путем ограниченного протеолиза. Из ангиотензина-I под действием фермента карбоксикатепсина образуется октапептид ангиотензин-II. Он обладает сосудосуживающим эффектом, а также стимулирует выработку гормона коры надпочечников — альдостерона. Альдостерон усиливает реабсорбцию натрия и воды в почечных канальцах — это приводит к увеличению объема крови, циркулирующей в сосудах. В результате повышается артериальное давление.
3)Моногенные заболевания
Задача.
2,4-динитрофенол (исключён из списка лекарственных веществ), в прошлом пытались использовать для лечения ожирения, но отказались из-за его токсических эффектов. На чём был основан выбор данного вещества как «средства для похудения», и чем опасно его применение?
При разобщении окислительного фосфолированиядля поддержания синтеза атф на необх уровне организму придется расщеплять больше субстратов, что действ приводит к снижению массы тела. Однако применение протонофакторов опасно развитием неконролируемой гипертензии при фатальном снижении синтеза атф
19 билет 1. Синтез мочевины: схема реакций, суммарное уравнение.
Впечени весь удаляемый аммиак используется для синтеза мочевины. Увеличение синтеза мочевины наблюдается при распаде тканевых белков и азотистых соединений (голодание, воспалительные процессы, сахарный диабет) или при избыточном белковом питании.
Синтез мочевины начинается в митохондриях (первая и вторая реакции), оставшиеся три реакции идут в цитозоле.
Вобразовании одной молекулы мочевины участвует 1 молекула NH4+, 1 молекула CO2, аминогруппа 1 молекулы аспарагиновой кислоты, затрачивается 4 макроэргических связи трех молекул АТФ.
Как побочный продукт орнитинового цикла образуется фумаровая кислота, переносимая обратно в митохондрии. Здесь в реакциях ЦТК из нее образуется оксалоацетат, который трансаминируется с глутаматом до аспартата, выходит в цитозоль и вновь реагирует с цитруллином.
Допустимое значение 2,5—8,3 миллимолей на литр в крови Нарастание содержания мочевины в крови
до 16—20 ммоль/л - нарушение функции почек средней тяжести,
до 35 ммоль/л — как тяжелое;
свыше 50 ммоль/л — очень тяжелое.
при острой почечной недостаточности - 50—83 ммоль/л. Увеличение содержания мочевины в крови наблюдается при:
усиленном её образовании в результате богатого белками рациона питания, чрезмерного катаболизма белка, лейкозов, желтухи, тяжелых инфекционных заболеваний, непроходимости кишечника, ожогов, дизентерии, шока;
кровотечении из верхних отделов желудочно-кишечного тракта;
приеме некоторых лекарств - сульфаниламидов, левомецитина, тетрациклина и других. Снижение содержания мочевины в крови наблюдается при:
особенно тяжелых поражениях печени, в частности при отравлении фосфором, мышьяком, декомпенсированном циррозе;
голодании;
пониженном катаболизме белков;
после введения глюкозы;
после гемодиализа.
Норма мочевины в моче330 до 580 ммоль/сутки.
2. Кальцитонин: химическая природа, механизм действия и биологические эффекты. Паратиреоидный гормон: химическая природа, органымишени, биологические эффекты. Влияние на обмен кальция и фосфора гипо- и гиперпродукции ПТГ.
Кальцитонин вырабатывается и секретируется клетками ЩЖ. В небольшом количестве его также могут вырабатывать тимус и паращит.железа.
Хим.природа – пептидная.
Механизм действия: мембранно-внутриклеточный.
Органы-мишени – кости (остеокласты), почки, желудок, кишечник, клетки ЦНС.
Стимулируют биосинтез и секрецию кальцитонина – гастрин и высокое содержание Ca2+ в крови. Кальцитонин антагонист ПТГ по биологическим эффектам – тормозит резорбтивные процессы в костной ткани и снижает уровень ионизированного кальция и фосфатов в крови.
Биологические эффекты:
Подавляет резорбцию костного минерала остеокластами
Подавляет реабсорбцию ионов Ca и фостфатов, а также ионов Na, K, Mg.
Снижает секрецию гастрина и соляной кислоты в желудке; трипсина и амилазы в экзокринной части поджелудочной железы.
Усиливает поступление в кишечник Н2О и ионом Na, K, Cl.
Оказывает прямой анальгетический эффект, действуя на рецепторы клеток гипоталамуса и лимбической системы.
Паратгормон синтезируется паращитовидными железами в видепрепрогормона, который затем превращается в зрелый гормон путем частичного протеолиза.
ПТГ секретируется в ответ на снижение концентрации кальция в крови. Основными органами-мишенями для гормона являются кости и почки.
Гормон инициирует каскад событий, связанный с аденилатциклазойостеобластов, которые стимулируют метаболическую активность остеоКластов. Происходит мобилизация Са2+ из кости и поступление фосфатов в кровь, а дистальных канальцах почек стимулируется реабсорбцияфосфатов, в результате чего восстанавливается нормальный уровень Са2+ во внеклеточной жидкости. Гиперпаратиреоз. Избыточная секреция паратгормона, возникающая в результате опухоли околощитовидной железы, диффузной гиперплазии желез, карциномы паращитовидной железы
(первичный гиперпаратиреоз), приводит к повышению мобилизации кальция и фосфатов из кости, усилению реабсорбции кальция и выведению фосфатов в почках. Вследствие этого возникает гиперкальциемия, которая может приводить к снижению нервно-мышечной возбудимости и мышечной гипотонии. У больных появляется общая и мышечная слабость, быстрая утомляемость и боли в отдельных группах мышц, увеличивается риск переломов позвоночника, бедренных костей и костей предплечья.Увеличение концентрации фосфата и ионов кальция в почечных канальцах может служить причиной образования в почках камней и приводит к гиперфосфатурии и гипофосфатемии. Гипопаратиреоз. Основным симптомом гипопаратироза, обусловленного недостаточностью паращитовидных желез, является гипокальциемия. Понижение концентрации ионов кальция в крови может вызвать неврологические, офтальмологические и сердечно-сосудистые нарушения, а также поражения соединительной ткани.У больного гипопаратиреозом отмечается повышение нервномышечной проводимости, приступы тонических судорог, судороги дыхательных мышц и диафрагмы, ларингоспазм.
3. Патобиохимия инфаркта миокарда.
Особенности обмена белков. Образование аммиака идет пуриновым циклом; Интенсивно идет переаминирование оксалоацетата с различными аминокислотами, поэтому высока в клетках активность АсАТ (аспартатаминотрансферазы). Активность АсАТ в сердечной мышце почти в 10.000 раз выше, чем в сыворотке. Повышение активности АсАТ в сыворотке крови отмечено при целом ряде заболиваний и особенно при поражении сердечной мышцы (инфаркт миокарда), когда идет разрушении клеток миокарда с выходом АсАТ в кровь.
Ранние маркеры некроза миокарда:
1.Миоглобин
2.МВ-КФК (сердечная форма креатинфосфокиназы — КФК)
3.Сердечная форма белка, связывающего жирные кислоты (сБСЖК)
Поздние маркеры некроза миокарда:
1.Лактатдегидрогеназа (ЛДГ)
2.Аспартатаминотрансфераза (АсАТ)
3.Сердечные тропонины I и Т
При проведении теста на толерантность к глюкозе её концентрация в крови натощак и через 2 ч после сахарной нагрузки оказалась, соответственно 5 и 11,1 ммоль/л. Имеется ли в этих результатах отклонение от нормы? С какой целью выполнено это исследование?
"Диабетическим порогом" считают концентрацию глюкозы выше 7 ммоль/л: при таком неоднократном результате исследования однозначно ставиться диагноз «сахарный диабет». Промежуток уровня глюкозы натощак 4,5-6,9 ммоль/л является неоднозначным и подозрительным, поэтому и требует проведения теста на толерантность к глюкозе.
В норме концентрация глюкозы плавно растёт в течение первого часа до максимального значения 9,5- 9,8 ммоль/л с последующим возвращением к фоновому значению через два часа. Нормой также считается уровень менее 7,8 ммоль/л по окончании исследования при любом значении уровня сахара натощак. В том случае, если через 2 часа после приёма глюкозы уровень сахара в крови составляет более 7,8 ммоль/л, но в тоже время он меньше критического показателя в 11,1 ммоль/л, то говорят о снижении толерантности организма к глюкозе. Если же после проведения теста на толерантность к
глюкозе уровень сахара в крови остался на уровне свыше 11,1 ммоль/л, то это является непосредственным признаком сахарного диабета.
Билет 20
1)Катаболизм пуриновых нуклеотидов. Резервные пути реутилизации пуриновых нуклеотидов. Подагра.
Наиболее активно катаболизм пуринов идет в печени, тонком кишечнике (пищевые пурины) и почках.
Реакции катаболизма пуринов Реакции распада пуринов можно условно разделить на 5 стадий:
1. Дефосфорилирование АМФ и ГМФ – фермент 5'-нуклеотидаза.
2. Гидролитическое отщепление аминогрупы от С6 в аденозине – фермент дезаминаза. Образуется инозин.
3. Удаление рибозы от инозина (с образованием гипоксантина) и гуанозина (с образованием гуанина) с ее одновременным фосфорилированием – фермент нуклеозидфосфорилаза.
4. Окисление С2 пуринового кольца: гипоксантин при этом окисляется до ксантина (фермент ксантиноксидаза), гуанин дезаминируется до ксантина – фермент дезаминаза.
5. Окисление С8 в ксантине с образованием мочевой кислоты – фермент ксантиноксидаза. Около 20% мочевой кислоты удаляется с желчью через кишечник, где она разрушается микрофлорой до CO2 и воды. Остальная часть удаляется через почки.
Гиперурикемия подагры. Когда в плазме крови концентрация мочевой кислоты превышает норму, то возникает гиперурикемия. Вследствие гиперурикемии может развиться подагра - заболевание, при котором кристаллы мочевой кислоты и уратов откладываются в суставных хрящах, синовиальной оболочке, подкожной клетчатке с образованием подагрических узлов, или тофусов. К характерным признакам подагры относят повторяющиеся приступы острого воспаления суставов (чаще всего мелких) - так называемого острого подагрического артрита. Заболевание может прогрессировать в хронический подагрический артрит. Поскольку лейкоциты фагоцитируют кристаллы уратов, то причиной воспаления является разрушение лизосомальных мембран лейкоцитов кристаллами мочевой кислоты. Освободившиеся лизосомальные ферменты выходят в иитозоль и разрушают клетки, а продукты клеточного катаболизма вызывают воспаление.
2)Инсулин: химическая природа, локализация биосинтеза, схема синтеза, механизм действия, органы-мишени, биологические эффекты.
Строение.
Инсулин представляет собой белок, состоящий из двух пептидных цепей А (21 аминокислота)
и В (30 аминокислот), связанных между собой дисульфидными мостиками. Всего в зрелом инсулине человека присутствует 51 аминокислота и его молекулярная масса равна 5,7 кДа.
Синтез
Инсулин синтезируется в β-клетках поджелудочной железы в виде препроинсулина, на N-конце которого находится концевая сигнальная последовательность из 23 аминокислот, служащая проводником всей молекулы в полость эндоплазматической сети. Здесь концевая последовательность сразу отщепляется и проинсулин транспортируется в аппарат Гольджи.
На данном этапе в молекуле проинсулина присутствуют А-цепь, В-цепь и С-
пептид (англ. connecting – связующий). В аппарате Гольджи проинсулин упаковывается в секреторные гранулы вместе с ферментами, необходимыми для "созревания" гормона . По мере перемещения гранул к плазматической мембране образуются дисульфидные мостики, вырезается связующий С-пептид (31 аминокислота) и формируется готовая молекула инсулина. В готовых гранулах инсулин находится в кристаллическом состоянии в виде гексамера, образуемого с участием двух ионов Zn2+.
Около 15% молекул проинсулина поступает в кровоток. Проинсулин обладает более слабой активностью (около 1:10), но большим периодом полувыведения (около 3:1), по сравнению с инсулином. Поэтому повышение его уровня может вызывать гипогликемические состояния, что наблюдается при инсулиномах.
Регуляция синтеза и секреции
Секреция инсулина происходит постоянно, и около 50% инсулина, высвобождаемого из β-клеток, никак не связано с приемом пищи или иными влияниями. В течение суток поджелудочная железа выделяет примерно 1/5 от запасов имеющегося в ней инсулина.
Главным стимулятором секреции инсулина является повышение концентрации глюкозы в крови выше 5,5 ммоль/л, максимума секреция достигает при 17-28 ммоль/л. Особенностью этой стимуляции является двухфазное усиление секреции инсулина:
первая фаза длится 5-10 минут и концентрация гормона может 10-кратно возрастать, после чего его количество понижается,
вторая фаза начинается примерно через 15 минут от начала гипергликемии и продолжается на протяжении всего ее периода, приводя к увеличению уровня гормона в 15-25 раз.
Чем дольше в крови сохраняется высокая концентрация глюкозы, тем большее число β-клеток подключается к секреции инсулина.
Мишени
Рецепторы инсулина находятся практически на всех клетках организма, кроме нервных, но в разном количестве. Нервные клетки не имеют рецепторов к инсулину, т.к. последний просто не проникает через гематоэнцефалический барьер.
Наибольшая концентрация рецепторов наблюдается на мембране гепатоцитов (100-200 тыс на клетку) и адипоцитов (около 50 тыс на клетку), клетка скелетной мышцы имеет около 10 тысяч рецепторов, а эритроциты - только 40 рецепторов на клетку.
Механизм действия
После связывания инсулина с рецептором активируется ферментативный домен рецептора. Так как он обладает тирозинкиназной активностью, то фосфорилирует внутриклеточные белки - субстраты инсулинового рецептора. Дальнейшее развитие событий обусловлено двумя направлениями: MAPкиназный путь и ФИ-3-киназный механизмы действия.
При активации фосфатидилинозитол-3-киназного механизма результатом являются быстрые эффекты – активация ГлюТ-4 и поступление глюкозы в клетку, изменение активности "метаболических" ферментов – ТАГ-липазы, гликогенсинтазы, гликогенфосфорилазы, киназы гликогенфосфорилазы, ацетил-SКоА-карбоксилазы и других.
При реализации MAP-киназного механизма (англ. MAP - mitogen-activated protein)
регулируются медленные эффекты – пролиферация и дифференцировка клеток, процессы апоптоза и антиапоптоза.
3) Полиморфизм гена апобелка Е, клиническое значение.
Аллельный полиморфизм гена aполипопротеина Е (ApoE) - генетический маркер риска нарушений липидного обмена. Исследование аллельного полиморфизма гена ApoE имеет
прогностическое значение, позволяющее определить риск развития ишемической болезни сердца вследствие нарушения липидного обмена.
Задача.
У больного обнаружена глюкоза в моче, концентрация глюкозы в крови – 11 ммоль/л, содержание С- пептида – ниже нормы. О каких нарушениях в организме говорят эти данные?
Ответ:
С-пептид освобождается при образовании активной формы инсулина. Снижение содержания С- пептида говорит о снижении синтеза инсулина, т.е., сахарном диабете I типа.
Билет 21
1. Схема переваривания пищевых липидов в ЖКТ: этапы, субстраты, ферменты, роль продуктов гидролиза, роль жёлчных кислот.
1.Основные липиды, поступающие с пищей, являются жирами (до 90%). Переваривание жиров - это процесс их гидролиза под действием фермента панкреатическая липаза. Для действия этого фермента необходимы следующие условия (рис. 8.1): рН-7,8; желчные кислоты, эмульгирующие жиры; белок колипаза, синтезируемый в поджелудочной железе и секретируемый вместе с панкреатической липазой.
2.Эмульгирование (смешивание жира с водой) происходит в тонком кишечнике под действием солей жёлчных кислот . Жёлчные кислоты синтезируются в печени из холестерола и сек-ретируются в жёлчный пузырь. Содержимое жёлчного пузыря - жёлчь. После приёма жирной пищи жёлчный пузырь сокращается и жёлчь изливается в просвет двенадцатиперстной кишки. Жёлчные кислоты действуют как детергенты, располагаясь на поверхности капель жира и снижая поверхностное натяжение. В результате крупные капли жира распадаются на множество мелких, т.е. происходит эмульгирование жира.
Б. Гормоны, активирующие переваривание жиров
При поступлении пищи в желудок, а затем в кишечник клетки слизистой оболочки тонкого кишечника начинают секретировать в кровь пептидный гормон холецистокинин . Этот гормон действует на жёлчный пузырь, стимулируя его сокращение, и на клетки поджелудочной железы, стимулируя секрецию числе панкреатической липазы.
В. Переваривание жиров панкреатической липазой
Панкреатическая липаза выделяется в полость тонкой кишки из поджелудочной железы вместе с белком колипазой.
Белок – колипаза активируется и после этого облегчает связывание панкреатической липазы с мицеллами и таким образом ускоряет процесс гидролиза. Панкреатическая липаза с большей скоростью расщепляет в жирах сложноэфирные связи в 1- и 3-положениях, поэтому основными продуктами переваривания жиров являются 2-моноацилглицеролы и жирные кислоты.
3. Образование смешанных мицелл. Продукты гидролиза жиров (жирные кислоты, моноацилглицеролы), а также желчные кислоты, холестерол, жирорастворимые витамины образуют смешанные мицеллы и в такой форме проникают в клетки слизистой оболочки тонкой кишки, где мицеллы распадаются на составные компоненты, а продукты гидролиза жиров подвергаются ресинтезу.
2. Особенности метаболизма и энергетического обмена в клетках поперечно-полосатой мускулатуры и миокарда.

3. Концепция «двууглеродного голода».
Задача.
В эксперименте с культурой клеток обнаружено, что при активации ПОЛ повышается концентрация ионов Са2+ в цитоплазме. Как можно объяснить это явление?
Ответ.
В норме ионы кальция могут проникнуть внутрь клетки через ионные каналы. В ходе ПОЛ в мембране образуются гидрофильные поры, что увеличивает проницаемость мембраны. Кроме того, ПОЛ может
нарушить функционирование кальциевого насоса (прямым повреждением и в результате снижения синтеза АТФ).

Билет 22 1) Анаэробный распад глюкозы (анаэробный гликолиз). Судьба продуктов гликолиза в
анаэробных условиях. Биологическое значение анаэробного распада глюкозы. Цикл Кори.
В определѐнных ситуациях обеспечение кислородом тканей может не соответствовать их потребностям. Например, на начальных стадиях интенсивной мышечной работы при стрессе сердечные сокращения могут не достигать нужной частоты, а потребности мышц в кислороде для аэробного распада глюкозы велики. В подобных случаях включается процесс, который протекает без кислорода и заканчивается образованием молочной кислоты (лактата) из ПВК. процесс называют анаэробным гликолизом. Он энергетически малоэффективен, но может стать единственным источником энергии для мышечной клетки. В дальнейшем, когда снабжение мышц кислородом будет достаточным в результате перехода сердца на ускоренный ритм, анаэробный распад переключается на аэробный.
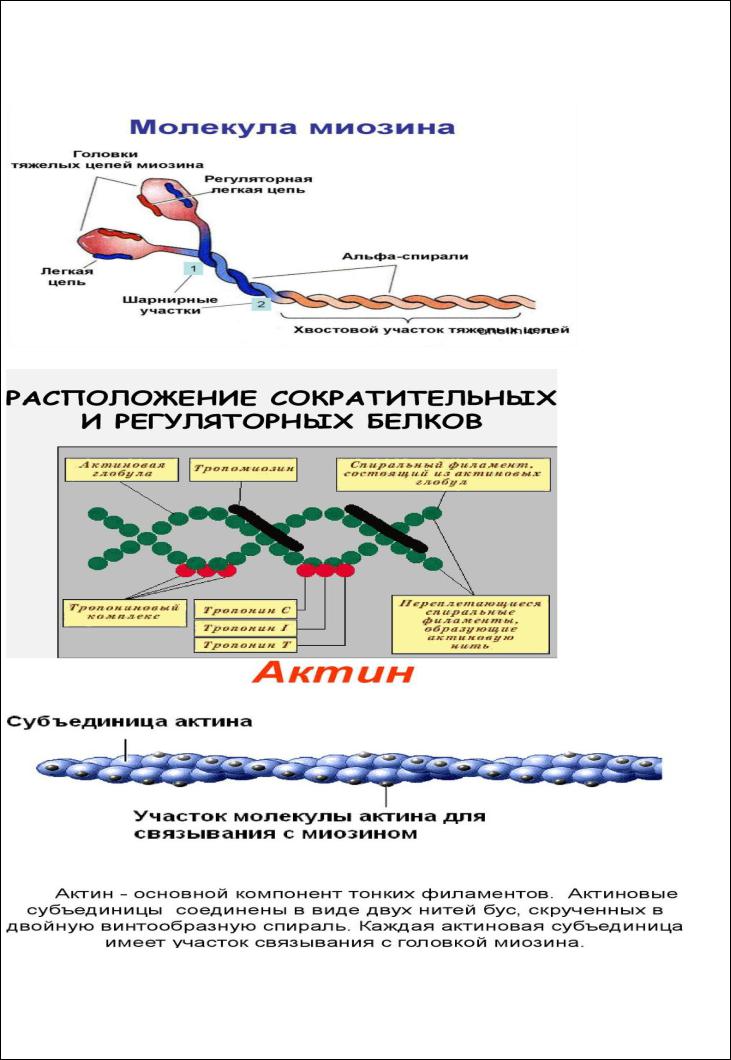
2) Характеристика и роль фибриллярных и регуляторных белков в процессе мышечного сокращения. Механизм мышечного сокращения, этапы. Роль ионов кальция в реализации механизма мышечного сокращения. Миозин - главный белок миофибрилл, обладающий АТФ-азной активностью. Т.е . в ходе реакции химическая энергия АТФ превращается в механическую энергию – сокращения мышц.
ТРОПОНИН Белок с четвертичной структурой, состоящей из трех субъединиц: • Тн-С – кальцийсвязывающей • (похож на кальмодулин), • Тн-Т - тропомиозинсвязывающей • Тн-I - ингибирующей . • Полный Тн комплекс имеет форму запятой, размеры которой сопоставимы с размерами 2-3 мономеров актина. Один тропониновый комплекс приходится на 7 мономеров актина.

ТРОПОМИОЗИН • палочковидная молекула длиной, состоит из двух неидентичных альфаспиралей, перекрученных друг относительно друга, и уложена в желобке спиральной цепочки Fактина
Механизм мышечного сокращения
При мышечном сокращении миозин вступает в соединение с F-актином , образуя новый белковый комплекс-актомиозин. Актомиозин обладает АТФ-азной активностью, но эта активность отличается от АТФ-азной активности миозина. АТФ-аза актомиозина активируется ионами Мg++ . Ингибируется ЭДТА ( этилендиамидтетраацетатом) и АТФ в высоких концентрациях. АТФ -аза миозина ингибируется Мg++ , активируется ЭДТА не ингибируется АТФ. рН ферментов также различны.
При сокращении поперечнополосатой мускулатуры важную роль играют временные мостики, которые возникают при продвижении активированных нитей (тонкий филамент) вдоль миозиновых (толстый филамент). Этими мостиками являются головки миозина, обладающие АТФазной активностью.
Этапы цикла мышечного сокращения
1.Когда мышца находится в состоянии покоя, АТФ (Мg++) присоединяется к головке миозина и вызывает ее отделение от актина.
2.В мышцу поступает нервный импульс, срабатывает мостиковый механизм, т.е. образуется актомиозин за счет энергии, которая выделяется при гидролизе АТФ до АДФ и фосфата. после освобождения неорганического фосфата из актимиозинового комплекса, головки миозина присоединяются к актиновой нити под углом 90 градусовэто напряженная конформация.
3.После этого наступает поворот на 45 градусов в шарнирной области. Это происходит за счет конформационных изменений головки, вызванным силовым ударом, связанным с освобождением АД Ф.
После отделения АДФ от белка миозина происходит основное выделение свободной 4. Головка миозина связана с актином в расслабленном состоянии , пока ее не освободит новая порция АТФ в присутствии ионов Мg++ , которая и обеспечивает возврат в первоначальное положение.
5. Последняя стадия и есть собственно раслабление, характеризуется отделением миозина от актина. Роль АТФ и Мg++ в том, что она отсоединяет миозин от актина , фосфорилируя миозин( зарядка свободного миозина), и является движущей силой сокращения. А сокращение происходит при отделении от миозина сначала неорганического фосфата (напряженная конформация), а затем силовой удар.
Ключевая роль в регуляции мышечного сокращения принадлежит ионам кальция (Са2+). Миофибриллы обладают способностью взаимодействовать с АТФ и сокращаться лишь при наличии в среде определенных концентраций ионов кальция. В покоящейся мышцеконцентрация ионов Са2+ поддерживается ниже пороговой величины при участии Са2+ -зависимой АТФазы.
3) ПЦР: биомедицинское значение.
ПЦР– это получение множества копий специфического фрагмента ДНК в процессе in vitro, позволяет выявить в генетическом материале даже единичную мутацию. 1. Применяют в микробиологических исследованиях, в медицине и ветеринарии для выявления (идентификации) возбудителей заболеваний, в том числе трудно культивируемых – вирусов, хламидий и бактерий – медленно растущих

(туберкулез).2. Для диагностики наследственных болезней, онкологических, в дифференциальной диагностике. 3. Для оценки эффективности лечения.4. В трансплантологии – обследование доноров или донорских органов, контролируют безопасность донорской крови и ее компонентов и препаратов плазмы.5. Устанавливают филогенетически родство, отцовство, материнство.6. Филогенетическое родство и происхождение штаммов микроорганизмов при эпидемиологических расследованиях вспышек инфекционных болезней7. Для филогенетического анализа родства видов применяют такую разновидность ПЦР, как VNTR-типирование – вариабельные тандемные повторы.8. Для определения антибиотикочувствительности – устойчивости микроорганизмов и опухолевых клеток.9. В пищевой промышленности для оценки качества пищевых продуктов.
Задача. Пациенту с жёлчнокаменной болезнью назначили препарат хенодезоксихолевой кислоты. С чем связано такое назначение? Ответ: Хенодезоксихолевая кислота – первичная желчная кислота, образующейся в гепатоцитах печени при окислении холестерина. В начальной стадии образования камней можно применять в качестве лекарства хенодезоксихолевую кислоту. Попадая в жёлчный пузырь, эта жёлчная кислота постепенно растворяет осадок холестерола (холестериновые камни), однако это медленный процесс. камней, состоящих из холестерина
Билет №23 Вопрос 1) Активные формы кислорода (АФК). Биологическое действие АФК.
Ферментативные и неферментативные системы, генерирующие АФК.
В организме в результате окислительно-восстановительных реакций постоянно происходит генерация активных форм кислорода (АФК) при одноэлектронном восстановлении кислорода (молекула имеет неспаренный электрон на молекулярной или внешней атомной орбите).
Источники АФК:
1)цепь тканевого дыхания (утечка электронов с восстановленного убихинона KoQH2 на кислород);
2)реакции, катализируемые оксидазами, гемопротеинами, цитохромом Р450;
3)реакции окисления в лейкоцитах, макрофагах и пероксисомах;
4)радиолиз воды;
5)под воздействием ксенобиотиков, пестицидов;
6)реакции самопроизвольного (неферментативного) окисления ряда веществ. Супероксид-анион – является одним из наиболее широко распространенных в организме свободных радикалов:
Fe2+ Fe3+
O2 + e- O2-
O2-
Он образуется в клетках болезнетворных бактерий и является повреждающим фактором для мембран клеток паренхиматозных органов человеческого организма. Для лейкоцитов и макрофагов супероксид-анион является фактором бактерицидности, с помощью которого клетки инактивируют патогенные микроорганизмы.
Другой путь образования свободных радикалов – взаимодействие кислорода с металлами переменной валентности. При этом образуется пероксидный радикал:
Fe2+ + O2 + H+ → Fe3+ + HO2
O2- + Н+ → HO2
Взаимодействие супероксиданиона с пероксидным радикалом (1) или одноэлектронное восстановление супероксид-аниона (2) в водной среде приводят к образованию пероксида водорода
O2- + НО2 + Н+ → Н2О2 + О2 |
(1) |
О2- + е- + 2Н+ → Н2О2 |
(2) |
Гидроксильный радикал ОН образуется при взаимодействии пероксида водорода с супероксид-анионом (1) либо с металлами (2):
Н2О2 |
+ О 2- → ОН + ОН- + О2 |
(1) |
Н2О2 |
+ Fe2+ → ОН + ОН- + Fe3+ |
(2) |
Кислородные радикалы обладают высокой реакционной способностью и легко вступают в химические реакции с органическими молекулами для приобретения недостающего электрона. Кислородные радикалы оказывают воздействие на различные структурные компоненты клеток: ДНК (повреждение азотистых оснований); белки (окисление аминокислотных остатков, образование ковалентных «сшивок»); липиды; мембранные структуры.
Активные формы кислорода могут отщеплять электроны от многих соединений, превращая их в новые свободные радикалы, и инициируют тем самым цепные окислительные реакции. Если в реакцию с АФК вступают ненасыщенные жирные кислоты плазматических мембран, говорят о перекисном окислении липидов.
Вопрос 2) Сущность молекулярной адаптации к хроническому действию наркотических веществ.
адаптация – это увеличение количества свободных опиатных рецепторов.
1.Центральным механизмом молекулярной адаптации к хроническому воздействию наркотика является активация образования цАМФ. При формировании синдрома отмены увеличение уровня цАМФ ответственно за развитие угнетенного состояния за счет усиления активности ГАМК нейронов. Они оказывают тормозное влияние на дофаминовые и серотониновые нейроны.
2.Наркоман должен увеличить дозу, промежутки сокращаются между приемами – функциональные изменения переходят в органические, формируя сначала психическую, а затем физиологическую зависимость, усиливая абстинентный синдром.
3.При состоянии опиоидного дефицита часть опиоидных рецепторов остается свободными, что способствует усилению воздействия. Синтез энкефалинов снижается, а усиленный метаболизм этанола сопровождается образованием ТГИХ, вызывая чувство ложного комфорта, так как этот продукт имеет структурное сходство с морфином.
Вопрос 3) Этапы катаболизма жирных кислот: реакции, ферменты. Энергетический эффект полного окисления С16:0. Регуляция процесса β- окисления ВЖК.
Вживых организмах катаболизм ЖК протекает как в ферментативных, так и в неферментативных реакциях.
· Ферментативный катаболизм ЖК происходит в основном в реакциях β-окисления. К побочным путям относиться ферментативное α- и ω-окисление ЖК, а также деградация ЖК в пероксисомах. Хотя эти побочные пути количественно менее важны, их нарушение может приводить к тяжелым заболеваниям.
· Неферментативный катаболизм ЖК протекает в реакциях перекисного окисления липидов (ПОЛ).
β-окисление ЖК
β-окисление — специфический путь катаболизма ЖК с неразветвленной средней и короткой углеводородной цепью. β-окисление протекает в матриксе митохондрий, при котором от С конца ЖК последовательно отделяется по 2 атома С в виде Ацетил-КоА. β-окисление ЖК происходит только в аэробных условиях и является источником большого количества энергии.
β-окисление ЖК активно протекает в красных скелетных мышцах, сердечной мышце, почках и печени. ЖК не служат источником энергии для нервных тканей, так как ЖК не проходят через гематоэнцефалический барьер, как и другие гидрофобные вещества.
Вэкспериментах показано, что скорость обмена жирных кислот в нервной ткани существенно меньше, чем в других тканях.
β-окисление ЖК увеличивается в постабсорбтивный период, при голодании и физической работе. При этом концентрация ЖК в крови увеличивается в результате мобилизации ЖК из жировых ткани.
Активация ЖК
Активация ЖК происходит в результате образования макроэргической связи между ЖК и HSКоА с образованием Ацил-КоА. Реакцию катализирует фермент Ацил-КоА синтетаза:
RCOOH + HSKoA + АТФ → RCO~SКоА + АМФ+ PPн
Пирофосфат гидролизуется ферментом пирофосфатазой: Н4Р2О7 + Н2О → 2Н3РО4 Ацил-КоА синтетазы находятся как в цитозоле (на внешней мембране митохондрий), так и в матриксе митохондрий. Эти ферменты отличаются по специфичности к ЖК с различной длиной углеводородной цепи.
Транспорт ЖК
Транспорт ЖК в матрикс митохондрий зависит от длины углеродной цепи. ЖК с короткой и средней длиной цепи (от 4 до 12 атомов С) могут проникать в
матрикс митохондрий путём диффузии. Активация этих ЖК происходит ацил-КоА синтетазами в матриксе митохондрий.
ЖК с длинной цепью, сначала активируются в цитозоле (ацил-КоА синтетазами на внешней мембране митохондрий), а затем переносятся в матрикс митохондрий специальной транспортной системой с помощью карнитина. Карнитин поступает с пищей или синтезируется из лизина и метионина с участием витамина С.
·В наружной мембране митохондрий фермент карнитинацилтрансфераза I (карнитинпальмитоилтрансфераза I) катализирует перенос ацила с КоА на карнитин с образованием ацилкарнитина;
·Ацилкарнитин проходит через межмембранное пространство к наружной стороне внутренней мембраны и транспортируется с помощью карнитинацилкарнитинтранслоказы на внутреннюю поверхность внутренней мембраны митохондрий;
·Фермент карнитинацилтрансфераза II катализирует перенос ацила с карнитина на внутримитохондриальный HSКоА с образованием Ацил-КоА;
·Свободный карнитин возвращается на цитозольную сторону внутренней мембраны митохондрий той же транслоказой.
Реакции β-окисление ЖК
1. β-окисление начинается с дегидрирования ацил-КоА ФАД-зависимой Ацил-КоА дегидрогеназой с образованием двойной связи (транс) между α- и β-атомами С в Еноил-КоА. Восстановленный ФАДН2 окисляясь в ЦПЭ, обеспечивает синтез 2 молекул АТФ; 2. Еноил-КоА гидратаза присоединяет воду к двойной связи Еноил-КоА с
образованием β-оксиацил-КоА; 3. β-оксиацил-КоА окисляется НАД зависимой дегидрогеназой до β-кетоацил-КоА.
Восстановленный НАДН2, окисляясь в ЦПЭ, обеспечивает синтез 3 молекул АТФ;
4. Тиолаза с участием HКоА отщепляет от β-кетоацил-КоА Ацетил-КоА. В результате 4 реакций образуется Ацил-КоА, который короче предыдущего Ацил-КоА на 2
углерода. Образованный Ацетил-КоА окисляясь в ЦТК, обеспечивает синтез в ЦПЭ 12 молекул АТФ.
Затем Ацил-КоА снова вступает в реакции β-окисления. Циклы продолжаются до тех пор, пока Ацил-КоА не превратится в Ацетил-КоА с 2 атома С (если ЖК имела четное количество атомов С) или Бутирил-КоА с 3 атомами С (если ЖК имела нечетное количество атомов С).
Задача.
Результат анализа мочи: суточный объём – 1,3 л, цвет – «тёмного пива», прозрачность
– неполная, плотность – 1058 кг/м3 , реакция – слабо кислая, осадок – нет, белок – следы, глюкоза – нет, кетоновые тела – нет, эритроциты – нет, лейкоциты – 3-6×', уробилин – следы, билирубин – большое количество, жёлчные кислоты – (+). Имеются ли отклонения от нормы у данного пациента?
Ответ: Да, характерные для подпечёночной (обтурационной) желтухи.

Билет 24 Вопрос 1) Биологическое значение и структуры кетоновых тел. Синтез
кетоновых тел в печени; регуляция синтеза. Представление о кетонемии, кетонурии и кетоацидозе.
Вопросы: какие кетоновые тела знаете? Из чего они образуются? Где? Кетонурия, кетонемия
Кето́новые тела́— группа продуктов обмена веществ, которые образуются в печени из ацетил-КоА.
В печени часть жирных кислот превращается в кетоновые тела, которые окисляются мозгом, нервной тканью, мышцами, обеспечивая достаточное количество энергии для синтеза АТФ и уменьшая потребление глюкозы. К кетоновым телам относят β – гидроксибутират, ацетоацетат и ацетон. Первые две молекулы могут окисляться в тканях, обеспечивая синтез АТФ. Ацетон образуется только при высоких концентрациях кетоновых тел в крови и, выделяясь с мочой, выдыхаемым воздухом и потом, позволяет организму избавляться от избытка кетоновых тел.
Регуляция синтеза.
Регуляторным ферментом синтеза кетоновых тел является ГМГ-КоАсинтаза. ГМГ- КоА-синтаза – индуцибельный фермент, его синтез увеличивается при повышении концентрации жирных кислот в крови. Это наблюдается при мобилизации триглицеридов из жировой ткани под действием глюкагона и адреналина, т.е. при голодании или физической работе. ГМГ-КоА-синтаза ингибируется высокими концентрациями свободного КоА. Если поступление жирных кислот в клетки печени уменьшается, то соответственно, увеличивается концентрация свободного КоА, ингибирующего фермент.
Кетонемия – повышение концентрации кетоновых тел выше нормы (более 2, 5 мг%). Развивается, как правило, при дефиците инсулина и обусловлена активацией окисления СЖК в клетках с образованием КТ (ацетон, ацетоуксусная кислота, β- оксимаслянная кислота).
Кетонурия - кетоновые тела (ацетон) появляются в крови при активном использовании в клетках жиров как энергетического субстрата, при этом образуются кетоны которые фильтруются и не реабсорбируясь попадают в мочу (сахарный диабет).
Кетоацидоз - дефицит инсулина и резкое повышение концентрации всех контринсулярных гормонов – причина активации липолиза и мобилизации СЖК, что способствует активной продукции кетоновых тел. Жиры используются в качестве источника энергии, ацетил-КоА идёт на синтез кетоновых тел.
Вопрос 2. Биохимические механизмы адаптации к голоданию, типы голодания. Фазы полного голодания. Изменение гормонального статуса и метаболизма при голодании
Вопросы: всё по вопросу.
Голодание может быть кратковременным, в течение суток (I фаза), продолжаться в течение недели (II фаза) или нескольких недель (III фаза).
Вотсутствие пищи в крови снижается уровень глюкозы, аминокислот и триацилглицеролов. Инсулинглюкагоновый индекс снижается, и повышается концентрация контринсулярных гормонов, в первую очередь кортизола. В этих условиях возникает состояние, для которого характерно преобладание процессов катаболизма жиров, гликогена и белков на фоне общего снижения скорости метаболизма. Под влиянием контринсулярных гормонов в этот период происходит обмен субстратами между печенью, жировой тканью, мышцами и мозгом. Этот обмен служит двум целям: 1) поддержанию концентрации глюкозы в крови для обеспечения глюкозозависимых тканей (мозга, эритроцитов); 2) мобилизации других источников энергии, в первую очередь жиров, для обеспечения энергией всех других тканей. Вследствие переключения метаболизма на режим мобилизации энергоносителей даже после 5-6 нед голодания концентрация глюкозы в крови составляет не менее 60 мг/дл. Так как за счёт мобилизации гликогена обеспечивается только кратковременное голодание, основным источником глюкозы при длительном голодании служит глюконеогенез, а основными субстратами глюконеогенеза - аминокислоты, лактат и глицерол. При низкой концентрации инсулина глюкоза используется только инсулиннезависимыми тканями, в основном мозгом, эритроцитами. Обеспечение энергетических потребностей других тканей происходит за счёт жирных кислот и кетоновых тел.
Жирные кислоты, образующиеся в процессе мобилизации жиров в жировых депо, становятся основными источниками энергии для большинства органов в первый период голодания. Во II фазе мобилизация жиров продолжается, и концентрация жирных кислот в крови увеличивается в 3-4 раза по сравнению с постабсорбтивным состоянием. Синтез кетоновых тел начинается в первые дни голодания. Во II фазе голодания скорость синтеза кетоновых тел значительно возрастает. Концентрация кетоновых тел в крови в этот период может достигать 20-30 мг/дл (в норме 1-3 мг/дл). Используются кетоновые тела, в основном, в мышцах. В этот период голодания часть энергетических потребностей мозга обеспечивается кетоновыми телами, а скорость окисления кетоновых тел в мышцах снижается.
Втечение нескольких первых дней голодания быстро распадаются мышечные белки - основной источник субстратов для глюконеогенеза. При голодании более 3 нед скорость катаболизма белков стабилизируется и составляет примерно 20 г в сутки. В этот период увеличивается потребление мозгом кетоновых тел, а скорость глюконеогенеза снижается. Снижение скорости глюконеогенеза способствует сбережению белков. В этот период и для мозга кетоновые тела становятся значительным источником энергии. Однако для окисления кетоновых тел необходимы оксало-ацетат и другие компоненты ЦТК. В норме они образуются из глюкозы и аминокислот, а при голодании - только из аминокислот. При продолжительности
голодания более 4 недель развиваются атрофические процессы, в результате которых происходит потеря значительного количества белков. В теле человека массой 70 кг масса белков составляет 15 кг. При потере 1/3-1/2 белков наступает смерть.
Вопрос 3. Танкираза: роль в образовании активной теломеразы.
Вопрос: что это такое?
Задача:
Убольного наблюдается желтушность кожных покровов и склер, головокружение. Селезёнка увеличена. Анализ крови: эритроциты – 2,6×1012/л; ретикулоциты – 18%; общий билирубин – 65 мкмоль/л; прямая фракция – 2 мкмоль/л. О каком нарушении пигментного обмена свидетельствует данный анализ? Каковы возможные причины развития такого состояния?
Ответ:
Упациента совокупности приведённых признаков повышен распад эритроцитов
(гемолиз), что привело к избыточному образованию неконъюгированного билирубина, вызвавшего желтушную окраску кожи и слизистых оболочек. Состояние называется гемолитическая желтуха. Причиной гемолитической желтухи может быть любой фактор, приводящий к гемолизу: наследственные дефекты структуры и ферментного аппарата эритроцитов, отравления гемолитическими ядами, переливание несовместимой крови и т.д.

Билет 25 1. Схема синтеза глицеролфосфолипидов. Особенности строения глицерофосфолипидов в функционировании сурфактанта легкого.
Глицерофосфолипиды являются производными фосфатидной кислоты. В их состав входят глицерин, жирные кислоты, фосфорная кислота и обычно азотсодержащие соединения.
Начальные этапы синтеза глицерофосфолипидов и жиров происходят одинаково до образования фосфатидной кислоты. Фосфатидная кислота может синтезироваться двумя разными путями: через глицеральдегид-3-фосфат и через дигидроксиацетонфосфат (рис. 8-57). R1 - радикал насыщенной
жирной кислоты; R2 - радикал полиеновой жирной кислоты; SAM - S-аденозилметионин.
На следующем этапе фосфатидаза отщепляет от фосфатидной кислоты фосфатный остаток, в результате чего образуется диацилглицерол. Дальнейшие превращения диацилглицерола также могут идти разными путями. Один из вариантов - образование активной формы "полярной головки" фосфолипида: холин, серии или этаноламин превращаются в ЦДФ-холин, ЦДФ-серин или ЦДФэтаноламин.
Далее диацилглицерол взаимодействует с ЦМФ-производными, при этом выделяется ЦМФ, и образуется соответствующий фосфолигщц, например фосфатидилхолин. Между глицерофосфолипидами возможны различные взаимопревращения. Фосфатидилхолин может образовываться и другим путём: из фосфатидилэтаноламина, получая последовательно 3 метальные группы от SAM. Фосфатидилсерин может превращаться в фосфа-тидилэтаноламин путём декарбоксилирования. Фосфатидилэтаноламин может превращаться в фосфатидилсерин путём обмена этаноламина на серии.
Сурфактант - внеклеточный липидный слой с небольшим количеством гидрофобных белков, выстилающий поверхность лёгочных альвеол и предотвращающий слипание стенок альвеол во время выдоха. Основной компонент сурфактанта - лецитина, составляющий до 80% от всех фосфолипидов, входящих в состав сурфактанта. Кроме того, в сурфактант входят гидрофобные белки, общее количество которых не превышает 10-20%. Лецитин является одним из главных составляющих легочного сурфактанта — вещества, которым легкие человека покрыты изнутри. Основное его назначение – препятствовать слипанию легкого при вдохе и выдохе. После перенесенных легочных заболеваний (пневмонии, бронхита), хирургических вмешательств именно лецитин восстанавливает легочный сурфактант.
Синтез лецитина в пневмоцитах II типа происходит в процессе эмбрионального развития и резко увеличивается в период от 32 до 36 нед беременности.
Недостаточное формирование сурфактанта у недоношенных детей после рождения приводит к развитию респираторного дистресс-синдрома - основной причины смерти у этой группы новорождённых. В случае необходимости лечение беременных кортикостерридами стимулирует синтез сурфактанта
2. Кальцитриол: химическая природа, этапы синтеза, механизм действия, органы-мишени, биологические эффекты. Представление о заболевании «рахит».
Кальцитриол синтезируется из холестерола. Действие гормона направлено на повышение концентрации кальция в плазме крови.
Представляет собой производное витамина D и относится к стероидам. Органами-мишенями для кальцитриола считают скелет, желудочно-кишечный тракт, почки, кишечник.
Вкоже 7-дегидрохолестерол (провитамин D3) превращается в непосредственного предшественника кальцитриола - холекальциферол (витамин D3),под действием уф. Образование кальцитриола из витамина D3 начинается в печени и заканчивается в почках.
Вэпидермисе холекальциферол связывается со специфическим витамин D-связывающим белком , поступает в кровь и переносится в печень. в печени 25-гидроксилаза превращает холекальциферол в кальцидиол. В комплексе с витамин D-связывающим белком кальцидиол транспортируется в почки и гидроксилируется по первому углеродному атому с образованием кальцитриола. в почках образование кальцитриола катализируется 1альфа-гидроксилазой
Механизм действия - Цитозольный.
Эффект: в клетках кишечника кальцитриол индуцирует синтез Са2+-переносящих белков, которые обеспечивают всасывание ионов кальция и фосфатов из полости кишечника в эпителиальную клетку кишечника и далее транспорт из клетки в кровь. В почках кальцитриол стимулирует реабсорбцию ионов кальция и фосфатов. в костной ткани усиливает активность остеобластов и остеокластов. При недостатке кальцитриола развивается рахит. Рахит — это болезнь быстpоpастущих
маленьких детей, связанное с недостаточной минерализацией костной ткани.нарушением обмена веществ и недостатком витамина D, и затрагивающая в пеpвую очеpедь костную и неpвную системы.
3. Синтез пуриновых нуклеотидов.
Задача При обследовании пациента, поступившего в стационар с подозрением на вирусный гепатит,
обнаружено, что активность фермента АЛТ в сыворотке крови превышает нормальный уровень в 10 раз (норма – 0,1-0,45 ммоль/л×час). О чём свидетельствует полученный результат?
АЛТ – цитоплазматический фермент, повышение его активности в плазме крови свидетельствует о синдроме цитолиза, в частности разрушении клеток печени, что характерно для вирусного гепатита.

Билет 26 Вопрос 1. Хиломикроны (ХМ): функции, формирование и метаболизм ХМ. Функции:
1)Транспортируют вновь синтезированные ТАГ из кишечника к периферическим тканям и печени.
2)В составе ХМ транспортируются жирорастворимые витамины,поступающие в организм с пищей.
Формирование ХМ
После приёма пищи и всасывания в энтероцитах происходит ресинтез ТАГ по бета-МАГ пути.Глицерин эстерифицируется насыщенными и мононовыми ЖК.
Апо В-48 синтезируются в энтероцитах и связывает ТАГ,образуя белок-липидный комплекс,который покрывается монослоем ФЛ.
Образовавшиеся насцентные ХМ содержат 90-95% ТАГ,2% ФЛ и по 1-2%белка,ХС и ЭХС.
Созревание ХМ
Сформированные насцентные ХМ из энтероцита секретируются в лимфу,по лимфатическим коллекторам попадают в грудиной лимфатический проток и далее в кровь,где происходит их созревание.
В процессе созревания ХМ приобретают динамические апобелки апо С-2 и апо Е,донором которых являются ЛПВП2альфа.
Ферментативная деградация ХМ и образование ремнантных ХМ
Зрелые ХМ током крови транспортируются к тканям,где на поверхности капилляров подвергаются гидролизу Е-гепаринзависимой ЛПЛ.АПО-С2 связывает ЛПЛ белок-белковой связью с ХМ и является её кофактором.ЛПЛ гидролизует ТАГ гидрофобного ядра ХМ в альфаположении,расщепляя их на ЖК,ДАГ и бета-МАГ.
ЖК покидают ХМ и пассивным путём поглощаются клетками тканей и органов.Перемещаясь по кровотоку,ХМ отдают часть ЖК тканям и деградируют постепенно.
Деградированные ХМ вступают во взаимодействие с ЛПВП2альфа и отдают им часть ДАГ взамен забирая ЭХС.
Процесс обмена ДАГ и ЭХС называется гетерообменом.
В результате гетерообмена изменяется липидный состав ХМ,повышается их плотность,отщепляются с поверхности динамические апобелки и переходят на ЛПВП2альфа,зрелые плазменные ХМ превращаются в ремнантные.Апо-Е остаётся.
Поглощение ремнантных ХМ гепатоцитами
Изменение липидного состава ядра ХМ приводит к изменению конформации АПО-В-48.Он взаимодействует с АПО-Е,формируя лиганд,который связывается с рецептором АПО-В-48 гепатоцита,где ремнантные ХМ подвергаются эндоцитозу.Попав в гепатоцит,ремнантный ХМ сливается с лизосомой и под действием лизосомальных ферментов распадается на мономеры:ДАГ и МАГ до глицерина и ЖК,белки-до АК,ЭХС-до ХС и ЖК.ХМ доставляют часть пищевых липидов в печень.
2. Адреналин: химическая природа, механизм действия, органы-мишени, биологические эффекты.

Задача.
В лаборатории исследовали активность АЛТ в сыворотке крови и определили, что она в 8 раз превышает нормальный уровень. Сделайте предположение о возможных причинах возрастания активности фермента в данной биологической жидкости.
Основной причиной повышения уровня аланинаминотрансферазы (АЛТ) является поражение печени (гепатиты, цирроз). Проникновение фермента в кровь происходит вследствие синдрома цитолиза. Активность АЛТ в этих случаях повышается больше, чем АСТ (см. задачу № 28). Самые высокие показатели фиксируются при острых гепатитах (токсическом, вирусном и т.д.). В этом случае показатель может превышать норму в 20, иногда даже 100 раз. При гепатите А уровень фермента начинает повышаться задолго до проявления желтухи (за 2-3 и более недель). Уровень нормализуется спустя 3-3,5 недели. При наличии гепатита В или С показатель меняется непредсказуемо: он может как резко повышаться, так и понижаться, но затем возвращается в норму..
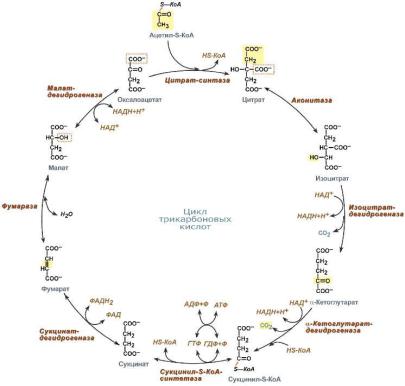
Билет 27 1. Функции клеточного метаболизма. Понятие о процессах катаболизма и анаболизма. Стадии генерирования энергии по Кребсу.
1. Поступление веществ в организм происходит в результате дыхания, питания и пищеварения. При пищеварении происходит гидролиз полимеров (белков, углеводов, липидов) до мономеров, которые легко всасываются в кровь.
Метаболизм представляет собой совокупность двух разнонаправленных процессов: катаболизма и анаболизма. В процессе катаболизма сложные органические молекулы превращаются в конечные продукты: СО2, Н2О и мочевину. Анаболизм представляет собой совокупность реакций синтеза сложных полимеров.
Реакции катаболизма сопровождаются выделением энергии (экзергонические реакции), а ее использование происходит в реакциях анаболизма и при выполнении различных видов работы (эндергонические реакции).
Функции клеточного метаболизма 1)Снабжение клеток химической энергией (источник - расщепление питательных веществ, фотосинтез) 2)Превращение молекул пищевых веществ в молекулы-строительные блоки для биосинтеза биомакромолекул 3)Сборка биомакромолекул (белки, НК, углеводы, липиды) и других клеточных компонентов из молекул-строительных блоков 4)Синтез и разрушение биомолекул для выполнения каких-либо специфических функций Катаболизм.Расщепление основных пищевых веществ в клетке представляет собой ряд последовательных ферментативных реакций, составляющих 3 основные стадиикатаболизма (Ганс Кребс) – диссимиляция.
I этап катаболизма – гидролитический. Под воздействием гидролаз в пищеварительном тракте белки, жиры, углеводы распадаются на соответствующие мономеры .
II этап – специфические пути катаболизма. Мономеры основных пищевых веществ при участии ферментов, специфичных для каждого метаболита, превращаются в основном в два метаболита - пировиноградную кислоту (ПВК) и ацетил-KоА.
Реакции специфических путей катаболизма протекают внутри клеток. На этом этапе высвобождается 1/3 энергии питательных веществ.
III этап - общий путь катаболизма. После образования ПВК дальнейший путь распада веществ до СО2 и Н2О происходит одинаково в общем пути катаболизма. Он включает два процесса:
1)окислительное декарбоксилирование ПВК;
2)цикл Кребса (цикл трикарбоновых кислот (ЦТК), цитратный цикл).
2. Ферментативные системы антирадикальной защиты. Катализируемые реакции.
К ферментам, защищающим клетки от действия активных форм кислорода, относят супероксиддисмутазу, каталазу и глутатионпероксидазу; Наиболее активны эти ферменты в печени, надпочечниках и почках, где содержание митохондрий, цитохрома Р450 . Супероксиддисмутаза (СОД) превращает супероксидные анионы в пероксид водорода:
2 + 2H+ → H2O2 + O2
+ 2H+ → H2O2 + O2
Пероксид водорода, который может инициировать образование самой активной формы ОН•, разрушается ферментом каталазой:
2Н2О2 → 2 Н2О + О2.
Каталаза находится в основном в пероксисомах, где образуется наибольшее количество пероксида водорода, а также в лейкоцитах, где она защищает клетки от последствий "респираторного взрыва" . Глутатионпероксидаза - важнейший фермент, обеспечивающий инактивацию активных форм кислорода, так как он разрушает и пероксид водорода и гидропероксиды липидов. Он катализирует восстановление пероксидов с помощью трипептида глутатиона . Сульфгидрильная группа глутатиона (GSH) служит донором электронов и, окисляясь, образует дисульфидную форму глутатиона.
Н2О2 + 2 GSH → 2 Н2О + G-S-S-G.
Окисленный глутатион восстанавливается глутатионредуктазой:
GS-SG + NADPH + Н+ → 2 GSH + NADP+.
Глутатионпероксидаза, которая восстанавливает гидропероксиды липидов в составе мембран, в качестве кофермента использует селен (необходимый микроэлемент пищи). При его недостатке активность антиоксидантной защиты снижается.
Задача.
У пациента с тяжёлой формой язвенной болезни двенадцатиперстной кишки (ЯБДК) при очередном обследовании обнаружена гормональноактивная опухоль – гастринома. Какова возможная связь наличия гастриномы с тяжёлым течением ЯБДК?
Наличие гастриномы является одним из отягчающих факторов течения ЯБДК. Т.к. гастринома (гормональноактивная опухоль), продуцирует гастрин (пептидный гормон), который является стимулятором секреции соляной кислоты в желудке. Повышенная секреция (гиперпродукция соляной кислоты) провоцируется язвообразование.
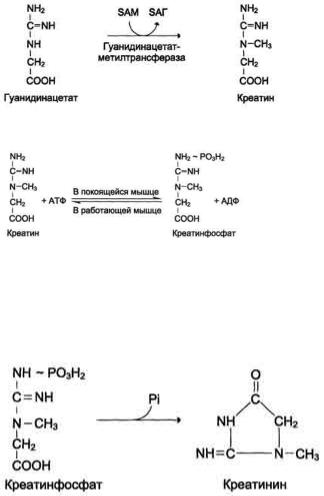
Билет 28 1. Синтез креатина, креатинфосфата, креатинина. Функции этих соединений в организме. Синтез карнитина
Карнитин - переносчик жирных кислот через мембрану митохондрий
Синтез креатина
Креатин необходим для образования в мышцах высокоэнергетического соединения - креатинфосфата. Синтез креатина идёт в 2 стадии с участием 3 аминокислот: аргинина, глицина и метионина. В почках образуется гуанидинацетат при действии глицинамидинотрансферазы Затем гуанидинацетат транспортируется в печень, где происходит реакция его метилирования
Креатин с кровотоком переносится в мышцы и клетки мозга, где из него образуется высокоэнергетическое соединение - креатинфосфат.
Эта реакция легко обратима и катализируется ферментом креатинкиназой. Фермент локализован в цитозоле и митохондриях клеток.
Креатинфосфат играет важную роль в обеспечении энергией работающей мышцы в начальный период. В результате неферментативного дефосфорилирования, главным образом в мышцах, креатинфосфат превращается в креатинин, выводимый с мочой. Суточное выделение креатинина у каждого индивидуума постоянно и пропорционально общей мышечной .
Определение содержания креатина и креатинина в крови и моче используется для характеристики интенсивности работы мышц в спортивной медицине и при некоторых патологических состояниях. Определение активности фермента креатинкиназы и его изоферментных форм в крови используется в медицине для диагностики таких заболеваний, как инфаркт миокарда, миопатии, мышечные дистрофии и др.
2. Типы переваривания. Функции ЖКТ как пищеварительно-транспортного конвейера. Функции слюны. Функции желчных кислот.
внутриклеточное, полостное и пристеночное.
Внутриклеточное пищеварение состоит в том, что транспортированные в клетку путем фагоцитоза и пиноцитоза (эндоцитоза). Эндоцитозу отводится значительная роль в кишечном пищеварении в период раннего постнатального развития млекопитающих.
Внеклеточное пищеварение делят на дистантное и контактное, пристеночное, или мембранное. Дистантное пищеварение совершается в среде, удаленной от места продукции гидролаз. Так осуществляется действие на питательные вещества в полости пищеварительного тракта ферментов слюны, желудочного сока и сока поджелудочной железы. Такое пищеварение в специальных полостях называется полостным. Эффективность полостного пищеварения определяется
активностью ферментов секретов пищеварительных желез в соответствующих отделах пищеварительного тракта.
ПристеночноеТакое пищеварение происходит в тонкой кишке на колоссальной поверхности, образованной складками, ворсинками и микроворсинками ее слизистой оболочки. Гидролиз происходит с помощью ферментов, «встроенных» в мембраны микроворсинок. -Переваривающие белки: пепсин,гастрин,трипсин,химотрипсин,карбоксипептидазы,диепептидаза,коллагеназа,эластаза- к белковой пище относится мясо, рыба, молочные продукты, яйца, соя и, отчасти, орехи. -Переваривающие углеводы:
-амилаза,мальтаза,сахараза,лактаза относятся сахар, фрукты, каши, хлеб и любые сладости – конфеты, зефир, мармелад и т.д.
-Перваривающие жиры(липазы)
Функции ЖКТ как пищ-транспортного конвейера:
представляется в виде последовательной цепи деградации пищи, ее питательных веществ. Пищеварительный конвейер заключается в преемственности следующих процессов:
1)органных: пищеварение в полости ртажелудочное пищеварение - кишечное пищеварение;
2)физических и химических: размельчение, увлажнение, набухание, растворение пищи; денатурация белков; гидролиз полимеров до стадии различных олигомеров, затем мономеров; их транспорт из пищеварительного тракта в кровь и лимфу;
3)полостного и пристеночного пищеварения
4)гидролиза на апикальных мембранах энтероцитов и транспорта в энтероцит образовавшихся мономеров, а из него — в интерстициальную ткань и затем в кровь и лимфу;
5)ферментативной деполимеризации питательных веществ.
Функции слюны:
Пищеварительная – слюна содержит пищеварительные ферменты осуществляющие начальный гидролиз углеводов. α-амилаза расщепляет крахмал до декстринов.
2)Выделительная – в составе слюны могут выделяться некоторые продукты обмена, такие как мочевина, мочевая кислота, лекарственные вещества
3)Защитная – слюна обладает бактерицидным действием, благодаря содержанию лизоцима. Муцин способен нейтрализовать кислоты и щёлочи. В слюне находятся большое количество иммуноглобулинов, что защищает организм от патогенной микрофлоры и обнаружены вещества, относящиеся к системе свёртывания крови (факторы свёртывания крови; вещества, препятствующие свёртыванию крови и обладающие фибринолитической активностью; вещество, стабилизирующее фибрин). Слюна защищает слизистую оболочку полости рта от пересыхания.
4)Трофическая – слюна является источником кальция, фосфора и цинка для эмали зуба.
5)кровоостанавливающую в связи с наличием в слюне тромбопластических веществ.
Задача.
По результатам исследования желудочного сока лаборатория дала заключение: «гипохлоргидрия». Что означает этот термин? Каким методом мог быть проведен анализ? Какие показатели определили в лаборатории, чтобы дать такое заключение?
Это – пониженное содержание соляной кислоты в желудочном соке. Титрованием (в настоящее время используется редко, чаще проводят прямую рН-метрию при ФГДС). Определили общую кислотность, свободную и связанную соляную кислоту или только рН.
