
Биохимия в таблицах, схемах и графиках
.pdf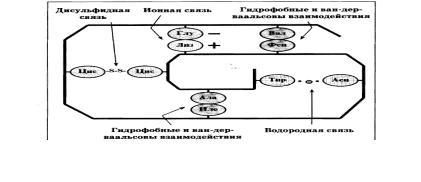
аминокислот, которые могут располагаться на значительном расстоянии друг от друга в пептидной цепи.
СВЯЗИ СТАБИЛИЗИРУЮЩИЕ ТРЕТИЧНУЮ СТРУКТУРУ ГЛОБУЛЯРНОГО БЕЛКА
Показаны только некоторые пары взаимодействующих радикалов
ТИПЫ РАДИКАЛОВ АМИНОКИСЛОТ И ОБРАЗУЕМЫЕ ИМИ СВЯЗИ
Типы радикалов |
Соответствующие |
Примерное |
Связи, образуемые |
|
аминокислоты |
содержание |
радикалами |
|
|
в белках |
|
Неполярные |
Гли, Ала, Вал, |
|
«Гидрофобные» и |
радикалы |
Лей, Иле, Фен, |
50% |
Ван-дер-ваальсовы |
|
Три, Про |
|
(индукционные и |
|
|
|
дисперсионные) |
|
|
|
взаимодействия |
Полярные |
Сер, Тре, Цис, |
|
Водородные связи, |
радикалы |
Тир, Асн, Глн |
20% |
для Цис еще и |
неспособные к |
|
|
дисульфидные |
ионизации |
|
|
связи |
Полярные |
Асп, Глу, Арг, |
|
|
радикалы |
Лиз, Гис |
30% |
Ионные и |
способные к |
|
|
водородные связи |
ионизации при |
|
|
|
физиологическом |
|
|
|
рН |
|
|
|
11
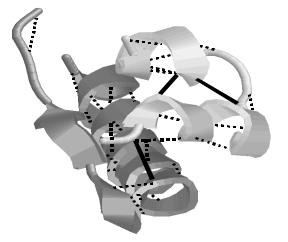
ТРЕТИЧНАЯ СТРУКТУРА ИНСУЛИНА
Спиралями представлены α-спиральные участки, цилиндрическими кривыми — нерегулярные участки. Пунктиром показаны водородные
связи, а сплошными линиями — S–S- |
мостики. |
НЕКОТОРЫЕ СЛОЖНЫЕ БЕЛКИ |
|
|
|
Белки |
Простетическая группа |
Металлопротеины |
Ионы металлов |
Фосфопротеины |
Н3РО4 |
Гемопротеины |
Гемы |
Гликопротеины |
Моносахариды, олигосахариды |
Липопротеины |
Триацилглицерины и сложные |
Нуклеопротеины |
липиды |
|
|
Рибонуклеопротеины (рибосомы и |
РНК |
др.) |
|
Дезоксирибонуклеопротеины |
ДНК |
(хроматин) |
|
12
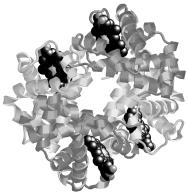
ПРОСТРАНСТВЕННАЯ ЧЕТВЕРТИЧНАЯ СТРУКТУРА ЧЕЛОВЕЧЕСКОГО ГЕМОГЛОБИНА
Гемоглобин – олигомерный белок. Основная функция гемоглобина – транспорт О2 из легких в ткани. Функция регулируется различными лигандами.
Состоит из четырех субъединиц, двух α (по 141 аминокислотному остатку в каждой) и двух β (по 146 остатков в каждой). Более темным цветом выделены β-субъединицы. С каждой субъединицей связана одна молекула гема – выделена черным цветом
ДЕНАТУРАЦИЯ БЕЛКОВ И ПОДДЕРЖАНИЕ ИХ НАТИВНОЙ КОНФОРМАЦИИ В УСЛОВИЯХ КЛЕТКИ
Денатурация белков – это разрушение их нативной конформации, вызванное разрывом слабых связей, стабилизирующих пространственные структуры, при действии денатурирующих агентов.
РЕАГЕНТЫ И УСЛОВИЯ, ВЫЗЫВАЮЩИЕ
ДЕНАТУРАЦИЮ БЕЛКОВ
Денатурирующие |
Особенности действия реагента |
агенты |
|
Высокая температура |
Разрушение слабых связей в белке |
(выше 600 С) |
|
Кислоты и щелочи |
Изменение ионизации ионогенных групп, разрыв |
|
ионных и водородных связей |
|
|
Мочевина |
Разрушение внутримолекулярных водородных |
|
связей в результате образования водородных |
|
связей с мочевиной |
|
13 |
|
|
Спирт, фенол, |
Разрушение гидрофобных и водородных связей |
хлорамин |
|
|
|
Соли тяжелых |
Образование нерастворимых солей белков и |
металлов |
ионов тяжелых металлов |
ФЕРМЕНТЫ
Ферменты (Е) – это белковые катализаторы, ускоряющие реакции в клетке.
Сходство ферментов с химическими катализаторами:
-увеличивают скорость реакции, но не расходуются в ходе процесса и не претерпевают необратимых изменений;
-не изменяют состояние равновесия химической реакции, ускоряя как прямую так и обратную реакцию в равной степени;
-повышают скорость реакции, понижая энергию активации, тот энергетический барьер, который отделяет одно состояние системы от другого.
Отличия ферментов от небиологических катализаторов:
-высокая эффективность действия;
-высокая специфичность действия – способность выбирать определенный субстрат и катализировать специфическую реакцию;
-мягкие условия протекания ферментативных реакций: температура 370С, нормальное атмосферное давление, рН, близкое к нейтральному;
-способность к регуляции.
КЛАССИФИКАЦИЯ ФЕРМЕНТОВ
Класс |
Тип катализируемой реакции |
Оксидоредуктазы |
Окислительно-восстановительные реакции |
Трансферазы |
Перенос отдельных групп атомов от донорной |
|
молекулы к акцепторной молекуле |
Гидролазы |
Гидролитическое (с участием воды) расщепление |
|
связей |
Лиазы |
Расщепление связей способом, отличным от |
|
гидролиза или окисления |
Изомеразы |
Взаимопревращение различных изомеров |
Лигазы (синтетазы) |
Образование связей в реакции конденсации двух |
|
различных соединений (используется энергия |
|
АТР) |
|
14 |

ФЕРМЕНТЫ
Простые |
Сложные |
(Однокомпонентные)
Построены из полипептидных цепей и при гидролизе распадаются только на аминокислоты
(Двухкомпонентные)
Состоят из белковой части – апофермента и небелковой части – кофактора
Апофермент + кофактор = Холофермент
|
|
|
|
|
КОФАКТОРЫ |
|
|
||
|
Ионы металлов |
|
|
|
Коферменты |
||||
|
|
|
|
|
|
|
(Органические вещества) |
||
|
НЕКОТОРЫЕ МЕТАЛЛОЗАВИСИМЫЕ ФЕРМЕНТЫ |
||||||||
|
|
|
|
|
|
|
|
|
|
|
Фермент |
|
|
Ион |
Функция иона металла |
||||
|
|
|
|
|
металла |
|
|
|
|
|
Гексокиназа |
|
|
Мg2+ |
Связывание субстрата |
||||
|
Пируваткиназа |
|
Мg2+, К+ |
Связывание субстрата и катализ |
|||||
|
Пируваткарбоксилаза |
|
4Mn2+ |
Катализ |
|
|
|||
|
α-Амилаза |
|
|
Са2+ (Сl-) |
Стабилизация третичной структуры |
||||
|
Транскетолаза |
|
Са2+ |
Стабилизация четвертичной |
|||||
|
|
|
|
2Zn2+,2Сu2+ |
структуры |
||||
|
Супероксиддисмутаза |
Катализ |
|
|
|||||
|
Карбоксипептидаза А |
|
Zn2+ |
Катализ |
|
|
|||
|
Аргиназа |
|
|
4Mn2+ |
Связывание субстрата и катализ |
||||
|
КОФЕРМЕНТЫ И ВИТАМИНЫ, ВХОДЯЩИЕ В ИХ СОСТАВ |
||||||||
|
|
|
|
|
|
|
|||
|
Витамин |
|
Коферментная форма |
|
Тип катализируемой |
|
|||
|
|
|
|
|
|
|
|
реакции |
|
|
|
|
|
|
|
||||
|
|
|
Водорастворимые витамины |
|
|||||
|
|
|
|
|
|||||
|
Тиамин (В1) |
|
Тиаминпирофосфат |
|
Декарбоксилирование |
|
|||
|
|
|
|
|
|
|
|
α-кетокислот |
|
|
Рибофлавин |
|
Флавинмононуклеотид, |
|
Окислительно- |
|
|||
|
(В2) |
|
флавинадениндинуклео- |
|
восстановительные |
|
|||
|
|
|
тид |
|
|
|
реакции |
|
|
|
|
|
|
|
|
15 |
|
|
|
Никотиновая |
Никотинамидаденинди- |
Окислительно-восста- |
кислота |
нуклеотид, никотинами- |
новительные реакции |
|
дадениндинуклеотид- |
|
|
фосфат |
|
Пантотеновая |
Кофермент (коэнзим) А |
Перенос ацильных |
кислота |
|
групп |
Пиридоксин |
Пиридоксальфосфат |
Перенос аминогрупп |
(В6) |
|
|
Биотин |
Биотицин |
Перенос СО2 |
Фолиевая |
Тетрагидрофолат |
Перенос одноуглерод- |
кислота |
|
ных групп |
Витамин В12 |
Дезоксиаденозилкобала- |
Перенос связанного с |
|
мин |
углеродом атома водо- |
|
|
рода на соседний атом |
|
|
углерода |
Аскорбино- |
Не известна |
Реакции гидроксилиро- |
вая кислота |
|
вания |
(С) |
|
|
|
Жирорастворимые витамины |
|
|
|
|
Витамин А |
Ретиналь |
Зрительный процесс |
Витамин D |
1,25-Дигидроксихоле- |
Регуляция обмена Ca |
|
кальциферол |
|
Витамин Е |
Не известна |
Защита мембранных |
|
|
липидов |
Витамин К |
Не известна |
Реакции декарбоксили- |
|
|
рования |
КОФЕРМЕНТНЫЕ ФОРМЫ РИБОФЛАВИНА
—флавинмононуклеотид FMN (слева) и флавинадениндинуклеотид
FAD (справа)
Циклическая изоаллаксазиновая система O
H3C |
N |
|
|
|
NH |
|||||
|
|
|||||||||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
H3C |
N N O |
|||||||||
|
-Dрибозы |
|
|
|
|
|
|
|||
|
CHOH |
|||||||||
|
|
|
CH2 |
|||||||
|
Остаток |
|
CHOH |
|||||||
|
|
|||||||||
|
|
|
||||||||
|
CH2OPO32– |
|||||||||
|
|
|
CHOH |
|||||||
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|||
H3C |
N |
|
|
|
NH |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
N |
N |
|
O |
|
|
|
|
|
|
|||||||||
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CHO H |
|
|
|
|
|
|
|
|
NH2 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
CHO H |
|
|
|
|
|
|
N |
|
N |
|||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
CHO H O |
|
|
|
O |
|
|
||||||||||
|
|
|
|
|
|
|
N |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
CH2O P O P |
O CH2 O |
|||||||||||||||
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
O |
|
|
|
O |
H |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O H |
O H |
|
|
|
|
16
МЕХАНИЗМ ПЕРЕНОСА АТОМОВ ВОДОРОДА ФЛАВИНОВЫМИ ФЕРМЕНТАМИ
|
|
|
O |
|
|
|
|
|
|
|
H |
O |
|||
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
||
H3C |
|
|
|
NH + X |
H |
H3C |
N |
|
NH |
||||||
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
X′ + |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
H3C |
N N |
|
O |
H |
H3C |
N N O |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
R |
|
|
|
|
|
|
|
|
|
R |
H |
|||
НИКОТИНАМИД (ВИТАМИН РР) И ЕГО КОФЕРМЕНТНЫЕ ФОРМЫ
|
|
|
|
|
|
|
CONH2 |
|
|
|
|
|
O |
|
CH2 O |
N |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
O |
P |
O |
H |
H |
|
|
|
|
|
H |
H |
|
|
|
|||
|
|
|
|
|
NH2 |
|
|
||
|
COOH |
|
O |
|
OH |
OH |
|
|
|
|
|
O |
P |
O |
|
N |
N |
|
|
|
N |
|
|
|
|
||||
|
|
|
|
|
N |
|
|
|
|
Никотинамид |
|
O |
|
CH2 O |
N |
|
|
||
|
|
|
|
|
|||||
|
|
|
|
|
H |
H |
|
|
|
|
CONH2 |
|
|
|
H |
H |
|
|
|
|
|
|
|
OH |
OR |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
Никотинамидадениндинуклеотид |
|
|
||||
|
N |
|
|
|
+ |
|
|
|
|
|
Никотиновая |
|
|
|
NAD (R = H) |
|
|
|
|
|
Никотинамидадениндинуклеотидфосфат |
|
|
||||||
|
кислота |
|
|
||||||
|
|
|
|
NADP+ (R = PO32– ) |
|
|
|||
|
|
|
|
|
|
|
|||
|
МЕХАНИЗМ ПЕРЕНОСА ГИДРИД-ИОНА |
|
|
||||||
|
CO NH2 |
|
|
|
|
H |
H |
|
|
H |
|
|
|
X′ + |
|
CO NH2 |
|
|
|
X |
|
|
|
|
|
+ |
H |
+ |
|
H |
N |
|
|
|
N |
|
|||
|
|
|
|
|
|
|
|||
|
R |
|
|
|
|
R |
|
|
|
Один из атомов водорода субстрата отщепляется с двумя электронами связи и в виде гидрид-иона (Н– ) переносится на окисленную форму коферменты NAD+.
17

ПРИМЕР ФЕРМЕНТАТИВНОГО ОКИСЛЕНИЯ
OOCCHCH2COO + NAD |
Малатдегидрогеназа |
+ NADH + H |
OOCCCH2COO |
||
OH |
O |
|
L-Малат |
Оксалоацетат |
|
Ферментативное окисление малата до оксалоацетата с помощью NAD– зависимой малатдегидрогеназы.
МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ
Первоначальным событием при действии фермента является его специфическое связывание с лигандом - субстратом (S). Это происходит в области активного центра, который формируется из нескольких
специфических |
R-групп |
аминокислот, |
определенным |
образом |
||
ориентированных в пространстве. |
|
|
|
|
||
Ферментативная реакция - это многостадийный процесс. |
|
|||||
На |
первом |
этапе |
устанавливается |
индуцированное |
||
комплементарное соответствие |
между ферментом |
и субстратом. В |
||||
результате образуется фермент-субстратный |
комплекс |
(ЕS), в |
котором |
|||
далее происходит химическое превращение субстрата, в результате чего образуется продукт, комплементарность снижается. После диссоциации продукта фермент возвращается в исходное состояние.
Механизм действия и конформация активного центра пищеварительного фермента эластазы (сериновой протеазы), осуществляющего гидролиз полипептидов
|
|
R' |
O |
|
|
|
|
R' |
|
|
|
|
|
|
O |
|||||||||
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|||||||||
NH |
|
CH |
|
C |
|
|
|
O |
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
+ H2O |
|
NH |
|
|
|
|
C |
|
+ H3N |
|
|
CH |
|
C |
|||||
|
|
|
|
|
|
|
|
CH |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
NH CH |
|
C |
|
|
|
|
O |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R'' |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
R'' |
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
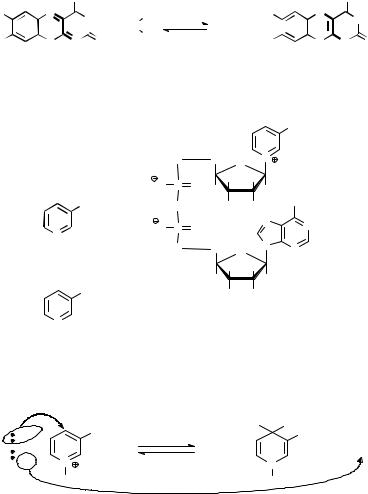
На первой стадии карбонильная группа расщепляемого пептида атакуется кислородом гидроксигруппы серина. Соседство с протонированным имидазольным кольцом гистидина, протонирование которого обеспечивается близким расположением карбоксильной группы остатка аспарагиновой кислоты, существенно повышает стабильность
18
ионизованной формы гидроксила остатка серина (за счет электростатической энергии притяжения зарядов). В значительной части молекул фермента этот гидроксил находится в виде аниона, что резко повышает его нуклеофильную активность.
I - этап |
|
|
|
А |
|
R' |
|
|
|
|
|
|
|
O |
O |
|
|
NH CH C NH CH C |
|
|
|
|
R'' |
|
|
|
O |
|
|
NH |
CH2 Ser 195 |
|
|
HN |
|
|
|
O |
|
Asp 102 |
CH2 C |
CH2 |
|
|
|
O |
|
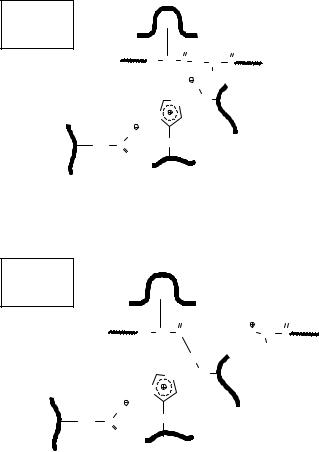
His 57
На второй стадии катализа промежуточно образовавшийся сложный эфир гидролизуется при действии воды, и активный центр освобождается для проведения следующего акта катализа.
II - этапБ
|
R' |
|
|
O |
O |
|
NH CH C |
+ H3N CH C |
|
|
R'' |
|
|
O |
|
NH |
CH2 |
|
HN |
|
|
O |
|
CH2 C |
CH2 |
|
|
O |
|
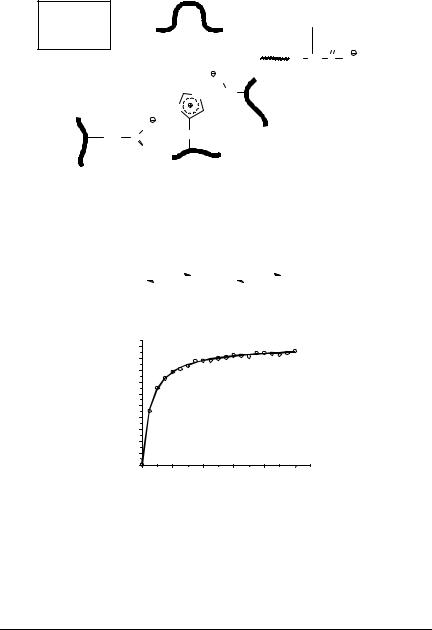
В результате атаки аниона пептидная связь разрывается и одна часть пептида покидает активный центр серинового фермента, а другая переносится на остаток серина с образованием ацилфермента.
19
III - этапВ
R'
O
+ 







 NH CH C O
NH CH C O
O
NH CH2
|
HN |
|
O |
CH2 C |
CH2 |
|
O |
КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
МОДЕЛЬ МИХАЭЛИСА-МЕНТОН
Химическое уравнение простейшей односубстратной реакции:
|
k1 |
k2 |
||
S + E |
|
ES |
|
P + E |
|
|
|||
|
|
|||
|
k–1 |
k–2 |
||
Здесь S — субстрат, E — |
фермент, ES — |
фермент-субстратный комплекс |
||
и P — продукт. |
|
|
|
|
Vмакс |
o |
v |
0.0 |
0.0 |
[S]o |
Зависимость начальной скорости ферментативной реакции от концентрации субстрата.
Чем выше [S], тем выше скорость реакции. Эта зависимость гиперболическая. Предельное значение, к которому стремится гипербола - Vmax данной реакции, характеризует максимальную работоспособность
фермента:
Vmax - это предел, к которому стремится скорость реакции при бесконечном повышении концентрации субстрата.
20
