
- •Министерство здравоохранения и социального развития Российской Федерации
- •Тема : Способы выражения состава растворов. Приготовление растворов. Теоретический материал к занятию:
- •Формулы перехода от одних способов выражения состава раствора к другим
- •Тема: Способы выражения состава растворов. Приготовление растворов Решение задач
- •Задания для самостоятельной работы из «Сборника задач и упражнений по общей химии».
- •Тема: Количественный анализ. Теоретический материал к занятию:
- •Домашнее задание:
- •Задания для самостоятельной работы из «Сборника задач и упражнений по общей химии».
- •Лабораторная работа. Определение массы гидроксида натрия в растворе.
- •Тема: Принципы качественного анализа. Теоретический материал к занятию:
- •Лабораторная работа. Качественные и групповые реакции ионов.
- •Модуль №02.
- •Примеры решения типовых задач Пример 1
- •Пример 2
- •Пример 3.
- •Пример 4.
- •Пример 5.
- •Пример 6.
- •Пример 7.
- •Пример 8.
- •Пример 9.
- •Пример 10.
- •Для реакции
- •Пример 11.
- •Химическая термодинамика. Энергетика химических реакций.
- •Лабораторная работа. Определение стандартной энтальпии реакции нейтрализации.
- •Тема: Химическая кинетика. Теоретический материал к занятию:
- •Истинная скорость (в любой момент времени) определяется первой производной концентрации по времени:
- •Примеры решения типовых задач Пример 1
- •Определите порядок реакции
- •Пример 2
- •Пример 3
- •Пример 4
- •Пример 5
- •Для ответа на вопрос а) воспользуемся модифицированым уравнением:
- •Пример 6
- •Пример 7
- •Пример 8
- •Пример 9
- •Пример 10
- •Пример 11
- •Пример 12
- •Лабораторная работа. Определение кинетических характеристик реакции окисления йодид йонов пероксидом водорода. (Оценка практических навыков.)
- •Приготовление реакционной смеси.
- •Проведение измерений при комнатной температуре.
- •Проведение измерений при повышенной температуре.
- •Проведение измерений в присутствии катализатора.
- •Тема: Свойства водных растворов Теоретический материал к занятию:
- •Примеры решения типовых задач Пример 1
- •Пример 2
- •Пример 3
- •Пример 4
- •Пример 5
- •Пример 6
- •Пример 7
- •Лабораторная работа. Наблюдение явлений плазмолиза и гемолиза эритроцитов.
- •Свойства растворов
- •Протолитические равновесия и процессы
- •Примеры решения типовых задач
- •Пример 9
- •M(сн3соок)
- •0,0482 Моль/л 0,1 л 98 г/моль
- •Пример 16
- •Пример 20
- •Домашнее задание:
- •Задания для самостоятельной работы из «Сборника задач и упражнений по общей химии».
- •Тема: Свойства буферных растворов. Лабораторная работа. Свойства буферных растворов, определение буферной емкости.
- •Экспериментальные данные
- •Расчет рН
- •Лигандообменные равновесия и процессы
- •Примеры решения типовых задач
- •Задания для самостоятельной работы из «Сборника задач и упражнений по общей химии».
- •Изучение реакций комплексообразования с неорганическими лигандами.
- •Редокс-равновесия и редокс-процессы
- •Примеры решения типовых задач Пример 1
- •Пример 2 . Определение направления редокс-процесса в стандартном состоянии
- •Пример 3
- •Пример 4
- •Пример 5
- •Пример 6
- •Пример 7
- •Пример 8
- •Пример 9
- •Пример 10
- •Пример 11
- •Пример 12
- •Пример 13
- •Пример 14
- •После введения некоторого количества протолита значение редокс-потенциала системы уменьшается:
- •Пример 15
- •Пример 16
- •Пример 17
- •Пример 18
- •Пример 19
- •Ответ: эдс гальванического элемента равна 0,118 в.
- •Задания для самостоятельной работы из «Сборника задач и упражнений по общей химии».
- •Изучение зависимости редокс-потенциала от соотношения концентраций окисленной и восстановленной форм
- •Изучение влияния лигандного окружения на редокс-потенциал
- •Задания для самостоятельной работы из «Сборника задач и упражнений по общей химии».
- •Изучение влияния рН на редокс-потенциал.
- •Измерение рН растворов с помощью стеклянного электрода
- •Влияние различных факторов на адсорбцию из растворов
- •Хроматография
- •Получение, очистка и свойства коллоидных растворов
Лабораторная работа. Определение стандартной энтальпии реакции нейтрализации.
Цель: научиться экспериментально определять изменение энтальпии реакции.
Задание: определить стандартную энтальпию реакции нейтрализации азотной кислоты гидроксидом натрия.
Оборудование: калориметр, мерные цилиндры, термометр, воронка.
Реактивы: растворы азотной кислоты и гидроксида натрия.
Сущность работы: теплота реакции нейтрализации определяется калориметрически по измеренному изменению температуры и рассчитанной теплоемкости системы.
Лабораторный калориметр:
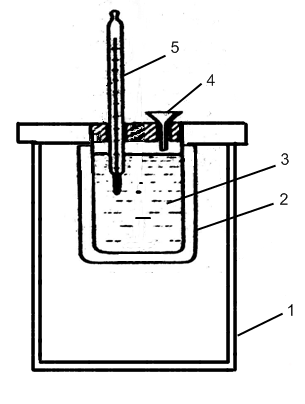
1 – внешний стакан, 2 – внутренний стакан, 3 – раствор, 4 – воронка, 5 – термометр.
Энтальпия реакции нейтрализации, протекающей между сильными одноосновными кислотами и сильными однокислотными основаниями практически не зависит от их природы, так как реально в растворах протекает одна и та же реакция:
Н+(aq) + ОН–(aq) = Н2О(ж) ; DН°r = -57,3 кДж/моль.
В случае реакции нейтрализации слабых кислот и слабых оснований такого постоянства не наблюдается, так как часть теплоты расходуется на ионизацию слабой кислоты и слабого основания.
Выполнение эксперимента:
1. Подготавливают калориметр к работе. (Осматривают его, чтобы убедиться в исправности всех деталей. Ополаскивают дистиллированной водой внутренний стакан).
2. Мерными цилиндрами отмеривают равные объемы растворов кислоты и основания (20 – 25 мл, по указанию преподавателя).
3. Измеряют начальные температуры кислоты и щелочи с помощью термометра.
4. Раствор кислоты переливают при помощи воронки во внутренний стакан калориметра.
5. Раствор щелочи быстро вливают в калориметр к раствору кислоты и наблюдают за столбиком ртути термометра. Записывают самое высокое показание. Опыт повторяют 2 - 3 раза.
Э
|
№ опыта |
Температура раствора, о С | ||
|
кислоты (нач.) |
щелочи (нач.) |
после нейтрализации | |
|
1 |
|
|
|
|
2 |
|
|
|
|
3 |
|
|
|
|
Среднее значение |
|
|
|
Масса внутреннего стакана калориметра, m (стакана) = ______ г
Объемы растворов реагирующих веществ, V(HNO3) = _______ мл, V(NaOH) = _______ мл
Концентрация растворов, c(HNO3) = _____ моль/л, c(NaOH) = _______ моль/л
Плотность растворов, ρ(HNO3) = _______ г/мл, ρ(NaOH) = _______ г/мл
Удельная теплоемкость растворов (воды), Cm(H2O) = 4,184 Дж/(г∙К)
Удельная теплоемкость стекла, Сm(ст.) = 0,753 Дж/(г∙К)
Обработка результатов эксперимента:
Для вычисления по экспериментальным данным теплоты реакций нейтрализации сначала рассчитывают общую теплоемкость калориметра Сm, учитывая теплоемкость раствора и теплоемкость внутреннего стакана:
Сm = Cm(H2O) ∙ m(раствора) + Сm(ст.) ∙ m(стакана)
где: m(раствора) = V(HNO3) ∙ ρ(HNO3) + V(NaOH) ∙ ρ(NaOH)
Затем вычисляют выделившуюся в калориметре теплоту: Q = Cm ∙ ΔT
где:
ΔT
= t(после
нейтрализации)
– ![]()
Эта теплота постепенно, по мере выравнивания температуры передается в окружающую среду и может быть принята равной по абсолютной величине изменению энтальпии системы (калориметра): ΔnH = -Q
Для расчета стандартной энтальпии реакции нейтрализации найденное значение теплоты необходимо пересчитать на 1 моль реагирующей кислоты или основания, что соответствует 1 моль образующейся воды:
ΔnH°
= ![]()
где: ν – количество вещества кислоты или щелочи (в зависимости от того, что находится в недостатке).
ν(HNO3) = V(HNO3) ∙ c(HNO3), или ν(NaOH) = V(NaOH) ∙ c(NaOH)
Рассчитанную стандартную энтальпию реакции нейтрализации сравнивают со справочными данными. Рассчитывают отклонение найденных значений от справочных. Объясняют вероятные причины отклонений.
|
Экспериментально определенную величину стандартной энтальпии реакции нейтрализации сравнивают со справочным значением, находят абсолютную и относительную ошибки определения:
Абсолютная ошибка: ξабс = ΔH°теор - ΔH°эксп
|
|
Относительная
ошибка: ξотн
=
|
Расчеты:
t01 =
 =
=∆t0 = t2 – t1 =
Cр-ра = C0m(H2O)
 mр-ра
=
mр-ра
=
V1 р-ра = Vк.
 ρк.
+ Vщ.
ρк.
+ Vщ. ρщ.
=
ρщ.
=
Сстак. = С0стак. mстак. =
Ссистемы = Сстак. + Cр-ра =
∆H = -Q = -Ссист.
 ∆t
=
∆t
=
ν = Ск.
 Vк.
=
( расчёт ведётся по недостатку)
Vк.
=
( расчёт ведётся по недостатку)
∆nH0эксп. =
 =
=
Относительная
ошибка: εотн.=
![]()
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Вывод (указывают полученный результат, метод исследования, относительную ошибку):
_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Занятие ___. Дата ____.____. 20___
