
- •Лекция 4 Метаболизм аминокислот (часть 2) биосинтез заменимых аминокислот
- •Глутамат
- •Глутамин
- •Данная реакция состоит из двух этапов:
- •Алании и аспартат
- •Аспарагин
- •Цистеин
- •Получаемый в последней реакции α–кетобутират может подвергаться дальнейшему окислению с образованием пропионил-СоА. Тирозин
- •Биосинтез незаменимых аминокислот
- •Аргинин
- •Метионин и треонин
- •Лейцин, валин и изолейцин
- •Гистидин
Лекция 4 Метаболизм аминокислот (часть 2) биосинтез заменимых аминокислот
Из 10 заменимых аминокислот 8 образуются из амфиболических метаболитов:
Ala, Asp, Asn, Gly, Glu, Gln, Pro, Ser,
а две (Суs и Туr) – из незаменимых аминокислот.
Центральное место в биосинтезе аминокислот занимают глутаматдегидрогеназа, глутаминсинтаза и трансаминазы. Благодаря совместному действию этих ферментов катализируется включение неорганического иона аммония в α-аминогруппу аминокислот.
Глутамат
Восстановительное аминирование α-кетоглутарата катализируется глутаматдегидрогеназой.
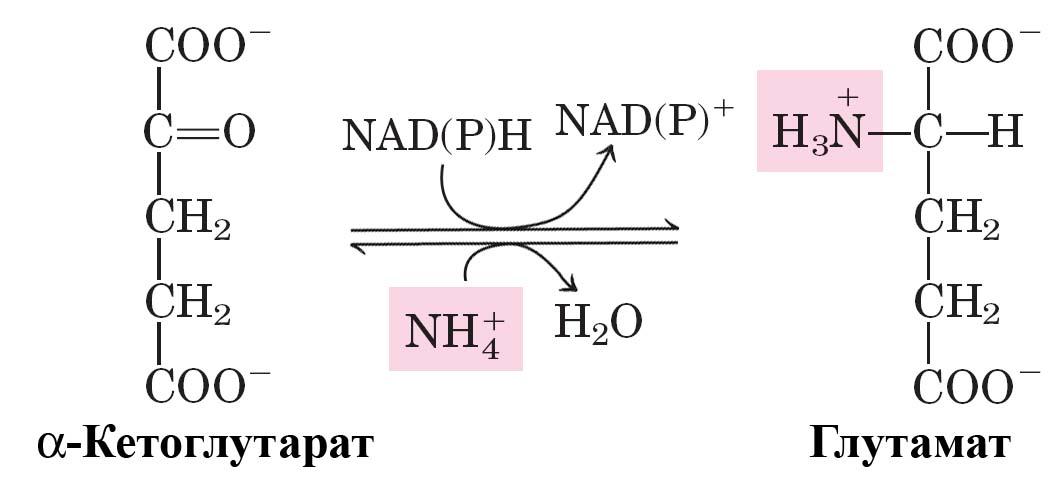
Данный фермент найден у всех организмов, однако наиболее важную роль он играет у животных. У растений и бактерий значительная часть глутамата синтезируется по другому механизму глутаматсинтетазой через промежуточное образование глутамина.
Помимо того, что эта реакция приводит к образованию L-глутамата из амфиболического метаболита, α-кетоглутарата, она является ключевой стадией биосинтеза многих других аминокислот.
Глутамин
Биосинтез глутамина из глутамата катализируется глутаминсинтетазой.
 Рис.
Структура глутаминсинтетазы.
Рис.
Структура глутаминсинтетазы.
Наряду с предыдущей реакцией, образование глутамина является ключевым как в синтезе аминокислот, так и в утилизации токсичного соединения – аммиака. Данная реакция имеет как сходство с реакцией, катализируемой глутаматдегидрогеназой, так и отличия от нее. В обоих случаях «фиксируется» неорганический азот, который в одном случае включается в аминогруппу, а в другом — в амидную группу. Обе реакции сопряжены с сильно экзергоническими реакциями: в случае глутаматдегидрогеназы с окислением NAD(P)H, а в случае глутаминсинтетазы с гидролизом АТР.
Данная реакция состоит из двух этапов:
Глутамат + ATP → γ-Глутамилфосфат + ADP
γ-Глутамилфосфат + NH4+ → Глутамин + Рi + Н+
-----------------------------------------------------------------------
Итог: Глутамат + ATP + NH4+ → Глутамин + ADP + Рi + Н+
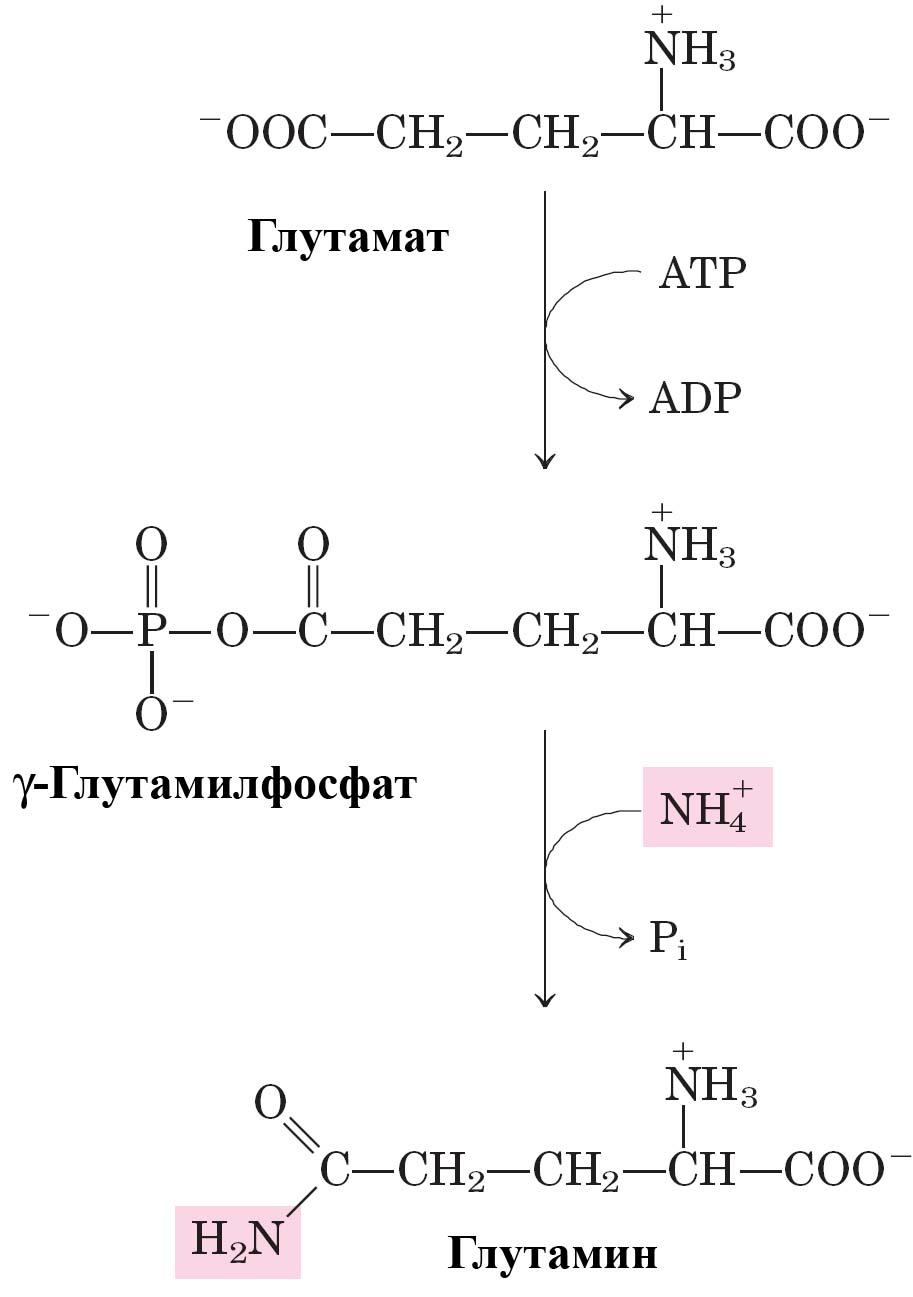 Рис.
Синтез глутамина.
Рис.
Синтез глутамина.
Алании и аспартат
L-аланин образуется из пирувата путем переаминирования с глутаматом, а L-аспартат – тем же путем из оксалоацетата. Ферменты аминотрансферазы (трансаминазы).
Рис.
Общий принцип функционирования
аминотрансфераз
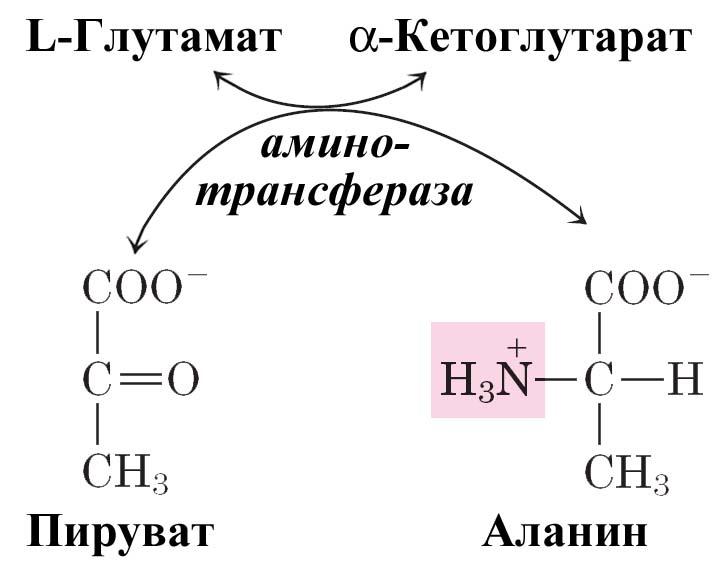 Рис.
Схема синтеза аланина.
Рис.
Схема синтеза аланина.
 Рис. Схема синтеза
аспартата.
Рис. Схема синтеза
аспартата.
Перенос α-аминогруппы глутамата на амфиболические метаболиты иллюстрирует участие трансаминаз в процессах включения иона аммония в α-аминогруппы аминокислот.
Дополнительно аланин может образовываться путем удаления β–карбоксигруппы аспартата (декарбоксилирования). Фермент аспартатдекарбоксилаза.
Аспарагин
Образование аспарагина из аспартата, катализируемое аспарагинсинтетазой, сходно с синтезом глутамина. Аспарагинсинтетаза млекопитающих в качестве источника азота использует не ион аммония, а глутамин и, следовательно, не «фиксирует» неорганического азота. Бактериальные же аспарагинсинтетазы используют ион аммония, следовательно, «фиксируют» неорганический азот. Как и в случае других реакций, сопровождающихся образованием РРi, последующий гидролиз РPi до Pi с участием неорганической пирофосфатазы обеспечивает энергетически благоприятные условия для протекания реакции. Особенность: донором азота в данной реакции выступает α-аминогруппа глутамата (а не амидная группа), поэтому образуется амид α-кетоглутарата – глутарамат.
Важно! Выше рассмотренные реакции синтеза глутамата и аспартата носят обратимый характер (реакции дегидрогеназ и аминотрансфераз обратимы!), в то время как реакции синтеза глутамина и аспарагина (катализируются синтетазами) идут с высвобождением значительного количества энергии (распад ATP) и не обратимы.
Серин
Серин образуется из промежуточного продукта гликолиза – 3-фосфоглицерата. В первой реакции α-гидроксильная группа при участии NAD+ окисляется в кетогруппу (фермент 3-фосфоглицератдегидрогеназа). Далее в результате переаминирования образуется фосфосерин (фосфосерин-аминотрансфераза), который затем дефосфорилируется, образуя серин (фосфатаза).
Также возможен вариант, когда сначала происходит дефосфорилирование 3-фосфоглицерара до глицерата (фосфатаза), а затем уже идут реакции окисления (глицератдегидрогеназа) и переаминирования (серин-аминотрансфераза).
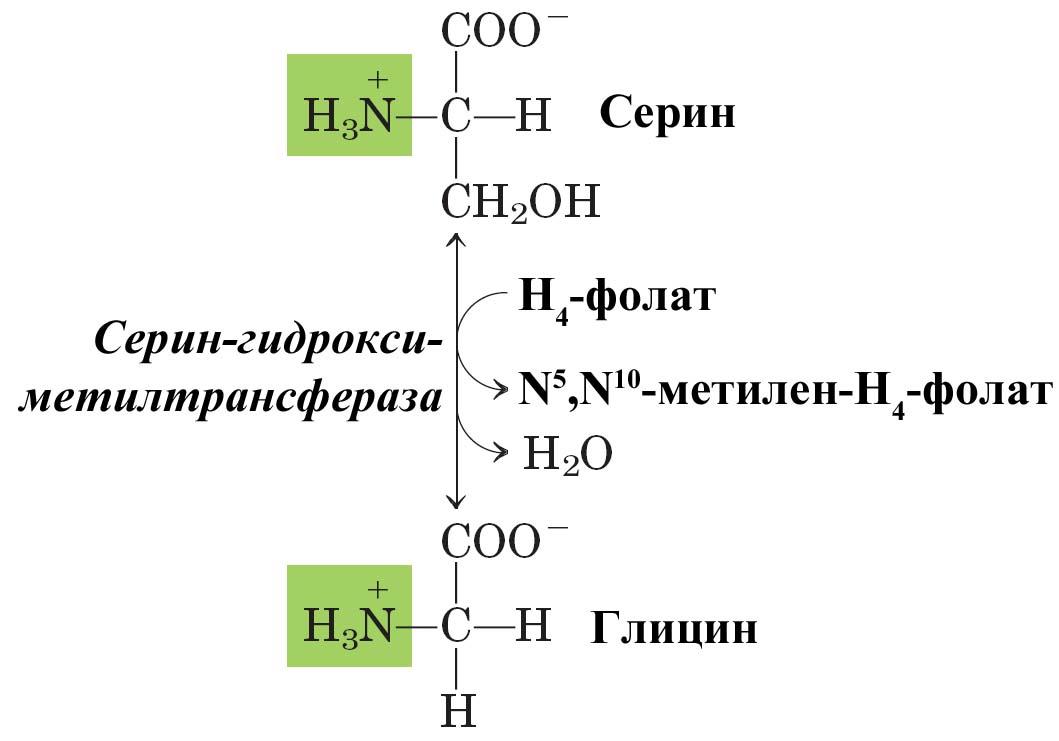
Другим важным путем образования серина является его обратимый синтез из глицина. Донором метильной группы является N5,N10-метилен-тетрагидрофолат, переходящий в тетрагидрофолат. Гидроксильная группа серина поступает из воды. Реакция катализируется серин-гидроксиметилтрансферазой.

А Б
Рис. А – синтез серина из 3-фосфоглицерата;
Б – реакция взаимопревращения серина и глицина.
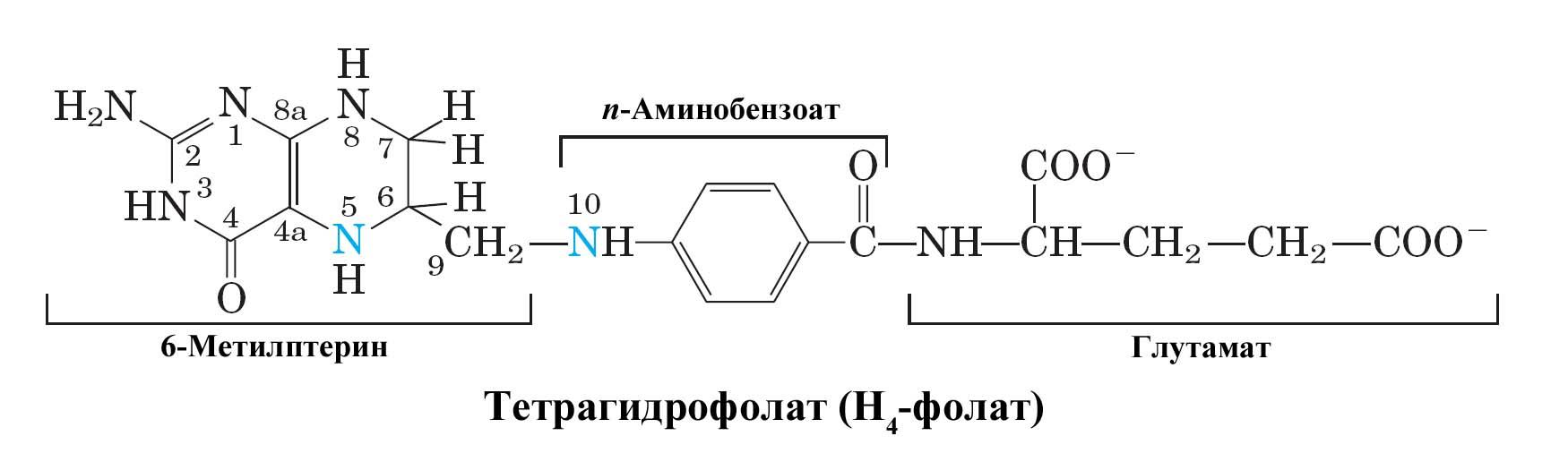
Рис. Структура тетрагидрофолата – одного из основных переносчиков одноуглеродных фрагментов в клетке (синим указаны атомы азота 5 и 10, к которым происходит присоединение одноуглеродных фрагментов – метильных, метиленовых, формильных и других групп).
Глицин
Синтез глицина в тканях млекопитающих осуществляется несколькими путями.
В цитозоле печени содержится глицинтрансаминаза, катализирующая синтез глицина из глиоксилата, донором аминогруппы выступает глутамат (или аланин). В отличие от большинства реакций переаминирования равновесие этой реакций сильно смещено в направлении синтеза глицина.
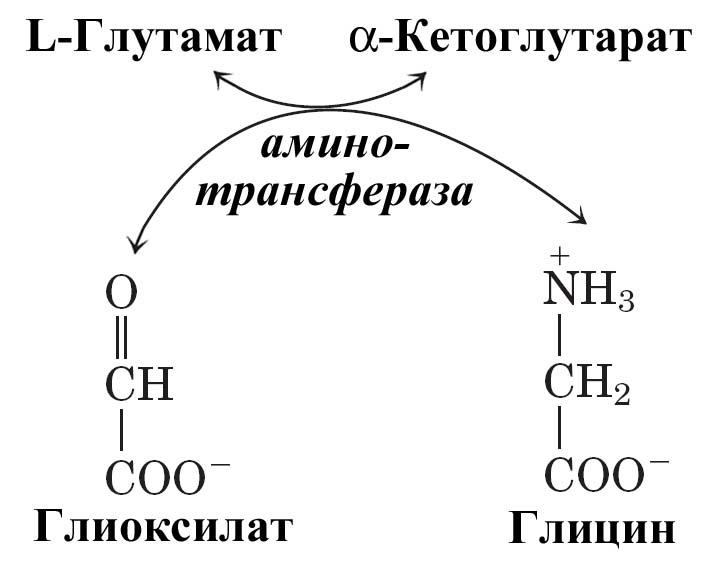 Рис.
Синтез глицина из глиоксилата.
Рис.
Синтез глицина из глиоксилата.
Два важных дополнительных пути, функционирующие у млекопитающих, используют для образования глицина серин (см. синтез серина) и холин.
Рис.
Синтез
глицина из холина.
adoHcy
– S-аденозилгомоцистеин;
adoMet
– S-аденозилметионин.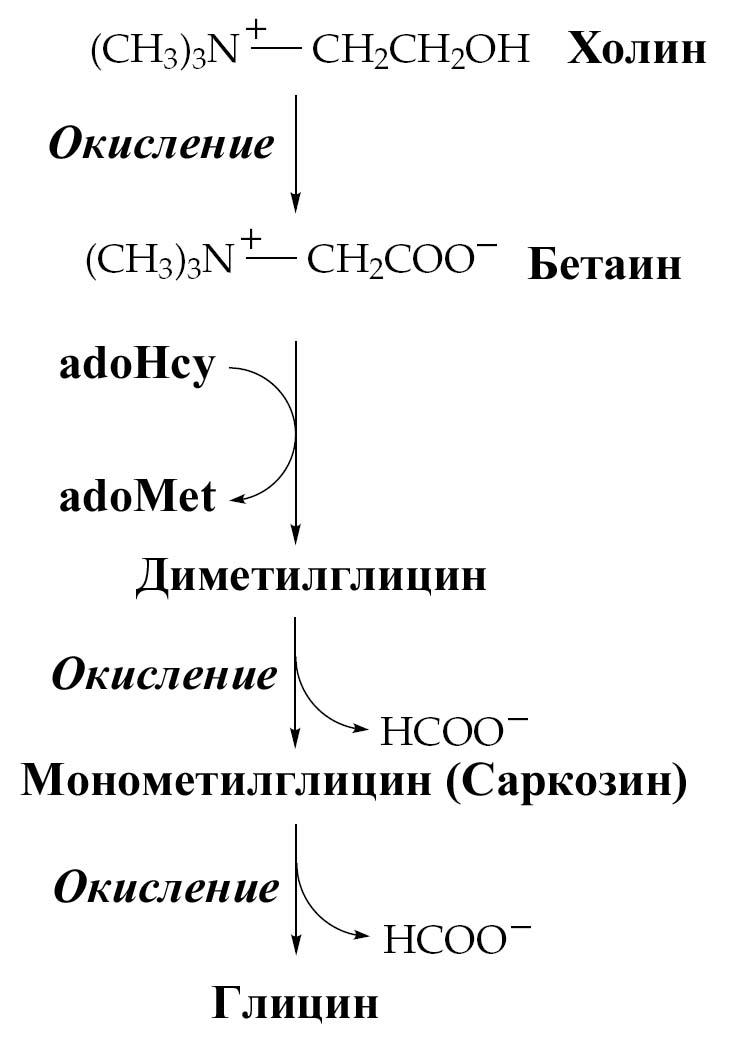
В клетках печени хордовых существует еще один путь синтеза глицина, катализируемый ферментом глицинсинтетазой. Глицин образуется из неорганических соединений: CO2 и NH4+. Донором дополнительного одноуглеродного фрагмента выступает N5,N10-метилен-тетрагидрофолат, восстановление происходит за счет энергии NADH.
Пролин
У млекопитающих и некоторых других организмов пролин образуется из глутамата путем обращения реакций катаболизма пролина.
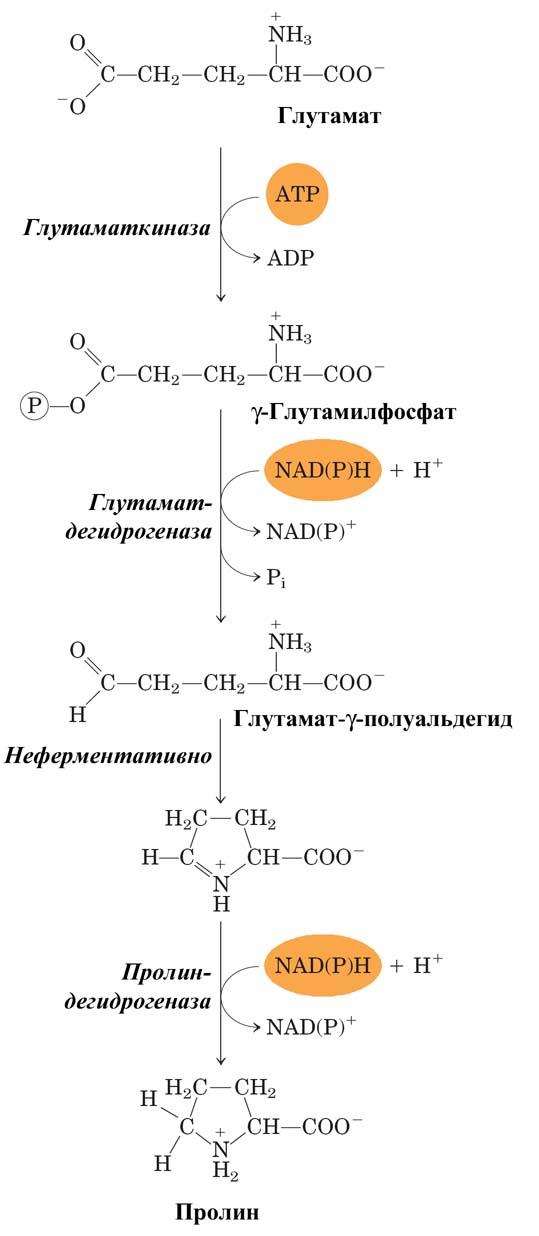
Рис. Синтез пролина.
