
- •Часть 1 основы квантовой механики Введение
- •§ 1. Волновые свойства электромагнитного излучения
- •§ 2. Квантовая природа электромагнитного излучения
- •§ 3. Корпускулярные свойства микрочастиц
- •§ 4. Волновые свойства микрочастиц
- •§ 5. Понятие «материальной точки»
- •§ 6. Соотношение неопределенности
- •§ 7. Волновая функция
- •§ 8. Уравнение Шредингера
- •§ 9. Частные случаи решения уравнения Шредингера
- •Часть 2 строение атомов
- •§ 1. Ядерная модель атома
- •§ 2. Теория атома водорода по Бору
- •§ 3. Атом водорода. Пространственное квантование
- •§ 4. Принцип исключения (Паули)
- •§ 5. Электронное строение атомов
- •§ 6. Спектры рентгеновских лучей
- •§ 7. Молекулярные спектры
- •Часть 3 основы квантовой статистики
- •§ 1. Вырожденные и невырожденные системы частиц
- •§ 2. Распределение Максвелла
- •§ 3. Распределение Ферми
- •Часть 4 основы квантовой электроники
- •§ 1. Электронные состояния атомов
- •§ 2. Влияние магнитного поля на атомные спектры
- •§ 3. Влияние электрического поля на атомные спектры
- •§ 4. Квантовые переходы. Спонтанное и вынужденное излучение
- •§ 5. Уширение спектральных линий
- •§ 6. Усиление электромагнитного излучения
- •§ 7. Электрооптические и магнитооптические эффекты
Часть 2 строение атомов
Рекомендую посмотреть учебник: Л.Н. Добрецов, «Атомная физика»
В настоящей главе даны представления об атомах с точки зрения как классической физики, так и квантовой механики.
§ 1. Ядерная модель атома
В 1904 г. Дж. Дж. Томсон предложил первую модель атома (рис. 1):
А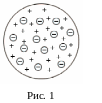 том
- равномерно заряженный шар с размерами
≈10-10 м. Электроны – маленькие
заряженные частицы – плавают в этом
шаре, уравновешивая своим зарядом заряд
шара. Подобная модель была отброшена,
т. к. не могла объяснить ряда опытов, в
первую очередь – рассеяния α-частиц
(ядер гелия).
том
- равномерно заряженный шар с размерами
≈10-10 м. Электроны – маленькие
заряженные частицы – плавают в этом
шаре, уравновешивая своим зарядом заряд
шара. Подобная модель была отброшена,
т. к. не могла объяснить ряда опытов, в
первую очередь – рассеяния α-частиц
(ядер гелия).
1911 г. Резерфорд – ядерная модель атома – положительно заряженное ядро, в котором сосредоточена почти вся масса атома, и летающие вокруг него по определенным орбитам электроны. Эта модель хорошо согласовалась с большим числом опытов, особенно по рассеянию α-частиц.
Недостаток ядерной модели: двигаясь по круговой орбите, т.е. представляя собой вместе с ядром вращающийся диполь, электрон должен излучать энергию, т.е. его энергия постепенно уменьшится, и в конце концов он (как заторможенный спутник) упадет на ядро, чего не происходит на самом деле.
В то же время, как мы уже отмечали, атомы могут поглощать и испускать энергию порциями (линейчатые спектры атомов). Классическая модель атомов, основанная на законах Ньютона и уравнениях Максвелла, оказалась непригодной.
Важным шагом в теории атома явилась теория Бора, который решил отказаться от представления о том, что для электронов верны законы Ньютона и уравнения Максвелла.
§ 2. Теория атома водорода по Бору
У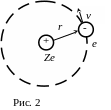 Бора – планетарная модель атома (он
рассматривал атом водорода).
Бора – планетарная модель атома (он
рассматривал атом водорода).
Постулаты Бора, т.е. положения, выдвинутые без доказательства и проверяемые результатами экспериментов:
1. Существуют такие стационарные, дискретные орбиты, двигаясь по которым электрон излучать не будет.
2. Устойчивы те орбиты, для которых
выполняется условие
![]() (*) (
(*) (![]() -
момент количества движения)
-
момент количества движения)
(В этих формулах и на рисунке из-за особенности набора v – скорость, а не частота !)
3. Атомы излучают свет в виде фотонов тогда, когда электрон переходит с одной орбиты на другую.
4. При поглощении атомом фотона энергия (фотона) идет на перевод атома из одного квантового состояния в другое, т.е. электрон при этом переходит с одной устойчивой орбиты на другую.
Условие устойчивых орбит Бора (*) вместе
с условием
![]() - (равенство центробежной и центростремительной
сил) позволяет определить разницу в
энергиях атома при переходе с одной
электронной орбиты на другую. Оказалось,
что она в точности соответствует hν,
где ν - частота
наблюдавшихся на опыте линейчатых
спектров атомов. (далее в формулах ν
– частота)
- (равенство центробежной и центростремительной
сил) позволяет определить разницу в
энергиях атома при переходе с одной
электронной орбиты на другую. Оказалось,
что она в точности соответствует hν,
где ν - частота
наблюдавшихся на опыте линейчатых
спектров атомов. (далее в формулах ν
– частота)
Теория Бора не отвергла классической механики, она только выбрала из бесконечного непрерывного многообразия движений дискретное многообразие типов движения. В этом была суть квантования.
Теория Бора – шаг вперед в объяснении атомных явлений. Она позволила объяснить много фактов. Основное положительное ее нововведение - квантование атомных состояний. Но поскольку она основана на представлении об электронах и ядрах как о материальных точках (микрошариках), она не могла быть абсолютно верной, т.к. не учитывала соотношения неопределенностей.
Действительно, модель Бора не могла объяснить ряда явлений, например влияния на линейчатые спектры атомов переменного электрического поля, преломления света в газах. По теории Бора невозможно вычислить интенсивность спектральных линий и т.д.
Более правильное представление получается с учетом принципа неопределенности, т.е. в результате решения уравнения Шредингера для атома. Это решение тоже дает квантованность состояний и в тоже время объясняет все особенности поведения атомов.
