
- •Методическое руководство
- •Предисловие
- •1. Скорость химических реакций. Химическое равновесие
- •2. Спецификация теста по теме “Скорость химических реакций. Химическое равновесие”
- •3. Варианты теста Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Библиографический список
- •394026 Воронеж, Московский просп., 14
- •Методическое руководство
ФГБОУ ВПО «Воронежский государственный технический университет»
Кафедра химии
Методическое руководство
для самостоятельной работы и контроля знаний (тестирование) по теме «Скорость химических реакций. Химическое равновесие» по дисциплине «Химия» для студентов направлений подготовки бакалавров 150100, 150400, 210100 221700, 223200
очной и заочной форм обучения

Воронеж 2012
Составители: канд. техн. наук В.В. Корнеева,
канд. техн. наук А.Н. Корнеева,
д-р техн. наук В.А. Небольсин
УДК.546
Методическое руководство для самостоятельной работы и контроля знаний (тестирование) по теме «Скорость химических реакций. Химическое равновесие» по дисциплине «Химия» для студентов направлений подготовки бакалавров 150100, 150400, 210100, 221700, 223200 очной и заочной форм обучения / ФГБОУ ВПО «Воронежский технический университет»; сост. В.В. Корнеева, А.Н. Корнеева, В.А. Небольсин. Воронеж, 2012. 29 с.
Методическое руководство имеет цель – оказать помощь студентам самостоятельно изучить, закрепить и углубить знания по теме «Скорость химических реакций. Химическое равновесие», без понимания которой невозможно успешное освоение механизма протекания химических процессов, а преподавателю – проверить знания тестированием.
Предназначено для студентов первого курса очной и заочной форм обучения.
Методические указания подготовлены в электронном виде в текстовом редакторе Microsoft Word 2003 и содержится в файле «Скорость химических реакций 2012.doc».
Библиогр.: 6 назв.
Рецензент канд. физ.-мат. наук, доц. О.И. Сысоев
Ответственный за выпуск зав. кафедрой д-р техн. наук, проф. В.А.Небольсин
Издаётся по решению редакционно-издательского совета Воронежского государственного технического университета
©ФГБОУ ВПО «Воронежский государственный технический университет», 2012
СОДЕРЖАНИЕ
-
Предисловие
2
1. Скорость химических реакций. Химическое
равновесие
2
2. Спецификация текста по теме: “Скорость
химических реакций. Химическое равновесие”
6
3. Варианты теста
7
Библиографический список
29
Предисловие
В методических указаниях по теме “Скорость химических реакций. Химическое равновесие” дается краткое теоретическое введение. Но для успешного выполнения вариантов теста необходимы прослушивание лекции, выполнение лабораторной работы и самоподготовка.
1. Скорость химических реакций. Химическое равновесие
Скорость химической реакции количественно характеризуется изменением концентраций реагирующих веществ в единицу времени.
Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции: концентрации, температуры, присутствия катализатора, а также от некоторых других факторов.
Основной закон кинетики устанавливает зависимость скорости гомогенной (однофазной) химической реакции от концентрации реагирующих веществ: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ в степенях, соответствующих стехиометрическим коэффициентам в уравнении реакции. Так, для реакции
m A + n B = p C + q D
![]() ,
,
где СА и СВ – концентрации веществ А и В, моль/л; k – константа скорости. Она численно равна скорости реакции при условии, если концентрации каждого из реагирующих веществ составляют 1 моль/л. Константа скорости зависит от температуры и от природы реагирующих веществ, но не зависит от концентрации последних.
Если в гомогенных системах химическое взаимодействие происходит во всем объеме, то в гетерогенных (многофазных) системах лишь на поверхности твердой фазы, которая остается также неизменной. При этом концентрация твердого участка реакции также не изменяется.
Так, для реакции горения угля Ств + О2 газ = СО2 газ закон действующих масс может быть записан следующим образом:
![]() , (1)
, (1)
где k – константа скорости; Sc – величина поверхности угля; Сс – его концентрация.
Обозначая произведение постоянных
величин
![]() через
через
![]() ,
получим:
,
получим:
![]() , (2)
, (2)
т.е. скорость гетерогенной химической реакции пропорциональна лишь концентрации газообразного реагента (кислорода), концентрация и площадь поверхности твердого вещества (угля) входит в значение константы скорости.
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа: при повышении температуры на каждые 10°С скорость реакции увеличивается в 2-4 раза:
![]() , (3)
, (3)
где
![]() и
и
![]() – скорости реакции при конечной (Т2)
и начальной (Т1) температурах,
а
– скорости реакции при конечной (Т2)
и начальной (Т1) температурах,
а
![]() – температурный коэффициент скорости
реакции.
– температурный коэффициент скорости
реакции.
Правило Вант-Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции.
Большинство химических реакций являются обратимыми. Они заканчиваются достижением состояния химического равновесия. В состоянии равновесия прямая и обратная реакции не прекращаются, поэтому такое равновесие называют подвижным, или динамическим. Концентрация всех веществ, которые устанавливаются при химическом равновесии, называются равновесными. В состоянии равновесия скорости прямой и обратной реакций равны между собой.
Так, для обратимого процесса
m A
+ nB pC
+ qD
A
+ nB pC
+ qD
при установившемся равновесии
![]() ,
или согласно основному кинетическому
закону
,
или согласно основному кинетическому
закону
![]() , (4)
, (4)
откуда
(5)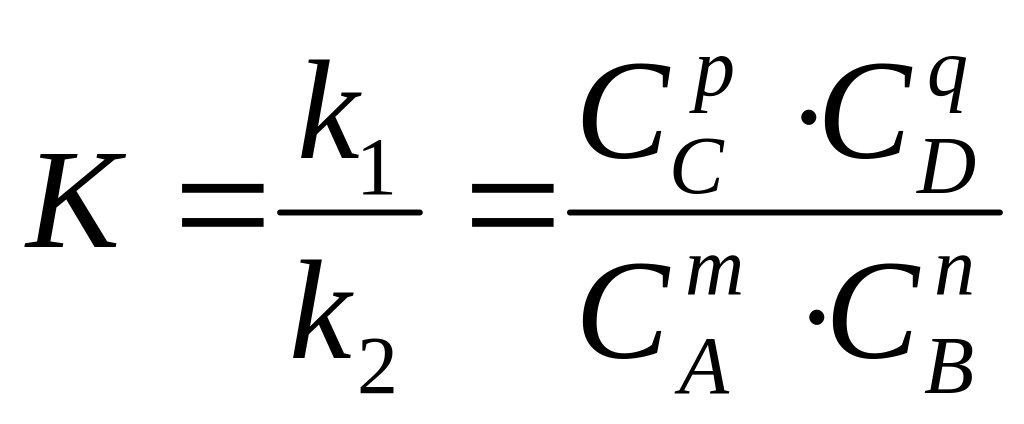
где
![]() ,
,
![]() ,
,
![]() и
и
![]() – равновесные концентрации участников
реакции;
– равновесные концентрации участников
реакции;
![]() и
и
![]() – константы скоростей прямой и обратной
реакций;
– константы скоростей прямой и обратной
реакций;
![]() –
константа химического равновесия.
–
константа химического равновесия.
Выражение (5) носит название закона действия масс: отношение произведения равновесных концентраций продуктов к произведению равновесных концентраций исходных веществ в степенях, равных стехиометрическим коэффициентам в уравнении реакции, есть величина постоянная при данной температуре.
Константа равновесия не зависит от концентрации, а изменяется лишь с изменением температуры.
Если константа равновесия выражена
через концентрации реагирующих веществ,
то ее принято обозначать
![]() .
Для реакций, протекающих с участием
газообразных веществ, константу
равновесия выражают через парциальные
давления и обозначают
.
Для реакций, протекающих с участием
газообразных веществ, константу
равновесия выражают через парциальные
давления и обозначают
![]() .
.
Например, для реакции
![]()
![]()
(6)

Если обратимая реакция является гетерогенной, то химическое равновесие должно устанавливаться на всех границах раздела между всеми фазами.
Если в гетерогенной реакции участвуют твердые вещества и газы, например реакция горения угля, то в выражение для константы химического равновесия входят лишь парциальные давления газообразных участков реакции:
![]()
![]()
(7)
Направление смещения химического равновесия определяется общим положением, известным под названием принципа Ле Шателье: изменение одного из условий (температуры, концентрации, давления), при которых система находится в состоянии равновесия, вызывает смещение равновесия в направлении той реакции, которая противодействует произведенному изменению.
Согласно принципу Ле Шателье при повышении температуры происходит смещение равновесия в сторону эндотермической реакции, при понижении – в сторону экзотермической.
Увеличение концентрации исходных веществ смещает равновесие в сторону образования продуктов: увеличение концентрации продуктов реакции смещает равновесие в сторону образования исходных веществ.
Изменение давления действует на смещение равновесия реакций, идущих с изменением числа молей газообразных веществ. Увеличение давления смещает равновесие в сторону реакции, приводящей к уменьшению числа молей в газовой фазе, а следовательно, к уменьшению давления в системе.
