
- •Методические указания
- •1. Растворы неэлектролитов
- •1.1.Общие положения
- •1.2. Концентрация растворов
- •1.3. Идеальные растворы
- •1.4. Растворимость жидкости в жидкостях и
- •1.5. Понижение давления насыщенного
- •1.6. Температура кристаллизации разбавленных
- •1.7. Температура кипения разбавленных растворов
- •1.8. Осмотическое давление растворов неэлектролитов
- •2. Растворы электролитов
- •2.1. Электролитическая диссоциация
- •2.2. Обменные реакции в растворах электролитов
- •2.3. Диссоциация воды. Водородный показатель
- •2.4. Гидролиз солей
- •Методические указания
- •Гоувпо «Воронежский государственный
- •394026 Воронеж, Московский просп., 14
1.5. Понижение давления насыщенного
пара разбавленных растворов
Давление насыщенного пара является весьма важной характеристикой растворов, с которой связаны некоторые их свойства.
Допустим, что пар подчиняется законам идеальных газов, и представим себе упрощенную схему процесса испарения. При растворении небольшого количества какого-либо вещества в данном растворителе понижается концентрация последнего в единице объема (рис. 1.3) и уменьшается число молекул, вылетающих в единицу времени из жидкой фазы в парообразную. В результате этого равновесие между жидкостью и паром установится при меньшей концентрации пара, т.е. при меньшем его давлении. Следовательно, давление насыщенного пара растворителя над раствором всегда меньше, чем над чистым растворителем. При этом понижение давления пара будет тем большим, чем больше концентрация растворенного вещества в растворе.
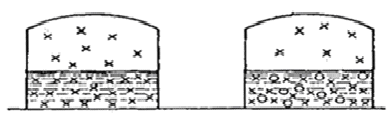
Рис.1.2. Схема испарения растворителя:
а – из чистого растворителя; б – из раствора
Когда оба компонента близки по составу и строению молекул, то сила взаимного притяжения обоих компонентов примерно одинакова, что наблюдается в идеальных растворах. В таких системах давление насыщенного пара растворителя РА над раствором прямо пропорциональна относительному содержанию его молекул в растворе, т.е. его мольной доле NA:
РА = k NA. (1.10)
При NA = 1 давление РА представляет собой давление насыщенного пара данного компонента в свободном состоянии РоА. Следовательно, k = PoA и равенство принимает вид:
РА = РоА NA. (1.11)
Обозначим через В растворенное вещество. Концентрация растворенного вещества и растворителя связаны между собой соотношением NA + NB = 1. Определяя отсюда NA и подставляя в (1.12), получаем
РА = (1 – NB) PoA . (1.12)
Из этого соотношения следует, что
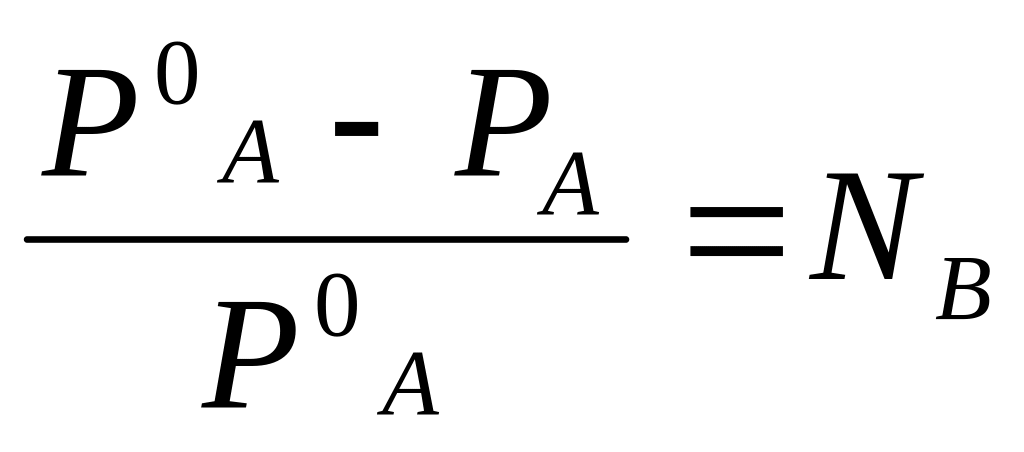 .
(1.13)
.
(1.13)
Разность (Р0А – РА) называется понижением давления на-
сыщенного
пара, а отношение
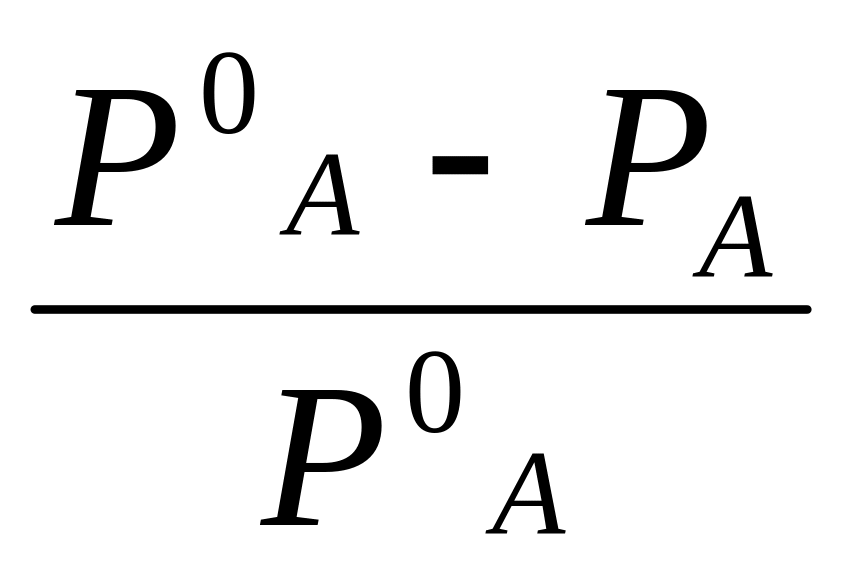 - относительным понижением давления
насыщенного пара.
- относительным понижением давления
насыщенного пара.
Относительное понижение давления насыщеного пара растворителя над раствором равно мольной доле растворенного вещества в растворе. Этот закон называется законом Рауля (1887 г.). Закон Рауля выполняется только для идеальных и реальных разбавленных растворов, близких к идеальным растворам.
1.6. Температура кристаллизации разбавленных
растворов
Раствор, в отличие от чистой жидкости, не отвердевает целиком при одной температуре. Кристаллы начинают выделяться при некоторой температуре. По мере понижения температуры количество их растет пока, наконец, весь раствор не отвердеет. Таким образом, отвердевание раствора происходит обычно не при одной температуре, а на протяжении некоторого интервала температур. Температурой начала кристаллизации раствора называют температуру, при которой в процессе охлаждения начинается образование кристаллов.
Температурой начала кристаллизации раствора называется температура, при которой кристаллы растворителя находятся в равновесии с раствором данного состава. Температуру начала кристаллизации называют также температурой замерзания раствора обычно в тех случаях, когда эта температура не выше комнатной.
Введем для характеристики температур замерзания растворов величину понижения температуры замерзания Тз, определяя ее как разность между температурами замерзания чистого растворителя Т0з и раствора Тз:
Тз = Т0з – Тз.
Рассмотрим р –Т – диаграмму состояния воды (растворитель) и растворов, полученных добавлением в воду различных количеств нелетучего растворенного вещества (рис. 1.3).
Кривая ОА представляет собой зависимость давления насыщенного пара над чистой водой от температуры, а кривые ВС, ДЕ, FG – давления насыщенного пара воды над растворами с различными концентрациями растворенного вещества. Они должны расположиться, очевидно, ниже кривой ОА, так как раствор, в соответствии с законом Рауля, обладает меньшим давлением насыщенного пара. Кривая ОН выражает температурную зависимость давления насыщенного пара воды надо льдом. Кристаллы растворителя будут находиться в равновесии с раствором только тогда, когда давление насыщенного пара растворителя над кристаллами и над раствором одинаково, т.е. когда кривая ОН пересечется с кривой давления насыщенного пара над раствором данной концентрации. Температура, отвечающая этому условию, должна быть более низкой, чем температура замерзания чистого растворителя. Рассматривая бесконечно разбавленные растворы. Можно считать, что отвечающие им бесконечно малые участки ОВ, ВВ’; OD, OD’; OF, FF’ кривых НО, ВС, DE и ЕD прямолинейными.
Из подобия треугольников ВОВ’; DOD’; FOF’ следует, что понижение температуры замерзания пропорционально концентрации растворенного вещества в растворе:
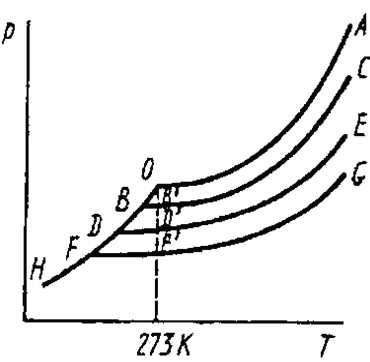
Рис. 1.3. Понижение температуры замерзания
разбавленных растворов
Тз = КСm, (1.14)
где Сm – моляльная концентрация растворенного вещества.
Для каждого данного растворителя коэффициент пропорциональности «К» является величиной постоянной. Он называется молярным понижением температуры замерзания или криоскопической постоянной. Криоскопические константы наиболее важных растворителей приведены в табл. 1.1.
Можно показать, что для бесконечно разбавленных растворов
К
=
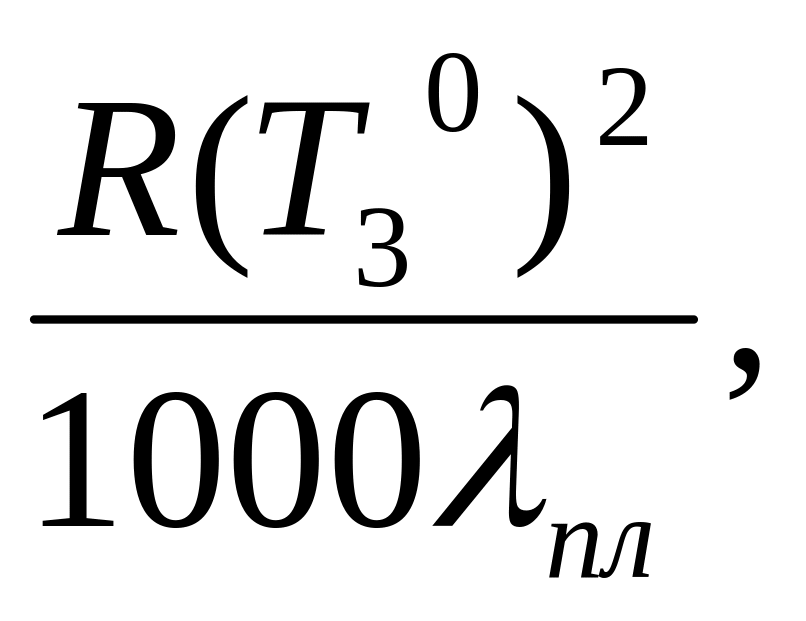 (1.15)
(1.15)
где Т30 – температура замерзания растворителя, К; пл. – удельная теплота плавления, Дж/г.
Уравнение (1.14) используют для определения концентрации растворенного вещества в разбавленном растворе. Оно может быть также применено для определения молярной массы растворенного вещества.
Если в G г растворителя было растворено моль вещества, то моляльная концентрация будет равна
Сm
=
![]() =
=
![]() Сm =
Сm =
![]() (1.16)
(1.16)
где g – масса растворенного вещества, г; М – его молярная масса, г/моль. Подставляя выражение Сm в уравнение (1.14), получаем
Т3 = К
откуда
М =
![]() .
(1.17)
.
(1.17)
Эту формулу используют для вычисления молярной массы методом криоскопии.
Криоскопические и эбуллиоскопические константы
некоторых веществ
Веще- ство |
К, град/моль |
Е, град/моль |
Веще- ство |
К, град/моль |
Е, град/моль |
Уксус- ная кислота Бензол Диэтиловый эфир Анилин |
3,90
5,12 1,73
5,87 |
2,93
2,57 2,02
3,69 |
Этанол Нафталин Толуол Вода ССl4 Камфора |
- 6,8 - 1,86 29,8 40,0 |
1,23 5,65 3,37 0,52 5,3 - |
