
Учебное пособие 800215
.pdf
|
|
Таблица 6.3 |
|
Слова и словосочетания для справок |
|
|
|
|
|
|
|
Русский язык |
Английский язык |
Родной язык |
|
Атмосферная коррозия |
Аtmospheric corrosion |
|
|
Влажная атмосфера |
humid atmosphere |
|
|
Внешние факторы |
External Factors |
|
|
Внутренние факторы |
Internal factors |
|
|
Возникновение электрического |
The emergence of electric |
|
|
тока |
current |
|
|
Газовая коррозия |
Gas corrosion |
|
|
|
|
|
|
Защита от коррозии |
Nrust protection |
|
|
Защитные покрытия |
Protective coating |
|
|
Инертный газ |
Inert gas |
|
|
Ингибитор |
Inhibitor |
|
|
Катодная защита |
Cathodic protection |
|
|
Корродировать |
Corrode |
|
|
Коррозионный элемент |
Corrosive element |
|
|
Коррозия |
Corrosion |
|
|
Легирование |
Doping |
|
|
|
|
|
|
Металлические покрытия |
Metal plating |
|
|
Неоднородность |
Inhomogeneity |
|
|
поверхности металла |
metal surface |
|
|
Неорганические покрытия |
Inorganic plating |
|
|
Непосредственное |
The direct interaction |
|
|
взаимодействие |
|
|
|
Окружающая среда |
Environment |
|
|
Органические покрытия |
Organic plating |
|
|
Пассивация |
Passivation |
|
|
Протекает самопроизвольно |
Occurs spontaneously |
|
|
Протекторная защита |
Tread protection |
|
|
Разряжаться |
Discharge |
|
|
Ржавчина |
Rust |
|
|
Сопряжённые процессы |
Paired processes |
|
|
Участок поверхности |
portion of the surface |
|
|
Физико-химическое |
Physicochemical |
|
|
взаимодействие |
interaction |
|
|
Характерные особенности |
Special features |
|
|
Химическая коррозия |
Chemical corrosion |
|
|
Электрохимическая коррозия |
Electrochemical corrosion |
|
|
|
|
|
|
71
На более активных участках поверхности металла (анодах) происходит окисление металла: Ме0 – n е → Меn+, на менее активных участках поверхности металла (катодах) происходит восстановление окислителя. Наиболее часто при электрохимической коррозии на катоде происходит восстановление ионов водорода или кислорода, растворенного в воде.
Пример 6.7. Рассмотрим коррозию железа с примесью никеля в воде, содержащей углекислый газ (СО2).
Углекислый газ взаимодействует с водой и образует слабую угольную кислоту:
СО2 + Н2О Н2СО3, которая диссоциирует по уравнению:
Н2СО3 Н+ + НСО3 .
Таким образом, раствор, в котором находится образец, будет проводить электрический ток, и окислителем в нем являются ионы Н+. Запишем схему коррозионного элемента:
|
|
Fe│H+, HCO3 │Ni |
0 = −0,44 B) , он является ано- |
|||
Железо (Fe) |
более активный металл (E0 2+ |
|||||
|
|
|
|
Fe |
/Fe |
|
дом, a никель (Ni) – |
катодом |
0 |
|
|
|
|
(ENi2+/Ni0 = −0,25 B) . |
|
|
||||
Схема электрохимической коррозии железа с примесью никеля в воде, |
||||||
содержащей углекислый газ, представлена на рис. 16. |
|
|||||
Внешняя среда: |
Fe2+ |
|
Fe2+ Fe2+ |
|
H+ HCO3 |
|
|
|
|
|
HCO3 |
H+ |
|
|
|
e |
e |
e |
|
|
|
|
Fe |
|
|
|
Ni |
Рис. 16. Схема электрохимической коррозии железа в воде, содержащей СО2 |
||||||
На поверхности железа (анода) происходит процесс окисления. Уравнение анодного процесса: (Fe0) : Fe0 − 2 е → Fe2+.
Железо в виде ионов Fe2+ переходит в раствор, а электроны перетекают на никель. Поверхность никеля заряжается отрицательно, к ней из раствора подходят катионы водорода, принимают электроны и восстанавливаются.
Уравнение катодного процесса: (Ni): 2Н+ + 2е → Н2.
Пример 6.8. Рассмотрим коррозию такого же образца (железо с примесью никеля), находящегося во влажной атмосфере, то есть в воде с растворенным в ней кислородом.
Коррозионный элемент в данном примере можно записать следующим образом:
Fe │ О2, Н2О │ Ni .
анод катод
72
Уравнения электродных процессов:
анодный (Fe): Fe0 − 2 е → Fe2+ − окисление;
катодный (Ni): О2 + 2Н2О + 4е → 4ОН − восстановление.
Упражнение 6.7. Рассмотрите коррозию железа с примесью цинка в атмосфере влажного воздуха.
На скорость коррозии влияют как внутренние факторы (неоднородность металла по химическому и фазовому составам, дефекты кристаллической решетки, наличие примесей и др.), так и внешние (реакция среды, наличие ионов– активаторов коррозии, агрессивных газов и др.).
Домашние задания
Задание 6.3. Железо или медь будет корродировать с бó льшей скоростью в атмосфере кислорода при высокой температуре? Напишите уравнения реакций в молекулярном виде, уравнения окисления и восстановления. Ответ объясните.
Задание 6.4. Напишите уравнения электродных процессов, которые происходят при коррозии никеля с примесью кобальта. Образец находится в растворе соляной кислоты.
Защита металлов от коррозии
Многочисленные методы защиты металлов от коррозии в зависимости от механизма их действия условно делятся на следующие группы:
а) легирование металлов; б) защитные покрытия; в) электрохимическая защита; г) изменение свойств окружающей среды.
Легирование металлов – это введение в состав металла или сплава компонентов, которые придают им определенные физико-химические и механические свойства. Например, для повышения коррозионной стойкости сталей применяют хром (Cr), вольфрам (W), никель (Ni), молибден (Mo), кремний (Si) и др. Легирование – метод эффективный, но дорогой. Широко используется для защиты от газовой коррозии.
Защитные покрытия. Суть действия любого покрытия заключается в изоляции поверхности металла от агрессивной окружающей среды. Покрытия делятся на органические и неорганические (неметаллические и металлические). Металлические покрытия делятся на анодные и катодные. В основу этого деления положено то, какую функцию выполняет металл покрытия при его разрушении и коррозии.
Катодные покрытия – это покрытие защищаемого металла менее активным металлом (электродный потенциал металла покрытия больше электродного потенциала защищаемого металла). В качестве катодного покрытия для железа (стали) используют покрытия из олова, меди, серебра.
Пример 6.9. Рассмотрите коррозию образца из железа, покрытого оловом (луженое железо). Образец находится в растворе соляной кислоты.
73

Решение. При нарушении покрытия в кислом растворе электролита возникает коррозионный элемент: Fe | H+ | Sn, в котором анодом является железо
(Fe), как более активный металл (E0 |
2+ |
) = −0,44 B) , катодом является металл по- |
Fе |
|
/Fe |
0 |
|
|
крытия – олово (Sn) (ESn2+/Snо = − 0,14 B) . |
|
|
Схема коррозии железа в кислой среде при нарушении покрытия представлена на рис. 17.
Уравнения электродных процессов:
анод (Fe): Fe0 – 2e |
→ Fe2+ (процесс окисления); |
|||
катод (Sn): 2Н+ + 2е → Н2 |
(процесс восстановления). |
|||
Sn |
Н+ |
Н+ |
Fe2+ |
Н+ |
(катод) |
|
|
|
|
Fe (анод) |
|
|
|
|
Рис. 17. Схема коррозии железа в кислой среде при нарушении катодного покрытия
При нарушении катодного покрытия корродирует защищаемый металл. Таким образом, катодное покрытие будет защищать металл от коррозии только при отсутствии повреждений.
Упражнение 6.8. Железо, покрытое никелем, находится в атмосфере влажного воздуха. Какой из двух металлов будет корродировать при нарушении покрытия? Составьте схему коррозионного элемента и уравнения электродных процессов.
Анодное покрытие – это покрытие защищаемого металла более активным металлом (электродный потенциал металла покрытия меньше электродного потенциала защищаемого металла). Примером анодного покрытия для железа (стали) являются покрытия из цинка (Zn) и хрома (Cr).
Пример 6.10. Рассмотрите коррозию образца из железа, покрытого цинком (оцинкованное железо), который находится во влажном воздухе.
Решение. При нарушении покрытия возникает коррозионный элемент:
Zn | Н2О, О2 | Fe,
где анодом является металл покрытия цинк (Zn), как более активный металл, катодом – защищаемый металл железо (Fe).
Схема коррозии оцинкованного железа во влажном воздухе при нарушении покрытия представлена на рис. 18.
Уравнения электродных процессов:
анод (Zn): Zn0 – 2e → Zn2+ (процесс окисления);
катод (Fe): 2Н2O + О2 + 4е → 4ОН (процесс восстановления).
74

Zn2+ |
Н2О, О2 |
Zn2+ |
Zn |
|
|
(анод) |
|
|
Fe (катод) |
|
|
Рис. 18. Схема коррозии железа во влажном воздухе
при нарушении анодного покрытия
Таким образом, при нарушении анодного покрытия корродирует металл покрытия, защищаемый металл не разрушается. Анодное покрытие защищает металл от коррозии как при отсутствии повреждений, так и при их наличии.
Упражнение 6.9. Железо, покрытое хромом, находится в кислой среде. Какой из двух металлов будет корродировать при нарушении покрытия? Составьте схему коррозионного элемента и напишите уравнения электродных процессов.
Электрохимические методы защиты. Эти методы основаны на торможении скорости анодных или катодных реакций коррозионного процесса. Применяются только в средах, которые хорошо проводят электрический ток. Примером электрохимических методов защиты является катодная и протекторная защита.
Катодная защита: защищаемую деталь присоединяют к отрицательному полюсу источника постоянного электрического тока, делая её катодом. На некотором расстоянии располагают вспомогательный электрод, который подключают к положительному полюсу источника тока, делая его анодом.
Протекторная защита: защищаемую деталь также делают катодом, но достигается это тем, что её соединяют с металлом-протектором, потенциал которого более отрицателен. Протектор, являясь анодом, разрушается, на защищаемой конструкции происходит процесс восстановления окислителя окружающей среды.
Пример 6.11. Можно ли защитить конструкцию из железа от коррозии в морской воде, если к нему приварить магниевую пластину?
Решение. Морская вода хорошо проводит электрический ток, окислителем будет растворенный в воде кислород. В данном случае возникает коррозионный элемент:
Mg │H2О, О2│Fe.
|
|
|
|
|
|
|
|
Анод |
катод |
|
E |
Mg |
В соответствии с величинами стандартных электродных потенциалов |
||||||||
/Mg |
= −2,36 B, |
E |
0 |
Fe |
/ Fe |
0 |
= − 0,44 B, |
магний будет анодом, а железо – ка- |
||
0 |
2+ |
|
0 |
|
2+ |
|
|
|
||
тодом (рис. 19). Уравнения электродных процессов: Анод (Mg – протектор): Mg0 – 2e → Mg2+, окисление.
Катод (Fe – защищаемая конструкция): 2H2O + O2 – 4e → 4OH , восстановление.
75

Внешняя среда: Н2О, О2
е е |
е |
|
|
) |
Mg2+ |
|
протектор( |
|
|
Mg2+ |
|
|
|
|
Fe |
Mg |
Mg2+ |
(катод) |
|
Рис. 19. Схема протекторной защиты железа
Конструкцию из железа можно защитить, если использовать в качестве протектора магний. Железо в этой паре будет катодом, и на нем будет восстанавливаться растворенный в воде окислитель.
Упражнение 6.10. Можно ли использовать в качестве протектора цинк для защиты стальных конструкций, находящихся во влажной почве, имеющей кислую реакцию среды?
Запишите величины стандартных электродных потенциалов цинка и железа. Составьте схемы коррозионного элемента и протекторной защиты, напишите уравнения электродных процессов.
Изменение свойств окружающей среды. Суть метода состоит в уменьше-
нии концентрации окислителя в окружающей среде, что приводит к снижению скорости коррозии. Достичь этого можно различными способами: а) кипячением воды (при повышении температуры растворимость кислорода уменьшается и, следовательно, уменьшается его концентрация в воде); б) продуванием инертного газа через раствор, в результате чего понижается концентрация кислорода в воде; в) применением восстановителей; д) уменьшением кислотности растворов; г) использованием ингибиторов.
Домашние задания
Задание 6.5. Можно ли использовать магний в качестве протектора для защиты алюминиевых конструкций от коррозии в морской воде. Ответ поясните.
Задание 6.6. Изделие из железа покрыто медью. Какой из металлов будет разрушаться при нарушении целостности покрытия? Напишите уравнения происходящих электродных процессов, если изделие находится в растворе кислоты.
6.4. ЭЛЕКТРОЛИЗ Прочитайте и запомните слова и словосочетания, приведённые в табл. 6.4.
76
|
|
Таблица 6.4 |
|
Слова и словосочетания для справок |
|
|
|
|
|
|
|
Русский язык |
Английский язык |
Родной язык |
|
Активный анод |
anode active |
|
|
Анодные (катодные) процессы |
The anode (cathode) |
|
|
|
processes |
|
|
Внешний источник |
External DC electric |
|
|
постоянного электрического |
current |
|
|
тока |
|
|
|
Инертный анод |
anode passive |
|
|
Наиболее сильный |
The strongest reducing |
|
|
восстановитель |
agent |
|
|
Наиболее сильный окислитель |
The most powerful oxidant |
|
|
Наиболее отрицательный |
The most negative |
|
|
потенциал |
potential |
|
|
Наиболее положительный |
The most positive potential |
|
|
потенциал |
|
|
|
Нерастворимый анод |
The insoluble anode |
|
|
Перемещение ионов |
Moving ions |
|
|
Подключён |
Connected |
|
|
Последовательность процессов на |
The sequence of processes |
|
|
аноде (на катоде) |
in the anode (the cathode) |
|
|
Потенциал водородного |
The potential of a hydro- |
|
|
электрода |
gen electrode |
|
|
Процесс восстановления |
The recovery process |
|
|
(окисления) |
(oxidation) |
|
|
Разряд ионов |
The discharge of ions |
|
|
Расплав электролита |
Electrolyte melt |
|
|
Растворимый анод |
Soluble anode |
|
|
Совокупность процессов |
A set of processes |
|
|
Электролиз |
Electrolysis |
|
|
Электролизёр |
The cell |
|
|
Электрохимическое |
Electrochemical reduction |
|
|
восстановление (окисление) |
(oxidation) |
|
|
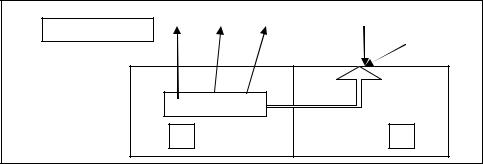
Электролизом называют совокупность процессов, происходящих на электродах при прохождении постоянного электрического тока через расплав или раствор электролита. Электролиз проводится в электролизёре (рис. 20).
Электрод, который подключён к отрицательному полюсу внешнего источника постоянного электрического тока, называется катодом. К катоду перемещаются положительно заряженные ионы (катионы) и на нём идёт процесс восстановления. Электрод, который подключён к положительному полюсу внешнего источника постоянного электрического тока, называется анодом. К аноду перемещаются отрицательно заряженные ионы (анионы) и на нём идёт процесс окисления.
77

Внешний источник тока
Катод (−) |
|
Анод (+) |
|
|
|
Раствор или расплав электролита
 Катион (+) Анион (−)
Катион (+) Анион (−) 
Рис. 20. Схема установки для проведения электролиза
Катодные процессы
Если в расплаве или растворе присутствуют несколько катионов, то пер-
вым на катоде будет восстанавливаться наиболее сильный окислитель, т.е.
тот катион, потенциал которого будет наиболее положительным (т.е. менее отрицательным). При электролизе водных растворов, необходимо учитывать, что молекулы воды также могут участвовать в процессе электрохимического восстановления и окисления. В зависимости от величины электродного потенциала все окислители можно разделить на три группы:
I – ионы металлов, потенциал которых существенно более отрицателен потенциала водородного электрода;
II – окислители, потенциал которых мало отличается от потенциала водородного электрода;
III – ионы, потенциал которых положительнее потенциала водородного электрода.
Процессы, протекающие на катоде при электролизе водных растворов электролитов, различны (табл. 6.5).
|
|
|
|
|
|
Таблица 6.5 |
|
|
Электродные процессы на катоде при электролизе |
||||||
|
|
водных растворов солей металлов |
|
|
|||
|
|
|
|
|
|
|
|
Группа |
|
I |
II |
|
|
III |
|
Катионы |
Li+, K+, Ca2+, Na+, |
Zn2+, Cr3+, Fe2+, Cd2+, |
Bi3+, Cu2+, Ag+ , |
|
|||
раствора |
2+ |
3+ |
2+ 2+ |
2+ |
2+ |
Au3+… |
|
Mg |
, Al … |
Co , Ni , Sn |
, Pb |
… |
|
|
|
|
|
|
|
|
|
||
Процесс |
2Н2О+2е →Н2+2ОН |
2Н2О +2е →Н2+2ОН |
Меⁿ+ + nе →Ме0 |
|
|||
на |
и |
|
|
|
|||
катоде |
|
|
Меⁿ+ + nе →Ме0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
78 |
|
|
|
|
Пример 6.12. Имеется водный раствор, содержащий соли лития, магния и меди. Укажите последовательность процессов на катоде. Ответ объясните.
Решение. В растворе присутствуют катионы лития Li+, магния Mg2+, меди Cu2+ и молекулы H2O. а катоде, прежде всего, восстанавливаются катионы, процесс восстановления которых характеризуется наиболее положительным электродным потенциалом. Стандартные электродные потенциалы:
0 |
= – 3,04 |
В, |
0 |
|
||
ELi+ /Li0 |
EMg 2+ /Mg0 |
|||||
0 |
|
= + 0,34 |
В, |
0 |
|
|
ECu2+ /Cu0 |
EH O/Н0 |
|||||
|
|
|
|
|
2 |
2 |
=– 2,36 В,
=– 0,41В.
Таким образом, первым восстанавливается Cu2+, затем вода (табл. 6.5):
1)Cu2+ +2е → Cu0;
2)2Н2О+2е →Н2+2ОН .
Ионы Li+ и Mg2+ относятся к первой группе ионов, поэтому из водных растворов не восстанавливаются (табл. 6.5).
Упражнение 6.11. Имеется водный раствор, содержащий соли алюминия, серебра и свинца(II). Укажите последовательность процессовна катоде. Ответ объясните.
Анодные процессы
Процессы, происходящие на аноде, зависят не только от вида аниона, но и от материала, из которого сделан анод. Различают инертные (нерастворимые
– Au, Pt, графит, ...) и активные (растворимые – Cu, Ni, ...) аноды. Активные аноды окисляются при электролизе. Инертные аноды не окисляются, на их поверхности идут процессы окисления восстановителей.
На аноде первым окисляется наиболее сильный восстановитель - веще-
ство, имеющее наиболее отрицательный (менее положительный) электродный потенциал. Процессы, протекающие на аноде при электролизе водных растворов электролитов, можно определить по табл. 6.6.
Таблица 6.6
Последовательность процессов на аноде при электролизе водных растворов солей
Анод |
Вид аниона |
Уравнение процесса |
|
|
|
Эn - → Э0 +ne |
|
|
|
Последовательность разряда: |
|
Инертный |
S2 , Br , I , Cl |
S2 , I , Br , Cl . |
|
(нерастворимый) |
|
Продукты электролиза: |
|
С, Pt, Au |
|
S, I2, Br2, Cl2 |
|
|
SO42 , PO43 , |
кислая среда: 2Н2О → О2 + 4Н++ 4е |
|
|
NO3 , F |
щелочная среда: 4ОН → 2Н2О +О2 +4е |
|
Активный |
|
Ме0 → Меⁿ+ +nе |
|
(растворимый) |
любой |
Продукты электролиза: |
|
Fe, Cu, Ni, Zn,.. |
Fe2+, Cu2+, Ni2+, Zn2+, ... |
||
|
|||
|
|
79 |
Пример 6.12. Укажите последовательность анодных процессов, протекающих при электролизе водного раствора, содержащего ионы S2 , SO42 . Ответ объясните.
Решение. В растворе присутствуют анионы S2– , SO42– и молекулы H2O. На аноде первым будет окисляться наиболее сильный восстановитель − S2– , затем окисляется H2О, а ион SO42– , как и другие кислородсодержащие анионы, из водных растворов электролитов не окисляются (табл. 6.6).
Пример 6.13. Составьте уравнения реакций, протекающих на электродах, при электролизе водного раствора хлорида натрия в случае: 1) инертного анода и 2) анода из меди.
Решение. 1) анод инертный:
Хлорид натрия диссоциирует на ионы: NaCl → Na+ + Cl− , в растворе также присутствуют молекулы воды. Инертный анод не окисляется, является только переносчиком электронов. На основании данных табл. 6.5 и табл. 6.6 процессы на электродах в данном случае представлены в табл. 6.7.
Таблица 6.7
Процессы на электродах при электролизе водного раствора хлорида натрия с нерастворимым анодом
Электрод |
Катод (– ) |
Анод (+) |
|
|
|
|
|
Возможные участники |
+ |
H2O, Cl |
− |
электролиза |
Na , H2O |
|
|
|
|
|
|
Уравнение процесса на |
2Н2О + 2e – → H2 + 2OH |
2Cl− − 2e – →2Cl |
|
электроде |
|
|
|
2) анод активный (медный анод):
Анод из меди – активный анод, он может окисляться при электролизе, поэтому процесс на аноде будет заключаться в окислении меди (табл. 6.8).
Таблица 6.8
Процессы на электродах при электролизе водного раствора хлорида натрия с растворимым анодом
Электрод |
Катод (– ) |
|
|
|
Анод (+) |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Возможные участники |
+ |
|
|
|
|
|
0 |
, H2O, Cl |
− |
|||
электролиза |
Na , H2O |
|
Cu |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Уравнение |
2Н2О + 2e |
– |
→ H2 |
+ 2OH |
Cu |
0 |
− 2e |
– |
→ Cu |
2+ |
||
процесса на электроде |
|
|
|
|
|
|||||||
Упражнение 6.12. Составьте уравнения электродных процессов, протекающих на электродах при электролизе водного раствора хлорида олова SnCI2 в случае инертного анода и анода из олова.
80
