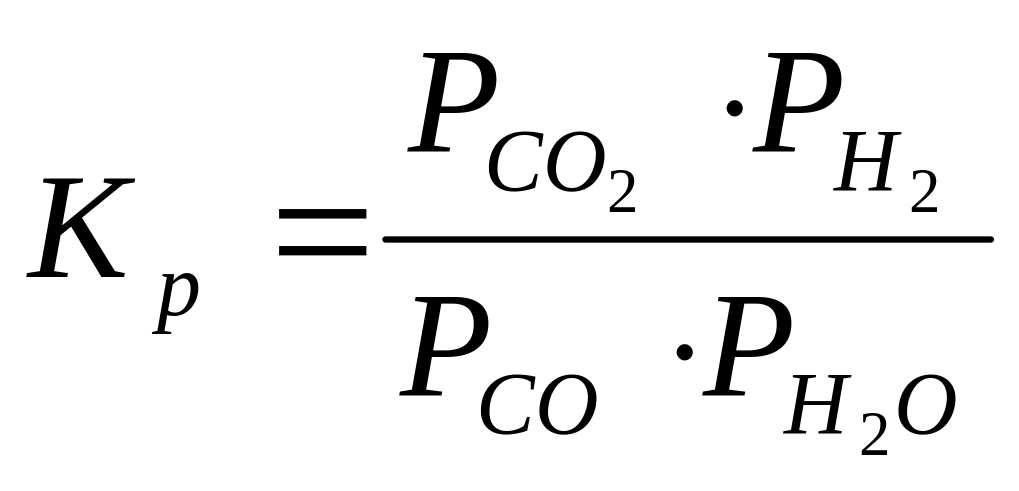- •Содержание
- •Лабораторная работа № 1 термохимические измерения
- •1. Определение теплоемкости калориметра
- •2. Определение теплоты нейтрализации
- •1000 Мл 1 h нСl содержат 36,5 г нСl
- •10 Мл 1 h нСl содержат х г нСl
- •Следовательно, удельный тепловой эффект равен
- •3. Определение теплоты растворения соли в воде
- •Лабораторная работа № 2 определение давления насыщенного пара
- •Лабораторная работа №3 парциально-молярный объем
- •Порядок выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №4 определение константы равновесия гомогенной реакции
- •В ионном виде уравнение реакции можно представить в виде:
- •Порядок выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №5 криоскопия
- •Порядок выполения работы
- •Контрольные вопросы
- •Гетерогенные равновесия
- •Так как число переменных уменьшается на единицу (либо давление, либо температура постоянны). Лабораторная работа № 6 термический анализ двухкомпонентной системы
- •Лабораторная работа № 7 диаграммы состояния ограниченно смешивающихся жидкостей
- •394026 Воронеж, Московский просп., 14
- •Методические указания
ФГБОУВПО «Воронежский государственный технический университет»
Кафедра химии
ТЕРМОХИМИЯ, ХИМИЧЕСКИЕ И ФАЗОВЫЕ
РАВНОВЕСИЯ, РАСТВОРЫ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
для выполнения лабораторных работ № 1-7
по дисциплине “Физическая химия”:
для студентов специальностей 150104, 150702, 200503, направления 223200
очной формы обучения
Воронеж 2011
Составители: канд. техн. наук В.В. Корнеева, канд. техн. наук А.Н. Корнеева, д-р техн. наук В.А. Небольсин
УДК 541.1(07)
Термохимия, химические и фазовые равновесия, растворы:
методические указания для и выполнения лабораторных работ № 1-7 по дисциплине “Физическая химия”, для студентов специальностей 150104, 150702, 200503, направления 223200 очной формы обучения / ФГБОУВПО «Воронежский государственный технический университет»; сост. В.В. Корнеева, А.Н. Корнеева, В.А. Небольсин. Воронеж, 2011. 41 с.
Методические указания содержат теоретический и практический материал для самостоятельной подготовки к выполнению лабораторных работ по дисциплине “Физическая химия”.
Предназначены для студентов первого и второго курсов
Методические указания подготовлены в электронном виде в текстовом редакторе Microsoft Word 97 и содержатся в файле Термохимия.doc.
Табл. 8. Ил. 7. Библиогр.: 4 назв.
Рецензент канд. хим. наук, доц. В.П. Горшунова
Ответственный за выпуск зав. кафедрой, д-р техн. наук, проф. В.А. Небольсин
Издаётся по решению редакционно-издательского совета Воронежского государственного технического университета
ФГБОУВПО «Воронежский
государственный технический
университет», 2011
Содержание
1. Предисловие…………………………………………..……..2
2. Выписка из инструкции по технике безопасности…….….2
3. Введение……………………………………………....…….3
.
4. Лабораторная работа № 1. Термохимические измерения……………………………………………….……..…5
5. Лабораторная работа № 2. Давление насыщенного пара………………………………………………………….…...11
6. Лабораторная работа № 3. Парциально – молярный объём……………………………………………………….…….15
7. Лабораторная работа № 4. Определение константы равновесия гомогенной реакции…………………………… …19
8. Лабораторная работа № 5. Криоскопия…………………..26
9. Гетерогенные равновесия…………………………………30
10. Лабораторная работа № 6.Термический анализ двух- компонентной системы…………………………………………31
11.Лабораторная работа № 7. Диаграммы состояния ог-
раниченно смешивающихся жидкостей……………………….35
12. Библиографический список……………………………...41
ПРЕДИСЛОВИЕ
Задача настоящих методических указаний – дать возможность самостоятельно подготовиться к выполнению лабораторных работ, углубляющих и закрепляющих теоретические основы физической химии. В конце каждой темы даны вопросы для самостоятельного контроля.
В Ы П И С К А
из инструкции по технике безопасности
При выполнении лабораторных работ по курсу физической химии обязательно выполнение требований по технике безопасности при работе в химических лабораториях и обслуживании электроустановок.
К выполнению лабораторных работ студенты допускаются только после беседы с преподавателем или дежурным лаборантом о содержании и порядке выполнения эксперимента.
Растворы кислот, щелочей и других реактивов следует отбирать только с помощью резиновых груш.
Осторожного обращения требуют термометры Бекмана.
Следует проявлять особую осторожность при работе с фенолом: отбирать пробы фенола в мерную пипетку только с помощью резиновой груши; следить, чтобы раствор не попадал на кожу рук. При попадании фенола на кожу необходимо смыть его большим количеством воды.
После выполнения работы выливать отработанные реактивы можно только по указанию преподавателя или дежурного лаборанта.
После работы тщательно вымыть руки.
Прием пищи в лаборатории категорически запрещен.
В В Е Д Е Н И Е
Опытные данные могут быть представлены с помощью таблиц, графиков и формул. Первый способ более точный; второй – наглядный; третий, обобщающий опытные данные в виде математических уравнений в исследованном диапазоне, позволяет методом интерполяции (а иногда и экстраполяции) получить результаты, отсутствующие в опытах.
Постоянные величины в уравнениях можно определить графически или с помощью методов математической статистики. При этом сложные зависимости желательно представлять в виде прямолинейных зависимостей изменения координат. Например, часто используемые выражения вида
ln
K
=
![]() (1)
(1)
можно привести к линейной зависимости
y = Ax + B,
если
принять lnK=
y
и
![]()
Покажем на примере способ обработки опытных данных и метод определения постоянных величин в полученном уравнении.
Пример. Определить температурную зависимость константы равновесия реакции
CО + Н2О = СО2 + Н2
по следующим опытным данным:
T, K |
1100 |
1200 |
1300 |
1400 |
1500 |
1600 |
1700 |
1800 |
|
0,941 |
0,682 |
0,475 |
0,360 |
0,256 |
0,242 |
0,180 |
0,141 |
Результаты
представим в виде уравнения (1), обозначив
-lnKp=
y и
![]() ·104
= х; соответственно имеем:
·104
= х; соответственно имеем:
y |
0,0608 |
0,3827 |
0,7444 |
0,9467 |
1,3626 |
1,4188 |
1,7148 |
1,9589 |
x |
9,09 |
8,33 |
7,69 |
7,14 |
6,67 |
6,25 |
5,88 |
5,56 |
В координатах lnK – на рис.1 проведем прямую линию, которая проходит через опытные точки. Постоянные А и В найдем следующим образом: из углового коэффициента прямой
А
= tgα
=
![]() =
5,2 ·103
=
5,2 ·103
Величину В оценим из любого значения lnКр на полученной прямой. При Т=1250 К ln Кр = -0,6. Отсюда
В
= –0,6 –![]()
Тогда зависимость примет вид
l nКр
=
nКр
=
![]()
где Т – температура, К;
Кр – константа равновесия данной реакции.
Для более точного определения постоянных А и В в уравнениях типа (1) можно применять метод наименьших квадратов.
Рис.
1