
- •Контроль качества ионообменников для водоподготовки
- •Введение
- •1. Подготовка ионитов к работе
- •1.1. Отбор проб и фракционирование ионитов
- •Гранулометрический состав ионита
- •1.2. Кондиционирование, очистка и получение различных ионных форм ионитов
- •2. Химическая устойчивость ионообменников
- •2.1. Определение химической устойчивости ионитов
- •Порядок выполнения работы
- •2.2. Определение содержания стирола при кондиционировании ионитов
- •Порядок выполнения работы
- •2.3. Определение содержания формальдегида в промывных водах
- •Порядок выполнения работы
- •2.4. Определение содержания этилендиамина (эда) в промывных водах
- •Порядок выполнения работы
- •Определение физико-химических свойств ионитов
- •3.1. Определение влагоемкости ионитов
- •3.2. Определение обменной емкости сильно- и слабокислотных катионитов
- •3.3. Определение обменной емкости сильно- и слабоосновных анионитов
- •Определение полной обменной емкости в динамических условиях
- •Порядок выполнения работы
- •3.5. Определение констант ионизации ионитов
- •3.7. Изучение набухания ионитов микроскопическим методом
- •3.8. Определение набухаемости ионообменников
- •Порядок выполнения работы
- •3.9. Определение прочности гранул сорбентов
- •Порядок выполнения работы
- •Практическая работа № 16
- •3.10. Изучение влияния гидроксида натрия на изменение характера функциональных групп анионообменников
- •3.11. Определение рабочей обменной емкости анионита
- •4. Условия хранения ионитов
- •Контроль качества ионообменников для водоподготовки
2. Химическая устойчивость ионообменников
При нагревании на воздухе, в воде, в растворах электролитов, в органических и смешанных средах, а также при действии агрессивных веществ на холоду иониты претерпевают разнообразные изменения. Совокупность этих изменений при нагревании ионообменников характеризует их термическую устойчивость. Изменения свойств ионообменников под действием агрессивных сред при комнатной температуре принимается в качестве характеристики их химической устойчивости.
В качестве меры термической и химической устойчивости ионообменников применяют абсолютную
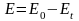
или
относительную (%)
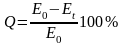 (1)
(1)
потерю емкости при данной температуре и продолжительности нагревания. Обе величины находят по значениям обменной емкости до (Е0) и после (Еt) термической или химической обработки.
Показано, что в процессе отщепления функциональных групп участвуют молекулы воды или другого растворителя из сольватных оболочек ионов в фазе смолы. При этом общее количество растворителя в сольватных оболочках пропорционально обменной емкости, так как вместе с отщепившейся функциональной группой из фазы ионита уходят принадлежащие ей сольватирующие молекулы. Таким образом, общая масса обменных групп и сольватирующей жидкости изменяется; постоянной остается лишь масса матрицы (при условии отсутствия деструкции полимера).
Установлено, что причиной снижения обменной емкости при термической обработке сульфо- и фосфорнокислых катионитов в Н- форме в воде и водных растворах веществ, не обладающих окислительными свойствами, является термический гидролиз:
R-SO3H + H2O R-H + H2SO4
R-PO(OH)2 + H2O R-H + H3PO4
Солевые формы катионитов значительно более устойчивы к нагреванию. При температуре 350 ОС они дают сульфоны и сульфаты металлов:
2R-SO3-M R-SO2 –R + M2SO4
Сильноосновные аниониты в ОН - форме при нагревании в воде, смешанных и органических средах снижают обменную емкость по реакции дезаминирования
R-CH2 N(CH3)3OH + H2O R-CH2OH + NH(CH3)3OH,
и деградации
R-CH2 N(CH3)3OH + H2O R- CH2NH(CH3)2OH + CH3OH
В этих реакциях ОН-ионы оказывают каталитическое действие, активируя нуклеофильные реагенты и потому скорость процессов дезаминирования и деградации анионитов в ОН-форме значительно выше, чем в Cl- форме. К уменьшению обменной емкости и замедлению реакции обмена ведут разнообразные формы блокирования ионитов крупными молекулами, например, аниониты сильно блокируются гуминовыми кислотами, ДНК и меланоидинами. Близкую к действительности характеристику относительного количества обменных групп, отщепленных ионообменником, дает величина
 которую
в зависимости от природы исследованного
полимера можно назвать степенью
дезаминирования, десульфирования,
дефосфорилирования
или
декарбоксилирования. Ее рассчитывают
по величинам начальной и конечной
обменной емкости и по соответствующим
им значениям массы высушенного ионита
m0
и mt.
которую
в зависимости от природы исследованного
полимера можно назвать степенью
дезаминирования, десульфирования,
дефосфорилирования
или
декарбоксилирования. Ее рассчитывают
по величинам начальной и конечной
обменной емкости и по соответствующим
им значениям массы высушенного ионита
m0
и mt.
Практическая работа № 3
