
- •Свойства неорганических соединений и водных растворов электролитов
- •Введение
- •Тема 1. Основные классы неорганических соединений
- •Примеры некоторых амфотерных гидроксидов
- •1.2. Соли
- •1.3. Примеры Решения задач
- •1.4. Вопросы для самостоятельной подготовки к контрольной работе
- •1.5. Задачи и упражнения для самостоятельной работы
- •Тема 2. Равновесия в водных растворах электролитов. Водородный показатель. Гидролиз солей
- •2.1. Электролитическая диссоциация
- •Кислот, оснований, солей
- •Константа диссоциации некоторых слабых электролитов в водных растворах (25°с)
- •2.2. Примеры заданий
- •2.3. Ионные реакции двойного обмена
- •Порядок составления уравнений реакций
- •2.4. Водородный показатель рН
- •Логарифмическая шкала и водородный показатель рН
- •Расчеты значений рН и рОн для сильных кислот и оснований Примеры, в которых концентрация выражена в стандартной форме
- •Примеры расчета рН для одноосновных кислот и однокислотных оснований
- •Примеры расчета рН для многоосновных кислот и многокислотных оснований
- •Расчеты значений pH, константы диссоциации, степени диссоциации и концентрации для слабых кислот
- •Примеры расчета значений рН, константы диссоциации и концентрации для слабых кислот
- •1,810-5 Моль/л. Определить рН раствора кислоты с концентрацией 0,1 моль/л.
- •Методы измерения рН
- •Характерная окраска и области перехода ряда индикаторов
- •2.5 Гидролиз солей
- •2.6. Вопросы для самостоятельной подготовки к контрольной работе
- •2.7. Задачи и упражнения для самостоятельной работы
- •Библиографический список рекомендуемой литературы
- •Оглавление
- •Свойства неорганических соединений и водных растворов электролитов
2.4. Водородный показатель рН
Вода очень слабый электролит, в незначительной степени диссоциирует: Н2О ↔ Н+ + ОН, константа диссоциации выражается:
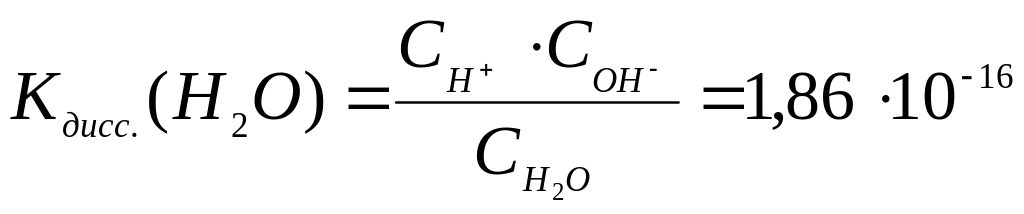 (2.3)
(2.3)
При 25 °С в любом водном растворе СН+ СОН = 10-14 эту величину называют ионным произведением воды и обозначают Кw.
В нейтральной среде СН+ = С ОН- =10-7(моль/л).
В кислой среде СН+ > С ОН-.
В щелочной среде СН+ < С ОН-.
Логарифмическая шкала и водородный показатель рН
Числа можно представлять при помощи различных шкал.
В нормальном числовом ряду промежутки между числами одинаковы. Например, в этом числовом ряду промежутки между 10 и 20 такие же, как между 20 и 30.
 -50 -40 -30 -20 -10 0 10 20
30 40 50
-50 -40 -30 -20 -10 0 10 20
30 40 50
В логарифмической шкале поддерживаются одинаковые расстояния между 1 и 10; 10 и 100 и так далее (т.е. числа увеличиваются в 10 раз).
 0,00001
0,00001
 0,0001 0,001 0,01 0,1 1 10 100 1000
10000 100000
0,0001 0,001 0,01 0,1 1 10 100 1000
10000 100000
10-5 10-4 10-3 10-2 10-1 100 101 102 103 104 105
Логарифмическая шкала используется для выражения концентрации водородных ионов (водородного показателя рН), для упрощения числового представления очень маленьких величин.
10-5 10-4 10-3 10-2 10-1 100 101 102 103 104 105
5 4 3 2 1 0 -1 -2 -3 -4 -5
водородный показатель рН.
Реакцию среды оценивают с помощью водородного показателя рН, котрый определяется как отрицательный десятичный логарифм концентрации водородных ионов или математически:
рН = - lg CH+. (2.4)
В нейтральной среде CH+ = C ОH = 107 моль/л, рН = - lg107 = 7.
В кислой среде CH+ от 107 до 101 моль/л, рН от 7 до 1, рН 7.
В щелочной среде CH+ от 107 до 1014 моль/л, рН от 7 до 14, рН 7.
Для выражения концентрации ионов гидроксида используют уравнение
рОН = - lg CОН. (2.5)
Так как произведение концентрации ионов водорода на ионы гидроксида есть величина постоянная: СН+ СОН = 10-14, то формулы (2.4 и 2.5) можно представить так:
рН + рОН = 14. (2.6)
Расчеты значений рН и рОн для сильных кислот и оснований Примеры, в которых концентрация выражена в стандартной форме
Какое
значение рН у раствора
азотной кислоты с концентрацией 0,001
моль/л ? HNO3
– сильная кислота. Таким
образом, [H+]
= [НNO3]
= 0,001; pH
= -lg [H+]
= -lg 10-3; pH
= 3
Определите
значение рН для раствора гидроксида
калия с концентрацией 0,001 моль/л ? КOH
– сильное основание. Таким
образом, [ОH]
= [КOH]
= 0,001; pОH
= -lg
[ОH]
= -lg
10-3; pОH
= 3, рН = 14 – 3 = 11

Примеры расчета рН для одноосновных кислот и однокислотных оснований
Какое
значение рН у раствора соляной кислоты
с концентрацией 0,1 моль/л? НСl
– сильная кислота, следовательно, она
полностью распадается в растворе на
ионы. Таким
образом, [H+]
= [НСl]
= 0,1; pH
= -lg [H+]
= -lg 10-1; pH
= 1
Определите
значение рН у раствора гидроксида
натрия с концентрацией 0,1 моль/л? NaOH
– сильное основание, следовательно,
оно полностью распадается в растворе
на ионы. Таким образом, [ОH]
= [NaOH]
= 0,1; pОH
= -lg
[ОH]
= -lg
10-1; pОH
= 1; рН = 14 – 1 = 13
