
- •Свойства неорганических соединений и водных растворов электролитов
- •Введение
- •Тема 1. Основные классы неорганических соединений
- •Примеры некоторых амфотерных гидроксидов
- •1.2. Соли
- •1.3. Примеры Решения задач
- •1.4. Вопросы для самостоятельной подготовки к контрольной работе
- •1.5. Задачи и упражнения для самостоятельной работы
- •Тема 2. Равновесия в водных растворах электролитов. Водородный показатель. Гидролиз солей
- •2.1. Электролитическая диссоциация
- •Кислот, оснований, солей
- •Константа диссоциации некоторых слабых электролитов в водных растворах (25°с)
- •2.2. Примеры заданий
- •2.3. Ионные реакции двойного обмена
- •Порядок составления уравнений реакций
- •2.4. Водородный показатель рН
- •Логарифмическая шкала и водородный показатель рН
- •Расчеты значений рН и рОн для сильных кислот и оснований Примеры, в которых концентрация выражена в стандартной форме
- •Примеры расчета рН для одноосновных кислот и однокислотных оснований
- •Примеры расчета рН для многоосновных кислот и многокислотных оснований
- •Расчеты значений pH, константы диссоциации, степени диссоциации и концентрации для слабых кислот
- •Примеры расчета значений рН, константы диссоциации и концентрации для слабых кислот
- •1,810-5 Моль/л. Определить рН раствора кислоты с концентрацией 0,1 моль/л.
- •Методы измерения рН
- •Характерная окраска и области перехода ряда индикаторов
- •2.5 Гидролиз солей
- •2.6. Вопросы для самостоятельной подготовки к контрольной работе
- •2.7. Задачи и упражнения для самостоятельной работы
- •Библиографический список рекомендуемой литературы
- •Оглавление
- •Свойства неорганических соединений и водных растворов электролитов
1.4. Вопросы для самостоятельной подготовки к контрольной работе
Назовите основные классы сложных неорганических веществ.
Какие соединения называются оксидами? На какие два типа они делятся? Приведите примеры.
Какие оксиды образуют металлы? Приведите примеры и охарактеризуйте их химические свойства.
Какие оксиды образуют неметаллы? Приведите примеры и охарактеризуйте их химические свойства.
Какие элементы образуют амфотерные оксиды? Приведите примеры и охарактеризуйте их химические свойства.
Какие соединения называются гидроксидами? Приведите примеры их получения. Приведите примеры оснований и их химических свойств.
Приведите примеры кислот и их химических свойств.
На какие типы делятся соли?
На примере химических реакций покажите, как можно получить средние соли.
10. Какие атомы и группы атомов входят в состав кислых, основных солей?
1.5. Задачи и упражнения для самостоятельной работы
К каким классам неорганических соединений относятся следующие вещества: NaCl, NaOH, CaO, HCl, P2O5, Cu(NO3)2, Zn(OH)2, Al2O3, CrCl3, Na2ZnO2 ?
Напишите формулы следующих оксидов: оксид калия, оксид железа (II), оксид фосфора, оксид алюминия, оксид серы (VI), оксид никеля (II).
Укажите кислотные, основные и амфотерные оксиды: SO3, Na2O, N2O5, Al2O3, BeO, CaO, Cl2O7, CO2, MgO, Cr2O3, SiO2.
Напишите формулы и названия гидроксидов, которые соответствуют следующим оксидам: NiO, K2O, CuO, CaO.
Напишите формулы и названия гидроксидов, которые соответствуют следующим оксидам: P2O5, SO2, N2O5, CO2, Cr2O3, SiO2.
Получите все возможные соли при взаимодействии:
а) Al(OH)3 и HCl; б) NaOH и H3PO4; в) LiOH и HNO3.
Составьте уравнения реакций получения хлорида магния: действием кислоты на металл; действием кислоты на основание; действием соли на соль.
Составьте уравнения реакций между кислотами и основаниями, приводящие к образованию следующих солей: NaNO3, LiHCO3, Fe2(SO4)3.
Как доказать амфотерный характер следующих соединений: ZnO, Al2O3, Cr(OH)3?
10. Какие из перечисленных кислот образуют кислые соли: HCl, H2SiO3, Н2СО3, СН3СООН?
11. Напишите молекулярные реакции, с помощью которых можно осуществить следующие превращения:
а) Na → Na2O → NaOH → NaCl → AgCl;
б) Si → SiO2 → CaSiO3 → H2SiO3;
в) S → SO3 → H2SO4 → KHSO4 → K2SO4;
г) Fe → Fe2O3 → FeCl3 → Fe2(SO4)3 → Fe(OH)3;
д) Zn → ZnSO3 → Zn(OH)2 → ZnOHCl → ZnCl2;
e) Al → Al2(SO4)3 → Al(OH)3 → Al(OH)2Cl → AlOHCl2 → AlCl3.
Литература: [1, гл. 4, §§ 4.1 – 4.4]; [2, гл. 1, § 15]; [4, гл. 4, §§ 4.1 – 4.4]; [5, работы 4, 5].
Тема 2. Равновесия в водных растворах электролитов. Водородный показатель. Гидролиз солей
2.1. Электролитическая диссоциация
Кислот, оснований, солей
Растворы – это гомогенные (однородные) системы, состоящие из растворенного вещества, растворителя и продуктов их взаимодействия.
Большое значение имеют жидкие растворы, где в качестве растворителя выступает вода. По способности растворяться в воде все вещества делятся на три группы: 1) хорошо растворимые (в табл. растворимости они обозначены буквой Р); 2) малорастворимые – М; 3) практически нерастворимые – Н (табл. 2.1).
Таблица 2.1
Таблица растворимости солей, кислот и оснований в воде
Анион |
Катион |
|||||||||||
H+ |
K+, Na+ |
NH4+ |
Ag+ |
Mg2+ |
Ca2+ |
Cu2+ |
Ba2+ |
Zn2+ |
Fe2+ |
Fe3+ |
AI3+ |
|
OH- |
Р |
Р |
Р |
- |
Н |
М |
Н |
Р |
Н |
Н |
Н |
Н |
CI- |
Р |
Р |
Р |
Н |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Br |
Р |
Р |
Р |
Н |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
NO3- |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
S2- |
Р |
Р |
Р |
Н |
- |
- |
Н |
Р |
Н |
Н |
Н |
- |
SO32- |
Р |
Р |
Р |
М |
М |
М |
- |
H |
М |
М |
- |
- |
SO42- |
Р |
Р |
Р |
М |
Р |
М |
Р |
H |
Р |
Р |
Р |
Р |
CO32- |
Р |
Р |
Р |
Н |
М |
Н |
Н |
H |
Н |
Н |
- |
- |
HCO3- |
Р |
Р |
Р |
Н |
Р |
Р |
- |
H |
- |
Р |
Р |
Р |
SiO32- |
Н |
Р |
- |
Н |
Н |
Н |
Н |
H |
Н |
Н |
Н |
Н |
PO43 |
Р |
Р |
Р |
Н |
H |
H |
H |
H |
H |
H |
H |
H |
CH3COO |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
- |
Р |
Примечание. Черта означает, что вещество не существует или разлагается водой.
Многие вещества, растворяясь в воде, под влиянием ее полярных молекул распадаются на ионы. Этот процесс называется электролитической диссоциацией, а вещества, распадающиеся на ионы (кислоты, основания, соли), – электролитами. Вещества, полностью распадающиеся на ионы (практически необратимый процесс), называются сильными электролитами. Соединения, частично распадающиеся на ионы (обратимый процесс), называются слабыми электролитами. Силу любого электролита количественно можно оценить степенью диссоциации (α) или константой диссоциации для слабых электролитов (обратимый процесс).
Степень диссоциации зависит от концентрации, температуры и природы вещества; выражается в процентах или долях единицы; определяется отношением числа молекул, которые распались на ионы (n), к общему числу молекул в растворе, N:
![]() .
(2.1)
.
(2.1)
Константа диссоциации КД – это отношение произведения равновесных концентраций ионов к равновесной концентрации недиссоциированных молекул. Константа диссоциации зависит от природы электролита, температуры и не зависит от концентрации вещества (табл. 2.2).
АnВm nАm+ + mВn;
молекула вещества ионы
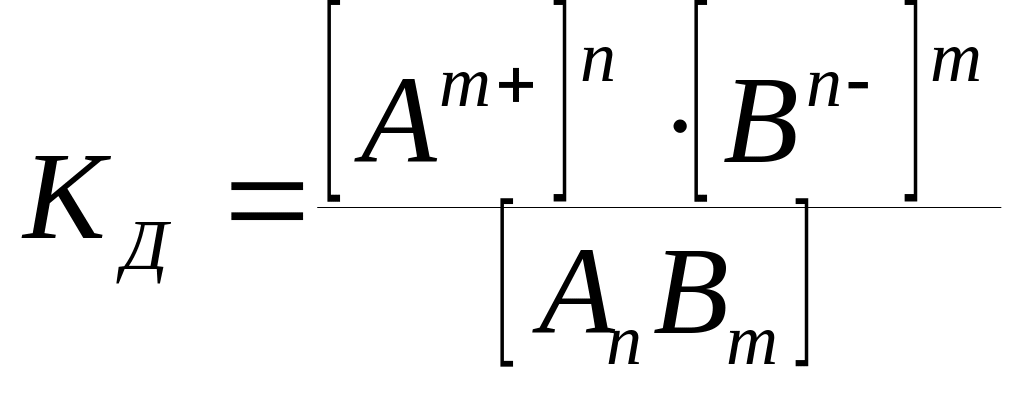 .
(2.2)
.
(2.2)
Чем меньше α или Кдисс., тем слабее электролит.
К сильным электролитам относятся: соли; сильные кислоты (HCI, H2SO4, HNO3, HBr, HI и др.); основания (LiOH, NaOH, KOH, CsOH, Ba(OH)2, Sr(OH)2).
К слабым электролитам относятся: слабые кислоты (H2SO3, HNO2, H2СO3, Н2SiO3, H3РО4, Н3ВО3, СН3СООН, H2S, НСN, HF и др.); слабые нерастворимые в воде основания (Fe(OH)2, Pb(OH)2, Cu(OH)2 и др.); гидроксид аммония NH4ОН; вода (Н2О).
Таблица 2.2
