
Учебное пособие 1184
.pdf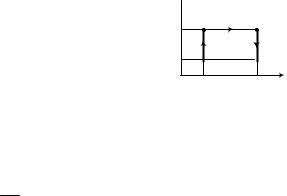
Примеры решения задач
Задача 4.1
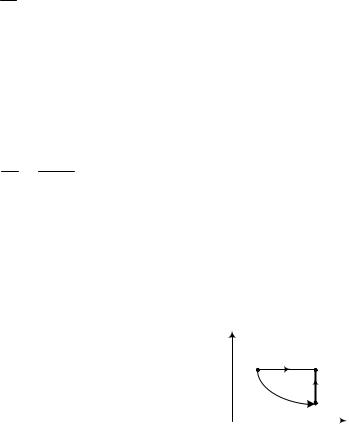
Цикла состоит из двух изобар и двух изохор (рис. 4.6), максимальное давление в цикле в n=2 раза больше минимального, а максимальный объем в ν=4 раза больше. Рабочее вещество – один моль идеального газа с показателем адиабаты γ. Определите КПД цикла.
Решение
p
2p0 |
2 |
3 |
p0 1

 4
4
V0 |
4V0 V |
Рис. 4.6
На рV – диаграмме представлен цикл из последовательных состояний.
Эта система – тепловая машина с КПД η = А .
Q1
Полную работу А за цикл определим как сумму работ на участках цикла:
2 |
3 |
4 |
1 |
2 |
4 |
A = С∫ pdV = ∫ pdV + ∫ pdV + ∫ pdV + ∫ pdV = ∫ pmaxdV + ∫ pmindV = Полная работа
= ( pmax − pmin |
1)(V2 −V12). |
3 |
4 |
1 |
3 |
положительна, так как pmax − pmin > 0, V2 − V1 > 0.
Определим количество теплоты на каждом участке цикла. Участки 1-2 и 3-4 – изобарические процессы, тогда
2 |
4 |
Q12 = ∫CpdT = Cp |
(T2 − T1 ) > 0, Q34 = ∫CpdT = Cp (T4 − T3 )< 0. |
1 |
3 |
Участки 2-3 и 4-1 – изохорические процессы, для них запишем |
|
3 |
1 |
Q23 = ∫CV dT = CV (T3 − T2 ) < 0, Q41 = ∫CV dT = CV (T4 − T1 ) > 0. |
|
2 |
4 |
Соответствующие температуры определим, используя уравнения состояния идеального газа
Из диаграммы следует, что p1 = p2 = pmax , тогда получимV2  V1 = T2
V1 = T2  T1 = ν ,
T1 = ν ,
T2 = νT1 .
Аналогично найдем T3 =νT4 .
Из диаграммы следует, что V1 = V4 = Vmin , тогда получим p1  p4 = T1 / T4 = n или T1 = nT4 .
p4 = T1 / T4 = n или T1 = nT4 .
Аналогично найдемT2 = nT3 .
Суммарное количество теплоты от нагревателей равно
Q1 = Q12 + Q41 .
61

Определим КПД цикла:
η = |
|
( pmax − pmin )(V2 −V1 ) |
|
= |
|
p4V4 (n −1)(ν −1) |
|
. |
|
||||||
C |
p |
(T − T )+ C |
(T − T ) |
|
T C nγ (ν −1) + (1− n) |
|
|||||||||
|
|
2 1 |
V |
4 |
|
1 |
|
|
|
4 V |
|
||||
|
|
С учетом что C |
= |
|
R |
|
, получим η = |
(γ −1)(n −1)(ν −1) |
. |
||||||
|
|
γ |
−1 |
|
|||||||||||
|
|
|
|
|
V |
|
|
nγ (ν −1)+ (1− n) |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Задача 4.2
Тепловая машина, работает по циклу Карно с η=40 %. Её хотят использовать как холодильную машину в тех же условиях. Определите величину холодильного коэффициента ε и количество теплоты, которое может быть передано за один цикл от холодильника к нагревателю, если к нагревателю передается работа за один цикл 200 Дж.
Решение
Холодильный коэффициент равен отношению забранной у холодильника теплоты Q2x к работе внешних сил Ав:
ε = Q2x .
AВ
По первому началу термодинамики полная работа за цикл равна
А = С∫ рdV = С∫ dQ − С∫ dU = С∫ dQ = −Q1x + Q2x ,
где Q2x − количество тепла, полученного рабочим телом от холодильника, Q1x − количество тепла, переданного окружающей среде.
Для цикла Карно:
|
|
Q |
= Q = |
m |
RT lnV3 |
, |
Q |
= Q = |
m |
RT lnV4 . |
|
|
|
||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
2x |
|
23 |
|
µ |
2 |
V2 |
1x |
41 |
|
|
µ |
|
1 |
|
|
V1 |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
Для процессов 1-2 и 3-4 запишем уравнения адиабат: |
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
TV γ−1 |
= T V γ−1 |
, T V γ−1 = T V |
γ−1 . |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
1 |
1 |
2 |
2 |
|
4 |
4 |
|
|
3 |
23 |
|
|
|
|||||
|
|
Если учесть, что T1=T4 и T2=T3, получаем |
V4 |
= |
V3 |
. |
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V1 |
V2 |
|
|
|
||||||
|
|
Найдем |
количество |
теплоты, |
переданное |
окружающей среде, |
|||||||||||||||||||||||
Q |
= |
m |
RT ln |
V3 |
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
1x |
µ |
|
1 |
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Работа внешних сил за цикл AВ = − A = Q1x |
− Q2 x . |
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
Найдем холодильный коэффициент: ε = |
|
Q2x |
|
|
= |
T2 |
|
. Для тепловой |
|||||||||||||||||||
|
|
|
|
− Q |
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Q |
|
|
|
|
|
T −T |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1x |
|
|
2x |
|
|
|
1 |
2 |
|
||
машины и прямого цикла Карно КПД равно
η = A = Q1 − Q2 ,
Q1 Q1
62
где Q1 − количество теплоты, полученной от нагревателя, Q2 − количество теплоты, переданной холодильнику. Машина обратима, и она забирает от холодильника столько же тепла, сколько отдает ему в прямом цикле. Или
|
|
|
|
|
|
|
= A (1−η ) |
|
Q2x |
|
|
= 1−η . |
|
|
Q |
|
= |
|
Q |
|
, ε = |
|
|
||||
|
|
|
|
||||||||||
|
|
|
|
|
|||||||||
|
2x |
|
|
|
2 |
|
η |
|
|
A |
|
|
η |
|
|
|
|
|
|
|
|
|
|
|
|||
Вычисляя, получим Q1x =300 Дж, ε = 1,5.
Задача 4.3
Определите, как изменится энтропия 6 г водорода при переходе от объема в 20 л и давления 1,5 105 Па к объему в 60 л и давлению в 1 105 Па.
Решение
Запишем первое начало термодинамики
δQ = m CV ∆T + pdV .
µ
Через уравнение Менделеева-Клапейрона заменим и получим
2 |
m dT |
2 |
m |
R |
dV |
= |
m |
ln |
T |
+ |
m |
V |
||||
S2 − S1 = ∫ |
µ CV T |
+ 2∫ |
µ |
V |
µ CV |
T |
µ |
Rln V . |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
2 |
|
1 |
|
|
|
1 |
|
|
|
|
|
|
|
1 |
|
|
1 |
|
Запишем уравнения Менделеева-Клапейрона для начального и конечного состояния, отсюда
T2 = p2V2 .
T1 p1V1
Заменим в логарифме отношение температур, а также R:
∆S = |
m |
C ln |
p2 |
+ |
m |
C ln |
V2 |
+ |
m |
Rln |
V2 |
= |
m |
(C ln |
p2 |
+ C |
|
ln |
V2 |
), |
||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
µ |
|
|
V |
p |
|
µ |
|
V |
V |
µ |
|
V |
µ |
V |
p |
|
p |
|
V |
|||||
|
|
|
|
|
1 |
|
|
|
|
|
1 |
|
|
1 |
|
|
|
1 |
|
|
1 |
|
||
где С |
= |
5 R , С |
= |
7 R . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
V |
|
|
2 |
|
p |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вычислим ∆S=71 Дж/К. |
|
|
|
|
|
|
|
|
|
|
|
|
p |
|||||||||||
Задача 4.4 |
1 |
2 |
|
|
Кислород, массой 0,2 кг нагревают |
от Т1=300 К до |
3 |
|
|
Т2=400 К. Как изменится энтропия цикла (рис. 4.7), если на- |
|
|
||
V |
||||
чальное давление р1 и конечное давление р2 |
равны. |
|||
Рис. 4.7 |
||||
|
|
|||
Решение
Изменение энтропии равно
2
∆S = ∫dQ / T .
1
Рассмотрим два произвольных процесса: 1) изобарический переход 1-2;
63

2) изотермическое расширение 1-3+изохорный нагрев 3-2. Процесс 1-2:
2 |
|
|
|
|
|
|
m |
|
|
|
|
|
|
i + 2 |
|
||
∆S = ∫dQ / T , где dQ = |
CpdT , |
Cp |
= |
R . |
|||||||||||||
|
|
|
|||||||||||||||
1 |
|
|
|
|
|
|
|
|
|
2 |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
∆S = |
m i + 2 |
2 |
dT m i + 2 |
Rln |
T |
||||||||||||
2 |
R∫ |
T = 2 |
T . |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
||
|
|
|
|
1 |
|
|
|
|
|
|
|
|
1 |
|
|
||
Процесс1-3-2 дает тот же результат:
3 2
∆S = ∆S13 + ∆S32 = ∫dQТ / T + ∫dQV / T ,
1 3
где dQT = dA = pdV , dQV = m CV dT .
Для изотермического процесса p = p1V1 / V = mRT1 ,
V
∆S13 = mR lnV3 V1 ,∆S32 = m CV lnT2 T3 .
С учетом, что Т3=Т1, V3=V2, иТ2  Т1 = V2
Т1 = V2  V1 окончательно
V1 окончательно
∆S = |
m(i + 2)R |
|
T |
|
|
ln |
2 . |
||
2 |
||||
|
|
T1 |
Для кислорода (двухатомный газ) число степеней свободы равно i=5. Вычисляя, получим
∆S =52 Дж/К.
Задача 4.5
Разность энтропии в цикле Карно для двух адиабат равна 4200 Дж/К. Изменение температур между изотермами 100 К. Определите работу совершенную за цикл?
Решение
Работу определим как A = Q1 − Q2 , где Q1 − полученное количество теплоты, Q2 − отданное количество теплоты.
∆S = Q1 = Q2 − изменение энтропии от одной адиабаты к другой.
T1 T2
T1 = T2 + ∆T , A = ∆S T1 − ∆S T2 = ∆S(T1 − T2 ) = ∆S ∆T . Вычисляя, получим
А=420 кДж.
64
Задача 4.6
1 кг льда при начальной температуре −20 0С превращают в пар при температуре 100 0С. Найдите изменение энтропии.
Решение
2 δQ
∆S = ∫1 T .
Процесс перехода льда в пар состоит из следующих этапов:
1.Нагревание льда от T1 до температуры плавленияT2;
2.Плавление льда при температуре плавления T2;
3.Нагревание полученной массы воды от T2 до температуры кипения T3;
4.Испарение воды при температуре кипения T3.
Общее изменение энтропии вычислим как
∆S = ∑ ∆Si , где ∆Si − изменение энтропии на этапах 1,2 и 3.
1.Нагревание льда на dT требует количества теплоты dQ = mc1dT , где с1
−удельная теплоемкость льда.
По определению для ∆S1 запишем: ∆S1 = mc1 ln T2 .
T1
2. Для плавления льда при T2 надо подвести теплоту Q = mλ,где λ − удельная теплота плавления. Для ∆S2 получим
∆S2 = mλ 1 . T2
3. При нагревании воды (ее удельная теплоемкость с2) энтропия повышается на
∆S3 = mc2 ln T3 . T2
4. Удельная теплота парообразования r. Кипение при T3 сопровождается повышением энтропии (как на втором этапе) на
|
|
|
∆S |
|
= mr |
1 |
. |
|
|
|
|||
|
|
|
4 |
|
|
|
|
||||||
|
|
|
|
|
|
|
T3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
λ |
|
|
|
|
T |
|
r |
|
Просуммируем: |
∆S = m c1 ln |
2 |
+ |
|
|
|
+ c2 ln |
3 |
+ |
|
. |
||
T1 |
T2 |
|
T2 |
T3 |
|||||||||
|
|
|
|
|
|
|
|
||||||
Подставим числовые значения: m=1кг,
с1=2100 Дж/(кг К) Дж/(кг·К),
65

с2=4200 Дж/(кг К),
T1=253 К, T2=273 К, T3=373 К, λ=3,35 105 Дж/кг,
r=2,26 106 Дж/кг. Вычисляя, получим
∆S=8,8 кДж/К.
Задачи для самостоятельного решения
4.1. Один моль идеального двухатомного газа, находящийся под давлением p1=0,1 МПа при температуре Т1=300 К, нагревают при постоянном объеме до давления p2=0,2 МПа. После этого газ изотермически расширялся до начального давления и затем изобарически был сжат до начального объема. Начертить график цикла. Определить температуру газа для характерных точек цикла и его
КПД. Ответ: Т2=Т3=T1 p2 = 600 К. p1
4.2.В ходе цикла Карно газ получает от нагревателя тепло Q=300 кДж. Температуры нагревателя и холодильника равны соответственно Т1=450 К и Т2=280 К. Определить работу А, совершаемую рабочим веществом за цикл. Ответ: А=113 кДж.
4.3.Найти КПД цикла, состоящего из двух изотерм и двух изохор. Изотермические процессы протекают при температурах Т1 и Т2 (Т1>Т2), изохорические – при объемах V1 и V2 и V2 в е раз больше, чем V1). Рабочим веществом
является |
идеальный |
газ |
с |
показателем |
адиабаты |
γ. |
Ответ: |
η= (γ −1)(Т1 − Т2 ) (γТ1 − Т2 ).
(γТ1 − Т2 ).
4.4.Идеальный газ совершает цикл Карно при температурах T1 теплоотдатчика в четыре раза (n=4) больше температуры теплоприемника. Какую долю количества теплоты, полученного за один цикл от теплоотдатчика, газ отдаст теплоприемнику? Ответ: 0,25.
4.5.Определить работу А2 изотермического сжатия газа, совершающего цикл Карно, КПД которого η=0,4, если работа изотермического расширения равна А1=8 Дж. Ответ: 4,8 Дж.
4.6.Идеальная тепловая машина работает по циклу Карно. Температура нагревателя Т1=500 К. Температура холодильника Т2=250 К. Определить КПД
66
цикла, а также работу А1 рабочего вещества при изотермическом расширении, если при изотермическом сжатии совершена работа А2=70 Дж? Ответ:140 Дж.
4.7. Вычислить КПД цикла, состоящего из изотермы, изобары и изохоры, если при изотермическом процессе объем идеального газа с показателем адиа-
баты γ увеличивается в n раз. Ответ: η = 1− γ |
( |
) |
( |
|
( |
|
) |
|
) |
|
|
n −1 |
|
n −1+ |
|
γ −1 |
|
n ln n |
|
. |
4.8.Тепловую машину, работающую по циклу Карно с КПД=10 %, используют при тех же тепловых резервуарах как холодильную машину. Найти её холодильный коэффициент. Ответ: ε = (1− η) / η .
4.9.Найти КПД цикла, состоящего из двух изохор и двух изотерм, если в пределах цикла объем изменяется в ν раз, а абсолютная температура – в τ раз. Рабочим веществом является идеальный газ с показате-
(τ −1)lnν
лем адиабаты γ. Ответ:η = τ lnν + (τ −1)(γ −1) .
4.10. Рассчитать КПД тепловой машины использующей в качестве рабочего тела идеальный одноатомный газ и работающей по циклу, изображенному на рис. 4.8. Ответ: 17,4%.
p
2p0 |
2 |
3 |
p0 1

 4
4
V0 |
3V0 V |
Рис. 4.8
4.11. Цикл состоит из изотермы (T1=600 К), изо- |
|
|
|
бары и изохоры (рис.4.9). Отношение V2/V3=2. Рабочее |
p |
|
|
вещество идеальный газ (i=5). Определить КПД цикла. |
1 |
|
|
|
|
|
|
Ответ: 10 %. |
|
|
|
4.12. Найти изменение энтропии 30 г льда при пре- |
|
3 |
2 |
|
|
||
|
|
|
|
вращении его в пар, если начальная температура льда |
|
|
V |
|
Рис. 4.9 |
|
|
−40 0С, а температура пара 100 0С. Теплоемкость воды и |
|
|
|
|
|
|
|
льда считать постоянными, а все процессы – происходящими при атмосферном |
|||
давлении. Ответ: 265 Дж/К. |
|
|
|
4.13. Найти приращение энтропии при превращении 1 кг воды при 0 0С в пар при 100 0С. Ответ: 7,5 кДж/К.
67
Контрольные вопросы
1.Дайте определение круговому процессу или циклу.
2.Каково отличие обратимых процессов от необратимых?
3.Чем отличается холодильная машина от теплового двигателя?
4.Можно ли осуществить процесс, в котором тепло, взятое от нагревателя, полностью превращается в работу?
5.Какой процесс называется циклом Карно?
6.Что характеризуют равенство и неравенство Клаузиуса?
7.Как изменяется энтропия в фазовых переходах?
8.Сформулируйте второе начало термодинамики.
9.Какую тепловую машину можно назвать двигателем второго рода?
10.Приведите объединенную форму первого и второго начал термодинамики?
11.Существует ли процесс, при котором тепло, полученное от нагревателя, преобразуется в работу полностью?
12.Как изменяется энтропия замкнутой системы и незамкнутой системы?
13.В каком состоянии энтропия и термодинамическая вероятность максимальны?
14.Приведите связь энтропии и термодинамической вероятности.
15.Приведите формулировку третьего начало термодинамики.
16.Каково основное следствие из третьего начала термодинамики?
ГЛАВА 5. ЯВЛЕНИЯ ПЕРЕНОСА В ГАЗАХ
5.1. Свободный пробег частицы
Из главы 1 знаем, что молекулы (атомы, частицы) в газе перемещаются быстро. Однако распространение газов идет гораздо медленнее, это связано с тем, что молекулы движутся беспорядочно и хаотично, постоянно испытывают соударения между собой, траектория движения у молекул газа не прямолинейная, а изломанная.
Введем обозначение li – длина свободного пробега частицы.
Молекула газа все время испытывает столкновение с другими молекулами. При соударении у молекулы меняется абсолютная величина и направление скорости. Среднее расстояние, которое пройдет молекула «без столкновений, называется средней длиной свободного пробега молекулы» [5].
Определим среднюю длину свободного
пробега как |
|
|
|
|
|
|
|
|
l |
|
|||||||
= υ |
τ, «где υ |
– средняя скорость |
λ1 |
|
||||
теплового движения молекулы, τ – среднее время |
λ2 |
λ3 |
||||||
между двумя последовательными соударениями |
Рис. 5.1 |
|||||||
(рис. 5.1)» [5]. |
||||||||
68 |
|
|
||||||

Введем физическую величину σ – и назовем ее эффективным сечением частицы, которое характеризует сечение рассеяния, при парном соударении между молеку-
лами (рис. 5.2). Тогдаσ = πd2 – площадь, в которую не может «пройти» середина другой частицы. На рис. 5.2 d=2r – диаметр частицы.
За единицу времени частица пройдет расстояние, численно равное средней арифметической скорости моле-
σ
d 
Рис. 5.2
кулы υ . За единицу времени частица претерпевает z соударений. Значит, сред-
няя длина свободного пробега l = υ . z
Определим число столкновений для двух частиц.
Теория вероятности показывает, что вероятность столкновения трех и более частиц очень мала.
Столкновения одной молекулы могут произойти только с молекулами, центры которых попадут в цилиндр радиусом d (рис. 5.3).
υ ′
 d
d
Рис. 5.3
Путь, который пройдет частица за единицу времени, численно равен длине этого цилиндра υ' . Если перемножим объём цилиндра υ'σ на число частиц в единичном объёме n, то получим среднее число столкновений в единицу времени ν = πd2υ' n.
Все частицы двигаются в разных направлениях, количество соударений определяется средней относительной скоростью движения частиц.
Среднюю относительную скорость вычислим так:
υ' = 
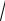 υ2 +υ2 =
υ2 +υ2 = 
 2υ2 =υ
2υ2 =υ 
 2.
2.
Как было определено выше, для средней длины свободного пробега для
l = υ . Подставляя значение средней относительной скорости, придем к выра- z
жению
|
= |
|
1 |
= |
|
1 |
. |
(5.1) |
|||
l |
|||||||||||
|
|
|
|
|
|
|
|||||
|
|
|
2nπd2 |
|
|
2nσ |
|
||||
Применив уравнение состояния идеального газа, выразим концентрацию
n, n = р , значит, средняя длина свободного пробега окончательно будет равна kT
69

|
= |
|
|
kT |
= |
|
kT |
. |
(5.2) |
||
l |
|||||||||||
|
|
π d2 р |
|
|
|
|
|||||
|
|
|
2 |
|
|
2σр |
|
||||
5.2. Диффузия газов
«Диффузия – процесс взаимного проникновения молекул или атомов одного вещества между молекулами или атомами другого, приводящий к самопроизвольному выравниванию их концентраций по всему занимаемому объёму» [12].
В состоянии термодинамического равновесия в системе частиц концентрация n во всех ее частях одинакова, а значит, и плотность. При изменении плотности от равновесной в некоторой части системы появляется перемещение структур вещества в направлениях, приводящих к выравниванию концентрации во всем объеме. Диффузионный поток, связанный с переносом вещества, прямо пропорционален градиенту концентрации:
J ~ dn . dx
Предположим, что в газе есть примесь концентрации n и расположена она в определенной точке А(x, y, z,).
Тогда градиент концентрации:
grad n = dn i + dn j + dn k. dx dy dz
Если взять одно выделенное направление, то
grad n = dn . dx
При наличии grаd n хаотичность в движении будет уменьшаться, появится течение частиц примеси, направленное от координат с большей концентрацией к координатам с меньшей концентрацией.
Определим в плоскости, содержащую координату х, единичную площадку dS, которая перпендикулярна оси ох. Вычислим число частиц, которые проскакивают через единичную площадку слева направо dN+ и справа налево dN− , за время dt. Вывод аналогичен выводу уравнения идеального газа:
dN+ = 16 n1υ dSdt ,dN− = 16 n2υ dSdt ,
где n1 − концентрация частиц слева от площади, а n2 − концентрация частиц справа от площадки dS. Значит, разница в числе частиц во встречных потоках будет равна
dN = dN+ − dN− .
70
