
Учебное пособие 1184
.pdf
Важной характеристикой распределения молекул газа по модулю скоростей является среднеквадратичная скорость, характеризующая скорость всех молекул газа:
υкв = 1 ∑N υi2 .
N i=1
Тогда окончательно давление газа равно
|
1 |
|
|
|
2 |
|
m υ |
2 |
|
2 |
|
|
|
|
|
|
p = |
nm υ |
2 |
= |
|
|
= |
|
|
|
. |
(1.17) |
|||||
|
|
n |
0 |
кв |
|
|
nE |
|
||||||||
|
кв |
|
|
|
|
|
K |
|||||||||
|
3 |
0 |
|
3 |
|
|
2 |
|
|
3 |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Это уравнение связывает давление идеального газа p, массу частицы m0, концентрацию частиц n, среднеквадратичную скорость частиц υкв и среднюю
кинетическую энергию поступательного движения частиц. Называют это выражением основным уравнением молекулярно-кинетической теории газов.
Сопоставляя формулы (1.16) и (1.17), получаем
|
|
(1.18) |
|
= |
3 kT . |
Е |
||
к |
|
2 |
1.4.Реальные газы
Вконце 19 века голландский физик Ван-дер-Ваальс (Johannes Diderik van der Waals) дал свою интерпретацию давления реальных газов.
Для каждой частицы можно определить объем, недоступный для других
частиц. Очевидно, что это будет4π (2r)3 / 3, где r – радиус одной молекулы.
Причем Vмолек = 4π r3 / 3 – объем одной молекулы. Значит, в сосуде, который содержит N одинаковых молекул, можно определить совокупный объем, в ко-
тором не будет столкновений частиц друг с другом:(N / 2)4π (2r)3 / 3 = 4NVмолек . Для упрощения будем считать, что половина молекул неподвижна и к ним движется другая половина частиц. Их кинетическая энергия в два раза больше, чем у покоящихся молекул. Обозначим b = 4NVмолек .
Объем, доступный для взаимодействия молекул, будет равен V − b, а дав-
ление на стенки сосуда будет создаваться |
только движущимися частицами |
||||
(N′ = N / 2) : |
|
|
|
|
|
p = nkT′ = |
N′ |
kT′ = |
NkT |
|
. |
|
|
|
|||
V − 4NV |
V − 4NV |
|
|||
|
молек |
|
|
молек |
|
Для одного моля газа: p(V−b)=RT.
Для ν=m/µ молей газа уравнение примет вид
p(V− νb)=νRT.
Дополнительное давление пропорционально числу молекул на единицу площади и силе взаимодействия этих молекул между собой в единичном объе-
11
ме. Давление реального газа будет пропорционально квадрату концентрации молекул n2 ~ N 2 /V 2 . Если в сосуде находится один моль газа, то
рi = а /V 2 ,
где а – постоянная величина, зависящая от газа. В случае ν-молей имеем
рi =ν 2а / V 2 рi=ν2а/V 2. Тогда уравнение состояния примет вид p+pi=nkT.
(p+ν2 а/V 2)V=νRT.
Учитывая суммарное действие сил притяжения и сил отталкивания и введенные выше поправки, получаем уравнение Ван-дер-Ваальса:
|
|
ν |
2 |
a |
|
|
|||
(V −νb) p + |
|
|
=ν RT , |
||||||
|
V |
2 |
|
||||||
|
|
|
|
|
|
|
|||
для моля реального газа: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a |
|
|
||
(Vm |
− b) p + |
|
|
|
|
|
|
= RT . |
|
|
|
|
2 |
|
|||||
|
|
|
Vm |
|
|
||||
Данное уравнение верно, если νb << V и ν 2а / V 2 << p . Умножим уравнение на V 2 и раскрывая скобки, получим
pV 3 – (RT + bp) νV 2 + аν2V − аbν3 = 0.
(1.19)
(1.20)
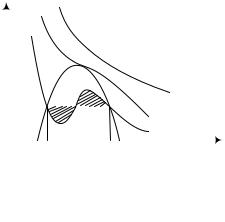
Очевидно, что уравнение имеет третью степень и имеет или один, или «три вещественных корня, т.е. изобара p = сonst пересекает кривую p=p(V) в одной или трех точках, как на рис. 1.5. При температуре выше критической зависимость p=p(V) является однозначной функцией объема. Это означает, что при T > Tкр вещество находится только в газообразном состоянии, как у идеального газа. При температуре газа ниже критической существует возможность перехода вещества из газообразного в жидкое и наоборот.
На участке АСВ изотермы Т1 давление растет с увеличением объема. Данное состояние неустойчиво. Поэтому область ВСА не может устойчиво существовать. В областях DLB и АGE давление падает с увеличением объема. Это необходимое, но не достаточное условие устойчивого равновесия. Опыты показали, что система переходит из области устойчивых состояний – газ (GE) в область устойчивых состояний – жидкость (LD) через двухфазное состояние» GL (газ – жидкость) вдоль GСL –изотермы.
Наличие критической точки на изотерме |
p |
|
F |
M |
|
|
|
||
|
|
|
|
||||||
|
|
|
|
|
|||||
Ван-дер-Ваальса означает, что для каждой |
|
|
|
|
|
|
|
|
|
|
D |
|
|
|
|
|
|
||
жидкости существует такая температура, вы- |
|
|
|
K |
|
|
|
|
|
ше которой вещество может существовать |
|
|
|
A |
|
N T2 <Tкр<T1 |
|||
только в газообразном состоянии» [5]. Крити- |
|
L |
|
|
|
G |
H |
Tкр |
|
ческая точка K – точка перегиба изотермы |
|
B |
C |
E |
|||||
|
|
||||||||
|
|
|
|
|
|
|
T |
||
(рис. 1.5). |
|
|
|
|
|
|
|
1 |
|
|
Q |
|
R |
|
|
V |
|||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|||
Рис. 1.5
12

Примеры решения задач
Задача 1.1
Какое количество молекул газа находится в 10-3м3 при температуре 273 К и давлении 133,33 Па?
Решение
Воспользуемся формулой, связывающей давление газа и
цию p=nkT= N kT.
V
Выразим число молекул N= pV.
kT
После подстановки значений, получим N=3,5·1019 шт.
Задача 1.2
В сосуде объемом10-2м3 находится Не (гелий) под давлением 106 Па и температуре 300 К. Из сосуда было выпущено 10 г гелия, температура в сосуде опустилась до 290 К. Определить давление гелия, который остался в сосуде.
Решение
Выразим конечное давление гелия из уравнения Менделеева-Клапейрона:
p = m2RT2
2 V
Очевидно, что оставшаяся масса равна разности первоначальной массы и массы, выпущенной из сосуда
m2= m1-m.
Массу m1 выразим также из уравнения Менделеева-Клапейрона для на-
чального состояния:m1 |
= |
pV |
|
1 |
|||
|
|
||
|
|
RT1 |
С учетом этого равенства масса m2 выражается так:
m = |
pV |
− m . |
1 |
||
2 |
RT1 |
|
|
|
Окончательно после преобразований получаем
|
|
pV |
|
RT |
|
p2 |
= |
1 |
−m |
2 |
. |
RT1 |
|
||||
|
|
|
V |
||
Раскроем скобки: p2 = T2 p1 − mRT2 .
T1 V
После подстановки значений получим p2=364кПа.
Задача 1.3
В газовый баллон объемом 7,5 10-3 м3 при температуре 300 Кзакачаны газы: ν1 =0,10 моля O2, ν2 =0,20 моля N2 и ν3 =0,30 моля СO2. Газы идеальные.
Определите: 1) общее давление смеси; 2) среднюю молярную массу µ смеси газов.
13

Решение
1. Смесь содержит ν1,ν 2 и ν 3 молей кислорода, азота, углекислого газа со-
ответственно. Общее количество вещества найдем как сумму молей газов в шарике: ν =ν1 +ν 2 +ν3 .
Уравнение состояния идеального газа для смеси газов |
|
||||||||||
|
|
pV =ν RT выразим через p = |
ν RT |
, получаем |
|
||||||
|
|
|
|||||||||
|
|
|
|
|
|
|
V |
|
|||
|
p = |
(ν1 +ν2 +ν3)RT |
= |
(0.1+ 0.2 + 0.3) 8.31 300 |
=1,9 105 |
Па. |
|||||
|
|
|
|
||||||||
|
|
V |
|
|
|
7.5 10−3 |
|
||||
2. Масса молекул |
кислорода m1 =ν1 µ1 , масса молекул азота равна |
||||||||||
m2 =ν 2 µ2 , масса молекул в смеси равна m3 =ν3 µ3 . Общая масса смеси |
|||||||||||
|
|
|
m=m1+m2+m3=ν1µ1+ν2µ2+ν3µ3. |
|
|||||||
Молярная масса смеси |
|
||||||||||
µ = |
ν1µ1 +ν2µ2 +ν3µ3 |
= |
0,1 32 + 0,2 28 + 0,3 44 |
= 36,7 г/моль. |
|
||||||
ν1 +ν2 +ν3 |
|
|
|||||||||
|
0,1+ 0,2 + 0,3 |
|
|
|
|
|
|||||
Задача 1.4
Вычислите количество молекул воды в объеме V=1 мм3 и массу m1 одной молекулы. Предполагается, что молекулы соприкасаются друг с другом. Найдите d – диаметр молекул. Плотность воды, 1000 кг/м3.
Решение
Число молекул, содержащихся в массе m, равно
N =ν NA . Так как ν = mµ , то N = mNµ A , m = ρV .
Вычислим молярную массу воды:
µ = 2 10−3 +16 10−3 = 18 10−3 (кг/моль).
|
|
|
|
|
103 |
10−9 |
6,02 1023 |
|
|
|||||||
Тогда число молекул воды |
N = |
|
|
|
|
|
|
|
|
= 3,34 1019 шт. |
|
|
||||
|
|
18 |
10−3 |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Для массы одной молекулы справедливо m = |
µ |
.Тогда, вычисляя, полу- |
||||||||||||||
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
1 |
NA |
|
|
||||
чим m = |
18 10−3 |
кг = 2,99 10−26 |
кг . |
|
|
|
|
|
|
|
|
|
|
|
||
6,02 |
1023 |
|
|
|
|
|
|
|
|
|
|
|
||||
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Так как молекулы расположены плотно и каждая молекула занимает объ- |
||||||||||||||||
ем V1=d3, где |
d - диаметр молекулы, тоd = 3 |
|
.Объем V1 найдем так: V = |
Vm |
. |
|||||||||||
V |
||||||||||||||||
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
1 |
|
1 |
NA |
||||
14

|
|
Подставим |
выражение V1 в выражение |
для |
диаметра молекулы: |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Vm |
|
|
µ |
|
|
|
|
|
|
= 3,11 10−10 м. |
||
d = 3 |
|
,где V = |
. Окончательно получимd = 3 |
µ |
|
|
|
||||||
|
|
ρ |
|
|
|
|
|||||||
|
|
N |
1 |
|
|
ρN |
A |
|
|||||
|
|
|
A |
|
|
|
|
|
|||||
Задача 1.5
Смесь газов занимает объем 2 10- 2м3 . Смесь состоит из 10 г кислорода О2 и 10 г азота N2. Газы находятся при температуре 300 С. Вычислите давление и молярную массу смеси газов.
Решение
Воспользуемся законом Дальтона p = ∑ pi = p1 + p2 ,
i
где давление для каждого из газов: p = |
mi RT |
. |
|
||
i |
iV |
|
|
|
|
Просуммируем парциальные давления для всех газов:
p = RT (m1 + m2 ) .
V 1 2
После подстановки значений получим p = 235 кПа. Найдем молярную массу:
|
|
= |
mсм |
= |
m1 + m2 |
= |
|
m1 + m2 |
= |
1 2(m1 + m2 ). |
|
|||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||||||
|
см |
|
ν |
|
|
ν + ν |
m1 |
|
m2 |
m + m |
|
|||||||||||||||||||
|
|
|
см |
1 |
2 |
|
|
|
+ |
|
|
|
2 |
1 |
1 |
|
2 |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
1 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Вычислив, получим µ |
см |
= 29,8 г/моль = 29,8 10-3 кг/моль. |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Задача 1.6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В сосуд цилиндрической формы объемом 0,5 м3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
закачивается воздух со скоростью 0,001 кг/с. В верхней |
|
|
|
С |
|
|
B |
|
||||||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||||||
части сосуда есть сквозная дырка, закрытая клапаном, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
который удерживается в закрытом состоянии стержнем, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
который может свободно вращаться вокруг оси в точ- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
ке С (рис. 1.6). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
К правому торцу стержня прикреплен груз мас- |
|
|
|
|
|
Рис. 1.6 |
|
|||||||||||||||||||||||
сой 2 кг. Клапан срабатывает и открывает отверстие |
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
через t=580 с работы насоса. До работы насоса давле- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
ние в сосуде было атмосферное. Площадь закрытого клапаном отверстия равна 5 10-4 м2, расстояние СВ равно 0,1 м. Температура в сосуде и снаружи 300 К. Определите длину стержня. Стержень считать невесомым. Молярная масса воздуха µ=29 кг/кмоль.
15
Решение
Найдем силу давления на клапан при превышении давления воздуха в сосуде над атмосферным ∆p, так как площадь клапана равна s, то
F = s∆p .
Сила, с которой стержень действует на клапан, равна mg L, l
где m, L и l – масса груза, длина стержня и длина его участка СВ.Клапан откро-
ется, если выполнится условие s∆p ≥ mg L . l
Дополнительное давление воздуха определяется увеличением массы ∆m воздуха в цилиндре. По уравнению Клапейрона-Менделеева
∆p = ∆mВ RT .
V
Подставим это выражение в неравенство s∆p ≥ mg L :
|
|
|
|
l |
|
s∆mВ |
RT ≥ mg |
L |
или L ≤ |
lsRT∆mВ |
. |
V |
|
|
|||
|
l |
|
mg V |
||
Таким образом, получаем окончательно, L = lsRT 0,001t = 0,25 м. mg V
Задача 1.7
Воздушный шар с оболочкой массой 400 кг заполнен гелием. Определите максимальную массу гелия в воздушном шаре, если температура окружающего шар воздуха 290 K , а давление наружного воздуха 105 Па, к шару прикреплен груз массой 200 кг. Оболочка не препятствует изменению объёма и не сообщается с атмосферой. Молярные массы: воздуха – 29 г/моль, гелия – 4 г/моль. Ответ дать с точность до сотых.
Решение
Шар с грузом удерживается в равновесии, если сумма всех сил, действующих на него, равна нулю:
(М + m)g + mг g − mВ g = 0 ,
где M и m – массы оболочки шара и груза, mг – масса гелия, а mВ g – сила Архи-
меда, действующая на шар, mВ – масса |
воздуха. Отсюда следует: |
|||||
М + m = mг + mВ . |
|
|
|
|
|
|
Запишем для гелия и воздуха: pV = |
mГ |
RT = |
mВ |
RT , |
||
|
|
|||||
|
|
Г |
|
В |
||
|
|
|
||||
где Г – молярная масса гелия, В – молярная масса воздуха, V– объём шара.
16
Отсюда m = m |
|
µВ |
, следовательно, |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||||
В |
Г µ |
Г |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
В |
|
|
29 |
|
|
|
|
|
|
mВ − mГ |
= mГ |
|
−1 |
= mГ |
|
−1 |
= 6,25mГ , |
|
|
|
|
|
Г |
4 |
|||||||
|
|
|
|
|
|
|
|
|
|
|||
М + m = 6,25 mг , окончательно получаем mг =96 кг.
Задача 1.8
Вертикальный герметичный цилиндр высотой 0,5 м разделен на две части поршнем массой 10 кг. В каждой части содержится одинаковое количество вещества идеального газа, поршень поднят на высоту 0,2 м от дна. Определите, какое количество молей газа находится в каждой части? Вся система находится при температуре 360 К. Поршень может свободно перемещаться, его толщиной можно пренебречь. Ответ дать с точность до сотых.
Решение
Запишем уравнения Менделеева–Клапейрона для верхней и нижней частей сосуда:
p1V1 =ν RT , p2V2 =ν RT ,
Найдем объемы верхней и нижней частей сосуда.
V1 = S(H − h),V2 = Sh,
где S – сечение поршня, Н – высота сосуда, h – высота, на которой находится поршень.
Запишем условие равновесия поршня. Сумма всех сил, действующих на поршень, равна нулю, то есть выполняется второй закон Ньютона:
p1S + mg − p2S = 0 .
Подставляя в последнее равенство выражения для давлений в верхней и нижней частях сосуда, получим выражением для количества молей газа:
ν = |
|
|
mg |
|
= 0,02 моль. |
|
|
|
|
|
|
||
|
1 |
− |
1 |
|
||
|
RT |
|
|
|
||
|
|
|
||||
|
h |
|
H − h |
|||
Задача 1.9
В цилиндре, расположенном горизонтально и запаянном с одного конца, помещают ртуть. Столбик ртути длиной 25 см отделяет воздух в трубочке от атмосферы. Затем цилиндр поставили вертикально запаянным концом вниз и нагрели на 10 К. Объем, который занимал воздух, не изменился. Давление атмосферы в лаборатории p0 =750 мм рт. ст . Какой была первоначальная темпе-
ратура T0 в цилиндре?
17

Решение
Запишем условие равновесия столбика ртути в вертикальном цилиндре: p = p0 + ρ gd , где p0 = ρ gH – атмосферное давление и равно 750. мм рт. ст.
Очевидно, что процесс изохорный, значит:
|
|
T |
= |
p |
, причем T = T + ∆T . |
|||||||
|
|
|
|
|||||||||
|
T0 |
p0 |
|
|
|
0 |
|
|
||||
|
|
|
|
|
|
|
||||||
Подставим выражения для p и p |
|
, тогда |
T |
=1+ |
d |
. |
||||||
0 |
|
|
||||||||||
|
|
|
|
|
|
|
|
T0 |
|
H |
||
|
|
|
|
|
|
|
|
|
|
|||
Отсюда |
|
T = ∆T |
H |
= 300 K. |
|
|
|
|||||
|
|
|
|
|
||||||||
|
0 |
|
|
d |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
||
Задача 1.10
Давление некоторого газа равно 10 кПа, а его средняя квадратичная скорость 500 м/с. Какова плотность газа?
Решение
Запишем основное уравнение МКТ:
|
2 |
|
m υ 2 |
2N m υ2 |
1 |
ρυ 2 . |
|||||
P = |
|
n |
0 |
кв |
= |
|
0 |
кв |
= |
|
|
|
|
|
|
|
|
|
|||||
|
3 |
2 |
|
|
3V 2 |
|
|
3 |
кв |
||
|
|
|
|
|
|
||||||
Следовательно, ρ = 3p = 0,12 кг/м3.
υкв2
Задача 1.11
В вертикальном сосуде цилиндрической формы под тяжелым поршнем, перемещающимся без трения, находится воздух под давлением 1,5 105 Па. Поршень находится в равновесии на высоте H1=0,2 м над дном сосуда. На сколько переместится поршень, если цилиндр перевернуть открытым концом вниз и дождаться установления равновесия. Температура воздуха постоянна и атмосферное давление постоянно и равно 105 Па. Массой воздуха в сосуде пренебречь.
Решение
В первом случае на поршень действуют направленные вниз сила тяжести Mg и сила атмосферного давления p0S , а вверх – сила, с которой давит воз-
дух на поршень p1S . Поршень находится в равновесии, и по закону Ньютона запишем:
p1 S = p0S + Mg .
Во втором случае давление воздуха в сосуде становится равным p2, а расстояние от дна сосуда до поршня – H2.
На поршень действуют направленные вниз сила тяжести Mg и сила давления воздуха над поршнем p2S, а вверх – сила атмосферного давления p0S.
18

Поршень находится в новом положении равновесия, и по закону Ньютона запишем:
p 0 S = p2S + Mg . Так как Т=const, то pV=const: p1H1S = p2 H2S .
Первые два уравнения позволяют установить, что p2 = 2 p0 − p1 . Подстав-
ляя это выражение в закон Бойля-Мариотта, получаем |
|
||||||||||
H2 = |
p1 |
|
|
|
|
|
|
|
|
||
|
H1 . Значит, поршень сместится на расстояние |
||||||||||
2p − p |
|||||||||||
|
0 |
1 |
|
|
|
|
|
|
|
|
|
|
|
∆H = H |
2 |
− H |
1 |
= |
2( p1 − p0 ) |
H |
1 |
= 0,4 м. |
|
|
|
|
|||||||||
|
|
|
|
|
|
2p0 − p1 |
|
||||
|
|
|
|
|
|
|
|
|
|
||
|
|
Задачи для самостоятельного решения |
|||||||||
1.1. В емкости вместимостью V=25,0 л находится Н2 (водород) при температуре T=290 К. Когда часть водорода использовали, давление в емкости понизилось на ∆p=0,4 МПа. Определить, сколько газа было израсходовано. Ответ: 8,3 г.
1.2. Оболочка аэростата емкостью V=1600 м3, находящегося на земле, за-
полнена Н2 (водородом) на |
7/8 |
при давлении p1 =100 кПа и температуре |
T1 =291 К. Аэростат поднялся |
на |
высоту, где термодинамические показатели |
уменьшились: давление стало p2=80 кПа, а температура снизилась до T2=280 К. Определить массу водорода, вышедшего из оболочки. Ответ: 6,16 кг.
1.3. В сосуд объемом 0,25 м3закачали газ при температуре 328 0С, состоящий из смеси углекислоты и паров воды. Число частиц углекислого газа N1 =6,60 1021 шт., молекул воды N2 = 9 1020 шт. Найдите давление и молярную массу смеси этих газов. Ответ: p=244 Па, µ=41 г/моль.
1.4. Плотность газа ρ, состоящего из He и Аr при давлении полторы атмосферы и температуре и 290 К, равна 2,0 г/л. Сколько атомов гелия содержится в одном миллилитре смеси газов? Ответ: 7 1018.
1.5.В камере емкостью 2 м3 при температуре 300 К и давлении 0,6 мкПа
содержится смесь N2 и окиси азота NO суммарной массой 14 кг. Вычислите массу окиси азота. Ответ: 13,5 кг.
1.6.Определите плотность водорода и кислорода , если их части относят-
ся как 1 |
8 |
соответственно. Давление p=100 кПа , температура Т=300 К. |
|
|
|
Ответ: 0,4 кг/м3 . |
||
1.7.В камере емкостью 0,5 л находится 1 г парообразного йода. Давление
всосуде достигло 700 мм рт. ст. при температуре 10000С. При заданных усло-
виях вычислите степень диссоциации молекул J2 на атомы J. Молярная масса молекулы йода 234 кг/кмоль. Ответ: 0,12.
19
1.8. Трубку установили вертикально и заполнили кислородом (О2). Высота трубки h=200 м, объем V=200 л . Температура стенок трубки Т=293 К . Давление газа у основания трубки равно 105 Па . Определите число молекул О2, содержащихся в трубке. Ответ: N=4,19 1024.
1.9.В горизонтально расположенном цилиндре с одним закрытым концом
спомощью столбика ртути закрыт воздух при температуре 300 К. Затем трубку переворачивают вертикально открытым концом вверх и нагревают на 60 К, в результате чего объём воздуха становится прежним. Найдите высоту столбика ртути, если атмосферное давление 750 мм рт. ст. Ответ: d=15 см.
1.10.Найдите минимальный объем камеры, вмещающей 6,4 кг кислорода, если её стенки при температуре 20 0С выдерживают давление в 18 Н/см2. Ответ: 2,86 м3.
1.11.Из неисправного баллона объемом 20 л вытекает водород. Давление
из-за утечки падает от |
10,2 до |
4,96 атм. |
При этом |
газ охлаждается |
от 127 до 27 0С. Какое |
количество |
водорода |
вытекло? |
Считать водород |
идеальным газом. Ответ:4,33 г. |
|
|
|
|
Контрольные вопросы
1.Чем термодинамический и статистический методы изучения макроскопических систем отличаются и чем дополняют друг друга?
2.Как определяется термодинамический параметр? Приведите примеры.
3.Объясните газовые законы с точки зрения молекулярно-кинетической теории?
4.Назовите законы, которыми описываются изотермический, изобарические и изохорические процессы?
5.В чем заключается физический смысл постоянной Авогадро?
6.В чем заключается молекулярно-кинетическое определение давления газа?
7.Дайте определение «количеству вещества»?
8.Что такое «реперная точка»? Какие шкалы температур Вы знаете? Каковы их реперные точки?
9.Когда газы можем считать идеальными?
10.Можно ли применять уравнения идеальных газов в реальных условиях?
20
