
Учебное пособие 1184
.pdf
Так как R = C |
|
− C |
, тогда |
|
dT |
+ |
Cp − CV |
|
|
dV |
|
= 0 . |
|||||||
p |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
V |
|
|
T |
|
|
|
|
CV |
|
|
V |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Известно, что |
|
Cp |
|
= γ тогда |
|
dT |
+ (γ −1) |
dV |
|
= 0. |
|||||||||
|
CV |
|
T |
|
|
V |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Интегрируя уравнение, получаем |
|
|
|
|
|
|
|||||||||||||
|
|
|
|
( |
γ −1 |
) |
|
= const . |
|
|
|
|
(3.34) |
||||||
|
|
lnT + ln V |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Или lnT (V γ −1 )= const. Потенцируя, получаем
T V γ −1 |
) |
= const. |
|
( |
|
|
|
Τ1V1γ −1 = Τ2V2γ −1 . |
(3.35) |
||
Выражение (3.35) называют уравнением Пуассона для адиабаты. Заменим в (3.35) T = µ рV (из уравнения Менделеева-Клапейрона):
Rm |
|
|
|
|
|
|
|||
µ |
|
рV Vγ −1 = const , |
|
||||||
|
|
|
|
|
|
||||
|
|
|
Rm |
|
|
|
|
||
т.к. для данной массы газа |
µ |
величина постоянная, то |
|
||||||
|
|
||||||||
|
m |
|
|
|
|
|
|
||
рV γ = const |
, р V γ = р V |
γ . |
(3.36) |
||||||
|
|
|
|
1 |
1 |
2 |
2 |
|
|
На рис. 3.3 приведены графики изотермы и адиабаты. Показатель степени γ >1, поэтому график адиабаты круче в сравнении с изотермой.
p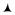
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
Рис. 3.3 |
|
|
|
|
|
Вычислим работу адиабатического процесса: |
|
|
|
|||||||
|
m T2 |
m |
|
m |
|
|
|
|||
A = ∫ рdV = − |
|
T∫CVM dT = − |
|
CVM |
(T2 −T1) = |
|
CVM |
(T1 |
−T2 ). |
(3.37) |
µ |
µ |
µ |
||||||||
|
1 |
|
|
|
|
|
|
|
|
|
41

3.6. Политропические процессы
Политропическими или политропными называют процессы, во время которых теплоёмкость газа остаётся неизменной. Уравнение политропы в параметрах p, V:
pV n = const, |
(3.38) |
где n – показатель политропы, произвольное число [−∞;+∞] .
Политропическими являются все рассмотренные выше процессы: адиабатический, изотермический, изобарический, изохорический. Представим их в виде (3.35).
1. Изобарический процесс p = сonst, n = 0:
γ R
C = γ −1 = γ CV = Cp.
2. Изотермический процесс Т = сonst, n = 1:
CT = ±∞.
3. Изохорический процесс V = сonst, n = ±∞:
R CV = γ −1.
4. Адиабатический процесс ∆Q = 0, n = γ, Сад = 0. Окончательно обобщённая формула для работы:
|
PV |
|
V |
n−1 |
|||
A = |
1 1 |
|
1− |
1 |
|
. |
|
n −1 |
|
||||||
|
|
V2 |
|
|
|||
|
|
|
|
|
|
|
|
Примеры решения задач
(3.39)
(3.40)
(3.41)
(3.42)
Задача 3.1
Определите удельные теплоемкости при постоянном объеме сV и при постоянном давлении сp для смеси неона и водорода, если их массовые доли составляют ω1=80 % и ω2=20 % соответственно.
Решение
Воспользуемся формулой для удельной теплоемкости: cV = 2i µR ,cp = i +22 µR .
Неон – инертный газ, который можем считать идеальным −i =3 и=20 10-3 кг/моль.
c |
= |
3 |
|
8,31 |
= 6,24 102 Дж/(кг К). |
|||
2 20 10=3 |
||||||||
V1 |
|
|
|
|||||
cp1 |
= |
3+ 2 8,31 |
=1,04 103 Дж/(кг К). |
|||||
|
|
|
||||||
2 |
|
20 10=3 |
||||||
|
|
|
|
|
|
|
42 |
|

Водород – двухатомный газ, значит, i=5 и µ=2 10-3 кг/моль.
c |
|
= |
5 |
8,31 |
=1,04 104 |
Дж/(кг К). |
|||
|
2 |
|
2 10=3 |
||||||
V 2 |
|
|
|
|
|
||||
c |
|
= 5 |
+ 2 |
8,31 |
=1,46 104 Дж/(кг К). |
||||
p2 |
|
|
|
||||||
|
|
|
2 |
2 10=3 |
|
||||
|
|
|
|
|
|||||
Запишем формулу для количества теплоты, необходимой для нагревания на ∆T:
Q = cV (m1 + m2 )∆T , и Q = (cV 1m1 + cV 2m2 )∆T .
Приравняем выражения и разделим обе части равенства на ∆T, тогда
cV (m1 + m2 ) = cV 1m1 + cV 2m2 . Выражаем cV:
c |
= c |
|
m1 |
+ c |
|
m2 |
, в этом выражении дроби и есть массовые до- |
|
+ m |
|
|
||||
V |
V1 m |
V2 m |
+ m |
||||
|
1 |
2 |
1 |
2 |
|
||
ли газов:
c = c ω + c ω |
, ω = |
|
m1 |
и ω |
2 |
= |
m2 |
. |
|||
|
|
|
|||||||||
V V |
1 |
V |
2 |
1 |
|
+ m2 |
|
|
m1 + m2 |
||
1 |
|
2 |
|
|
m1 |
|
|
|
|||
|
|
|
|
|
|
|
|
||||
Аналогично для ср: cp = cp1ω1 + cp2ω2 . Вычисляя, получаем:
cV = 6,24 102 0,8 +1,04 104 0,2 = 2,58 кДж/(кг К); cp =1,04 103 0,8 +1,46 104 0,2 = 3,75 кДж/(кг К).
Задача 3.2
Кислород находится в объеме V1=1 м3 под давлением p1=0,2 МПа, масса кислорода m=2 кг. Кислород нагрели при постоянном давлении до объема V2=3 м3, а потом при постоянном объеме − до давления p2=0,5 МПа. Как изменилась внутренняя энергия кислорода ∆U, какая работа им была совершена А и какое количество теплоты Q было передано газу?
Решение
Подставим в формулу для изменения внутренней энергии выражение для удельной теплоемкости при постоянном объеме
∆U = c m∆T = |
i |
|
R |
m∆T , где |
∆T = T − T – разница температур конечного |
|
|
||||
V |
2 |
µ |
|
3 |
|
|
|
|
|||
и начального состояния. Для водорода i=5, так как газ двухатомный. Начальную и конечную температуру выразим из уравнения Менделеева -
Клапейрона pV = mµ RT , откуда
T = pV / (mR).
43

Работа газа при изобарном расширении равна A1 = m1 R∆T .
Работа газа при изохорном процессе равна нулю: A2 = 0. Суммарная работа газа в двух процессах равна A = A1 + A2 = A1 . Вычислим
T = |
2 105 |
1 32 10−3 |
= 385 К, и T = |
2 105 |
3 32 10−3 |
=1155 К. |
|
|
|
|
|||
1 |
2 8,31 |
2 |
2 8,31 |
|
||
|
|
|
||||
T = |
5 105 3 32 10−3 |
= 2887 К. A = |
8,31 2 (1155 − 385) |
= 0,4 МДж. |
||
2 8,31 |
32 10−3 |
|||||
3 |
|
1 |
|
|||
По первому началу термодинамики Q = ∆U + A. |
|
|||||
A = A = 0,4 МДж. ∆U = 5 |
8,31 2 (2887 − 385) = 3,24 МДж. |
|||||
|
1 |
2 |
32 10−3 |
|
||
Q = 3,24 + 0,4 = 3,64 МДж.
Задача 3.3
Показатель адиабаты идеального газа количеством 1 моль равен γ . Газ совершает процесс по закону p = АTα ,где А и α − постоянные величины. Найдите: а) работу, которую совершит газ, если его температура увеличивается на ∆T; б) молярную теплоемкость газа.
Решение
По условию p = АT α , тогда pT −α = А. Из уравнение состояния идеального газа получим T = pV / R , тогда
|
pV −α |
= A, или |
p1−αV −α = AR−α , |
p1−αV −α = AR−α , |
||||||||||||||||||||||
p |
|
|
|
|||||||||||||||||||||||
|
|
|||||||||||||||||||||||||
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
тогда pV −α /(α −1) = const . Показатель политропы равен n = |
α |
|
; |
|||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
α-1 |
|
||
а) при политропическом процессе для одного моля газа работа газа равна |
||||||||||||||||||||||||||
|
|
|
A = |
R∆T |
= |
|
R∆T |
|
|
= R∆T(1−α); |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
г |
|
|
1-n |
|
|
|
|
α |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
− |
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
α −1 |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
б) молярная теплоемкость может быть найдена по формуле |
||||||||||||||||||||||||||
|
|
|
R |
|
|
R |
R |
|
|
|
|
R |
|
|
R |
|
||||||||||
C = |
|
|
− |
|
= |
|
− |
|
|
|
|
|
= |
|
+ R(1−α). |
|||||||||||
γ −1 |
n −1 |
γ −1 |
|
α |
|
|
−1 |
γ −1 |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
α −1 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Задача 3.4
Найдите удельную теплоемкость при изохорном процессе для газовой смеси, которая состоит из 4 кг неона и 1 кг водорода.
44
Решение
Количество теплоты δQ, переданное смеси, равно
δ Q = cV mdT ,
где сV – удельная теплоемкость смеси при постоянном объеме.
Однако выражение для δQ можно записать и так:
δQ = δ Q1 + δQ2 = (cV1m1 + cV 2m2 )dT ,
где сV1, сV2, m1, m2 − удельные теплоемкости и массы газов смеси соответственно. Приравняем эти выражения и сократим на dT:
|
|
|
|
|
|
|
|
cV (m1 + m2 ) = cV 1m1 + cV 2m2 . |
|||||||||
Выразим сV: c |
= |
|
cV1m1 + cV 2m2 |
. |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
V |
|
|
|
m1 + m2 |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Запишем формулы для удельных теплоемкостей для неона и кислорода |
|||||||||||||||||
сV1, сV2:c |
= |
i1R |
, c |
= |
i2R |
. |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|||||||||
V1 |
2µ |
V 2 |
2µ |
2 |
|
|
|
|
|
|
|
|
|
|
|||
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
С учетом этих выражений окончательно получаем |
|||||||||||||||||
|
|
|
|
|
|
|
|
cV = |
|
R |
|
i1m1 |
+ |
i2m2 |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
||||
|
|
|
|
|
|
|
|
2(m + m ) |
µ |
µ |
2 |
||||||
|
|
|
|
|
|
|
1 |
2 |
1 |
|
|
|
|||||
Для неона i1=3 − инертный одноатомный газ; для водорода i2=5 – двухатомный газ. Вычисляя, получим сV =2,58 103 Дж/кг К.
Задача 3.5
Определите степень диссоциации азота, если соотношение его теплоемкостей cp 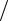 cV равно 1,47.Молярная масса атомарного азота µ1=14 кг/кмоль, мо-
cV равно 1,47.Молярная масса атомарного азота µ1=14 кг/кмоль, мо-
лярная масса молекулярного азота µ2=28 кг/кмоль.
Решение
Обозначим через α степень диссоциации. Диссоциированный азот – это одноатомный газ с тремя степенями свободы, i=3. Недиссоциированный азот (молекулярный азот) – это двухатомный газ с пятью степенями свободы, i=5. Для диссоциированного (одноатомного) азота:
c = |
i1R |
, c = |
(i1 + 2)R |
. |
|
2µ1 |
2µ1 |
||||
V |
p |
|
|||
|
|
|
Для недиссоциированного (молекулярного) азота:
c |
|
= |
i2R |
; c |
|
= |
(i2 + 2)R |
. |
||
|
|
|
||||||||
|
|
|
|
|
||||||
|
DV |
2µ |
2 |
|
Dp |
|
2µ |
2 |
|
|
|
|
|
|
|
|
|
|
|
||
Для смеси атомарного и молекулярного азота запишем (см. задачу 3.4):
cсм = |
cV m1 + cDV m2 |
= c |
m1 |
|
+ c |
|
|
m2 |
= c α + c |
|
(1−α ), |
|
m + m |
|
|
DV m + m |
|
||||||||
V |
V |
m + m |
V |
DV |
|
|||||||
|
1 |
2 |
|
1 |
2 |
|
1 |
2 |
|
|
|
|
|
|
|
|
|
45 |
|
|
|
|
|
|
|

где m1 и m2 – массы соответственно (атомарного) диссоциированного и (молекулярного) недиссоциированного азота.
Для вычисления удельной теплоемкости смеси при постоянном давлении применим тот же алгоритм и получим
cсмp = cpα − cDp (1 − α ).
Приняв отношение теплоемкостей γ = ссмp  сVсм , запишем и вычислим
сVсм , запишем и вычислим
α = 53γ−−γ7 =23 %.
Задача 3.6
Нагреем один килограмм кислорода разными способами: от 300 до 350 К: а) изобарически, б) изохорически, в) адиабатически. Докажите, что изменение внутренней энергии идеального газа не зависит от способа нагревания. Найдите изменение внутренней энергии кислорода в каждом случае.
Решение
а) при p=сonst, изобарическое нагревание:
Q = mµ Cp ∆T и A = p∆V = mµ R∆T .
Из первого начала термодинамики найдем
∆U = Q − A = mµ ∆T (Cp − R)= mµ CV ∆T ; б) при V=сonst, изохорическое нагревание:
Q = mµ CV ∆T , А=0. Получаем ∆U = Q = mµ CV ∆T ;
в) при адиабатическом нагревании, из первого начала термодинамики следует: ∆U = − А = mµ CV ∆T .
Отсюда следует, что при любом способе нагревания газа изменение внутренней энергии одно и то же:
∆U = mµ CV (Т2 − Т1 )=3,2 103 Дж.
Задача 3.7
Идеальный газ расширяется изобарно так, что его объем увеличивается в 2 раза. Количество вещества – 103 моль, начальная температура Т1=290 К. Потом газ изохорно охладили до первоначальной температуры. Найдите: а) изменение внутренней энергии газа; б) работу газа; в) количество теплоты, полученной газом.
46

Решение |
|
|
|
|
|
||
Построим графики перехода газа из одного состоя- |
p |
|
|
|
|||
|
|
Q12 |
|||||
ния в другое в |
рV координатах (рис. 3.4). Участок 1-2 – |
p1 |
1 |
|
2 |
||
|
|
|
|
||||
изобара, температура повышается, внутренняя энергия |
p2 |
|
|
3 Q23 |
|||
увеличивается. Газ, расширяется (V2>V1), совершает по- |
|
V1 |
V2 V |
||||
ложительную работу, на графике показана площадью за- |
|
||||||
|
|
|
|
||||
штрихованного прямоугольника V112V2. |
|
|
Рис. 3.4 |
||||
Прямая 2-3 – изохора. Давление уменьшается при |
|
|
|
|
|||
охлаждении газа от Т2 до Т3=Т1, внутренняя энергия уменьшается, работа не |
|||||||
совершается. |
|
|
|
|
|
|
|
Суммарное изменение внутренней энергии ∆U складывается из измене- |
|||||||
ния внутренней энергии на участке 1-2 и изменения внутренней энергии на уча- |
|||||||
стке 2-3. Так как начальная и конечная температуры совпадают, то ∆T=0: |
|||||||
|
|
|
∆U = ∆U1 + ∆U2 = 0 . |
|
|
|
|
Работа, совершаемая газом при переходе из состояния 1 в состояние 3 |
|||||||
равна работе газа на участке 1-2, так как на участке 2-3 работа равна нулю: |
|||||||
|
|
|
А13 = А12 = p1 (V2 −V1 ). |
|
|
|
|
С учетом уравнения состояния идеального газа и условия V2 |
= 2V1 |
получа- |
|||||
ем A |
= pV = m RT . |
|
|
|
|
||
13 |
1 1 |
|
1 |
|
|
|
|
Для киломоля газа m = 1, тогда A13 = RT1 = 2,4 106 Дж.
Количество теплоты при переходе из состояния 1 в состояние 3 равно сумме количеств теплоты Q12 и Q23. Q13=Q12+Q23.
По первому началу термодинамики:
Q12 = ∆U12 + A12 и Q23 = ∆U23 , (А13=0).
Учитывая, что ∆U12 = −∆U23 , получаем Q13 = A12 =2,4 106 Дж.
Задача 3.8
Воздух в объеме 10 л сжимается в двигателе дизеля в 12 раз адиабатически. Начальная температура 10 0С. Вычислите конечное давление, конечную температуру, работу при сжатии.
Решение
|
Атмосферный воздух состоит в большей степени из кислорода О2 и азота |
||||||
N2. |
Его |
можно |
считать |
двухатомным |
газом, |
для |
которого |
γ = С |
|
С = |
i + 2 |
=1,41. |
p |
|
|||
|
V |
i |
|
|
|
|
|
|
|
|
|
|
|
47 |

Конечное давление p2 найдем из уравнения адиабаты: p1V1γ = p2V2γ .
Выразим p2 = p1 (V1  V2 )γ и вычислим p2=32,5 105 Па. Запишем основное уравнение для двух состояний газа:
V2 )γ и вычислим p2=32,5 105 Па. Запишем основное уравнение для двух состояний газа:
p1V1 = m RT1 , p2V2 = m RT2 ,
подставим уравнение адиабаты, найдем конечную температуру: Т2 = Т1 (V1 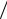 V2 )γ −1 =763 К.
V2 )γ −1 =763 К.
Работу адиабатического сжатия можно вычислить двумя способами. Из определения работы при адиабатическом сжатии
|
V2 |
V2 |
pVγ −1 |
pV |
1− (V1 V2 ) |
γ −1 |
. |
|
|||
|
A = ∫ pdV =∫ |
|
1 1 |
dV = |
1 1 |
|
|
|
|||
|
|
γ |
γ −1 |
|
|
||||||
|
V |
V |
|
V |
|
|
|
|
|||
|
1 |
1 |
|
|
|
|
|
|
|
|
|
Вычисляя, получаем А=−4,8 103 Дж. |
|
|
|
|
|
|
|||||
Или, |
используя |
первое |
начало |
термодинамики, |
запишем: |
||||||
dA = −dU = − m CV dT , получим A = − m CV (T2 − T1 ) = − m CVT1 (V1  V2 )γ −1 ,
V2 )γ −1 ,
где CV = 52 R , А=− 4,8 103 Дж.
Задачи для самостоятельного решения
3.1.Определить удельные теплоемкости cV и cр газообразной окиси углерода (СО). Молекулы считать жесткими. Ответ: cV=7,42 102 Дж/кг град; cр=1,04 103 Дж/кг град.
3.2.Чему равны удельные теплоемкости cV и cр некоторого двухатомного газа, если плотность этого газа при нормальных условиях равна ρ0=1,43 кг м-3 Ответ: cV=6,5 102 Дж/кг град, cр=9,1 102 Дж/кг град.
3.3.Определить удельные теплоемкости cV и cр для газа, состоящего по массе из 85 % О2 и 15 % озона (О3). Молекулы О2 и О3 считать жесткими.
Ответ: cV=6,3 102 Дж/кг град, cр=8,8 102 Дж/кг град.
3.4. Смесь газов состоит из 8 г гелия и 16 г кислорода. Определить отношение ср  сV для данной смеси. Ответ: γ=1,59.
сV для данной смеси. Ответ: γ=1,59.
48
3.5.Часть молекул кислорода (25 %) диссоциировано на атомы. Опреде-
лить удельные теплоемкости cV и cр такого газа. Ответ: cр=1,05 кДж/кг К, cV=67 кДж/кг К.
3.6.Определить отношение γ=ср  сV для смеси 3 молей аргона и 5 молей кислорода. Ответ: γ=1,46.
сV для смеси 3 молей аргона и 5 молей кислорода. Ответ: γ=1,46.
3.7.Определить молярную массу M двухатомного газа и его удельные теплоемкости, если известно, что разность (сp-cv) удельных теплоемкостей этого
газа равна 260 Дж/(кг К). Ответ: сp=909 Дж/(кг К), cv=649 Дж/(кг К), M=32 г/моль.
3.8.Определить показатель адиабаты γ идеального газа, который при температуре Т=350 К и давлении p=0,4 МПа занимает объем V=300 л и имеет теплоемкость СV =857 Дж/К. Ответ: 1,4.
3.9.В сосуде вместимостью V=6 л находится при нормальных условиях
двухатомный газ. Определить теплоемкость СV этого газа при постоянном объеме. Ответ: 5,5 Дж/К.
3. 10. Определить молярные теплоемкости газа, если удельные теплоемкости cV=10,4 кДж/(кг·К) cp=14,6 кДж/(кг·К). Ответ: Сp=29,2 Дж/(моль К), Сv=20,8 Дж/(моль кг).
3.11.Вычислить удельные теплоемкости газа, зная, что его молярная масса M=4 10-3 кг/моль и отношение теплоемкостей. Ответ: Сp/CV=1,67.
3.12.Трехатомный газ под давлением p=240 кПа и температуре t=20 0C
занимает объем V=10 л. Определить теплоемкость Сp этого газа при постоянном давлении. Ответ: 32,8 Дж/К.
3.13.Одноатомный газ при нормальных условиях занимает объем V=5 л.
Вычислить теплоемкость СV этого газа при постоянном объеме. Ответ: 2,75 Дж/К.
3.14.При изотермическом расширении азота при температуре T=280 К объем его увеличился в два раза. Определить: 1) совершенную при расширении газа работу А; 2) изменение внутренней энергии∆U; 3) количество теплоты Q, полученное газом. Масса азота m=0,2 кг. Ответ: Q=A=11,5 кДж, ∆U=0.
3.15.При адиабатном сжатии давление воздуха было увеличено от
p1=50 кПа до р2=0,5 МПа. Затем при неизменном объеме температура воздуха была понижена до первоначальной. Определить давление р3 газа в конце процесса. Ответ: 0,26 МПа.
3.16.Кислород массой m=200 г занимает объем V1=100 л и находится под давлением р1=200 кПа. При нагревании газ расширился при постоянном давле-
нии до объема V2=300 л, а затем его давление возросло до р3=500 кПа при неизменном объеме. Найти изменение внутренней энергии ∆U газа, совершенную
49
газом работу А и теплоту Q, переданную газу. Ответ: A=40 кДж, ∆U=325 кДж, Q=365 кДж.
3.17.Во сколько раз увеличится объем водорода, содержащий количество вещества ν=0,4 моль при изотермическом расширении, если при этом газ полу-
чит количество теплоты Q=800 Дж? Температура водорода Т=300 К. Ответ: е0,8=2,2.
3.18.Какая работа совершается при изотермическом расширении водорода массой m=5 г, взятого при температуре T=290 К, если объем газа увеличился
втри раза? Ответ: 6,62 кДж.
Контрольные вопросы
1.Каков физический смысл первого начала термодинамики? Сформулируйте первое начало термодинамики.
2.Можно ли осуществить процесс, при котором тепло, взятое от нагревателя, полностью преобразуется в работу?
3.Что такое внутренняя энергия идеального газа? В результаате чего может изменяться внутренняя энергия системы?
4.Как определяется работа в термодинамике?
5.Что называется количеством теплоты?
6.Какая из величин А, Q, U является функцией состояния термодинамической системы и почему?
7.Запишите первое начало термодинамики для всех известных изопроцессов идеального газа.
8.Что такое теплоемкость тела?
9.Какая из теплоемкостей – СV или Ср – больше и почему?
10.Приведите уравнение Майера. В чем физический смысл универсальной газовой постоянной?
11.Каковы теплоемкости одноатомных и многоатомных газов?
12.Что характеризует коэффициент Пуассона?
13.Что такое степень свободы частицы?
14.Почему колебательная степень свободы частицы имеет вдвое большую энергию, чем поступательная и вращательная?
15.Сформулируйте закон Больцмана о равномерном распределении энергии по степеням свободы молекул?
16.Какой процесс является адиабатическим или адиабатным?
17.Как можно осущеставить процесс, близкий к адиабатному?
18.Почему на графике адиабата круче изотермы?
19.Изменится ли температура газа при адиабатическом сжатии?
20.Дайте определение политропическому процессу.
50
