
Методическое пособие 325
.pdf5.4. Порядок выполнения работы
5.4.1.Кратко описать физико-химические свойства каждого компонента реакции. Указать температуру фазовых переходов в исследуемом интервале температур.
5.4.2.Используя справочные данные термодинамических величин, рассчитать температурную зависимость стандартно-
го изменения энергии Гиббса r GT0 и константы равновесия K p0 реакции в заданном интервале температур с шагом 100 К.
5.4.3. Построить графики зависимостей lg K p0 f (1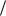 T ) и
T ) и
r GT0 f (T ) .
4.На основании полученных результатов сделать выво-
ды о направлении реакции и влиянии температуры на выход продукта, выбрать оптимальные условия проведения реакции.
5. Определить степень завершенности реакции в состоянии равновесия.
5.5. Методика расчета константы равновесия с помощью стандартных термодинамических величин
5.5.1. Условия химического равновесия и направления химической реакции
Энергия Гиббса G определяется соотношением
G H TS , |
(5.1) |
где H и S – соответственно энтальпия и энтропия системы; Т – температура.
При любом процессе, протекающем самопроизвольно при постоянных давлении и температуре, энергия Гиббса уменьшается, следовательно, условием протекания химической реакции является неравенство
r GP,T 0 , |
(5.2) |
39
условием химического равновесия: |
|
r GP,T 0 . |
(5.3) |
Отсюда следует, что не может самопроизвольно протекать химическая реакция, для которой r GP,T 0 .
Другой важнейшей величиной в определении химического равновесия является константа равновесия, выражающая связь между концентрацией или парциальным давлением компонентов реакции в условиях равновесия – закон действующих масс.
Для реакции
aA bB cC dD |
(5.4) |
константа равновесия через парциальные давления Кр или концентрацию Кс компонентов соответственно выражается
|
|
|
Pc Pd |
|
|
|
C c C d |
|
||||
K |
|
C |
D |
; |
K |
|
C |
D |
. |
(5.5) |
||
p |
|
|
c |
|
|
|||||||
|
|
Pa Pb |
|
|
C a C b |
|
||||||
|
|
|
|
|
|
|
||||||
|
|
|
A |
B |
|
|
|
A |
B |
|
||
Константа равновесия обратимой реакции для данного состава реакционной смеси позволяет определить, в каком направлении и до какого предела протекает реакция в условиях, отличных от равновесия, с использованием уравнения изотермы
|
|
PC |
|
PD |
|
|
|
r GT |
|
c |
|
d |
|
||
RT ln |
P |
a P b |
ln K p . |
(5.6) |
|||
|
|
|
|
||||
|
|
A |
|
B |
|
|
|
При рассмотрении равновесий имеет значение особый случай, когда исходные вещества реагируют в своих стандартных условиях при парциальных давлениях, равных атмо-
40
сферному, т.е. |
|
|
|
|
1 атм. Из уравнения (5.6) |
|||
РА |
РВ |
РC |
РD |
|||||
следует, что при этом |
|
|
|
|
|
|
||
|
|
|
G0 |
RT ln K |
p |
. |
(5.7) |
|
|
|
|
|
|
|
|
|
|
Величина G0 называется стандартным или нормальным изменением энергии Гиббса. Из уравнения (5.7) следует, что условия равновесия и протекания реакции в прямом и обратном направлениях – Кр = 1, Кр 1 и Кр 1 соответственно.
Следует отметить, что положительная величина G0 (или Кр 1) означает полную невозможность протекания данной реакции в прямом направлении лишь в случае, когда все участники реакции имеют одинаковые парциальные давления, равные атмосферному. Если изменить эти давления, то, согласно уравнению (5.6), можно изменить направление реакции. Кроме того, Кр зависит от температуры, что тоже надо использовать при выборе оптимальных условий реакции.
5.5.2. Расчет стандартного изменения энергии Гиббса r GT0 и константы равновесия K p0 с помощью
стандартных термодинамических величин
Исходными данными для расчета являются температурные зависимости теплоемкостей компонентов С р0 , стандарт-
ная теплота образования |
|
f |
H 0 |
, |
энтропия S 0 |
или стандарт- |
|||||
|
|
|
|
298 |
|
|
|
|
298 |
|
|
ное изменение энергии Гиббса |
f |
G0 . |
|
|
|||||||
|
|
|
|
|
|
298 |
|
|
|
||
В этом методе расчета используются два исходных |
|||||||||||
уравнения: |
|
|
|
|
|
|
|
|
|
|
|
G0 |
|
r |
H 0 |
T |
r |
S 0 |
; |
(5.8) |
|||
r T |
|
|
|
T |
|
|
T |
|
|
||
41
ln K 0 |
G 0 |
(5.9) |
r T . |
||
p |
RT |
|
|
|
|
Тепловой эффект химической реакции r HT |
(см. лабо- |
|
раторную работу № 4) определяется уравнением |
|
|
|
T2 |
|
r HT r HT1 |
C p dT , |
(5.10) |
|
T1 |
|
где Ср – изменение теплоемкости системы, обусловленное протеканием данной реакции.
Для реакции (5.4), если
|
|
0 |
|
|
2 |
; |
|
|
|
(5.11) |
|
|
C p a bT |
c T |
|
|
|
|
|||
C 0 |
cC 0 |
dC 0 |
aC |
0 |
|
bC 0 |
; |
(5.12) |
||
p |
|
p,C |
p,D |
|
p, A |
|
p,B |
|
|
|
|
C p |
|
|
|
2 |
, |
|
(5.13) |
||
|
a bT c T |
|
|
|
||||||
где а, b, с – алгебраические суммы коэффициентов при одинаковой температуре в выражении (5.12), например,
|
|
|
a |
ni ai |
|
|
i |
прод |
|
|
|
|
|
|
ni ai |
, |
(5.14) |
|
|
i |
|
исх |
|
где ni – стехиометрические коэффициенты в уравнении реакции.
Аналогично определяются b, с .
После интегрирования уравнения (5.10) получаем
|
H 0 |
H |
|
aT |
1 |
bT 2 |
c , |
(5.15) |
0 |
|
|||||||
r |
T |
|
2 |
|
T |
|
||
|
|
|
|
|
|
|||
где Н0 – константа интегрирования.
42
Для определения Н0 вычисляем при Т = 298 С тепловой эффект реакции rH298, используя табличные значения величин стандартных теплот образования компонентов реакции
f H 2980 :
|
r |
H |
0 |
|
|
n |
f |
H |
0 |
|
|
|
|
|
n |
f |
H 0 |
. |
(5.16) |
|||||||||
|
|
298 |
|
|
i |
|
|
|
298 |
|
прод |
|
i |
298 |
|
исх |
|
|||||||||||
Подставив значения |
r |
H 0 |
|
из уравнения (5.16) в урав- |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
298 |
|
|
|
|
|
|
|
|
|
|
|
|||
нение (5.15), определяем Н0: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
H |
|
|
|
H 0 |
a 298 |
1 |
b 2982 |
c |
. |
(5.17) |
||||||||||||||||||
0 |
r |
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
298 |
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
298 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Далее рассчитаем |
r |
S |
0 : |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C 0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
r ST0 |
|
|
|
|
p |
|
dT const . |
|
|
|
|
|
(5.18) |
||||||||||
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Подставив Ср из выражения (5.11) в уравнение (5.18) и |
||||||||||||||||||||||||||||
проинтегрировав, получаем |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
2 |
|
|
|
|
|
|
|
|
|
r ST |
a ln T |
|
bT |
|
c T |
|
const . |
(5.19) |
||||||||||||||||||
|
|
|
2 |
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Подставив |
r |
Н 0 и |
|
r |
S |
0 |
в уравнение (5.8), получим |
|||||||||||||||||||||
|
|
|
|
|
|
|
T |
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
G0 |
H |
0 |
T a ln T b T 2 |
c T 1 IT , |
(5.20) |
|||||||||||||||||||||||
r T |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
2 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
где I – константа интегрирования.
Из уравнений (5.16) – (5.18) очевидно, что I = а – const. Константу интегрирования I находим по известному
значению r G2980 :
43
r G2980 r H2980 T r S2980 ,
тогда
IT r G2980 H0 a298 ln 298
|
b 298 2 |
|
c 298 1 . |
(5.21) |
|
2 |
|
2 |
|
Температурную зависимость константы равновесия химической реакции определяем по уравнению (5.9).
5.5.3. Пример расчета
Рассчитать температурную зависимость r GT0 и K p0 для
химической реакции 2СО + О2 = 2СО2.
Термодинамические характеристики компонентов реакции приведены в таблице.
Стандартные термодинамические величины веществ
|
|
|
H 0 |
|
S 0 , |
|
|
|
|
2 |
|
|
f |
, |
C p a bT c T |
|
, |
||||||
Вещество |
|
298 |
|
298 |
|
Дж/моль К |
|
|
|
||
кДж/моль |
Дж/моль К |
|
|
|
|
||||||
|
а |
b 103 |
|
c 10-5 |
|||||||
|
|
|
|
|
|
|
|||||
СО2 |
–393,51 |
|
213,6 |
44,14 |
9,04 |
|
–8,53 |
||||
О2 |
|
|
0 |
|
205,03 |
31,46 |
3,39 |
|
–3,77 |
||
СО |
–110,50 |
|
197,40 |
28,41 |
4,10 |
|
–0,46 |
||||
Вычислим а, b, с реакции:
a 2aCO2 2aCO cO2 2 44,14 2 28,41 31,46 0 .
Аналогично:
44
b (2 9,04 2 4,1 3,39) 10 3 6,49 10 3 ;
c [2( 8,53) 2 0,46 3,77] 105 12,37 105 .
Следовательно для реакции 2СО + О2 = 2СО2
|
|
С 0 |
6,49 103 |
T 12,37 105 |
T 1 [Дж/моль К]. |
|
||||||||||||||
|
|
|
|
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Согласно уравнению (5.15), для данной реакции |
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
r |
H 0 H |
0 |
b T 2 c , |
(5.22) |
|||||||
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
2 |
T |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
так как а = 0. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Для определения Н0 |
вычислим r H 2980 , используя зна- |
|||||||||||||||||||
чения |
|
f |
H |
|
0 |
по уравнению (5.16): |
|
|
|
|||||||||||
|
|
|
|
298 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
r H2980 |
2 f H 2980 ,CO 2 f H2980 ,CO f H 2980 ,O ; |
(2.23) |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
2 |
|
|
|
r |
H |
0 |
|
2( 393,51) 2( 110,5) 566,02 [кДж/моль], |
|||||||||||||||
|
|
|
298 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
затем из уравнения (5.22) находим Н0: |
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
6,49 10 |
3 |
|
|
12,37 105 |
|
||||||
H |
0 |
556020 |
|
|
|
|
|
|
2982 |
|
570459,2. |
|||||||||
|
|
|
2 |
|
|
298 |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Для данной реакции, согласно уравнению (5.20), опреде- |
||||||||||||||||||||
лим G |
0 : |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
r T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
G0 |
H |
0 |
b T 2 c T 1 IT ; |
(5.24) |
||||||||
|
|
|
|
|
|
|
|
r T |
|
|
|
|
2 |
|
2 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
и вычислим r G2980 , чтобы найти константу интегрирования I.
45
|
|
|
G0 |
|
|
f |
H 0 |
|
TS |
0 . |
|
(5.25) |
|
|
|
r 298 |
|
298 |
|
298 |
|
|
|||
|
r |
H 0 |
= -566,02 кДж/моль, согласно уравнению (5.25). |
|
||||||||
|
298 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
r S2980 |
2S2980 ,CO |
2S2980 ,CO |
S2980 ,O ; |
(5.26) |
|||||
|
|
|
|
|
|
|
2 |
|
|
|
2 |
|
r S2980 2 213,6 2 197,4 205,03 172,63 [Дж/К].
Следовательно,
r G2980 566020 298 172,63 514576,3 [Дж].
Затем по уравнению (5.21) находим I:
I 298 514576,3 570459,2 |
6,49 10 3 |
|
||||||||||
|
|
|
(298)2 |
|||||||||
|
2 |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12,49 105 |
|
|
|
|
|
|
|||
|
|
|
|
|
(298) 1 54067,1; |
|
||||||
|
|
2 |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I = 181,43. |
|
|
|
|
|
|||
Таким образом, для заданной реакции |
|
|||||||||||
|
|
|
|
|
|
|
6,49 10 |
3 |
|
|||
G0 |
570452,2 |
|
|
|
T 2 |
|
||||||
|
|
|
|
|||||||||
r T |
|
|
|
|
2 |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12,37 105 |
|
|
|
|
|
|
|||||
|
|
|
|
|
181,43 T [Дж/моль]. |
(5.27) |
||||||
|
|
|
|
|||||||||
|
|
|
|
2T |
|
|
|
|
|
|
||
Подставив значения Т в уравнение (5.27), можно найтиr GT0 для любой температуры в заданном интервале температур. Нужно только помнить, что выражение r GT0 получено
46

при условии, что каждый компонент реакции не имеет фазового перехода в заданном интервале температур.
Вычислим, например, r G10000 :
|
|
G0 |
|
570452,2 |
6,49 10 3 |
10002 |
||||||
|
|
|
|
|
||||||||
|
|
r 1000 |
|
|
|
|
2 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||
|
12,37 105 |
|
181,43 1000 391648,7 [Дж/моль]. |
|||||||||
2 |
1000 |
|||||||||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
G0 |
391648,7 |
|
|
|||
|
ln K 0 |
|
|
r 1000 |
|
|
|
|
47,11. |
|||
|
|
|
|
|
|
|||||||
|
|
p,1000 |
|
RT |
8,314 1000 |
|||||||
|
|
|
|
|
|
|||||||
5.6. Определение степени завершенности реакции в состоянии равновесия
Степень завершенности реакции в состоянии равновесия можно характеризовать через долю прореагировавшего исходного вещества.
5.6.1. Первый пример расчета
Вычислим выход NO (х) при окислении азота при 4000 К
1/2 N2газ + 1/2 О2газ = NOгаз.
Исходное число молей N2 и О2 равно1/2. Для данной реакции
K 0 |
|
PNO |
|
|
. |
(5.28) |
||
|
|
|
|
|
||||
p |
|
P1 |
2 P1 |
2 |
|
|
||
|
|
|
|
|||||
|
|
N |
2 |
O |
|
|
|
|
|
|
|
|
2 |
|
|
||
При равновесии парциальное давление N2 и О2 составляет 1/2(1 – х) атм, парциальное давление NO - х атм. Тогда зна-
чение K p0 можно выразить через значение х:
47

K 0 |
|
|
|
|
x |
|
. |
(5.29) |
||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
||||
p |
|
|
1 |
|
1 2 |
1 |
1 2 |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
1 |
x |
|
|
1 x |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|||
|
|
2 |
|
|
2 |
|
|
|
||
Значение Кр можно рассчитать любым из приведенных выше способов.
Например, при Т = 4000 К Кр = 0,3, следовательно, из выражения
0,3 |
|
|
|
x |
|
||
|
|
|
|
|
|
|
|
|
1 |
|
1 2 |
1 |
1 2 |
||
|
|
||||||
|
|
|
1 |
x |
|
|
1 x |
|
|
|
|
||||
|
|
|
|
|
|||
|
2 |
|
|
2 |
|
||
получаем х = 0,13, т.е. выход NO при этой температуре составляет лишь 13 %.
Аналогично можно рассчитать выход в гетерогенных системах.
5.6.2. Второй пример расчета
Рассчитать выход реакции восстановления при Т = 873 К
FeOт + CO = Feт + CO2.
Любым из приведенных выше способов рассчитаем Кр. Например, при Т = 873 К Кр = 2,6.
Если исходное давление СО составляет единицу, то выход х можно найти из значения Кр:
|
|
|
PCO |
|
x |
|
|
|
K |
|
2 |
|
. |
(5.30) |
|||
p |
PCO |
1 x |
||||||
|
|
|
|
|
||||
|
|
|
|
|
|
Выход составляет 72 %.
48
