
Методическое пособие 325
.pdfгде m - вес вещества в граммах; М - молекулярная масса.
Задача 4. Определить, пойдет ли самопроизвольно процесс кристаллизации воды при Т = 263 К и давлении Р = 1 атм.
H 2O(ж, 263K) S ? H 2O(Тв, 273K) .
Процесс явно необратим, т.к. при 363 К вода и лед не находятся в равновесии, т. е. для расчета общей энтропииSсист необходимо заменить данный необратимый процесс
совокупностью обратимых стадий.
Решение. 1. Нагреем воду до Т = 273 К при P = const
H 2O(ж, 263K) S1 H 2O(ж, 273K) .
2. Заморозим воду при 273 К, при этом H2O(ж) и H2O(Тв) будут в равновесии
H 2O(ж, 273K) S2 H 2O(Тв, 273K) .
3. Охладим лед до Т = 263 К
H 2O(Тв, 273K) S3 H 2O(Тв, 263K) ;
или
H 2O(ж, 263K) S H 2O(Тв, 263K)
S1 |
|
|
S3 |
|
|
|
|
|
|
|
|
|
||
H |
|
S2 |
|
|
|
|
|
|
|
|
|
|
||
2O(ж, 273K) H 2O(Тв, |
273K) |
|
|
|
|
|
||||||||
|
273 C |
P |
(ж) |
|
H |
пл |
|
263 C |
P |
(тв) |
|
|||
S S1 S2 S3 |
|
|
dT |
|
|
|
|
|
dT . |
|||||
|
|
|
|
|
|
|
|
|
||||||
|
263 |
|
T |
|
Т пл |
273 |
|
|
T |
|
||||
29

Справочные данные: |
|
|
|
|
|||||
CP (ж) 75,312 |
Дж/(моль К) , |
|
|
|
|
||||
CP (тв) 37,656 |
Дж/(моль К) , |
|
|
||||||
H пл -6024,76 |
Дж/моль , |
|
|
|
|
||||
тогда |
|
|
|
|
|
|
|
||
S 75.312 ln |
273 |
|
6024,76 |
37,656 ln |
263 |
20,6 |
Дж/(моль К) |
||
|
|
|
|
||||||
263 |
|
273 |
|
273 |
|
|
|||
Чтобы установить направление процесса, используя энтропийный критерий самопроизвольности процесса, необходимо найти изменение энтропии системы, т.е. включить окружающую среду
S S Sср 20,6 Н крист , 263
Н крист (263К ) 5619,1 Дж /моль .
тогда
S 20,6 5619,1 0,81 Дж/(моль К) . 263
Т. о. Sсист 0,81 Дж/(моль К) 0 .
Следовательно, данный процесс является самопроизвольным.
30
ЛАБОРАТОРНАЯ РАБОТА № 4 Определение зависимости теплового эффекта химической реакции от температуры
4.1. Цель работы
4.1.1.Изучить основные законы термохимии: закон Гесса, следствия закона Гесса, закон Кирхгофа.
4.1.2.Изучить основные методы определения теплового эффекта химической реакции.
4.1.3.Определить температурную зависимость теплового эффекта заданной химической реакции в заданном интервале температур.
4.2. Подготовка к лабораторной работе
Подготовка к лабораторной работе включает:
–изучение основных теоретических вопросов: закона Гесса, следствий закона Гесса, закона Кирхгофа;
–методики расчета теплового эффекта химической реакции в зависимости от температуры [1, C. 64 – 71, 72 – 81].
4.3. Порядок выполнения работы
4.3.1.Кратко описать физико-химические свойства каждого компонента реакции. Указать температуру фазовых переходов.
4.3.2.Используя справочные данные термодинамических величин реагентов, рассчитать температурную зависимость теплового эффекта химической реакции в заданном интервале температур.
4.3.3.Построить график зависимости r HT f (T ) . На
основании полученных результатов сделать вывод.
4.3.4. Оформление отчета лабораторной работы должно соответствовать требованиям стандарта.
31

4.4. Теоретическая часть
Для реакции
aA bB cC dD |
(4.1) |
температурную зависимость теплового эффекта химической
реакции r HT
или
определяем по закону Кирхгофа
|
|
H |
T |
|
C |
|
|
r |
|
|
|
||
T |
|
P |
||||
|
|
P |
|
|||
|
|
|
||||
|
|
ΩМХ |
|
|
||
|
U |
CV , |
|
|||
|
T |
|
|
|||
|
V |
|
|
|
||
(4.2)
(4.3)
где СP , СV – изменения молярной теплоемкости в резуль-
тате протекания процесса при P = const или V = const. Для реакции (4.1)
СP |
cCP,C dCP,D aCP, A bCP,B |
(4.4) |
||||||||||||
или |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
С |
P |
|
n C |
P,i |
|
|
n C |
P,i |
, |
(4.5) |
||||
|
i |
|
прод |
i |
|
исх |
|
|||||||
где СP,C , СP,D , СP, A , |
СP,B |
|
– молярные теплоемкости реаген- |
|||||||||||
тов при P = const; |
n C |
P,i |
|
|
и |
n C |
P,i |
|
|
– суммы тепло- |
||||
|
i |
|
прод |
i |
|
исх |
|
|
||||||
емкостей соответственно продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов ni.
Из (4.1) следует, что при
32
С |
P |
0 |
H 0 , |
H 0 ; |
(4.6) |
|
|
T |
|
|
|
|
|
|
|
|
|
С |
P |
0 |
H 0 , |
H 0 ; |
(4.7) |
|
|
T |
|
|
|
|
|
|
|
|
|
С |
P |
0 |
H 0 , |
H const , |
(4.8) |
|
|
T |
|
|
|
|
|
|
|
|
т. е. тепловой эффект не зависит от температуры.
При интегрировании уравнения (4.2), если известен тепловой эффект при Т1, получим
|
T2 |
|
|
r HT |
r H1 |
CP dT , |
(4.9) |
|
T1 |
|
|
где r H1 – тепловой эффект данной химической реакции при
Т = Т1 (обычно 298 К) при условии, что в заданном интервале температур нет фазовых переходов веществ, участвующих в реакции.
Если для реагентов |
|
|
|
|
||
С |
|
a bT |
c |
, |
(4.10) |
|
P |
|
|||||
|
|
|
T 2 |
|
||
|
|
|
|
|
||
то |
|
|
|
|
|
|
C |
P |
a bT c , |
(4.11) |
|||
|
|
|
T 2 |
|
||
|
|
|
|
|
||
где |
|
|
|
|
|
|
a ni ai прод ni ai исх . |
(4.12) |
|||||
Например, для реакции (4.1)
33
a cC 0 |
dC 0 |
aC 0 |
bC 0 |
. |
(4.13) |
P,C |
P,D |
P, A |
P,B |
|
|
Аналогичным образом определяются b, c, c , d. Подставив СР из (4.11) в (4.9), после интегрирования
получим
|
|
|
|
|
|
T2 |
|
|
|
|
|
|
|
|
r HT0 r H10 |
CP dT |
|
|
|
|
|
||||||
|
|
|
|
|
|
T1 |
|
|
|
|
|
|
|
0 |
|
|
|
1 |
2 |
|
2 |
|
1 |
|
1 |
|
|
r H1 |
a T1 |
T2 |
|
|
b T2 |
T1 |
|
|
|
|
|
. (4.14) |
|
|
|
|
|||||||||||
|
c |
|
T1 |
|
|||||||||
|
|
|
|
2 |
|
|
|
T2 |
|
|
|
||
Если вычислить r HT0 через неопределенный интеграл, получим
|
H 0 |
H |
0 |
aT b T 2 |
c , |
(4.15) |
r |
T |
|
2 |
T |
|
|
|
|
|
|
|
где Н0 – постоянная интегрирования, которая определяется обычно из значения теплового эффекта при стандартных условиях.
4.5. Пример расчета
Найти температурную зависимость теплового эффекта реакции
СаСО3 = СаО + СО2,
если известно, что при Т = 1173 К тепловой эффект данной реакции r H11730 = 178,074 кДж/моль. Термодинамические характеристики веществ приведены в таблице.
34
Термодинамические характеристики веществ
|
|
|
2 |
, Дж/моль К |
0 |
|
|
Вещество |
C p a bT c T |
|
f H 298 |
, |
|||
|
а |
b 103 |
|
c 10-5 |
кДж/моль |
||
СаСО3 |
104,52 |
21,92 |
|
–25,04 |
–1206,88 |
||
СаО |
49,63 |
4,52 |
|
|
–6,95 |
–635,55 |
|
СО2 |
44,14 |
9,04 |
|
|
–8,53 |
–393,51 |
|
Так как C p a bT c T 2 , то
C p aТ bT 2 c T 2 .
Согласно уравнению Кирхгофа (4.15), определяем а, b
и c .
а aCaO аСО2 аСаСО2
49,64 44,14 104,5 10,73 ,
|
|
|
b bСО |
bСаО |
bСаСО |
|
|||||||
|
|
|
|
|
|
2 |
|
|
|
2 |
|
|
|
4,52 10 3 |
9,04 10 3 21,92 10 3 |
8,36 10 3 , |
|||||||||||
|
|
|
c |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
cСО |
cСаО |
cСаСО |
|||||||
|
|
|
|
|
|
2 |
|
|
|
2 |
|
|
|
6,95 105 |
8,53 105 25,94 105 |
|
10,46 105 . |
||||||||||
Таким образом, для данной реакции |
|
|
|||||||||||
С |
|
10,73 |
8,36 |
10 |
3 Т 2 |
10,46 105 |
|||||||
Р |
|
|
|
|
|
. |
|||||||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
2 |
|
|
|
|
Т |
||
|
|
|
|
|
|
|
|
|
|
|
|||
Отсюда
35
|
|
|
|
|
|
8,36 10 3 |
|
10,46 105 |
|||||||
|
r |
H 0 |
H |
0 |
10,73T |
|
|
|
T 2 |
|
|
|
. |
|
|
|
|
|
|
|
|
||||||||||
|
T |
|
|
2 |
|
|
|
|
T |
||||||
|
|
|
|
|
|
|
|
|
|
||||||
На |
|
основании |
определенного |
теплового |
эффекта при |
||||||||||
Т = 1173 К |
находим Н0, подставив |
значения r H11730 и |
|||||||||||||
Т = 1173 в (1.15): |
|
|
|
|
|
|
|
|
|
|
|
|
|||
r H11730 |
H0 10,73 1173 |
8,36 10 3 |
1173 2 |
|
10,46 105 |
. |
|||||||||
|
|
||||||||||||||
|
|
|
|
|
|
2 |
|
|
|
|
1173 |
|
|||
Отсюда Н0 = 191141,4.
Тогда уравнение (4.15) для рассматриваемой реакции имеет вид:
|
|
H 0 |
191141,4 10,73T 4,18 10 3 T 2 |
10,46 105 |
|
r |
|
. |
|||
|
|||||
|
T |
|
T |
||
|
|
|
|
||
На основании этого уравнения можно рассчитать тепловой эффект реакции при любой температуре.
Для определения теплового эффекта, например, при 1300 К подставим значение температуры в полученное уравнение:
|
|
|
191141,4 10,73 1300 4,18 10 313002 |
10,46 105 |
|
|
r |
H 0 |
|
|
|
|
|||||
|
1300 |
|
1300 |
|
|
|
|
|
|
|
|
= 163869 [Дж/моль].
Для определения расхода теплоты, например, на разложение 1 кг СаСО3 при 1300 К нужно определить число молей п в 1 кг CaCO3, тогда
H 0 r H13000 n ,
36

H 0 163,869 1000100 1638 [кДж/кг].
Если значение теплового эффекта не задано в условии, то для определения Н0 нужно найти тепловой эффект реакции при Т = 298 К, используя справочные значения стандартных теплот образования компонентов реакции f H 2980 .
r H2980 f H2980 ,CaO f H2980 ,CO2 f H 2980 ,CfCO3
635,55 393,51 1206,88 77,82 [кДж/моль].
На основании определенного теплового эффекта r H 2980
находим Н0:
77820 H 0 10,73 298 4,18 10 3 2982 10,46 105 , 298
Н0 = 191149,4.
4.6. Отчет о работе
Отчет о работе должен содержать:
–краткое описание физико-химических свойств каждого компонента реакции с указанием фазовых переходов;
–термодинамические характеристики веществ;
–методику расчета теплового эффекта химической ре-
акции r HT ;
– результаты расчета температурной зависимости теплового эффекта r HT с шагом 100 К, представленные в виде
таблицы и графика;
– выводы.
Оформление отчета должно соответствовать требованиям стандарта предприятия СТП006.
37
ЛАБОРАТОРНАЯ РАБОТА № 5 Определение направления и степени завершенности
химической реакции в равновесных условиях
5.1. Цель работы
5.1.1.Определить направление и степень завершенности химической реакции в равновесных условиях.
5.1.2.Определить оптимальные условия реакции в заданном интервале температур.
5.1.3.Рассчитать температурную зависимость стандарт-
ного изменения энергии Гиббса r GT0 и константы равновесия химической реакции K p0 с помощью стандартных термодинамических величин.
5.2. Задание
5.2.1.Рассчитать температурную зависимость стандартного изменения энергии Гиббса и константы равновесия химической реакции в заданном интервале температур с помощью стандартных термодинамических величин.
5.2.2.Построить графики зависимостей lg K p0 f (1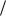 T ) и
T ) и
r GT0 f (T ) .
5.2.3.Определить направление и предел протекания хи-
мической реакции.
2.3. Подготовка к лабораторной работе
Подготовка к лабораторной работе включает:
–изучение основных теоретических вопросов – закона действующих масс, константы равновесия, уравнений изотер-
мы [1, С. 108 – 143; 2, С. 74 – 87, 3, С. 45 – 59];
–изучение методов расчета химических равновесий, приведенных в данных методических указаниях [1, С. 113 –
121].
38
