
- •Исследование фазовой структуры сплавов методические указания
- •Лабораторная работа 1 исследование фазовой структуры сплавов
- •1.Общие указания
- •2. Домашнее задание и методические указания по их выполнению
- •4.Лабораторные задания и методические
- •5.Контрольные вопросы по выполненной
- •Исследование фазовой структуры сплавов методические указания
- •394026 Воронеж, Московский просп.,14
ФГБОУ ВПО «Воронежский государственный технический университет»
Кафедра «радиоэлектронных устройств и систем»
Исследование фазовой структуры сплавов методические указания
к лабораторной работе № 1 по дисциплине «Материаловедение и технология конструкционных материалов» для студентов направления 200 100.62 «Приборостроение» (профиль «Приборостроение») очной и заочной форм обучения
Воронеж 2013Составитель канд. физ. - мат. наук А.В. Чернышов
УДК 621.396.66
Методические указания к лабораторной работе № 1 по дисциплине «Материаловедение и технология конструкционных материалов» для студентов направления 200 100.62 «Приборостроение» (профиль «Приборострение») очной и заочной форм обучения / ФГБОУ ВПО «Воронежский государственный технический университет»; сост. А.В. Чернышов. Воронеж, 2013. 39с.
В лабораторной работе рассматриваются вопросы исследования фазовой структуры различных типов сплавов. Тематика лабораторной работы соответствует рабочей программе дисциплины «Материаловедение и технология конструкционных материалов».
Методические указания подготовлены в электронном виде в текстовом редакторе Word for Windows и содержатся в файле TCERNYSHOV LAB1.rtf
Ил. 31. Библиогр.: 2 назв.
Рецензент канд. физ.-мат. наук, доц. В.С. Скоробогатов
Ответственный за выпуск зав. кафедрой д-р физ.-мат. наук, проф. Ю.С. Балашов
Издаётся по решению редакционно-издательского совета Воронежского государственного технического университета
-
© ФГБОУ ВПО «Воронежский государственный технический университет», 2013
Лабораторная работа 1 исследование фазовой структуры сплавов
1.Общие указания
1.1. Цель работы
Изучение фазовой структуры основных сплавов, применяемых в РЭС, оптическим методом с использованием металлографического микроскопа.
1.2. Содержания работы
Основным содержанием работы является ознакомление с работой на металлографическом микроскопе МИМ-8 при исследовании фазовой структуры сплавов и проведение экспериментальных наблюдений фазовой структуры конструкционных сплавов.
При выполнении работы студенты изучают строение сплавов и основные типы фазовых диаграмм.
2. Домашнее задание и методические указания по их выполнению
Задание № 1.
Ознакомиться и занести в отчет сведения о строении сплавов (механических смесей, твердых растворов и химических соединений) и их механических технологических свойствах.
Методические указания
Для выполнения задания необходимо изучить материал / 1, с.41- 47/.
При производстве различных деталей радиоэлектронных средств применяются различные сплавы - материалы, получаемые при сплавлении в жидком состоянии двух или более компонентов. В зависимости от состава и структуры бывают следующие типы сплавов: механические смеси, твердые растворы и химические соединения.
Механическая смесь образуется тогда, когда компоненты А и В не способны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соединения. Сплав будет состоять из отдельных зерен кристаллов компонентов А и В, отчетливо выявленных на микроструктуре (рис. 1). Механическая смесь представляет собой двухфазную систему. Фазой называют однородные гомогенные составные части системы, имеющие одинаковый состав, кристаллическое строение и свойства, одно и то же агрегатное и отделены друг от друга поверхностями раздела. При переходе через границы раздела химический состав или структура фаз изменяются скачками.
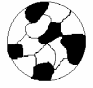
Рис.1. Микроструктура механической смеси (схема)
Механические свойства (прочность и твердость) сплава зависят от размеров и форм зерен, количественного соотношения компонентов и занимают промежуточное положение между соответствующими параметрами чистых компонентов. Сплавы хорошо обрабатываются резанием (на токарных и фрезерных станках), но из-за пониженной пластичности они не применяются для изготовления деталей холодной листовой штамповкой. К механическим смесям относятся сплавы Pb-Sn, Pb-Ag, Ni- Cr, Cu- Bi, Al-Si b др.
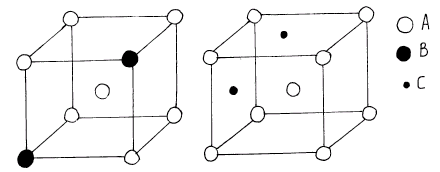
Твердые растворы – это сплавы, в которых один из компонентов (растворитель) сохраняет свою кристаллическую решетку, а атомы другого компонента (растворимого) располагаются в решетке первого, изменяя ее размеры (периоды). Таким образом, твердый раствор, состоящий из двух или более компонентов, имеет один тип кристаллической решетки и представляет собой одну фазу, то есть однофазную систему (рис. 2).
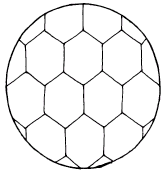
Рис.2. Микроструктура твердого раствора (схема)
Химический или спектральный анализ может показывать в твердом растворе наличие двух или более компонентов, тогда как по данным металлографического анализа такой сплав, как и чистый металл, имеет однородные зерна. Различают твердые растворы замещения и твердые растворы внедрения (рис. 2, а), б)). В твердых растворах замещения атомы растворенного компонента В частично замещают атомы в решетке основного элемента А (рис.3, а)).
а) б)
Рис.3. Схема твердого раствора замещения (а) и твердого раствора внедрения (б)
При образовании твердых растворов замещения (рис. 3, а) периоды решетки изменяются в зависимости от разности диаметров атомов растворителя А и растворенного элемента В. Если атом В больше атома А, то элементарная ячейка увеличивается, если меньше, то сокращается. Независимо от видов элементов, входящих в твердый раствор, изменение параметров решетки обусловливает изменение различных свойств сплавов, например, прочности; при этом уменьшение размера решетки приводит к большему упрочнению, чем при расширении. Твердые растворы замещения могут быть ограниченные и неограниченные. При ограниченной растворимости только до определенного количества атомы элемента В могут замещать атомы растворителя А в кристаллической решетке. Например, в сплаве Al-Cu может растворяться до 5,7 % Cu в алюминии, в сплаве Cu-Zn до 39 % Zn в меди без изменения их кристаллической решетки. При неограниченной растворимости любое количество атомов А может быть заменено атомами В, т.е. образуется непрерывный ряд твердых растворов. Неограниченные твердые растворы могут образоваться при соблюдении следующих условий:
*наличие в обоих компонентах одинаковых по типу (изоморфных) кристаллических решеток; небольшое различие в атомных размерах компонентов (DR не должна превышать 8-15 %);
*компоненты сплава должны близко располагаться в периодической таблице Д.И. Менделеева, т. е. близкими по строению валентной оболочке атомов, по физической природе.
Например, неограниченный ряд твердых растворов образуется в сплавах, компоненты которых имеют ГЦК-решетку: Au-Ag (DR = 0,2 %), Ni-Cu (DR = 2,7 %) и др.; в сплавах с ОЦК-решеткой: Мо-W (DR = 9,9%), V-Ti(DR = 2 %). Если элементы не отвечают перечисленным выше условиям, то они ограниченно растворяются друг в друге. Ограниченная растворимость почти всегда уменьшается с понижением температуры.
В твердых растворах внедрения атомы растворенного компонента С (рис. 3, б), располагаются в междоузлиях (пустотах) кристаллической решетки растворителя А. В данном случае размеры атомов компонентов, входящих в сплав могут и должны отличаться по величине, а кристаллическая решетка компонента растворителя должна давать возможность размещения дополнительных атомов. Твердые растворы этого типа возникают в тех случаях, когда диаметр атома растворенного элемента невелик, а внутри решетки растворителя А должно иметься достаточное количество пространства для атома С. Твердые растворы внедрения возникают при растворении в металлах (Fe, Cr, Mo) элементов с малым радиусом: углерода (атомный радиус 0,077 нм), азота (0,071 нм), водорода (0,046 нм), например, при образовании сталей.
Твердые растворы внедрения могут быть только ограниченной концентрации, так как число пор в решетке ограничено, а атомы основного компонента сохраняются в узлах решетки. Как указывалось выше, при образовании твердых растворов замещения период решетки может увеличиваться или уменьшатся в зависимости от соотношения размеров атомов растворителя или растворенного компонента, в случае твердых растворов внедрения период решетки растворителя всегда возрастает.
Однофазные твердые растворы имеют механические свойства (прочность, твердость) выше, чем свойства металлов, входящих в этот сплав и имеют высокую пластичность. Они хорошо обрабатываются давлением (холодной листовой штамповкой), но из–за высокой вязкости плохо обрабатываются резанием; имеют низкие литейные свойства. К неограниченным твердым раствора замещения относятся сплав, например, Cu- Ni, Cu-Ag, Ag-Au; к ограниченным твердым раствора замещения, например, Al-Cu, Cu- Zn, Cu-Sn. К твердым растворам внедрения сплавы, например, на основе Fe- C, Cr-C, Mo-C.
Химические соединения - структура сплава, образованная компонентами его, взаимодействующими между собой в соответствии со стехиометрическими законами. Химические соединения обладают рядом особенностей:
*образуется специфическая кристаллическая решетка с упорядоченным расположением атомов, отличная от решетки компонентов, входящих в химическое соединение;
*соотношение чисел атомов соответствует кратному соотношению компонентов, входящих в химическое соединение, что может быть выражено простой формулой АnВm;
*определенная температура плавления (диссоциации) и скачкообразное изменение свойств при изменении состава (так называемой сингулярностью свойств).
Химические соединения обычно образуются из компонентов сплава, имеющих большое различие в размерах атомов, в электронном строении их и кристаллических решеток. Структура химических соединений зависит от следующих факторов: относительного размера атомов, их валентности и от положения в периодической системе элементов, что и определяет строение электронной оболочки.
Химические соединения могут быть образованы только металлическими элементами; в этом случае связь металлическая. Она не является жесткой и поэтому при определенных условиях количество элементов, входящих в соединение могут быть различными и отличаться от стехиометрического состава. Соединение одних металлов с другими носят общее название интерметаллидов или интерметаллических соединений.
При образовании химических соединений металла с неметаллом возникает ионная связь. В этом случае атом металла отдает валентные электроны и становится положительным ионом, а атом металлоида принимает электроны и становится отрицательным ионом. В соединениях такого типа связь жесткая, химический состав постоянный и соответствует стехиометрическому соотношению. Такие химические соединения подчиняются закону валентности. В настоящее время известно большое число различных химических соединений при образовании сплавов (электронные соединения, фазы Лавеса, γ-фазы, фазы внедрения), которые отличаются спецификой формирования структур и особыми свойствами. Рассмотрим химическое соединение – фазы внедрения, образующиеся в сплавах. Фазы внедрения образуют переходные металлы (Fe, Mn, Cr, Mo, V, Ti, W и др.) с металлоидами, имеющими малый радиус: Н (RH = 0,046 нм), N(RN = 0,071 нм), С (R = 0,077 нм). Кристаллическая структура фаз внедрения определяется соотношением атомных радиусов металлоида и металла Rx/Rм: если соотношение Rx/Rм < 0,53, то структура фаз внедрения простая (кубическая, объемно-центрированная, гранецентрированная, или гексагональная плотноупакованная), если это соотношение больше, то образуется структура с более сложной решеткой. Формулы многих фаз внедрения соответствуют соотношениям Ме4Х (Fe4N, Mn4N, Nb4N), Me2X (Fe2N, W2C, Мо2C, Co2N), MeX (WC, TaC, VC, TiC, VN и др.). Фазы внедрения (карбиды, нитриды) важны в техническом отношении, так как они обладают высокой твердостью, прочностью, и высокой температурой плавления, например, карбид вольфрама WC (Тпл=2867 оС, HV1730), карбид титана TiC (HV2850). Фазы внедрения (карбиды, нитриды) важны в техническом отношении, так как они обладают высокой твердостью, прочностью, и высокой температурой плавления, например, карбид вольфрама WC (Тпл=2867 оС, HV1730), карбид титана TiC (HV2850).
В общем случае химические соединения имеют очень высокую прочность и твердость, но они хрупки (обладают очень низкой пластичностью).
Задание № 2
Ознакомиться с основными типами фазовых диаграмм, в заготовку отчета внести четыре основных фазовых диаграмм с указанием фаз, микроструктуры и механических свойств сплавов, кристаллизующихся по этим диаграммам.
Методические указания
Для выполнения задания следует проработать материал /1, с. 48 - 64/. Прежде всего, необходимо хорошо разобраться в самом понятии «ФАЗА». Фаза – гомогенная часть гетерогенной системы, имеющая границы раздела. Например, если сплав состоит из кристаллов двух сортов, то говорят, что он двухфазный, т.к. каждый кристалл имеет границы раздела. Если сплав состоит из нескольких элементов, и все они вместе образуют одинаковые кристаллы (т.е. все элементы входят в состав любого кристалла сплава, и все кристаллы одинаковые), то это – однофазная система.
Металлы из-за различной природы составляющих их атомов при сплавлении могут образовывать разнообразные фазы, что отражают фазовые диаграммы сплавов. Среди множества их можно выделить пять основных типов. Рассмотрим диаграммы, наиболее часто встречающиеся при кристаллизации сплавов.
2.1. Диаграмма состояния сплавов из компонентов, образующих механическую смесь (І рода).
Общий вид диаграммы состояния изображен на рис. 4; кривая охлаждения при кристаллизации сплавов и схематическое изображение структур сплава при различном содержании компонентов А и В представлено на рис. 5.
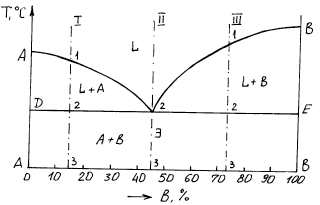
Рис. 4. Диаграмма состояния сплавов, образующих механическую смесь (схема)
Линия АСВ является началом кристаллизации (линия ликвидуса), линия ДСЕ - конец кристаллизации (линия солидуса).
Оба компонента в жидком состоянии неограниченно растворимы и образуют жидкую фазу. При охлаждении ниже линии АС из жидкости выпадают кристаллы А и смесь состоит из двух фаз L + А, ниже линии СВ из жидкости выпадают кристаллы В и сплав состоит из 2-х фаз (L + В).
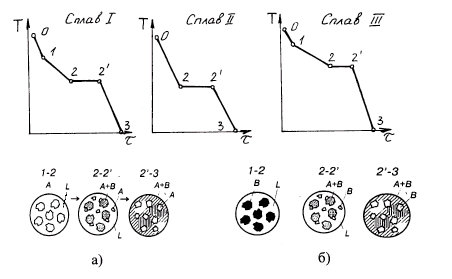
Рис. 5. Кривые охлаждения сплавов и структура сплавов: а) – доэвтектического; б) – заэвтектического
На рис. 4 приведены три линии I, II, III, изображающих сплавы с различным содержанием компонентов А и В. Кривые охлаждения для этих сплавов будут иметь вид, изображенный на рис. 5 (I, II, III) соответственно. На этом рисунке участки 0-1 соответствуют охлаждению жидкого расплава; участки 1-2 соответствуют началу кристаллизации, в результате которой из жидкости непрерывно выделяются отдельно кристаллы А и В (рис.5 а, в) и кристаллизация протекает при переменной температуре. При этом оставшаяся жидкая фаза обогащается компонентами В и А (ниже кривой АС компонентом В, а ниже кривой СВ компонентом А).
Участки 2-2 соответствуют совместному выделению кристаллов А и В и окончательному переходу сплава из жидкого в твердое состояние, а участки 2-3 - охлаждению твердого сплава. На участках 2-2 температура сплава остается постоянной до окончания процесса кристаллизации, что обусловлено значительным выделением тепла при переходе сплава из жидкого в твердое состояние.
При концентрации сплава, соответствующему линии II (рис.5, б) происходит совместное одновременное выделение кристаллов из жидкого расплава, представляющих из себя механическую смесь кристаллов (компонентов А и В).
Механическая смесь различных видов кристаллов (двух и более), кристаллизующихся одновременно из жидкого расплава называется эвтектикой (т.е. легко плавящейся). Структура эвтектики зависит от вида компонентов, входящих в сплав и кристаллизация ее происходит при строго определенной концентрации компонентов и температуре. На рис. 4 температура сплава, соответствующая линии ДЕ носит название температуры эвтектики.
Схематически структура сплавов доэвтектического, эвтектического и заэвтектического изображена на рис. 5. Согласно правилу фаз, в двухкомпонентном сплаве может существовать три фазы (f = 3) в области, где наблюдается температурная остановка (температура эвтектики): жидкая фаза L, кристаллы А и кристаллы В. Структура доэвтектического сплава при температуре ниже линии ДЕ состоит из кристаллов А и эвтектики (А+ В), заэвтектического - из кристаллов компонента В и эвтектики (А + В). Но необходимо отметить, что в твердом состоянии в сплаве существуют только две фазы - это кристаллы компонентов А и В.
По рассмотренной диаграмме состояния кристаллизуются сплавы Pb-Sb, Pb-Ag, Ni-Cr, Cu-Bi, Al-Si и др.
2.2. Диаграмма состояния сплавов , образующих неограниченные твердые растворы (ІІ рода).
По этой диаграмме состояния кристаллизуются сплавы из компонентов А и В, обладающих полной взаимной растворимостью в жидком и твердом состоянии и не образующих химических соединений. На рис. 6 представлена диаграмма, кривые охлаждения и схематическое изображение структуры сплава в различном температурном интервале.
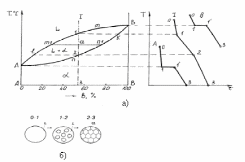
Рис. 6. Диаграмма состояния, кривые охлаждения (а) и строение сплава при неограниченной растворимости компонентов А и В (б)
Полная взаимная растворимость в твердом состоянии возможна в том случае, когда компоненты А и В имеют одинаковые кристаллические решетки и атомные диаметры мало отличаются друг от друга.
Диаграмма состояния состоит из трех областей: жидкости L, жидкости и твердого раствора L+б и твердого раствора б. Линия A m B является началом кристаллизации (линией ликвидуса), Линия А n В является окончанием кристаллизации (линией солидуса).
При кристаллизации чистых компонентов А и В температура охлаждения компонентов равномерно понижается до точек 1 (линии А и В на рис. 6, б), при этих температурах наблюдается остановка температуры (1-1`), так как согласно правилу фаз только при постоянной температуре могут существовать две фазы - жидкая и твердая (с = k + f + 1 = 1 - 2 + 1 = 0). После полной кристаллизации чистых компонентов А и В, тогда f = 1, температура будет равномерно понижаться (линия 1-3).
Рассмотрим процесс кристаллизации сплава, соответствующего составу I. При охлаждении сплава температура будет равномерно понижаться до точки 1, что соответствует линии 0-1 на кривой охлаждения сплава I. При температуре, соответствующей т. 1 начинается процесс кристаллизации и на кривой охлаждения отмечается перегиб (линия 1-2), что связано с уменьшением скорости охлаждения сплава, обусловленного выделением скрытой теплоты кристаллизации. Между точками 1 и 2 сплав находится в двухфазном состоянии (L+a).
Этот процесс протекает при понижающейся температуре, так как при двух компонентах и двух фазах система моновариантна (с = k - f + 1 = 2 - 2 + 1). При температуре, соответствующей т. 2 заканчивается процесс кристаллизации и при более низких температурах существует только одна фаза - a твердый раствор; охлаждение сплава происходит по линии 2-3. На рис. 6, б) представлено схематическое изображение структуры сплава, соответствующее различным температурным интервалам кристаллизации.
В процессе кристаллизации сплава при определенной концентрации компонентов А и В изменяется не только состав фаз, но и количественное соотношение жидкой и твердой фаз при любой температуре, лежащей между линиями ликвидуса и солидуса. Выделяющиеся кристаллы твердого раствора имеют переменный состав, зависящий от температуры. Однако при медленном охлаждении процессы диффузии в жидкой и твердых фазах, а также процессы взаимной диффузии между ними (межфазная диффузия ) успевают за процессом кристаллизации, поэтому состав кристаллов выравнивается. В этих условиях сплав после окончания процесса кристаллизации будет состоять из однородных кристаллов твердого раствора состава, соответствующему исходному составу сплава.
По рассмотренной фазовой диаграмме состояния кристаллизуются сплавы систем Cu-Ni, Cu-Ag, Ag-Au, Ni-Au, Fe-V и др.
3. Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии (ІІІ рода).
В сплавах, образующих ограниченные твердые растворы, существуют 3 фазы: жидкая фаза L, твердая фаза a и твердая фаза b. Твердая фаза a представляет собой твердый раствор компонента В в А (a-раствор), твердая фаза b - твердый раствор компонента А в В (b-раствор).
В зависимости от того, какая реакция протекает при одновременном существовании 3-х фаз, различают два типа диаграмм состояния: диаграмма с эвтектическим превращением и диаграмма с перитектическим превращением.
2.3.1. Диаграмма состояния с эвтектикой
Д
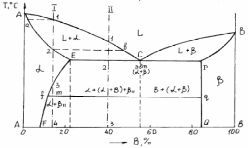
Рис. 7. Диаграмма состояния с эвтектикой
На диаграмме линия АСВ является линией ликвидус, АЕРВ - линия солидус. При температурах ниже линии AЕPB сплавы находятся в твердом состоянии. Сплавы, составы которых расположены в областях a и b, кристаллизуются так же, как и сплавы с диаграммой состояния, образующих неограниченные растворы (рис. 6). Предельная растворимость компонента В в А определяется линией EF, а предельная растворимость компонента А в В определяется линией PQ. Так как линия PQ на диаграмме изображена вертикальной, в отличии от линии EF, то растворимость компонента А в В не изменяется при охлаждении сплава. Раствор компонента В в А является твердым раствором не только ограниченной, но и переменной растворимости. Максимальное содержание компонента В в a-растворе определяется точкой Е, а минимальное - точкой F. Сплавы, находящиеся между линиями EF и PQ являются двухфазными, состоящими из a+b.
Рассмотрим процесс кристаллизации сплава для двух характерных концентраций компонентов А и В, соответствующих прямым I и II. Кривые охлаждения и схемы структур при разных температурах и концентрациях изображены на рис. 8. При температуре, соответствующей точке 1 (концентрация сплава I), начинается процесс кристаллизации и из жидкости L выделяются кристаллы a, концентрация которых изменятся по кривой a-2, находящейся на линии солидус АE, а состав жидкой фазы по кривой 1-b, находящейся на линии ликвидус АС. В точке 2 процесс кристаллизации заканчивается, при этом концентрация a-раствора соответствует концентрации жидкой фазы L, находящейся выше точки 1. На кривой охлаждения в т. 1 и 2 наблюдаются перегибы (рис. 8, а)), идентичные перегибам при кристаллизации сплавов с неограниченной растворимостью (рис. 6, б)). Кристаллы a-раствора не изменяют своего состава до температуры, соответствующей точке 3, лежащей на линии предельной растворимости EF. Ниже точки 3 a-твердый раствор является перенасыщенным, поэтому из него выпадают кристаллы b, выделяющиеся из твердого раствора. Кристаллы b, выделяющиеся из твердого раствора, называют вторичными кристаллами и обозначают bII, в отличии от кристаллов b, выделяющихся из жидкости ниже линии СВ, которые называют первичными b-кристаллами (bI).
Кривые охлаждения сплава концентрации I и структура сплава, соответствующая различным температурам кристаллизации изображена на рис. 8, а). При кристаллизации сплава концентрации II ниже точки 1 процесс образования твердой фазы a происходит в интервале температур, как и в предыдущем случае, так как система моновариантна (с = 2-2+1 = 1).
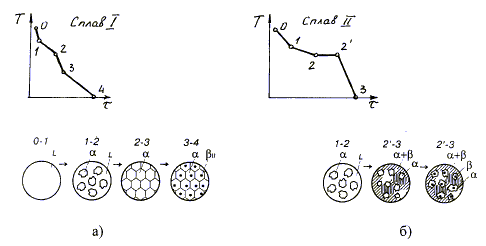
Рис. 8. Кривые охлаждения и схемы структур
Но при достижении температуры эвтектики, соответствующей линии ЕСР из жидкой фазы L одновременно выделяются твердые растворы aЕ и bP с образованием эвтектики
LC ®aE +bP.
Концентрация aE-раствора соответствует точке Е, а концентрация bP-раствора соответствует точке Р. На кривой охлаждения (рис. 8, б)) наблюдается горизонтальный участок 2-2', так как согласно правилу фаз только при постоянной температуре в двухкомпонентной системе возможно существование 3-х фаз; реакция кристаллизации нонвариантна (с = 2 - 3 + 1 = 0). После окончания процесса кристаллизации при эвтектической температуре сплав II будет состоять из первичных кристаллов a-фазы, выделившихся из жидкой фазы от точки 1 до точки 2 и эвтектики (a+b). При дальнейшем охлаждении сплава состав b-фазы не изменяется, а состав a-фазы будет меняться (как первичные кристаллы, так и входящие в эвтектику) вследствие переменной растворимости, в результате чего будут выделяться вторичные кристаллы bII. Схематически структура сплава II при различных температурах кристаллизации изображена на рис. 8, б). Так как вторичные кристаллы bII, выделившиеся из эвтектики обычно не обнаруживаются под микроскопом, то их объединяют со структурой эвтектики.
Кристаллизация сплавов, концентрации которых расположены правее точки С на диаграмме (заэвтектические сплавы), подобна процессу кристаллизации сплавов, расположенных левее точки С (доэвтектические сплавы). Для заэвтектических сплавов кристаллизация сопровождается выделением из жидкой фазы твердого раствора компонента А в В, т.е. b-растворов. При охлаждении сплавов ниже линии СР не будет наблюдаться выделение вторичных кристаллов из b-растворов, так как на диаграмме предельная растворимость компонента В в А, определяемая линией PQ, не изменяется. На рис. 8, а, б показаны структуры сплавов при различных температурах и составах. Но несмотря на многообразие структурных составляющих охлажденный сплав будет состоять из двух фаз: a и b.
По рассмотренной диаграмме состояния кристаллизуются сплавы Pb-Sn, Mg-Cu, Al-Cu и др.
2.3.2. Диаграмма с перитектикой
Диаграмма состояния сплавов, образующих ограниченные твердые растворы c перитектикой изображена на рис. 9.
На диаграмме линия АСВ является линией ликвидус, линия АDEB - линией солидус. Точка D показывает предельную растворимость компонента В в А, а точка Е - предельную растворимость компонента А в В. Линия СDE называется линией перитектического превращения. При эвтектическом превращении из жидкой фазы одновременно кристаллизуются две твердые фазы. При перитектическом превращении в результате взаимодействия жидкого раствора с твердой фазой образуется новая твердая фаза. Перитектическое превращение, как и эвтектическое, соответствует нонвариантному равновесию, так как протекает в условиях существования жидкой фазы L и двух твердых a и b фаз (с = k - f + 1 = 2 -3 + 1 = 0).
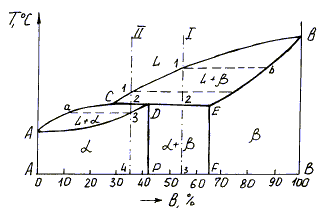
Рис. 9. Диаграмма состояния с перитектикой
Рассмотрим процесс перитектического превращения сплавов, соответствующих концентрациям компонентов I и II. На рис. 10 представлены кривые охлаждения и структуры сплавов после окончания перитектической реакции. При охлаждении сплава I от точки 1 до точки 2 из жидкого сплава L выпадают кристаллы b-сплава.

Рис. 10. Кривые охлаждения и схема структуры сплава (I) после перитектического превращения
При этом концентрация жидкой фазы изменяется по линии ликвидус 1-С, а концентрация твёрдой фазы β по линии солидус b-E. По достижении температуры, соответствующей перитектической линии CDE, состав жидкой фазы будет отвечать точке С, а состав твёрдой фазы β-точке Е. При условии некоторого переохлаждения обе фазы реагируют и в результате перитектического превращения образуется новая твердая фаза a, концентрация которой определяется точкой D. Перитектическая реакция изображается в виде L+b ® a, а для конкретного сплава I LC+bE ® aD. Перитектическая реакция соответствует нонвариантному равновесию (с = k - f + 1 = 2 - 3+ 1 = 0), поэтому на кривой охлаждения наблюдается горизонтальный участок 2-2`.
После окончания процесса кристаллизации структура сплава состоит из перитектической смеси твердых растворов a и b, предельная концентрация которых соответствует точкам P и F (для простоты кривые предельной растворимости DP и ЕF даны вертикальными линиями относительно концентрации компонентов А и В).
Процесс кристаллизации сплава II начинается в точке 1 с выделения из жидкой фазы b-раствора. В этом сплаве при температуре перитектической реакции имеет место избыток жидкой фазы в отличие от сплава I, где наблюдается избыток твердой фазы b. Поэтому процесс кристаллизации этого сплава не заканчивается, так как наряду с вновь образовавшейся твердой фазой a сохраняется жидкая фаза L. В интервале 2`-3 из оставшейся жидкой фазы выделяются кристаллы a-фазы.
Концентрация жидкости изменяется по линии С-а, а концентрация кристаллов a-фазы по линии Д-3. Ниже линии DA сплав II состоит из кристаллов a -твердого раствора.
Перитектическое превращение наблюдается в конструкционных сплавах на основе меди (Cu-Zn, Cu-Sn), железа (Fe-C) и др.
3. ВОПРОСЫ К ДОМАШНЕМУ ЗАДАНИЮ
Какие материалы называют сплавами?
Дайте определение понятию «фаза».
Какие сплавы называют механическими смесями? Приведите основные механические и технологические свойства сплавов типа «механическая смесь». Приведите примеры сплавов.
Какие сплавы называют твердыми растворами и какими твердые растворы бывают по растворимости компонентов друг с другом? Приведите основные механические и технологические свойства сплавов типа «твердые растворы». Приведите примеры сплавов.
Какие сплавы называют химическими соединениями? Какими механическими свойствами обладают сплавы типа «химические соединения»? Приведите примеры сплавов.
Изобразите фазовые диаграммы І, ІІ, и ІІІ (с эвтектикой и перитектикой) рода и опишите процессы кристаллизации, протекающие в сплавах при охлаждении их из жидкого в твердое состояние. Приведите фазовое состояние сплавов при различной концентрации компонентов, входящих в сплавы.
Что такое линия ликвидуса и линия солидуса? Что они обозначают при кристаллизации сплавов?
Расшифруйте понятие «эвтектика». Какую структуру приобретают сплавы, концентрация компонентов которых соответствует эвтектике?
Какими свойствами обладают сплавы, концентрация компонентов которых соответствует эвтектики?
