
- •150104, 150702, 200503, Направления 223200
- •Содержание
- •9. Лабораторная работа №7. Определение константы скорости инверсии сахара………………………………………………....31
- •Поверхностные явления лабораторная работа № 1 адсорбция уксусной кислоты углем
- •Цель работы – изучение зависимости величины адсорбции уксусной кислоты от ее концентрации, построение изотермы адсорбции и определение постоянных a0 и b в уравнении Ленгмюра. Порядок выполнения работы
- •Лабораторная работа № 2 определение поверхностного натяжения жидкостей
- •Электролиты
- •Электропроводность электролитов
- •Кондуктометрическое титрование
- •Электродвижущие силы
- •Кинетика химических реакций
- •Определение константы скорости реакции омыления уксусно-этилового эфира
- •Определение константы скорости инверсии сахара
- •394026 Воронеж, Московский просп., 14
- •Методические указания
Кондуктометрическое титрование
Электропроводность раствора электролита пропорциональна сумме подвижностей ионов. Если в результате химической реакции один из ионов заменяется другим, более подвижным или менее подвижным, то электропроводность раствора возрастает или убывает. Характер изменения электропроводности при титровании, обусловленный замещением одних ионов другими, позволяет найти точки эквивалентности без использования индикатора.
Допустим, что соляную кислоту титруют раствором едкого натра. Раствор соляной кислоты, содержащий ионы
HCI + NaOH NaCI + H2O.
П
Рис.1
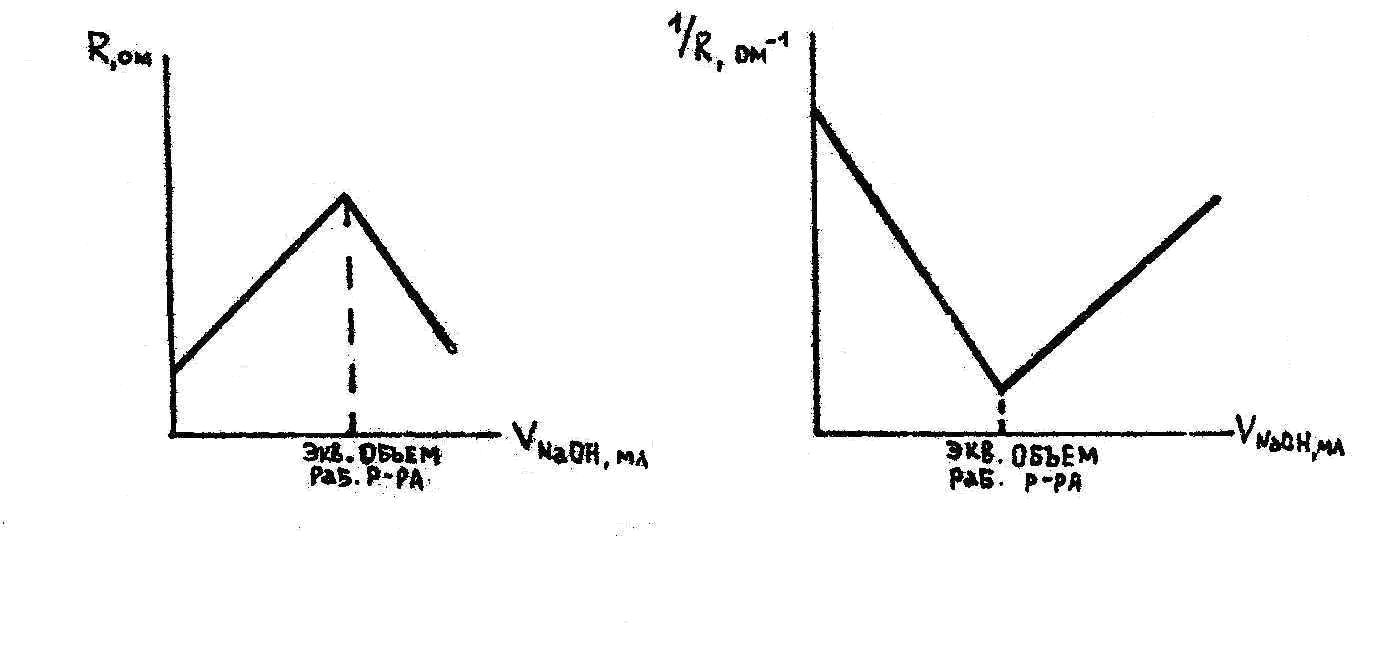
Таким же образом можно проводить кондуктометрическое титрование слабой кислоты сильным основанием и слабого основания сильной кислотой, например:
CH3COOH +NaOH CH3COONa + H2O,
NH4OH + HCI NH4CI + H2O.
При титровании слабой кислоты сильным основанием и слабого основания сильной кислотой электропроводность раствора растет вследствие замещения слабо диссоциированной кислоты (основания) ее сильно диссоциированной солью. После точки эквивалентности электропроводность растет еще более круто, так как в растворе появляются ионы с большой подвижностью (OH- или H+) (рис.2).
М
Рис. 2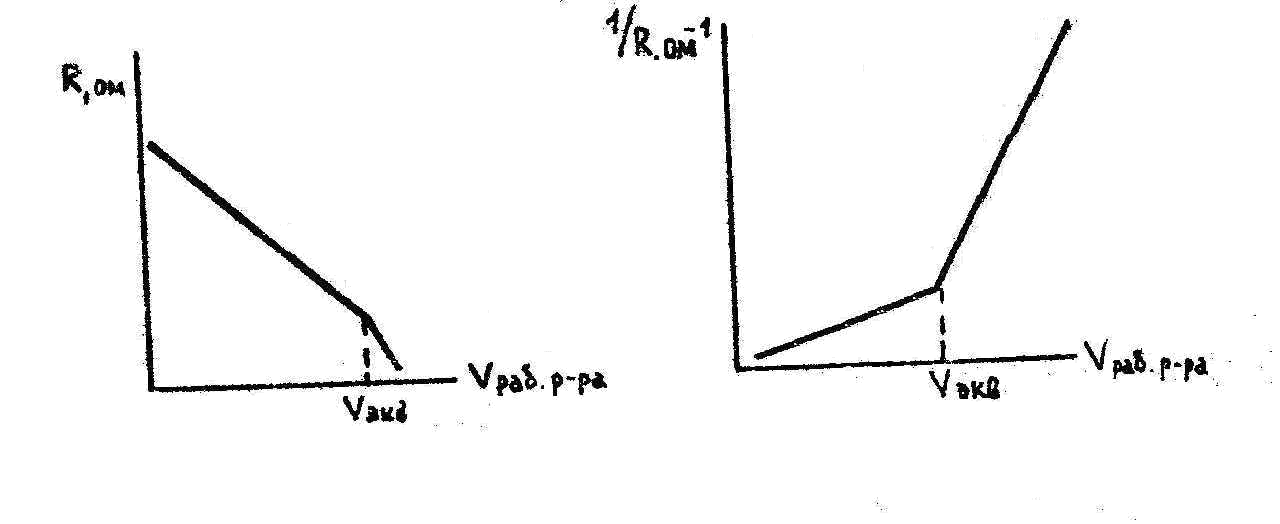
AgNO3 + NaCI AgCI + NaNO3.
Электропроводность раствора AgNO3 при титровании NaCI до эквивалентной точки практически не меняется, так как ионы серебра и натрия имеют очень близкие значения подвижностей, а после эквивалентной точки электропроводность растет, так как подвижность иона хлора больше подвижности нитрат-иона (рис.3).
Ц
Рис. 3
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
Для измерений пользуются мостом Р-38, как описано в работе “Электропроводность электролитов”. Сосудом для титрования служит склянка, закрытая пробкой с тремя отверстиями. Большое отверстие предназначается для вливания рабочего раствора; в малые отверстия плотно вставлены платиновые электроды, впаянные в стеклянные трубки. Электроды покрыты платиновой чернью.
В склянку наливают заданный объем раствора KOH неизвестной концентрации, присоединяют электроды к контактам Rх моста Р-38. Приливая по 0,5 мл рабочего раствора 0,5 н. HCI в содержимое склянки, тщательно взбалтывают раствор и измеряют сопротивление. Опыт продолжают до тех пор, пока не будет получено достаточное количество убывающих показаний сопротивления (5-6 точек).
Окончив опыт, строят график, откладывая по оси абсцисс количество миллилитров рабочего раствора, а по оси ординат – величину сопротивления, обратно пропорционального электропроводности раствора. График состоит из двух пересекающихся прямых. Абсцисса точки пересечения есть эквивалентная точка, отвечающая моменту полной нейтрализации.
Зная объем взятого исследуемого раствора и концентрацию рабочего раствора, а также объем рабочего раствора, пошедшего на титрование (из графика по эквивалентной точке), определяют концентрацию исследуемого раствора по формуле
![]() ,
,
![]() .
.
КОНТРОЛЬНЫЕ ВОПРОСЫ
по теме “Электропроводность электролитов”
Основные положения теории электролитической диссоциации, ее недостатки.
Закон разведения Оствальда.
Основные представления о модели сильного электролита.
Скорость движения ионов, абсолютная скорость и подвижность ионов.
Удельная электропроводность, ее зависимость от концентрации, температуры.
Эквивалентная электропроводность, ее зависимость от разведения, связь с удельной электропроводностью.
Предельная эквивалентная электропроводность. Закон независимости движения ионов Кольрауша.
Числа переноса.
Выражение степени диссоциации и константы диссоциации через эквивалентную электропроводность.
Измерение электропроводности.
Кондуктометрическое титрование.
ЛАБОРАТОРНАЯ РАБОТА № 5
