
- •201001 «Биотехнические и медицинские аппараты и системы»,
- •210413 «Радиоаппаратостроение», 230113 «Компьютерные системы и комплексы», 151901 «Технология машиностроения», 060501 «Сестринское дело» очной формы обучения
- •Тема 1. Основные понятия и законы химии. Количественные отношения в химии
- •Тема 2. Периодический закон и периодическая система д.И. Менделеева в свете современных представлений о строении атома
- •Тема 3. Химическая связь. Строение вещества
- •Тема 4. Закономерности протекания химических реакций. Химическое равновесие
- •Тема 5. Водные растворы. Способы выражения концентрации растворов. Электролитическая диссоциация. Гидролиз солей
- •Тема 6. Окислительно-восстановительные реакции. Электролиз
- •Тема 7. Химия металлов
- •Тема 8. Химия неметаллов
- •Тема 9. Обобщение знаний по общей и неорганической химии
- •Тема 10. Основные положения теории химического строения органических соединений а.М. Бутлерова
- •Тема 11. Предельные углеводороды (алканы, циклоалканы)
- •Тема 12. Непредельные углеводороды (алкены, алкины, алкадиены)
- •Тема 13. Ароматические углеводороды (арены)
- •Тема 14. Природные источники углеводородов
- •Тема 15. Спирты. Фенолы
- •Тема 16. Альдегиды и кетоны
- •Тема 17. Карбоновые кислоты
- •Тема 18. Сложные эфиры. Жиры
- •Тема 19. Углеводы
- •Тема 20. Азотсодержащие соединения. Амины. Аминокислоты. Белки
- •Тема 21. Синтетические высокомолекулярные соединения
- •Тема 22. Обобщение знаний по органической химии
- •Тема 23. Обобщение знаний по неорганической и органической химии
- •394026 Воронеж, Московский просп., 14
Тема 1. Основные понятия и законы химии. Количественные отношения в химии
Химия - наука, изучающая процессы превращения веществ, сопровождающиеся изменением состава и структуры, а также взаимные переходы между этими процессами и другими формами движения материи.
Все количественные расчеты в химии производят в соответствии со стехиометрическими законами. На основании закона постоянства состава составляют химические формулы. На основании закона сохранения массы веществ расставляют коэффициенты в уравнениях реакций.
Пример 1: Вычислите массовые доли элементов в ортофосфате магния.
Д Mg3(PO4)2 ____________ ω(Mg) - ? ω(Р) - ? ω(О) - ? |
Решение:
М = 3∙24 + 2∙31 + 8∙16 = 262 г/моль
массовую долю кислорода можно рассчитать иначе: ω(О) = 100 % - (27,48 % + 23,66 %) = 48,86 %), так как сумма всех массовых долей элементов в сложном веществе составляет 100%. Ответ: массовые доли элементов в Mg3(PO4)2 равны: ω(Mg) = 27,48 %; ω(Р) = 23,66 %; ω(О) = 48,86 %. |
Пример 2: Какая масса серной кислоты потребуется для полной нейтрализации 120 г гидроксида натрия?
Д m(NaОН) = 120 г M(Н2SО4) = 98 г/моль М(КОН) = 56 г/моль
m(Н2SО4) = ?
|
Решение:
120 г х г 2NaОН + Н2SО4 = Na2SО4 + 2Н2О 2 моль 1 моль 2) Определим количество вещества гидроксида натрия
ν(Н2SО4) = ½·ν(NaОН) = ½·3 = 1,5 (моль)
m(Н2SО4) = ν(Н2SО4)·М(Н2SО4) = = 1,5 моль·98 г/моль = 147 г Ответ: для полной нейтрализации 120 г гидроксида натрия потребуется 147 г серной кислоты. |
Пример 3: Какой объем водорода (н.у.) необходим для получения 60 л аммиака?

Задания для самостоятельной работы:
1. Вычислите молярные массы соединений: Ва3(РO4)2, Sn(ОН)4, I2O5, Pb(NO2)2, Са(ClO3)2, Na2Cr2O7, ZnOHNO3, CuCl2, Аl2(SO4)3, H3AsO4, SnSO3, PН3, О3, As2S3, H2O2.
2. Рассчитайте массовые доли элементов в нитрате меди (II).
3. Определите массу 0,25 моль карбоната натрия.
4. Определите массу одной молекулы брома.
5. Какой объем занимают 96 г озона?
6. Сколько атомов содержится в 20,8 г хрома?
7. Какой объем водорода (н.у.) выделится при действии цинка массой 32,5 г на избыток серной кислоты?
8. Какие объемы (н.у.) кислорода и сернистого газа (SO2) необходимы для получения серного ангидрида (SO3)?
9. К раствору, содержащему 20 г нитрата серебра (I), прилили раствор, содержащий 5,85 г хлорида натрия. Определите массу осадка, если выход продукта реакции равен 95%.
10. При действии соляной кислоты на 44,8 г неизвестного металла образуется хлорид металла (II) и выделяется 17,92 л газа (н.у.). Определить, какой металл вступил в данную реакцию.

 ано:
ано: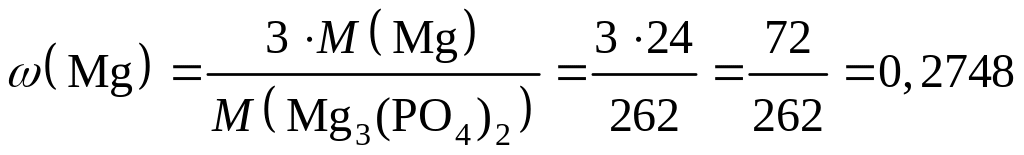 или (27,48 %)
или (27,48 %)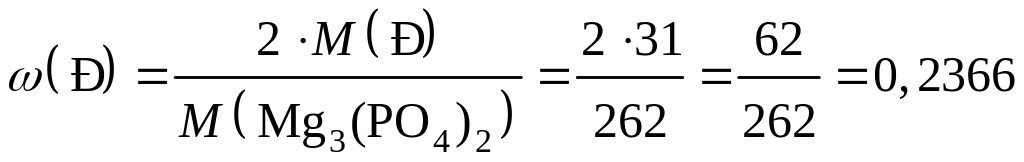 или (23,66 %)
или (23,66 %) или (48,86 %)
или (48,86 %) ано:
ано:
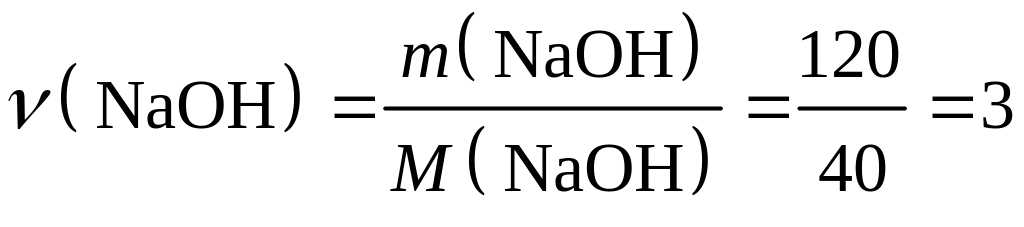 (моль)
(моль)