
- •Составитель О.П. Тарасова
- •Кинетика изучает скорость реакций, факторы, влияющие на скорость и механизмы реакций
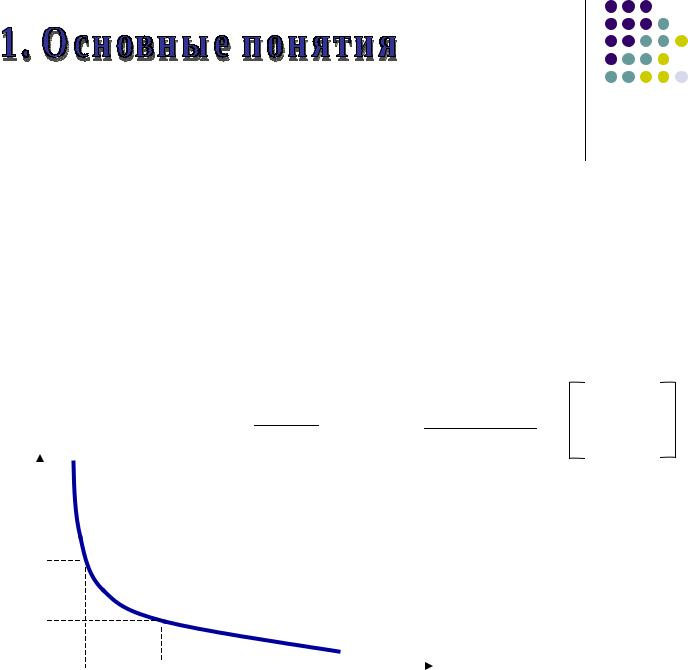
- •Средняя скорость (Vср) определяется по изменению концентрации в определенный промежуток времени
- •I. По скорости
- •II. По агрегатному состоянию
- •III. По механизму
- •IV. По молекулярности
- •I. Природа веществ
- •Кинетическое уравнение
- •Простые реакции
- •n ≠ молекулярности
- •• по С реагентов или продуктов
- •III. Температура
- •IV. Катализатор
- •1) Сложность строения
- •3) Специфичность
- •Обратимые процессы
- •Химическое равновесие
- •Химическое равновесие
- •Принцип Ле-Шателье
- •Химическое равновесие in vivo

Составитель О.П. Тарасова
Кинетика изучает скорость реакций,


 факторы, влияющие на скорость и
факторы, влияющие на скорость и 
 механизмы реакций
механизмы реакций
Скорость (V ) определяется по изменению концентрации веществ (С) в единицу времени (t):
+ |
С |
|
+ |
С2 – С1 |
моль |
||||||||
= |
_____ |
||||||||||||
C |
|
|
|
|
V = – |
t |
– |
|
t2 – t1 |
л · сек |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
С2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t |
|
|
|
t1 t2 |
|
|
|
|
|
||||||

Средняя скорость (Vср) 



 определяется по изменению концентрации
определяется по изменению концентрации


 в определенный промежуток времени
в определенный промежуток времени
Vср = |
|
С |
|
||
|
|
t |
Истинная скорость (Vист)
измеряется в данный момент времени, т.е. t → 0
Vист= dtdС
I. По скорости
Реакции
быстрые |
медленные |
Еакт < 50 кДж /моль
•Реакция нейтрализации
•Взрыв
•Передача нервного импульса
Еакт > 50 кДж /моль
•Коррозия
•Фотосинтез
•Формирование костной ткани (4 – 7 лет)
•Обновление белков в организме (70 суток)

II. По агрегатному состоянию
Реакции
гомогенные
Вещества в одном агрегатному состоянию ( 1 фаза )
•Ферментативные
реакции в растворах
•Реакция нейтрализации
гетерогенные
Вещества разные по агрегатному состоянию
( несколько фаз )
Сакт(тв) |
|
3 С2Н2 (г) → С6Н6 |
(ж) |
Vгом > Vгет

III. По механизму
Реакции  простые (в одну стадию)
простые (в одну стадию)
NaOH + HCl → NaCl +H2O
сложные (через промежуточные стадии) Большинство реакций in vivo
1) Цепные |
|
|
2) Последовательные |
||||
|
|||||||
• SR (СН4 + Сl2) |
А → B → C |
||||||
3) Параллельные |
2KClO3 |
|
KClO4 + KCl |
||||
|
|
B |
|
||||
|
|
|
|||||
А |
|
C |
|
|
2KCl + 3O2 |
||
|
|
|
|||||
|
|
D |
|
|
|||
4) Циклические · цикл Кребса
Ершов, стр. 410

IV. По молекулярности
-по числу молекул в элементарной
реакции с образованием продукта
Реакции
мономолекулярные COOH–COOH → CO2 + HCOOH
бимолекулярные
CH3COOH + C2H5OH → CH3COOC2H5 + H2O тримолекулярные
2NO + O2 → 2NO2

I. Природа веществ
NaCl |
V1 |
Na+ + Cl- |
V1 |
> V2 |
|
|
|
||||
|
|||||
ионная связь |
|
||||
CH3COOH V2 CH3COO- + H+
ковалентная связь
II. Концентрация реагентов
по закону действующих масс (ЗДМ) aA + bB → cC + dD
a, b, c, d – коэффициенты A, B, C, D – вещества

Кинетическое уравнение
V= К [A] a [B] b |
или |
аb
V= К∙СА • СB
а, b – порядок реакции (ν или n)
nА= а nВ = b общий n = а + b К – константа скорости
К= V при С =1 моль/л
Зависит от природы и температуры, не зависит от С

n = 0
Кинетическое уравнение
V K CA0 |
V K |
V |
|
V не зависит от концентрации
 С
С
•in vivo – ферментативные реакции с избытком субстрата
•2NH3 → N2 + 3H2

|
n = 1 |
|
|
|
|
1 |
|
|
|
V |
V= К∙ СА |
|
|
|
|
||||
прямолинейная зависимость |
||||
|
||||
|
(во сколько раз изменяется С, |
|||
|
во столько же раз изменяется |
|||
СV)
•in vivo ферментативные реакции при малых
концентрациях субстрата
•С(тв) + О2(г) → СО2(г)
•Дегидратация спиртов
•Декарбоксилирование аминокислот

|
|
n = 2 |
|
||
2 |
|
или |
|
V= К∙ СА • СB |
|
V= К∙ СА |
|
|
|
||
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
парабола (квадратичная |
|||
|
|
||||
|
|
|
|||
|
|
|
|
зависимость) |
|
|
|
|
|
V~С 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
С |
||
•in vivo – реакция осаждения эритроцитов (РОЭ)
•гидролиз жиров, сложных эфиров, дисахаридов
•Hb + O2 → HbO2
