
Лекция № 4 (карбон. кис-ты)
.pdf
Лекция |
КАРБОНОВЫЕ КИСЛОТЫ, ЛИПИДЫ |
Лектор - доцент ГейнЛ.Ф.
Карбоновые кислоты – это производные углеводородов, в которых один или несколько атомов водорода замещены на карбоксильную группу – СООН.
Общая формула кислот – R-COOH. Название карбоновых кислот по международной номенклатуре образуется добавлением окончания –овая к названию углеводорода.
Одноосновные карбоновые кислоты
Н-СООН муравьиная, метановая
СН3-СООН уксусная, этановая
СН3-СН2- СООН пропионовая, пропановая
СН3-СН2- СН2- СООН масляная, бутановая
СН2 = СНСООН акриловая, пропеновая
СН3-СН= СНСООН 2-бутеновая
Остаток кислоты R – С=О называется ацил
Строение карбоксильной группы
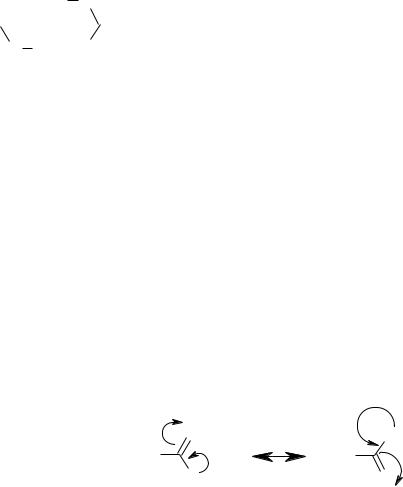
Формально карбоксильная группа состоит из карбонильной (С=О) и гидроксильной (ОН) групп. Вследствие взаимного влияния их друг на друга они теряют старые свойства и приобретают новые. Например, в карбоксильной группе вследствие рπ-сопряжения гидроксильная группа может диссоциировать в отличие от спиртов.
Реакционные центры:
O
R CH 
O H
H
Гидроксильная группа ОН – это сильный кислотный центр, α-углеродный атом СН – это слабый кислотный центр, атом кислорода карбонильной группы – нуклеофильный центр, может присоединять протон Н+.
Водородные связи.
Водородные связи в кислотах образуются между электронодефицитным атомом водорода гидроксильной группы и атомом кислорода при двойной связи, имеющего неподеленную пару электронов. Водородная связь является разновидностью донорно-акцепторной связи. Энергия ее не велика, определяется электростатическим взаимодействием. Графически она обозначается тремя точками. Межмолекулярные связи возникают между одинаковыми или разными молекулами, внутримолекулярные – между функциональными группами внутри молекулы.
O H O
R 
 R
R
O H O
Химические свойства
1.Диссоциация кислот в водных растворах.
R – СООН + Н2О → R – СОО- + Н3О +
карбоксилат ион
Карбоновые кислоты самые сильные кислоты среди органических соединений, так как в карбоксилат-ионе вследствие рπ-сопряжения отрицательного заряда на атоме кислорода и электронов π-связи происходит выравнивание зарядов и связей. Отрицательный заряд практически делится поровну между атомами кислорода, образуется наиболее устойчивый ион
O |
O _ |
R |
R |
_ |
O |
O |
Резонансные структуры
Сила кислоты зависит также от природы заместителя в углеродной цепи: электроноакцепторные (ЭА) заместители увеличивают кислотность, а электронодонорные (ЭД) заместители – уменьшают.

|
O |
O |
O |
|
H |
CH3 |
CH2 |
|
OH |
OH |
OH |
|
|
|
Cl |
|
|
ЭД |
ЭА |
рКа |
3,8 |
4,75 |
2,8 |
По этой причине хлоруксусная кислота более сильная, чем уксусная, а уксусная более слабая, чем муравьиная, что подтверждается значениями их рКа (чем меньше рКа , тем сильнее кислота). По этой же причине двухосновные кислоты более сильные, чем одноосновные. Например, щавелевая кислота более сильная, чем хлоруксусная, ее рКа=1,2
НООС←СООН
ЭД
2. Образование солей. Карбоновые кислоты взаимодействуют не только с основаниями, но и солями более слабых кислот, например угольной.
СН3-СООН + NaOH → СН3-СООNa + Н2О
СН3-СООН + NaHCO3 → СН3-СООNa + Н2О + СО2
3. Образование сложных эфиров (реакция этерификации). Реакция протекает при нагревании кислот со спиртами в присутствии кислого катализатора (серной или хлороводородной кислот).
|
|
O |
t, H+ |
|
O |
|
|
CH3 |
|
+ CH3CH2OH |
CH3 |
|
|
|
+ H2O |
|
|
|
|||||
|
|
|
|||||
|
|
OH |
|
|
O |
|
CH2CH3 |
|
|
|
|
|
Процесс этерификации обратим, обратная реакция называется гидролиз, сложные эфиры подвергаются гидролизу как в кислой, так и в щелочной среде.
4.Образование тиоэфиров. Тиоэфиры образуются при взаимодействии органических кислот с тиоспиртами. В организме (in vivo) наиболее распространенным тиолом является кофермент А (кофермент реакций ацилирования), обозначаемый КоА–SН.
|
|
O |
|
|
O |
||
CH3 |
|
+ KoA-SH |
CH3 |
|
|
|
+ H2O |
|
|||||||
|
|
||||||
|
|
OH |
|
|
S |
|
KoA |
|
|
|
|
|
|||
Ацетилкофермент А
Кофермент А играет важную роль в процессах обмена веществ, в частности активирует карбоновые кислоты. С уксусной кислотой он образует ацетилкофермент, который служит переносчиком ацетильной группы на субстрат.
5. Образование амидов. Амиды образуются при взаимодействии карбоновых кислот с аммиаком или аминами (R-NH2). Реакция протекает в две стадии (замещение-элиминирование), первоначально образуется аммонийная соль, а далее при нагревании отщепляется вода с образованием амида.
|
|
O |
|
|
O |
t |
O |
||
|
|
|
|
|
|
+ H2O |
|||
CH3 |
|
+ NH3 |
CH3 |
|
|
CH3 |
|
|
|
|
|
|
|
||||||
|
|
OH |
|
|
ONH4 |
|
|
|
NH2 |
|
|
|
соль |
|
амид |
|
|||
6. Образование ангидридов. Ангидриды образуются при нагревании карбоновых кислот в присутствии водоотнимающих реагентов, например пятиокиси фосфора P2O5.
O |
|
|
|
R |
|
O |
|
|
|
|
|
O |
H |
R |
|
|
+ HOH |
||
+ O |
H |
O |
|
|
|
||
|
|
R |
|
R |
|
O |
|
|
|
|
|
O |
|
|
|
R – COOH + HOOC – R → RCO – O – COR + HOH
Наиболее известные производные кислот – амиды и эфиры карбоновых кислот широко распространены в природе, ангидриды, хлорангидриды используются в химических лабораториях.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
R |
|
O |
R |
|
O |
R |
|
O |
R |
|
O |
R |
|
O |
||
|
|
|
|
|
||||||||||||
|
O |
|
R |
|
SR |
|
NH2 |
|
Cl |
R |
|
|||||
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
O |
||||||
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Эфиры |
тиоэфиры |
амиды |
галогениды |
ангидриды |
||||||||||||
Дикарбоновые кислоты. |
|
|
|
|
|
|
|
|
|
|||||||
HOOC – COOH щавелевая кислота, этандиовая, соли –оксалаты
HOOC – CH2 – COOH малоновая, пропандиовая, соли –малонаты
HOOC – CH2 – CH2 – COOH янтарная, соли – сукцинаты
НООС – СН=СН – СООН фумаровая, бутендиовая, соли – фумараты
HOOC – CH2 – CH2 – CH2 – COOH глутаровая
Химические свойства.
Дикарбоновые кислоты содержат в своем составе две карбоксильные группы, проявляют те же свойства, что и монокарбоновые, при этом образуют два ряда функциональных производных – по одной и по двум карбоксильным группам. Однако дикарбоновые кислоты проявляют и отличные свойства.
- Одна из наиболее важных реакций – реакция разложения дикарбоновых кислот при нагревании с серной кислотой, отщепление одной карбоксильной группы в виде углекислого газа (CO2).
HOOC – COOH → |
HOOCH + CO2 |
|
Щавелевая кислота |
|
муравьиная кислота |
HOOC – CH2 – COOH → |
CH3COOH + CO2 |
|
Малоновая кислота |
|
уксусная кислота |
- Образование циклических ангидридов. Янтарная и глутаровая кислоты при нагревании легко отщепляют воду с образованием пяти- и шестичленных циклических ангидридов.
H2 |
H2 |
|
|
|
+ |
HOH |
C |
C |
O |
|
O |
||
HOOC |
COOH |
O |
|
|
||
|
|
|
|
|||
|
|
|
|
|
||
Янтарная кислота |
янтарный ангидрид |
|
||||
|
COOH |
|
|
|
+ |
HOH |
HOOC |
O O |
|
O |
|
|
|
|
|
|
|
|
||
Глутаровая кислота |
глутаровый ангидрид |
|
||||
-Окисление (дегидрирование) янтарной кислоты в фумаровую в организме с участием кофермента ФАД. Реакция протекает стереоспецифично с
отщеплением атомов водород в транс-положении и образованием трансизомера – фумаровой кислоты.
HOOC – CH2 – CH2 – COOH |
→ HOOC – CH=CH – COOH + H2 |
|
Янтарная кислота |
фумаровая кислота |
|
- OOC |
H |
|
|
C=C |
|
H |
COO |
- |
|
|
транс-изомер |
ВЫСОКОМОЛЕКУЛЯРНЫЕ КАРБОНОВЫЕ КИСЛОТЫ
Высокомолекулярные карбоновые кислоты, которые входят в состав жиров называются высшими жирными кислотами (ВЖК). Биологически важные жирные кислоты – это монокарбоновые кислоты с неразветвленной углеродной цепью и четным числом атомов углерода (от 4 до 28). В организме наиболее распространены ВЖК с числом атомов 16-18. Они могут быть насыщенными и ненасыщенными, последние содержат одну или несколько двойных связей, имеющих цис-конфигурацию.
Насыщенные жирные кислоты не содержат кратных связей.
C15H31COOH |
CH3 |
(CH2)14COOH |
пальмитиновая |
C17H35COOH |
CH3 |
(CH2)16COOH |
стеариновая |
Ненасыщенные жирные кислоты. |
|
||
Олеиновая (одна π-связь, ∆9) C17H33COOH CH3 (CH2)7CH=CH(CH2)7 COOH
Линолевая (2π-связи, ∆ 9,12) C17H31COOH
CH3 (CH2)4СН=СН СН2 CH=CH(CH2)7 COOH
линоленовая (3π-связи, ∆ 9,12,15) C17H29COOH
CH3СН2 СН=СН CH2 СН=СН СН2 CH=CH(CH2)7 COOH
Арахидоновая (4π-связи), С19Н31СООН участвует в синтезе простогландинов – гормонов местного действия.
Ненасыщенные жирные кислоты, кроме олеиновой, не синтезируются в организме, называются незаменимыми и должны поступать с пищей.
Источником ненасыщенных жирных кислот являются растительные масла, орехи, жирные сорта рыбы.
ЛИПИДЫ
Липиды - вещества растительного и животного происхождения, практически нерастворимые в воде, но растворимые в органических растворителях.
Функции липидов.
1.Пластическая функция. Липиды являются основными структурными компонентами клеточных мембран.
2.Защитная функция (терморегуляция)
3.Энергетическая функция и резервно-энергетическая (1 грамм жира дает 9.3 ккал энергии).
4.Жиры способствуют усвоению жирораствворимых витаминов (А, Е,К, D), являются источником витамина D и предшественниками стероидных гормонов (глюкокортикоидов, минералкортокоидов, половых гормонов).
Липиды делятся на - омыляемые и неомыляемые в зависимости о их способности к гидролизу.
Неомыляемые липиды – однокомпонентны, не подвергаются гидролизу (стероиды, терпены)
Омыляемые липиды могут быть двухкомпонентными (простые липиды) или состоять и трех и более компонентов (сложные липиды).
Простые липиды
Кпростым липидам относятся:
Стериды – сложные эфиры стеринов, например, холестерина .
Воска – это сложные эфиры высших одноатомных спиртов и ВЖК, например, пчелиный воск, спермацетовый воск. Воска имеют высокую температуру плавления, так как в них преобладают насыщенные ВЖК. Они выполняют защитную функцию, покрывают плоды, листья, кожу, шерсть, перья,
Жиры и масла – это сложные эфиры трехатомного спирта глицерина и высокомолекулярных карбоновых кислот (ВЖК), называются триацилглицерины.

Синтез триацилглицеринов.
|
CH2OH |
C17H33COOH |
|
CH2OOCC17H33 |
|
|
CHOH + |
C17H31COOH |
|
|
CHOOCC17H31 + 3 HOH |
|
|
||||
CH2OH |
C17H35COOH |
CH2OOCC17H35 |
|||
|
|
|
1-олеоил-2-линолеоил-3-стеароилглицерин |
||
|
|
|
1-олео-2-линолео-3-стеарин |
||
Жиры, в которых преобладают насыщенные жирные кислоты, по консистенции твердые (говяжий жир, свиной, бараний, молочный), жиры, в которых преобладают ненасыщенные жирные кислоты, по консистенции жидкие (оливковое, льняное, подсолнечное, кукурузное)
Свойства триацилглицеринов.
1.Гидролиз триацилглицеринов. Гидролиз – это расщепление сложных веществ на простые компоненты водой. Гидролиз протекает при нагревании жиров с водой в присутствии катализаторов: кислот, щелочей, или в организме под действием ферментов (липаз). Гидролиз в присутствии кислот приводит к образованию глицерина и жирных кислот, гидролиз в присутствии щелочей приводит к образованию глицерина и натриевых солей жирных кислот, которые называются мыла, поэтому щелочной гидролиз называется омыление.
CH OOCC H |
|
|
CH2OH |
C17H33COONa |
|||
|
|
2 |
17 |
33 |
|
CHOH + |
C17H31COONA |
|
|
CHOOCC17H31 + 3 NaOH |
|
||||
|
|
||||||
CH2OOCC17H35 |
CH2OH |
C17H35COONa |
|||||
Триацилглицерин |
глицерин |
соли ВЖК - мыла |
|||||
Натриевые и калиевые соли ВЖК растворимы в воде, а кальциевые соли не растворимы. Нерастворимые кальциевые соли образуются при растворении мыла в жесткой воде.
2 C17H35COONa + |
Ca |
+2 |
(C17H35COO)2Ca + |
2 Na |
+ |
|
|
2.Реакции присоединения.
- реакции гидрирования (гидрогенизации) – это присоединения водорода по двойным связям остатков непредельных жирных кислот, при этом жидкие
масла превращаются в твердые жиры. Маргарин и твердые кулинарные масла получают этим методом из растительных масел.
|
CH2OOCC17H33 |
Pd or Ni, 150-200 oC |
|
CH2OOCC17H35 |
|
|
CHOOCC17H31 |
+ 3 H2 |
|
|
CHOOCC17H35 |
|
|
||||
CH2OOCC17H35 |
|
CH2OOCC17H35 |
|||
1-олеоил-2-линолеоил-3-стеароил |
|
|
1,2,3-тристеароил |
||
Жидкий триацилглицерин |
твердый триацилглицерин |
||||
- присоединение иода протекает аналогично. Количество грамм иода присоединившееся к 100 г жира называется иодное число. Оно характеризует степень ненасыщенности жира.
|
|
|
|
|
|
|
|
|
|
I |
I |
|
|
|
CH2O-CO-(CH2)7CH=CH(CH2)7CH3 |
|
|
|
|
||||||||
|
|
|
|
|
|
||||||||
|
|
CH O-CO-(CH ) CH-CH(CH ) CH |
|
||||||||||
|
CHO-CO-C17H35 |
|
|
|
|
|
2 |
|
2 7 |
|
2 7 |
3 |
|
|
|
|
|
|
|||||||||
|
I2 |
|
|
CHO-CO-C17H35 |
|
|
|||||||
|
|
|
|
||||||||||
CH2O-CO-C17H35 |
|
CH O-CO-C H |
35 |
|
|
|
|||||||
|
|
|
2 |
17 |
|
|
|
|
|||||
Сложные липиды. Фосфолипиды.
Фосфолипиды – липиды, отщепляющие при гидролизе фосфорную кислоту. В состав фосфолипидов могут входить разные спирты, например, глицерин, сфингозин. Глицерофосфолипиды – это сложные эфиры глицерина, ВЖК, фосфорной кислоты и аминоспиртов. В качестве аминоспирта в состав сложных липидов входят: аминокислота серин, коламин (2-аминоэтанол), холин. Промежуточным веществом в синтезе фосфолипидов является фосфатидовая кислота. При взаимодействии фосфатидовой кислоты с аминоспиртом образуются фосфолипиды.
CH2O COR
RCO O CH O
CH2O P OH
OH
Фосфатидовая кислота
Образование фосфолипидов

|
|
|
|
|
|
|
CH2O |
|
|
|
|
|
|
|
COR |
+ |
|
|
|
+ |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
RCO |
|
|
O |
|
|
|
CH |
|
|
|
|
O |
|
|
|
|
|
|
|
HOCH2CH2N(CH3)3 |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
CH2O |
|
|
|
|
|
|
P |
|
|
|
OH |
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
RCO |
|
|
|
|
|
|
|
|
CH2O |
|
|
COR |
+ HOH |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
O |
|
CH |
|
O |
+ |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2O |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
|
OCH2CH2N(CH3)3 |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|||||
|
|
|
|
|
|
|
|
Фосфатидилхолин, лецитин |
|
|||||||||||||||||||||||||||
|
|
|
|
|
CH2O |
|
|
|
COR |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
RCOO |
|
CH |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
CH2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
P |
|
|
|
|
|
|
|
OCH2CH2NH3 |
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
OH
Фосфатидилколамин, кефалин
Фосфолипиды тоже могут гидролизоваться в присутствии кислот или щелочей. При полном гидролизе освобождаются все компоненты фосфолипидов
|
|
CH O |
|
|
COR |
+ |
|
CH2OH |
||||||
|
|
|
|
|
||||||||||
|
|
|
2 |
|
|
|
|
|
|
|
H , HOH |
|
||
RCOO |
|
CH |
O |
|
|
+ |
||||||||
|
+ |
|
|
CHOH + 2 RCOOH + H3PO4 + HOCH2CH2NH3 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
CH2O |
|
|
P |
|
O CH2CH2NH3 |
CH OH |
||||||
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
2 |
||
|
|
|
|
|
|
OH |
|
|
|
|
||||
В условиях организма (рН=7,4) оставшийся свободный гидроксил фосфорной кислоты и другие ионогенные группировки в фосфатидах и фосфолипидах ионизированы.
RCO |
|
|
|
|
CH2O |
|
CO-R |
|
||||
|
|
|
|
|
|
|||||||
|
O |
|
CH |
|
|
P O |
|
|||||
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
CH2O |
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
_ O |
|
|
O |
|
|||
|
|
|
|
|
H N+ |
|
|
|
|
|
||
|
|
|
|
|
|
|
CH |
2 |
||||
3 |
|
|
C |
|||||||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
H2 |
|
|||
Характерная особенность сложных липидов – бифильность, обусловленная наличием неполярных гидрофобных и ионизированных гидрофильных групп.
